近年来,我国奶牛、肉牛和肉羊等反刍动物养殖业发展迅速,但粗饲料资源不足和品质较差的现状制约着牛羊产业的快速发展。为了提高饲粮能量浓度和生产性能,泌乳高峰期或育肥期牛、羊通常大量饲喂以谷物为主的高精料饲粮,过量淀粉在瘤胃中发酵导致瘤胃内产生大量的挥发性脂肪酸(VFA),从而使瘤胃液pH下降和波动增加,引发亚急性瘤胃酸中毒(SARA)、肝脓肿、蹄叶炎、乳脂降低等多种营养代谢性疾病[1-3];同时,过量的过瘤胃淀粉会进入小肠和大肠,引起肠道上皮结构和后肠道发酵参数发生变化,可进一步损害机体健康。因此,本文综述了高精料饲粮对反刍动物胃肠道发酵、代谢产物、微生物多样性和瘤胃上皮的影响及其调控措施,以期挖掘高精料饲粮影响反刍动物胃肠道健康的机理和提升生产性能。
1 高精料饲粮对反刍动物瘤胃健康的影响 1.1 对反刍动物瘤胃内环境和微生物区系的影响为了提高饲粮的能量浓度和牛、羊的生产性能,在生产中常常饲喂大量谷物,当饲喂比例过高时会破坏瘤胃的内环境,降低pH,改变瘤胃发酵模式及代谢产物的种类和浓度。李洋[4]研究表明,高精料饲粮使山羊瘤胃内乙酸浓度、乙酸/丙酸下降,丙酸和丁酸浓度上升,并产生大量组胺、脂多糖(LPS)、乙醇胺和D-乳酸等异常代谢产物,引起瘤胃代谢紊乱。奶牛的某些代谢性疾病可能是因这些代谢物的改变所引起,Zhang等[5]通过整合代谢组学和相关网络分析,比较了饲喂低精料饲粮和高精料饲粮的奶牛瘤胃代谢产物组成发现,高精料饲粮增加奶牛瘤胃液中的细菌降解产物(包括黄嘌呤、次黄嘌呤、尿嘧啶等)、有毒化合物(包括脂多糖、生物胺、乙醇胺等)和15种氨基酸(包括丙氨酸、亮氨酸、甘氨酸等)的浓度,而这些代谢产物可能会增加SARA的发生。
瘤胃内存在许多不同种类的细菌、真菌及原虫等微生物群体,它们相互协同或竞争构成了瘤胃内稳定的微生物区系,而瘤胃微生物的代谢产物会对反刍动物的生产性能和产品产生影响。因此,保证瘤胃微生物菌群的稳态是保证反刍动物的健康和产品安全的关键因素[6]。高精料饲粮模式会改变瘤胃内微生物菌群的丰度和多样性。以奶牛为例,Plaizier等[7]研究表明,基于16S rRNA基因V3~V4区域高通量测序分析奶牛瘤胃液的菌群,共观察到11个不同门,90种细菌群落;在门水平上,高精料饲粮增加了瘤胃液中厚壁菌门和放线菌门的相对丰度,而降低了蓝细菌门和拟杆菌门的相对丰度。厚壁菌门具有消化代谢淀粉类碳水化合物的能力,其相对丰度的增加会加速淀粉的降解,不利于高精料饲喂时瘤胃内环境的健康。而拟杆菌门能降解纤维素,且与瘤胃液pH关系密切,其相对丰度的下降可能与瘤胃液pH下降有关[8]。
饲粮精粗饲料的比例会影响瘤胃菌群的变化。Fernando等[9]研究表明,使用末端限制性片段长度多态性(T-RFLP)分析肉牛瘤胃液16S rRNA基因,发现谷物和干草比为20 ∶ 80、40 ∶ 60与60 ∶ 40、80 ∶ 20的细菌种群结构存在明显差异,且精料比例越高,瘤胃微生物菌群的变化越明显;在门水平上,低精料饲粮中肉牛瘤胃中含有大量的纤维杆菌,随着精料的增加,琥珀酸纤维杆菌的相对丰度逐渐降低,而高精料饲粮组肉牛瘤胃中含有大量的厚壁菌和变形菌。
饲喂高精料饲粮会改变山羊瘤胃上皮细菌菌群的丰度和多样性。Liu等[10]研究发现,高精料增加了山羊瘤胃上皮丁酸弧菌属、Mogibacterium和琥珀酸菌属的相对丰度,降低了未分类的瘤胃菌科的相对丰度;Mogibacterium通常在人类的大肠癌患者结肠黏膜中比较丰富,因此其相对丰度的上升可能会损害山羊瘤胃上皮健康。此外,高精料饲粮还可增加山羊瘤胃内色胺、内毒素、酪胺等的含量和纤毛虫的数量,降低了古细菌菌群的多样性[11]。
1.2 对反刍动物瘤胃上皮的影响反刍动物可利用瘤胃微生物对结构性碳水化合物进行发酵,产生大量的乙酸、丙酸和丁酸等VFA,其中复层鳞状瘤胃上皮(SSE)在吸收VFA中起关键作用。从瘤胃壁突出的乳头可增加吸收VFA的表面积,从而利于瘤胃上皮对营养物质的吸收和离子转运。瘤胃上皮分为4层,棘突层和基底层相邻,拥有功能性线粒体,有助于VFA代谢、酮体生成;颗粒层邻近棘突层,细胞通过桥粒连接形成致密结构,可防止物质以扩散方式透过瘤胃壁。角质层与瘤胃环境直接接触,是瘤胃上皮对瘤胃内环境的物理保护屏障[12]。
高精料饲粮会引起反刍动物瘤胃上皮出现损伤。Steele等[13]用高精料饲粮诱导羔羊发生SARA时发现其瘤胃上皮出现过度角质化,且瘤胃角质层厚度、乳头高度及宽度都呈下降趋势。此外,还会破坏上皮细胞间的紧密连接,使瘤胃上皮细胞间的间隙增大,最终削弱瘤胃上皮的屏障功能。Steele等[14]研究发现,高精料饲粮组奶牛的瘤胃颗粒层、基底层和棘突层厚度以及活检瘤胃乳头中的整个SSE厚度均明显降低;通过用电子显微镜高放大倍数时发现,高精料组瘤胃颗粒层的桥粒数目减少,细胞黏附程度降低,表明颗粒细胞没有形成紧密的屏障。因此,高精料饲喂会增加反刍动物瘤胃上皮通透性,损伤瘤胃上皮屏障功能和健康。
2 高精料饲粮对反刍动物肠道健康的影响 2.1 对反刍动物肠道发酵和微生物的影响奶牛后肠道碳水化合物的微生物发酵占总碳水化合物消化量的5%~10%。随着淀粉摄入量的增加,肠道和粪便中的淀粉含量也逐渐增加,并且淀粉的消化率呈下降趋势。这说明当淀粉含量摄入过多时,会限制小肠对淀粉的吸收,造成淀粉消化率的下降(表 1)。
|
|
表 1 反刍动物淀粉摄取量与肠道消化的关系 Table 1 Relationship between starch ingestion and intestinal digestion of ruminants |
当摄入过量淀粉时,在消化道前部不能被完全消化,通常进入大肠进行发酵,由于肠道缺乏唾液缓冲和原生动物,会导致肠道中pH降低,LPS和VFA浓度上升,从而引起后肠酸中毒。酸中毒导致消化道处于酸性环境从而损伤大肠上皮,此时动物会分泌黏液来保护大肠上皮免受进一步的损伤,从而导致粪便稀薄。同时,由于VFA的积累增加了肠道内部的渗透压,会导致体液向粪便中渗出,而二氧化碳的产生会导致粪便呈泡沫状,进一步引发腹泻;同时,肠道LPS浓度的上升,会破坏肠道的屏障功能,并导致游离LPS进入血液循环,引发全身炎症[19]。
饲喂高精料饲粮会改变后肠道内的pH,以及细菌菌群的丰度和多样性。Danscher等[20]研究表明,高精料饲粮可降低奶牛粪便pH(6.04 vs. 6.49)和尿液pH(7.80 vs. 8.05)。Mao等[21]研究表明,高精料饲粮增加了奶牛粪便中毛螺菌属、嗜麦芽寡养单胞菌的百分比,减少了赖氨酸芽孢杆菌属的百分比;嗜麦芽寡养单胞菌与乙酸盐、丙酸盐和VFA浓度之间存在显著正相关,而赖氨酸芽孢杆菌属相对丰度与其呈负相关。Li等[22]发现,高谷物饲粮使诱导组奶牛盲肠中LPS浓度从16 508 EU/g增加到118 522 EU/g,粪便中LPS浓度从12 832 EU/g增加到93 154 EU/g。Liu等[23]研究也发现,高精料饲粮降低了山羊盲肠内容物的pH和异丁酸盐的浓度,增加了VFA和LPS的浓度,且盲肠中游离LPS的浓度与革兰氏阴性细菌的比例之间存在显著负相关,说明盲肠pH降低与游离LPS的浓度增加可能是某些革兰氏阴性细菌死亡和溶解所导致。因此,饲喂高精料饲粮可能会导致肠道LPS浓度过高从而引发反刍动物肠道局部炎症的发生。
2.2 对反刍动物肠道上皮结构的影响衡量反刍动物肠道消化和吸收能力的主要指标是小肠上皮中的隐窝深度和绒毛长度。肠道上皮对营养物质消化吸收功能的变化与肠隐窝深度的变化有关,肠道绒毛长度提升会增加其上皮细胞的数量,隐窝变浅或绒毛长度下降,表示小肠吸收能力减弱、黏膜功能下降。薛春旭[24]研究表明,饲喂高精料饲粮的山羊十二指肠、空肠和回肠绒毛高度和隐窝深度都显著提高,说明饲喂高精料饲粮会提升山羊小肠黏膜的功能,从而促进肠道的吸收能力,但空肠绒毛高度与隐窝深度的比值显著下降,也说明饲喂高精料使山羊的空肠黏膜受到损伤。
高精料饲粮通常会损伤反刍动物的后肠道上皮。后肠道上皮是由单层上皮细胞构成,比瘤胃更容易受到酸性损伤、屏障损伤和毒素易位的影响,因此肠道酸度的增加可能会破坏肠道上皮形态结构的完整性,导致大肠上皮细胞损伤和脱落[25]。Ye等[26]研究表明,高谷物饲粮可导致山羊结肠上皮出现脱落,细胞线粒体出现溶解以及细胞间的紧密连接被破坏,其中肠道低pH和高渗透压是造成上皮损伤的重要因素;对黏膜具有损伤作用的菌属Blautia丰富度显著升高,也证明了高精料饲粮会造成肠道上皮受损。Tao等[27]研究发现,饲喂高精料使山羊盲肠上皮细胞线粒体肿胀,破坏盲肠黏膜超微结构;盲肠上皮中的丙二醛含量显著升高,谷胱甘肽过氧化物酶和超氧化物歧化酶活性则显著降低,说明盲肠黏膜中氧化反应增加和抗氧化作用降低,从而导致了上皮细胞凋亡。
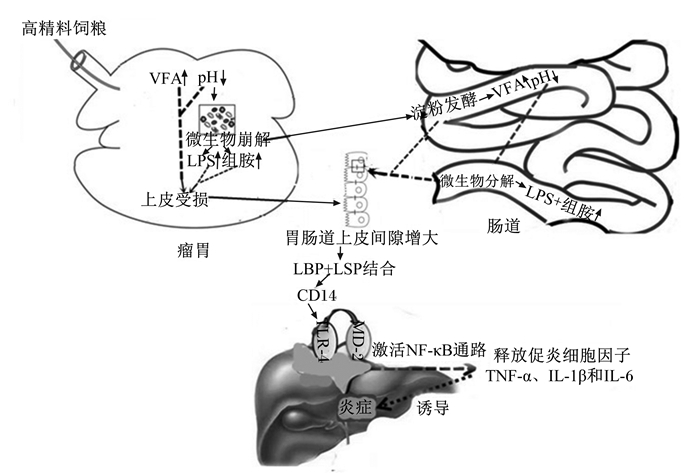
3 反刍动物胃肠道健康与炎症高精料饲粮可引起反刍动物胃肠道和机体的炎症。如瘤胃炎主要是由于瘤胃液的酸度和LPS浓度增加而导致瘤胃上皮角化不全所致,全身性炎症可能是由于内毒素(如LPS或其他免疫原性化合物)从消化道外移位引起的;而LPS是革兰氏阴性菌外壁的一个组成部分,当瘤胃内革兰氏阴性菌死亡溶解后,会增加瘤胃中游离LPS的浓度,随后通过瘤胃屏障进入血液,使血液中的LPS浓度增加,引发全身性炎症反应[28-29]。由图 1可知高谷物饲粮饲喂奶牛时,胃肠道中的LPS和组胺的浓度上升会激活核因子-κB(nuclear factor-kappa B,NF-κB)炎症信号通路,引起奶牛胃肠道上皮细胞的炎症损伤[30]。血清中LPS结合蛋白(LBP)与LPS形成复合物并催化其转移到CD14(膜结合型或可溶性),再与Toll样受体-4(Toll-like receptors-4,TLR-4)组合,然后与髓样分化蛋白-2(myeloid differential protein-2,MD-2)共同形成巨噬细胞膜内的信号复合物,激活NF-κB炎症信号通路[31],刺激下游靶基因转录并诱导释放白细胞介素-6(IL-6)、白细胞介素-1(IL-1β)和肿瘤坏死因子-α(TNF-α)等炎性细胞因子,进而诱导炎性反应[32-33]。
|
LPS:脂多糖lipopolysaccharide;VFA:挥发性脂肪酸volatile fatty acid;LBP:脂多糖结合蛋白lipopolysaccharide binding protein;CD14:脂多糖受体lipopolysaccharide receptor;TLR-4:Toll样受体-4 Toll-like receptors-4;MD-2:髓样分化蛋白-2 myeloid differential protein-2;NF-κB:核转录因子-κB nuclear factor-kappa B;IL-6:白细胞介素-6 interleukin-6;IL-1:白细胞介素-1 interleukin-1;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α。 图 1 高谷物喂养引起奶牛炎症的机制 Fig. 1 Mechanism of dairy cow inflammation induced by high grain feeding[34] |
燕麦、稻谷、小麦和玉米等是反刍动物饲粮中常见的谷物原料,通过适当的物理或化学方法处理谷物可以减缓其瘤胃淀粉降解速率,有效预防SARA的发生。谷物的物理加工方法主要包括粉碎、制粒、滚压、蒸汽压片、膨化等,其中粉碎可以提高淀粉的利用率,但由于不能充分刺激咀嚼和反刍,导致唾液分泌减少,相应地增加了SARA发生的可能性。Wang等[35]研究发现,在相同的情况下,相比干燥滚压使用浸泡滚压会让大麦在瘤胃中降解率显著降低。曹玉伟等[36]研究表明,玉米经蒸汽压片有利于维持正常的瘤胃发酵模式,从而提高淀粉在瘤胃的利用率和维持pH的稳定。
早期谷物化学处理方法包括氢氧化钠、甲醛和氨处理法等。但这几种化学方法预处理时间过长,同时存在潜在毒性和损害动物健康等问题而未得到广泛推广应用。最新研究发现,柠檬酸、单宁酸和乳酸等多种有机酸有利于提高谷物中的抗性淀粉水平,降低淀粉在瘤胃降解率从而缓解SARA;这些有机酸在自然界分布很广,且并未在牛奶和肉中发现残留,因此这些有机酸都是安全可靠的[37-38]。Deckardt等[39]通过研究表明,大麦籽粒中加入5%的乳酸进行处理会降低发酵液中VFA浓度,并促进纤维降解。Shen等[40]研究表明,玉米在0.5%柠檬酸中浸泡48 h后饲喂,能有效地改善奶山羊瘤胃液pH,使瘤胃pH < 5.6的时长降低,缓解瘤胃酸中毒的风险,减轻炎症反应,提高产奶量和乳脂率。沈宜钊[19]通过体外研究表明,用0.5%的柠檬酸浸泡玉米48 h可以有效增加玉米中抗性淀粉比例,提高玉米的瘤胃消化抗性,从而缓解SARA。Yang等[41]研究表明,玉米在1%乳酸或1%盐酸中浸泡48 h后饲喂肉牛,能显著提高肉牛瘤胃液pH,并降低肉牛瘤胃LPS浓度,且1%乳酸处理还可降低血浆中LPS浓度,说明使用乳酸等有机酸处理饲粮有利于预防SARA的发生。
4.2 保证饲粮中的物理有效纤维的供给提高饲粮的物理有效纤维(peNDF)水平,能够促进咀嚼,增加唾液产生和瘤胃缓冲能力,以及防止碳水化合物发酵过程中产生的大量有机酸造成的pH下降。德国要求奶牛全混合日粮(TMR)的干物质中粗纤维(CF)含量>18%,且粗饲料要占TMR的65%以上;NRC(2001)规定奶牛TMR中CF含量>25%,泌乳奶牛的peNDF含量应>15%[42]。除CF含量外,饲粮粒度也能刺激反刍和咀嚼,赵向辉等[43]研究表明,增加苜蓿干草粒度,提高了饲粮的peNDF含量,刺激山羊咀嚼并分泌唾液,提高了瘤胃液平均pH,从而缓解SARA。
可溶性纤维在瘤胃中发酵时不产生乳酸,且丙酸的产量也较低。倪海星等[44]以含有较高可溶性纤维的甜菜粕代替部分玉米,提高了肉牛的瘤胃液pH和养分消化率,且在不损害动物健康的前提下提高了日增重,降低了料重比,综合考虑甜菜粕替代玉米的适宜水平为67%。Mojtahedi等[45]以甜菜粕代替部分大麦籽粒,也提高了荷斯坦奶牛的咀嚼率、瘤胃pH和养分消化率。因此,可以考虑用甜菜颗粒粕替代玉米等高淀粉谷物来减轻其对瘤胃发酵造成的负面影响。
4.3 应用添加剂除了对饲料原料进行处理外,还可以通过添加缓冲剂、硫胺素、酵母和酵母培养物等物质来改善胃肠道的发酵环境,降低SARA的发病率。
肠道细菌会降解和发酵淀粉,且吸收效率比瘤胃高,但过量的过瘤胃淀粉进入小肠会使小肠淀粉消化率降低,而胰腺α-淀粉酶分泌不足是导致小肠淀粉消化率降低的主要原因。添加功能性氨基酸可促进胰腺酶的合成和分泌,从而提高小肠淀粉的消化率,促进能量的高效利用,且苯丙氨酸和亮氨酸分别是调控胰腺酶的最有效氨基酸[46]。Cao等[47]研究表明,在奶山羊十二指肠灌注亮氨酸或苯丙氨酸能有效改善奶山羊胰腺淀粉酶的表达和分泌,进而促进山羊肠道淀粉的消化。刘烨[48]在山羊和奶牛十二指肠中灌注亮氨酸,结果表明亮氨酸能促进α-淀粉酶分泌,进而提高小肠淀粉消化率,促进饲料的高效利用。
饲粮中添加硫胺素可以有效地缓解瘤胃酸中毒。Pan等[49]研究表明,奶牛瘤胃中注入硫胺素(180 mg/kg DM)可以改善VFA的比例、降低瘤胃液和血液中乳酸的浓度,从而减轻SARA时瘤胃液pH的下降。Zhang等[50]研究表明,在山羊饲粮中添加硫胺素(200 mg/kg DM)提高了瘤胃液pH,降低丁酸、乳酸和瘤胃LPS的浓度,改善了瘤胃内环境;并抑制NF-κB炎症信号通路的激活和炎细胞因子(IL-6和TNF-α)的合成。这些结果说明硫胺素可通过改善瘤胃发酵和减轻瘤胃炎症来缓解了SARA。
酵母和酵母培养物作为一种微生物发酵产物添加剂,主要通过稳定瘤胃液pH、乳酸产量减少和纤维消化能力增强来发挥作用。任胜男等[51]研究表明,非纤维性碳水化合物(NFC)/中性洗涤纤维(NDF)为2.30时,成功建立体外SARA模型,添加酵母培养物能提高瘤胃液pH和VFA浓度,并降低乳酸浓度,其中以添加底物干重的2.0%的酵母培养物对SARA的缓解作用最佳。Neubauer等[52]研究表明,在奶牛TMR中添加自溶酵母[15 g/(d·头)]可以在低pH期间对细菌菌群及其随后的发酵具有最显著的调节作用,能降低淀粉的发酵速率,从而降低SARA的发病率。
氢氧化镁、碳酸氢钠、氧化镁等缓冲剂经常被运用到奶牛饲粮中,因为它们的酸解离常数接近正常瘤胃液pH,具有较高的耗酸能力。Neville等[53]研究表明,在饲粮中加入0.9%碳酸氢钠可提高奶牛的瘤胃液pH。李林等[54]研究表明,在高精料饲粮的基础上添加复合缓冲剂(碳酸氢钠、氧化镁等混合),可以提高泌乳期山羊瘤胃液pH并减少瘤胃中LPS的释放,且对产奶量以及乳脂和乳蛋白含量的提高也具有一定作用。Alexd等[55]研究表明,在饲喂相同TMR的基础上分别添加0.4%氧化镁和0.8%碳酸氢钠,发现均提高了奶牛瘤胃液pH,且添加氧化镁可防止奶牛干物质摄入量和产奶量下降,而添加碳酸氢钠可防止奶牛产奶量下降,但不能阻止采食量的减少。
5 小结高精料饲喂模式在短时间内可以提高反刍动物的生产性能,但这种模式同时会损伤胃肠道,诱发SARA及后肠道酸中毒等营养代谢病。通过合理的谷物加工处理、保证饲粮中的物理有效纤维、使用添加剂等措施可以改善反刍动物的胃肠道健康。今后研究中一方面可以利用微生物组学、代谢组学等技术揭示高淀粉饲粮对反刍动物胃肠道健康的影响和作用机制;另一方面需研究更有效的谷物处理方法及合理精粗比来减缓高精料饲粮对胃肠道健康的影响,对于提高反刍动物生产性能和胃肠道健康具有重要意义。
| [1] |
SNYDER E, CREDILLE B. Diagnosis and treatment of clinical rumen acidosis[J]. Veterinary Clinics of North America: Food Animal Practice, 2017, 33(3): 451-461. DOI:10.1016/j.cvfa.2017.06.003 |
| [2] |
OETZEL G R. Diagnosis and management of subacute ruminal acidosis in dairy Herds[J]. Veterinary Clinics of North America: Food Animal Practice, 2017, 33(3): 463-480. DOI:10.1016/j.cvfa.2017.06.004 |
| [3] |
柳君辉, 董国忠, 田可. 高精料饲粮对反刍动物胃肠道微生物区系的影响及调控[J]. 动物营养学报, 2018, 30(12): 4821-4827. LIU J H, DONG G Z, TIAN K. Effects of high concentrate diets on gastrointestinal microflora in ruminants and its regulation[J]. Chinese Journal of Animal Nutrition, 2018, 30(12): 4821-4827 (in Chinese). |
| [4] |
李洋. 亚急性瘤胃酸中毒对奶山羊瘤胃上皮挥发性脂肪酸吸收的影响及其机制研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2019. LI Y.Effect of subacute rumen acidosis on the absorption of volatile fatty acids in the rumen epithelium of dairy goats and its mechanism research[D]. Master's Thesis.Hohhot: Inner Mongolia Agricultural University, 2019.(in Chinese) |
| [5] |
ZHANG R Y, ZHU W Y, JIANG L S, et al. Comparative metabolome analysis of ruminal changes in Holstein dairy cows fed low-or high-concentrate diets[J]. Metabolomics, 2017, 13(6): 74. DOI:10.1007/s11306-017-1204-0 |
| [6] |
CHERDTHONG A. Potential use of rumen digesta as ruminant diet—a review[J]. Tropical Animal Health and Production, 2020, 52(1): 1-6. DOI:10.1007/s11250-019-02018-6 |
| [7] |
PLAIZIER J C, LI S C, DANSCHER A M, et al. Changes in microbiota in rumen digesta and feces due to a grain-based subacute ruminal acidosis (SARA) challenge[J]. Microbial Ecology, 2017, 74(2): 485-495. DOI:10.1007/s00248-017-0940-z |
| [8] |
张瑞阳. 组学技术研究亚急性瘤胃酸中毒对奶牛瘤胃微生物、代谢和上皮功能的影响[D]. 博士学位论文. 南京: 南京农业大学, 2015. ZHANG R Y.Omics-based approaches to assess the effects of suabcute ruminal acidosis on rumen microbiota, metabolism and epithelial function in dairy cows[D]. Ph.D.Thesis.Nanjing: Nanjing Agricultural University, 2015.(in Chinese) |
| [9] |
FERNANDO S C, PURVIS Ⅱ H T, NAJAR F Z, et al. Rumen microbial population dynamics during adaptation to a high-grain diet[J]. Applied and Environmental Microbiology, 2010, 76(22): 7482-7490. DOI:10.1128/AEM.00388-10 |
| [10] |
LIU J H, BIAN G R, ZHU W Y, et al. High-grain feeding causes strong shifts in ruminal epithelial bacterial community and expression of Toll-like receptor genes in goats[J]. Frontiers in Microbiology, 2015, 6: 167. |
| [11] |
MAO S Y, HUO W J, ZHU W Y. Microbiome-metabolome analysis reveals unhealthy alterations in the composition and metabolism of ruminal microbiota with increasing dietary grain in a goat model[J]. Environmental Microbiology, 2016, 18(2): 525-541. DOI:10.1111/1462-2920.12724 |
| [12] |
卢劲晔, 黄智南, 沈赞明. 反刍动物瘤胃上皮的结构特点[J]. 黑龙江畜牧兽医, 2014(16): 50-52. LU J Y, HUANG Z N, SHEN Z M. Structure features of rumen epithelium in ruminants[J]. Heilongjiang Animal Science and Veterinary Medicine, 2014(16): 50-52 (in Chinese). |
| [13] |
STEELE M A, GREENWOOD S L, CROOM J, et al. An increase in dietary non-structural carbohydrates alters the structure and metabolism of the rumen epithelium in lambs[J]. Canadian Journal of Animal Science, 2012, 92(2): 123-130. DOI:10.4141/cjas2011-095 |
| [14] |
STEELE M A, CROOM J, KAHLER M, et al. Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J]. American Journal of Physiology-Regulatory, Integrative and Comparative physiology, 2011, 300(6): R1515-R1523. DOI:10.1152/ajpregu.00120.2010 |
| [15] |
JENSEN C, WEISBJERG M R, NORGAARD P, et al. Effect of maize silage maturity on site of starch and NDF digestion in lactating dairy cows[J]. Animal Feed Science and Technology, 2005, 118(3/4): 279-294. |
| [16] |
MATTHÉ A, LEBZIEN P, HRIC I, et al. Influence of prolonged adaptation periods on starch degradation in the digestive tract of dairy cows[J]. Animal Feed Science and Technology, 2003, 103(1/2/3/4): 15-27. |
| [17] |
CORONA L, OWENS F N, ZINN R A. Impact of corn vitreousness and processing on site and extent of digestion by feedlot cattle[J]. Journal of Animal Science, 2006, 84(11): 3020-3031. DOI:10.2527/jas.2005-603 |
| [18] |
PLASCENCIA A, BERM U ' DEZ R M, CERVANTES M, et al. Influence of processing method on comparative digestion of white corn versus conventional steam-flaked yellow dent corn in finishing diets for feedlot cattle[J]. Journal of Animal Science, 2011, 89(1): 136-141. DOI:10.2527/jas.2010-3116 |
| [19] |
沈宜钊. 日粮淀粉来源与有机酸预处理玉米对奶山羊瘤胃酸中毒的影响及机制[D]. 博士学位论文. 扬州: 扬州大学, 2018. SHEN Y Z.Effect and mechanism of dietary starch source and organic acid pretreated corn on ruminal acidosis in dairy goats[D]. Ph.D. Thesis.Yangzhou: Yangzhou University, 2018.(in Chinese) |
| [20] |
DANSCHER A M, LI S C, ANDERSEN P H, et al. Indicators of induced subacute ruminal acidosis (SARA) in Danish Holstein cows[J]. Acta Veterinaria Scandinavica, 2015, 57(1): 39. DOI:10.1186/s13028-015-0128-9 |
| [21] |
MAO S Y, ZHANG R Y, WANG D S, et al. The diversity of the fecal bacterial community and its relationship with the concentration of volatile fatty acids in the feces during subacute rumen acidosis in dairy cows[J]. BMC Veterinary Research, 2012, 8: 237. DOI:10.1186/1746-6148-8-237 |
| [22] |
LI S, KHAFIPOUR E, KRAUSE D O, et al. Effects of subacute ruminal acidosis challenges on fermentation and endotoxins in the rumen and hindgut of dairy cows[J]. Journal of Dairy Science, 2012, 95(1): 294-303. DOI:10.3168/jds.2011-4447 |
| [23] |
LIU J H, XU T T, ZHU W Y, et al. High-grain feeding alters caecal bacterial microbiota composition and fermentation and results in caecal mucosal injury in goats[J]. British Journal of Nutrition, 2014, 112(3): 416-427. DOI:10.1017/S0007114514000993 |
| [24] |
薛春旭. 高精料日粮对山羊小肠微生物发酵、微生物区系及上皮形态结构的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2017. XUE C X.The impact of high concentrate diet on small intestinal fermentation, microbial community and epithelial morphology of goats[D]. Master's Thesis.Nanjing: Nanjing Agricultural University, 2017.(in Chinese) |
| [25] |
WANG Y, XU L, LIU J H, et al. A high grain diet dynamically shifted the composition of mucosa-associated microbiota and induced mucosal injuries in the colon of sheep[J]. Frontiers in Microbiology, 2017, 8: 2080. DOI:10.3389/fmicb.2017.02080 |
| [26] |
YE H M, LIU J H, FENG P F, et al. Grain-rich diets altered the colonic fermentation and mucosa-associated bacterial communities and induced mucosal injuries in goats[J]. Scientific Reports, 2016, 6: 20329. DOI:10.1038/srep20329 |
| [27] |
TAO S Y, TIAN J, CONG R H, et al. Activation of cellular apoptosis in the caecal epithelium is associated with increased oxidative reactions in lactating goats after feeding a high-concentrate diet[J]. Experimental Physiology, 2015, 100(3): 278-287. DOI:10.1113/expphysiol.2014.083352 |
| [28] |
LI S, YOON I, SCOTT I, et al. Impact of Saccharomyces cerevisiae fermentation product and subacute ruminal acidosis on production, inflammation, and fermentation in the rumen and hindgut of dairy cows[J]. Animal Feed Science and Technology, 2016, 211: 50-60. DOI:10.1016/j.anifeedsci.2015.10.010 |
| [29] |
QUMAR M, KHIAOSA-ARD R, KLEVENHUSEN F, et al. Gastrointestinal endotoxin and metabolic responses in cows fed and recovered from two different grain-rich challenges[J]. Livestock Science, 2017, 203: 120-123. DOI:10.1016/j.livsci.2017.07.015 |
| [30] |
SUN X, YUAN X, CHEN L, et al. Histamine induces bovine rumen epithelial cell inflammatory response via NF-κB pathway[J]. Cellular Physiology and Biochemistry, 2017, 42(3): 1109-1119. DOI:10.1159/000478765 |
| [31] |
HAO C X, LIU G W, LI X B, et al. Inflammatory mechanism of rumenitis in dairy cows with subacute ruminal acidosis[J]. BMC Veterinary Research, 2018, 14(1): 135. DOI:10.1186/s12917-018-1463-7 |
| [32] |
赵晨旭. SARA奶牛瘤胃炎性反应发生机制及瘤胃上皮SLC22A转运蛋白的变化[D]. 博士学位论文, 长春: 吉林大学, 2019. ZHAO C X.The mechanism of inflammation of rumen and the changes of rumen epithelial SLC22A transporter proteins in dairy cows with SARA[D]. Ph.D. Thesis.Changchun: Jilin University, 2019.(in Chinese) |
| [33] |
赵芳芳, 王洪荣, 张营, 等. 谷物作为反刍动物能量饲料的营养特性及高谷物饲粮对消化道健康的影响[J]. 动物营养学报, 2020, 32(6): 2476-2482. ZHAO F F, WANG H R, ZHANG Y, et al. Nutritional characteristics of grain as energy feed for ruminants and effects of high-grain diet on gastrointestinal tract health[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2476-2482 (in Chinese). |
| [34] |
PLAIZIER J C, DANESH MESGARAN M, DERAKHSHAN H, et al. Review: enhancing gastrointestinal health in dairy cows[J]. Animal, 2018, 12(S2): S399-S418. |
| [35] |
WANG Y, GREER D, MCALLISTER T A, et al. Effects of moisture, roller setting, and saponin-based surfactant on barley processing, ruminal degradation of barley, and growth performance by feedlot steers[J]. Journal of Animal Science, 2003, 81(9): 2145-2154. DOI:10.2527/2003.8192145x |
| [36] |
曹玉伟, 丁健, 李艳玲. 蒸汽压片玉米在奶牛生产中的应用研究进展[J]. 中国畜牧兽医, 2018, 45(5): 1211-1218. CAO Y W, DING J, LI Y L. Research progress of steam-flaked corn and its application in dairy cattle production[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(5): 1211-1218 (in Chinese). |
| [37] |
GIGER-REVERDIN S, RIGALMA K, DESNOYERS M, et al. Effect of concentrate level on feeding behavior and rumen and blood parameters in dairy goats: relationships between behavioral and physiological parameters and effect of between-animal variability[J]. Journal of Dairy Science, 2014, 97(7): 4367-4378. DOI:10.3168/jds.2013-7383 |
| [38] |
HARDER H, KHOL-PARISINI A, ZEBELI Q. Modulation of resistant starch and nutrient composition of barley grain using organic acids and thermal cycling treatments[J]. Starch-Stärke, 2015, 67(7/8): 654-662. |
| [39] |
DECKARDT K, METZLER-ZEBELI B U, ZEBELI Q. Processing barley grain with lactic acid and tannic acid ameliorates rumen microbial fermentation and degradation of dietary fibre in vitro[J]. Science of Food and Agriculture, 2016, 96(1): 223-231. DOI:10.1002/jsfa.7085 |
| [40] |
SHEN Y Z, DING L Y, CHEN L M, et al. Feeding corn grain steeped in citric acid modulates rumen fermentation and inflammatory responses in dairy goats[J]. Animal, 2019, 13(2): 301-308. DOI:10.1017/S1751731118001064 |
| [41] |
YANG Y, DONG G Z, WANG Z, et al. Treatment of corn with lactic acid or hydrochloric acid modulates the rumen and plasma metabolic profiles as well as inflammatory responses in beef steers[J]. BMC Veterinary Research, 2018, 14(1): 408. DOI:10.1186/s12917-018-1734-3 |
| [42] |
汤利民, 王文丹, 苏衍菁, 等. 预防亚急性瘤胃酸中毒的营养调控措施[J]. 中国奶牛, 2019(4): 9-13. TANG L M, WANG W D, SU F Q, et al. Nutritional regulation measures for preventing subacute rumen acidosis[J]. China Dairy Cattle, 2019(4): 9-13 (in Chinese). |
| [43] |
赵向辉, 张涛, 徐明, 等. 苜蓿干草粒度对山羊采食行为、瘤胃pH和瘤胃内养分降解动力学的影响[J]. 动物营养学报, 2010, 22(5): 1293-1300. ZHAO X H, ZHANG T, XU M, et al. Effects of alfalfa hay particle size on eating behavior, ruminal pH, and nutrient digestion kinetics of goats[J]. Chinese Journal of Animal Nutrition, 2010, 22(5): 1293-1300 (in Chinese). |
| [44] |
倪海星, 赵慧敏, 王铁岗. 甜菜粕替代玉米对肉牛生长性能及瘤胃发酵成分的影响[J]. 中国饲料, 2019(12): 89-93. NI H X, ZHAO H M, WANG T G. Effects of dietary sugar beet pulp substitute of corn on growth performance, rumen fermentation and nutrient digestibility of beef[J]. China Feed, 2019(12): 89-93 (in Chinese). |
| [45] |
MOJTAHEDI M, DANESH MESGARAN M. Effects of the inclusion of dried molassed sugar beet pulp in a low-forage diet on the digestive process and blood biochemical parameters of Holstein steers[J]. Livestock Science, 2011, 141(2/3): 95-103. |
| [46] |
姚军虎. 反刍动物碳水化合物高效利用的综合调控[J]. 饲料工业, 2013, 34(17): 1-12. YAO J H. Comprehensive control of efficient utilization of carbohydrates in ruminants[J]. Feed Industry, 2013, 34(17): 1-12 (in Chinese). |
| [47] |
CAO Y C, YANG X J, GUO L, et al. Regulation of pancreas development and enzymatic gene expression by duodenal infusion of leucine and phenylalanine in dairy goats[J]. Livestock Science, 2018, 216: 9-15. DOI:10.1016/j.livsci.2018.03.010 |
| [48] |
刘烨. 十二指肠灌注亮氨酸对奶牛胰腺外分泌功能及血液指标的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2013. LIU Y.Effect of duodenal perfusion with leucine on exocrine function of pancreas and blood indexes in dairy cows[D]. Master's Thesis.Yangling: Northwest Agriculture and Forestry University, 2013.(in Chinese) |
| [49] |
PAN X H, YANG L, XUE F G, et al. Relationship between thiamine and subacute ruminal acidosis induced by a high-grain diet in dairy cows[J]. Journal of Dairy Science, 2016, 99(11): 8790-8801. DOI:10.3168/jds.2016-10865 |
| [50] |
ZHANG H, PENG A L, ZHAO F F, et al. Thiamine ameliorates inflammation of the ruminal epithelium of Saanen goats suffering from subacute ruminal acidosis[J]. Journal of Dairy Science, 2020, 103(2): 1931-1943. DOI:10.3168/jds.2019-16944 |
| [51] |
任胜男, 金亚倩, 赵芳芳, 等. 酵母培养物对山羊亚急性瘤胃酸中毒体外发酵模型的调控作用[J]. 动物营养学报, 2020, 32(5): 2263-2272. REN S N, JIN Y Q, ZHAO F F, et al. Regulating effects of yeast culture on subacute ruminal acidosis fermentation model in vitro in goats[J]. Chinese Journal of Animal Nutrition, 2020, 32(5): 2263-2272 (in Chinese). |
| [52] |
NEUBAUER V, PETRI R, HUMER E, et al. High-grain diets supplemented with phytogenic compounds or autolyzed yeast modulate ruminal bacterial community and fermentation in dry cows[J]. Journal of Dairy Science, 2018, 101(3): 2335-2349. DOI:10.3168/jds.2017-13565 |
| [53] |
NEVILLE E W, FAHEY A G, GATH V P, et al. The effect of calcareous marine algae, with or without marine magnesium oxide, and sodium bicarbonate on rumen pH and milk production in mid-lactation dairy cows[J]. Journal of Dairy Science, 2019, 102(9): 8027-8039. |
| [54] |
李林, 曹洋, 权素玉, 等. 添加复合缓冲剂对高精料饲喂泌乳奶山羊乳品质的改善及机制[J]. 食品科学, 2017, 38(1): 188-192. LI L, CAO Y, QUAN S Y, et al. Improvement and underlying mechanism of milk quality of lactating goats fed high concentrate diet by dietary supplementation of composite buffer[J]. Food Science, 2017, 38(1): 188-192 (in Chinese). |
| [55] |
ALEX B, ISABEL G, GUILLERMO E, et al. Modulation of rumen pH by sodium bicarbonate and a blend of different sources of magnesium oxide in lactating dairy cows submitted to a concentrate challenge[J]. Journal of Dairy Science, 2018, 101(11): 9777-9788. |




