2. 新疆生产建设兵团塔里木畜牧科技重点实验室, 阿拉尔 843300
2. Key Laboratory of Tarim Animal Husbandry Science and Technology, Xinjiang Production & Construction Corps, Alar 843300, China
反刍动物瘤胃是一种复杂的微生物发酵系统,其中主要有细菌、原虫、真菌三大类以及少量噬菌体,它们在瘤胃内起到了将饲粮中的纤维物质转化为营养物质的重要作用[1-3]。据估算,每克瘤胃液中细菌总数为1010~1011个、原虫数量为105~106个(瘤胃原生动物可能占瘤胃微生物量的50%[4])及厌氧真菌(游离孢子)数量为103~105个[5]。反刍动物具有通过瘤胃细菌、原虫和真菌的高特异性种群的底物特异性酶活性消化植物多糖的能力[6]。其中瘤胃中各种酶的种类和数量受动物的年龄和饲粮类型的影响较大,而碳水化合物需要依靠这些酶系消化;当反刍动物采食量增加时,瘤胃液原虫数量会随之减少,与此同时,果胶酶和纤维素酶活性增加较缓慢,木聚糖酶和淀粉酶活性增加较快[7-8]。饲粮中有50%~70%的纤维类营养物质在瘤胃被消化,部分在大肠被微生物发酵;而淀粉以及多糖类物质在消化道内降解[9]。由于瘤胃微生物的多样性与微生物、饲粮与宿主三者相互之间复杂的结构互惠共生的关系,使得反刍动物营养研究的热点主要集中在瘤胃调控等方面[10-11]。很多学者研究认为,瘤胃微生物菌群具有稳定性和可变性的特点,在奶牛不同生理阶段组成结构也不相同,其菌群的相互作用随奶牛生理状态改变,有助于促进奶牛的健康生长和提高生产性能[12-14]。pH是衡量瘤胃微生物发酵及消化饲粮的一个重要指标,饲喂高精料较多时,可以降低反刍动物咀嚼时间,加快饲料降解速率,随着饲粮在胃部的流动,可提高挥发性脂肪酸(VFA)及丙酸浓度,降低瘤胃pH、甲烷及乙酸浓度[15-17];当瘤胃pH在6.46~6.80时,纤维素消化可以达到适宜环境[18-20];饲粮中粗纤维含量较多时,纤维降解酶在瘤胃中的比例升高,寡糖降解酶比例降低[21];饲粮中粗蛋白质含量增多时,瘤胃消化道内消化酶活性明显提高[18]。前人的研究表明,饲粮类型、饲粮加工工艺及营养水平等均对反刍动物瘤胃pH、消化酶活性以及瘤胃微生物的数量有明显的影响,并且有关瘤胃内环境的研究多集中于不同饲粮组成对瘤胃VFA、氨态氮浓度及瘤胃微生物等方面的影响。然而,对反刍动物不同时间点瘤胃pH、消化酶活性及原虫数量变化的研究鲜见报道。因此,本试验以瘤胃瘘管奶牛为试验动物,通过测定分析反刍动物采食饲粮前后不同时间点的瘤胃pH、消化酶活性、原虫数量动态变化及种类组成,旨在探索瘤胃微生物环境日变化规律,以期为进一步调控瘤胃功能和鉴定原虫形态提供基础数据。
1 材料与方法 1.1 试验动物及饲养管理选择3头体重为(500±30) kg、泌乳胎次为2~4、健康状况良好、装永久性瘤胃瘘管的干乳期荷斯坦奶牛作为试验瘤胃液供体,分圈单独饲养。在塔里木大学动物科学学院实训基地开展试验,试验预试期前3天进行驱虫,自由饮水;每日在09:30和18:30各饲喂1次,每次投喂量为22.5 kg,持续采食时间为3 h左右。
1.2 试验设计为稳定奶牛瘤胃微生物区系,试验预试期14 d,正试期7 d。正试期第1、4、7天的09:00、12:00、14:00、16:00、18:00、21:00、23:00采集瘤胃液,测定各时间点瘤胃的pH、蛋白酶、淀粉酶、果胶酶、木聚糖酶、纤维素酶的活性、原虫数量及种类组成。
1.3 试验饲粮试验所用基础饲粮根据NRC(2001)饲养标准配制,可满足干乳期奶牛的维持营养需要,基础饲粮组成及营养水平见表 1。基础饲粮的精粗比控制在30 ∶ 70;其中甜高粱种植于阿拉尔市10团农场,蜡熟期收割后,青贮于塔里木大学动物科学学院实训基地青贮窖内。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
基础饲粮中干物质(DM)、粗蛋白质(CP)、钙(Ca)、磷(P)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)等常规养分含量参照张丽英[22]《饲料分析及饲料质量检测技术》中的方法测定;产奶净能(NEL)计算公式[23]如下:
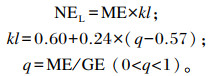
|
式中:kl是代谢能转化为净能的效率系数;q为饲料的代谢能与总能比值系数;总能(GE)、代谢能(ME)、NEL单位为MJ/kg。
1.4 样品采集及指标测定方法 1.4.1 瘤胃液的采集通过奶牛瘤胃瘘管采集瘤胃前、中、后3个部位的瘤胃食糜,用手将瘤胃食糜中瘤胃液挤压于保温瓶中,不同部位瘤胃液混合装置,将采集混匀的瘤胃液迅速带回实验室,备用。
1.4.2 瘤胃pH的测定7个时间点未过滤瘤胃液各取100 mL,每个时间点瘤胃液样品重复测定4次,用pH计(pHSJ-5,上海仪电科学仪器有限公司)测定其pH。
1.4.3 瘤胃消化酶活性的测定采用相应的酶联免疫试剂盒(购自上海邦奕生物科技有限公司)对蛋白酶、淀粉酶、木聚糖酶、纤维素酶、果胶酶5种酶活性进行测定,具体操作按试剂盒说明书进行。
1.4.4 瘤胃原虫的计数参照王加启[24]《反刍动物营养学研究方法》中瘤胃原虫方法进行计数,计算公式如下:

|
根据在400倍的显微镜下进行观察,并参照冯仰廉[25]《反刍动物营养学》中提供的原虫标准图谱进行比对,从属水平上对瘤胃原虫进行鉴定分析。
1.5 数据处理试验数据采用SPSS 21.0统计分析软件的one-way ANOVA程序进行单因素方差分析,以Duncan氏法进行多重比较,结果用平均值和SEM表示,P < 0.05为差异显著。
2 结果与分析 2.1 各时间点瘤胃pH、消化酶活性及原虫数量动态变化由表 2可见,随时间变化,瘤胃pH整体差异极显著(P < 0.01),在6.58~6.80上下浮动,即在奶牛采食前瘤胃pH均处在较高水平,采食后随饲粮进入瘤胃,瘤胃pH迅速降低,然后随瘤胃中饲粮减少,瘤胃pH逐渐恢复至采食前水平。奶牛采食前(09:00和18:00)瘤胃pH均高于采食5 h后(09:00—14:00和18:00—23:00)瘤胃pH,且瘤胃pH均差异显著(P < 0.05)。
|
|
表 2 各时间点瘤胃pH、消化酶活性及原虫数量动态变化 Table 2 Dynamic changes of rumen pH, digestive enzyme activities and protozoa number at different time points |
由表 2可知,在瘤胃蛋白酶和淀粉酶活性方面,随时间变化,瘤胃中蛋白酶、淀粉酶活性整体差异极显著(P < 0.01),分别在156.16~173.26 U/L、31.25~34.54 U/mL变化,即在奶牛采食前这2个酶活性均维持在较低水平,采食后随饲粮进入瘤胃,酶活性迅速升高,然后随饲粮消化,酶活性逐渐下降恢复至采食前水平。在第1次采食前(09:00)酶活性均低于第1次采食3 h后(09:00—12:00)酶活性,且酶活性均差异显著(P < 0.05);在第2次采食前(18:00)酶活性均低于第2次采食5 h后(18:00—23:00)酶活性,且蛋白酶活性差异显著(P < 0.05),但淀粉酶活性差异不显著(P>0.05)。
由表 2可见,在瘤胃果胶酶、木聚糖酶、纤维素酶活性方面,随时间变化,瘤胃中果胶酶活性整体差异极显著(P < 0.01),木聚糖酶活性整体差异显著(P < 0.05),纤维素酶活性整体差异极显著(P < 0.01),分别在11.67~22.55 U/mL、1 003.82~1 286.96 U/L、13.98~21.85 mU/L发生变化,即在奶牛采食前3种酶活性维持在相对较低水平,采食后随饲粮进入瘤胃,酶活性缓慢升高(木聚糖酶活性迅速升高),然后随饲粮消化,酶活性逐渐下降,在较长时间维持较高水平,且第1次采食前(09:00)酶活性略高于第2次采食前(18:00)酶活性,最终恢复至采食前水平。在第1次采食前(09:00)酶活性均低于第1次采食5 h后(09:00—14:00)酶活性,且酶活性均差异显著(P < 0.05);在第1次采食前(18:00)酶活性均低于第1次采食5 h后(18:00—23:00)酶活性,且酶活性均差异显著(P < 0.05),但木聚糖酶活性差异不显著(P>0.05)。
由表 2可知,在瘤胃原虫数量方面,随时间变化,每毫升瘤胃液原虫数量整体差异不显著(P=0.38),在2.67×105~4.00×105个凹凸变化,即在奶牛采食前原虫数量相对较高,采食后随着饲粮进入瘤胃,瘤胃内容物被稀释,原虫数量缓慢降低,然后随食糜的排空,原虫数量逐渐恢复至甚至高于原来水平,但采食前后原虫数量均差异不显著(P>0.05)。在采食前(09:00和18:00)原虫数量比较接近,每毫升瘤胃液分别含有3.47×105和3.20×105个,均高于采食3 h后(09:00—12:00和18:00—21:00)瘤胃原虫数量,但均差异不显著(P>0.05)。
2.2 瘤胃原虫形态学鉴定对瘤胃原虫染色后,在400倍的显微镜下观察鉴定出了6个属的12种原虫,结果如下:
厚毛属(Dasytricha):周身纤毛,纤毛与虫体中轴呈倾斜螺旋排列,有一个收缩空泡,无骨板(图 1-1)。
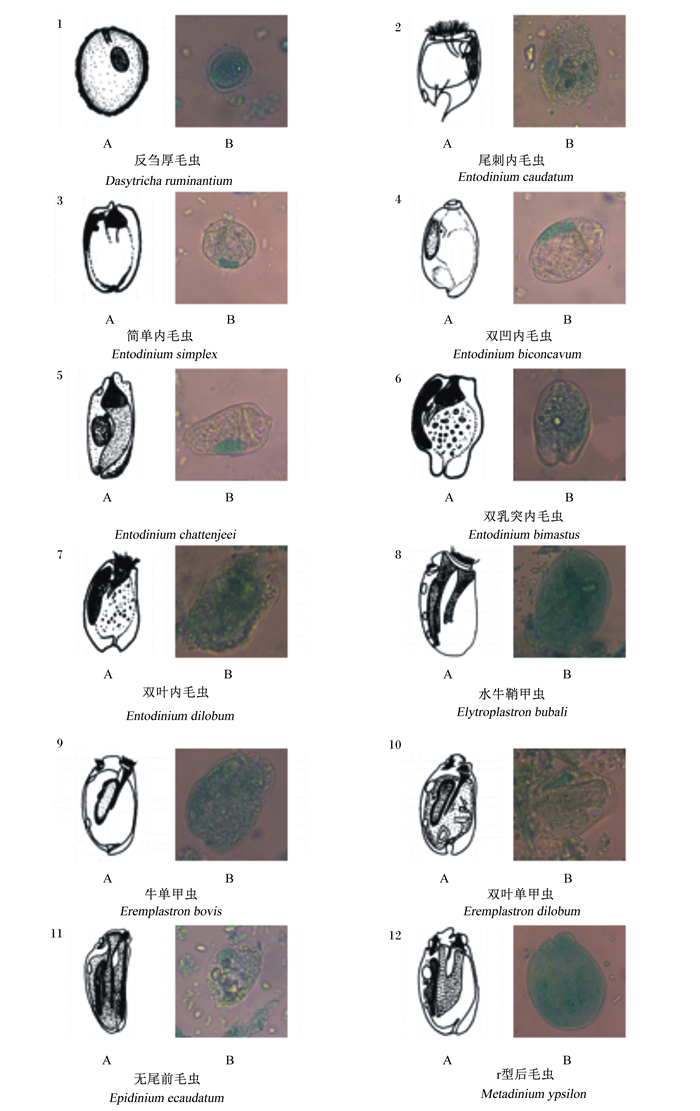
|
A:标准图谱;B:观察图谱。 A: standard atlas; B: observation atlas. 图 1 光学显微镜下的瘤胃原虫形态学对比鉴定结果 Fig. 1 Morphological comparison and identification results of rumen protozoa under light microscope (400×) |
内毛属(Entodinium):种类最多,头部单处纤毛,无骨板,但因福尔马林的作用,纤毛向内缩在光学显微镜下基本看不到(图 1-2至图 1-7)。
鞘甲属(Elytroplastron):主要特征是具有4块骨板,虫体的上面的体表下(较大的2块)和底面的体表下(较长的位于左侧,较小的位于有前端)各2块骨板,一般4个收缩空泡排列在大核的左面(图 1-8)。
单甲属(Eremplastron):仅有1块骨板,位于虫体上面,前端位于近口唇下面,随核延伸(图 1-9至图 1-10)。
前毛属(Epidinium):有2束复合纤毛带,但在不同的水平(图 1-11)。
后毛属(Metadinium):后毛属属于内毛目双毛亚科,此属最大特征是大核类似“E”字型(图 1-12)。
3 讨论 3.1 瘤胃pH瘤胃pH对维持瘤胃微生物的生长代谢发挥着重要作用,影响其变化的因素众多(饲粮组成、唾液分泌、瘤胃发酵产物利用、吸收效率等),其中饲粮的组成结构是关键性因素[26-27]。本研究的结果表明,随时间变化,奶牛采食前瘤胃pH均处在较高水平,采食后随饲粮进入瘤胃,瘤胃pH迅速降低,最后恢复至采食前水平。王晓佳[28]认为,各时间点瘤胃pH呈现凹凸线型变化,在采食3 h以后呈现最低值;王淑玲等[29]研究表明,如果瘤胃中VFA浓度超过唾液的缓冲能力和瘤胃上皮的吸收能力就会导致瘤胃内VFA的积累和长时间的低pH状态;崔爽青[30]研究认为,原虫降低了淀粉转化为VFA的速率,间接的缓冲了瘤胃pH,稳定瘤胃内环境,均与本试验结果趋势一致。这说明了瘤胃pH的变化与食糜在瘤胃中降解产生VFA的量及唾液中缓冲盐相互作用密不可分[27]。
3.2 瘤胃中消化酶活性瘤胃微生物分泌的各种酶参与了饲粮在瘤胃内消化的过程,微生物数量及活力决定了消化酶活性及饲粮消化速率[31];其中蛋白酶和淀粉酶活性可以直观表现出瘤胃中蛋白分解菌和淀粉分解菌的数量及活力,果胶酶、木聚糖酶和纤维素酶活性可以直观表现出瘤胃纤维分解菌的数量及活力[32]。微生物的生长速度与营养物质存在很强相关性,它分泌的酶是其消化活动的表现[33]。
本试验研究表明,在不同时间点的瘤胃蛋白酶和淀粉酶活性变化趋势较相似,果胶酶、木聚糖酶和纤维素酶活性变化趋势基本相似。酶活性与其底物降解是相适应的,这5种酶在奶牛采食前酶活性较低,在采食后因其容易消化,前2种酶活性快速上升,从而导致其活性维持较高的时间比纤维素酶及果胶酶短;后3种酶活性缓慢增加,这一结果与瘤胃消化降解粗纤维的消化生理功能是相一致的,后3种酶的主要功能是降解非淀粉多糖(NSP),在一定程度上能反映瘤胃降解NSP的能力[34]。杨开伦等[35]研究表明,蛋白酶活性最高值出现在绵羊采食后3 h左右,然后在8 h左右下降至采食前的蛋白酶活性;李钰琪等[36]研究中绵羊采食饲粮(试验Ⅰ期对照组)后,瘤胃液蛋白酶和纤维素酶活性呈先升高后下降的变化趋势;王晓东等[37]、蔡娟[38]研究表明,对照组小尾寒羊公羊的瘤胃液中蛋白酶、淀粉酶、果胶酶、木聚糖酶、纤维素酶在不同时间点的活性均呈先升高后下降的趋势,这些趋势变化均与本试验研究的结果一致。奶牛在采食后,纤维素酶、果胶酶、木聚糖酶活性的增加,有利于粗纤维的消化降解,可为奶牛提供更多营养物质。由于NSP类物质结构复杂,相比淀粉类、糖类更不易消化。因此,以上纤维素酶、果胶酶活性缓慢的上升速度正是适应其降解NSP特性的表现。
瘤胃反刍活动一般在夜间进行,特别是在天刚黑时最活跃[39],而且只有在奶牛大量采食较长的纤维饲粮时才会出现[40];加之秸秆类饲粮中纤维素、木聚糖、果胶又是植物细胞壁的主要成分,三者按顺序由外向内排列于植物细胞壁[41]。这解释了奶牛在第2次采食前(18:00)比第1次采食前(09:00)纤维素酶、木聚糖酶及果胶酶的活性维持在较高水平且持久性较长的现象。孙盛楠等[42]研究表明,在给山羊饲用苎麻青贮时,长纤维青贮饲料可以让纤维素酶活性随着时间的延长维持在一个相对较高的水平(晨饲后6 h纤维素酶活性显著高于晨饲后0.5 h),这也与本试验研究结果一致。综上所述,饲喂反刍动物的饲粮精粗比例、饲粮长度、瘤胃微生物数量及活力不同等因素可以改变瘤胃中几种主要消化酶活性在不同时间点变化趋势。
3.3 瘤胃原虫数量变化瘤胃原虫数量变化应该根据动物种类、采食时间、食糜停留时间、生理状况、内容物稀释率、外流速率、饲粮类型、个体等不同条件进行综合评定[43-45]。本试验研究发现,随时间变化,奶牛采食前原虫数量相对较高,采食后随着饲粮进入瘤胃,原虫数量缓慢降低,最后原虫数量逐渐恢复甚至高于原来水平。巴桑珠扎等[44]研究证明,伴随黄牛采食饲粮及饮水,瘤胃液排空,原虫数量明显下降,随后由于瘤胃中养分增加,其数量显示上升,这一结果解释了瘤胃原虫在不同时间点的数量变化因素。王帅等[46]、方翟等[47]、王晓东等[37]研究表明,饲喂基础饲粮后,瘤胃液的原虫数量和不同属的原虫频率在各个时间虽然有降有升,但均差异不显著,这与本试验研究结果一致。综上所述,瘤胃原虫数量变化是因为瘤胃内容物被稀释,原虫数量缓慢降低,随着新的可利用的营养物质进入瘤胃,原虫将其利用,导致数量有所增加,然后使其维持于一个动态范围内。
3.4 瘤胃原虫形态学鉴定通过在光学显微镜下观察,鉴别出了Dasytricha的反刍厚毛虫;Entodinium的尾刺内毛虫、简单内毛虫、双凹内毛虫、Entodinium chattenjeei、双乳突内毛虫和双叶内毛虫;Elytroplastron的水牛鞘甲虫;Eremplastron的牛单甲虫和双叶单甲虫;Epidinium的无尾前毛虫;Metadinium的r型后毛虫;共6个属12种瘤胃原虫,其中50%为Entodinium的原虫。蔡娟等[48]、崔爽青等[49]及De la Fuente等[50]研究发现,在瘤胃原虫中鉴别后发现,Entodinium的原虫所占比例最高,与本研究结果一致,从而进一步证明了该属的原虫有吞食淀粉和可溶性糖的能力,同时宿主采食高精饲粮后种属的数量显著升高[50-52]。目前国内对瘤胃原虫种属鉴别比较全面的是吐尔逊阿依[53]在塔里木马鹿瘤胃中共鉴别出16个属176种原虫;其次是桂荣等[54]对牛瘤胃纤毛虫种类共检出了18个属57种纤毛虫。而随着分子生物的发展,不同的分子鉴别技术的完善,对原虫种属及数量鉴别方法也越来越多,如Lin等[55]利用454焦磷酸测序法、Kittelmann等[56]利用变性梯度凝胶电泳(PCR-DGGE)技术、Singh等[57]利用实时荧光定量(real-time PCR)技术及刘旗[58]利用MiSeq测序平台等各项技术方法均能鉴别出更多的瘤胃原虫种属及数量。综上所述,本试验鉴别瘤胃原虫种属及数量比较少的原因,是受鉴别技术、原虫密度及自溶性等因素的影响。
4 结论① 在奶牛采食前后,随时间变化,瘤胃pH均差异显著;原虫数量差异不显著;蛋白酶、果胶酶、纤维素酶、淀粉酶、木聚糖酶活性均差异显著,后2种酶活性在第2次采食前后差异不显著。
② 本次试验共鉴别出了Dasytricha、Entodinium、Elytroplastron、Eremplastron、Epidinium和Metadinium 6个属的12种原虫,其中50%属于Entodinium的原虫。
| [1] |
吐尔逊阿依·赛买提, 钱文熙, 敖维平, 等. 不同纤维水平饲粮对塔里木马鹿瘤胃原虫种群结构的影响[J]. 甘肃农业大学学报, 2018, 53(2): 13-22. TURSUNAY S, QIAN W X, AO W P, et al. Effects of different fiber levels on population structure of the Tarim wapiti rumen protozoa[J]. Journal of Gansu Agricultural University, 2018, 53(2): 13-22 (in Chinese). |
| [2] |
WANG S Q, ZHANG G M, ZHANG P Y, et al. Rumen fluid fermentation for enhancement of hydrolysis and acidification of grass clipping[J]. Journal of Environmental Management, 2018, 220: 142-148. |
| [3] |
FRANCO A, MASOT J, REDONDO E. Ontogenesis of the rumen: a comparative analysis of the Merino sheep and Iberian red deer[J]. Animal Science Journal, 2011, 82(1): 107-116. DOI:10.1111/j.1740-0929.2010.00814.x |
| [4] |
WILLIAMS C L, THPMAS B J, MCEWAN N R, et al. Rumen protozoa play a significant role in fungal predation and plant carbohydrate breakdown[J]. Frontiers in Microbiology, 2020, 11: 720. DOI:10.3389/fmicb.2020.00720 |
| [5] |
陈代文, 王恬. 动物营养与饲养学[M]. 北京: 中国农业出版社, 2011. CHEN D W, WANG T. Animal nutrition and feeding[M]. Beijing: China Agriculture Press, 2011 (in Chinese). |
| [6] |
KREHBIEL C R. Invited review: applied nutrition of ruminants: fermentation and digestive physiology[J]. The Professional Animal Scientist, 2014, 30(2): 129-139. DOI:10.15232/S1080-7446(15)30100-5 |
| [7] |
雷智嘉, 雒秋江, 黄振, 等. 多聚甲醛对牛瘤胃消化酶活性及营养物质消化的影响[J]. 动物营养学报, 2019, 31(11): 5080-5088. LEI Z J, LUO Q J, HUANG Z, et al. Effects of paraformaldehyde on activities of digestive enzymes of rumen and nutrient digestion in cattle[J]. Chinese Journal of Animal Nutrition, 2019, 31(11): 5080-5088 (in Chinese). |
| [8] |
赵恒波, 罗海玲, 徐永锋, 等. 羔羊消化器官的早期生长发育和瘤胃内主要消化酶活性的变化[J]. 中国畜牧杂志, 2006, 42(11): 15-18. ZHAO H B, LUO H L, XU Y F, et al. Study on early development of gastrointestinal tract and activities of main digestive enzymes in rumen of lamb[J]. Chinese Journal of Animal Science, 2006, 42(11): 15-18 (in Chinese). |
| [9] |
赵亚军. 高精料条件下奶牛复合益生菌的筛选[D]. 硕士学位论文. 晋中: 山西农业大学, 2019. ZHAO Y J.Screening of compound probiotics for dairy cows fed high concentrate diets[D].Master's Thesis.Jinzhong: Shanxi Agricultural University, 2019.(in Chinese) |
| [10] |
BUCHON N, BRODERICK N A, LEMAITRE B. Gut homeostasis in a microbial world: insights from Drosophila melanogaster[J]. Nature Reviews Microbiology, 2013, 11(9): 615-626. DOI:10.1038/nrmicro3074 |
| [11] |
陈旭伟. 不同皂苷对山羊瘤胃原虫和细菌种属变化以及纤维降解的影响[D]. 硕士学位论文. 扬州: 扬州大学, 2009. CHEN X W.Effects of different saponins on species variety of rumen protozoa and pacteria and fiber digestibilities[D].Master's Thesis.Yangzhou: Yangzhou University, 2009.(in Chinese) |
| [12] |
LIMA F S, OIKONOMOU G, LIMA S F, et al. Prepartum and postpartum rumen fluid microbiomes: characterization and correlation with production traits in dairy cows[J]. Applied and Environmental Microbiology, 2015, 81(4): 1327-1337. DOI:10.1128/AEM.03138-14 |
| [13] |
DERAKHSHANI H, TUN H M, CARDOSO F C, et al. Linking peripartal dynamics of ruminal microbiota to dietary changes and production parameters[J]. Frontiers in Microbiology, 2017, 7: 2143. |
| [14] |
MINUTI A, PALLADINO A, KHAN M J, et al. Abundance of ruminal bacteria, epithelial gene expression, and systemic biomarkers of metabolism and inflammation are altered during the peripartal period in dairy cows[J]. Journal of Dairy Science, 2015, 98(12): 8940-8951. DOI:10.3168/jds.2015-9722 |
| [15] |
GIGER-REVERDIN S, RIGALMA K, DESNOYERS M, et al. Effect of concentrate level on feeding behavior and rumen and blood parameters in dairy goats: relationships between behavioral and physiological parameters and effect of between-animal variability[J]. Journal of Dairy Science, 2014, 97(7): 4367-4378. DOI:10.3168/jds.2013-7383 |
| [16] |
YANG W Z, BEAUCHEMIN K A. Physically effective fiber: method of determination and effects on chewing, ruminal acidosis, and digestion by dairy cows[J]. Journal of Dairy Science, 2006, 89(7): 2618-2633. DOI:10.3168/jds.S0022-0302(06)72339-6 |
| [17] |
DOREAU M, VAN DER WERF H M G, MICOL D, et al. Enteric methane production and greenhouse gases balance of diets differing in concentrate in the fattening phase of a beef production system[J]. Journal of Animal Science, 2011, 89(8): 2518-2528. DOI:10.2527/jas.2010-3140 |
| [18] |
王娇, 杨宝钰, 阿依古丽·艾买尔, 等. 日粮添加甜高粱与苜蓿混贮对卡拉库尔羊消化道酶活性的影响[J/OL]. 中国畜牧杂志, 2020: 1-14. (2020-07-03)[2020-07-10]. https://doi.org/10.19556/j.0258-7033.20200108-04. WANG J, YANG B Y, AYGUL A, et al.Effect of dietary supplementation of sweet sorghum and alfalfa silage mixtures on enzyme activity of digestive tract of Karakul sheep[J/OL].Chinese Journal of Animal Science, 2020: 1-14.(2020-07-03)[2020-07-10].https://doi.org/10.19556/j.0258-7033.20200108-04.(in Chinese) |
| [19] |
ZHANG R Y, ZHU W Y, JIANG L S, et al. Comparative metabolome analysis of ruminal changes in Holstein dairy cows fed low- or high-concentrate diets[J]. Metabolomics, 2017, 13(6): 74. DOI:10.1007/s11306-017-1204-0 |
| [20] |
赵天章, 李慧英, 闫素梅. 反刍动物饲料纤维物质瘤胃降解规律研究进展[J]. 畜牧与饲料科学, 2011, 32(9/10): 158-160, 164. ZHAO T Z, LI H Y, YAN S M. Research progress in rumen degradation of ruminant feed fiber[J]. Animal Husbandry and Feed Science, 2011, 32(9/10): 158-160, 164 (in Chinese). |
| [21] |
张辉, 丛立新, 魏园, 等. 不同纤维源日粮下东北梅花鹿瘤胃微生物功能基因的宏基因组分析[J]. 中国兽医学报, 2020, 40(7): 1391-1396. ZHANG H, CONG L X, WEI Y, et al. Effect of different crude fiber source diets on rumen gene function of Sika deer[J]. Chinese Journal of Veterinary Science, 2020, 40(7): 1391-1396 (in Chinese). |
| [22] |
张丽英. 饲料分析及饲料质量检测技术[M]. 4版. 北京: 中国农业大学出版社, 2016. ZHANG L Y. Feed analysis and quality test technology[M]. 4th ed. Beijing: China Agricultural University Press, 2016 (in Chinese). |
| [23] |
黄亚宇, 司如, 陈晓波, 等. 牛、绵羊和山羊饲养精要: 动物营养需要与饲料成分表[M]. 北京: 中国农业大学出版社, 2013. HUANG Y Y, SI R, CHEN X B, et al. Essentials of feeding cattle, sheep and goats: animal nutrition needs and feed composition table[M]. Beijing: China Agricultural University Press, 2013 (in Chinese). |
| [24] |
王加启. 反刍动物营养学研究方法[M]. 北京: 现代教育出版社, 2011. WANG J Q. Methods in ruminant nutrition research[M]. Beijing: Modern Education Press, 2011 (in Chinese). |
| [25] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2006. FENG Y L. Ruminant nutrition[M]. Beijing: Science Press, 2006 (in Chinese). |
| [26] |
JIANG F G, LIN X Y, YAN Z G, et al. Effects of forage source and particle size on chewing activity, ruminal pH, and saliva secretion in lactating Holstein cows[J]. Animal Science Journal, 2019, 90(3): 382-392. DOI:10.1111/asj.13153 |
| [27] |
王洪荣. 反刍动物瘤胃酸中毒机制解析及其营养调控措施的研究进展[C]//第七届中国饲料营养学术研讨会论文集. 郑州: 中国畜牧兽医学会动物营养学分会, 2014: 1. WANG H R.Mechanism analysis and nutritional strategies for prevention of sub-acute ruminal acidosis in ruminants[C]//Proceedings of the 7th Chinese Symposium on Feed Nutrition.Zhengzhou: Animal Nutrition Branch of Chinese Animal Husbandry and Veterinary Association, 2014: 1.(in Chinese) |
| [28] |
王晓佳. 瘤胃内不同时间不同位点pH值的变化规律[J]. 当代畜牧, 2017(20): 10-11. WANG X J. Changes of pH value in rumen at different time points[J]. Contemporary Animal Husbandry, 2017(20): 10-11 (in Chinese). |
| [29] |
王淑玲, 王后福, 盖叶顶, 等. 反刍动物生成VFA的研究进展[J]. 中国草食动物科学, 2019, 39(5): 46-49. WANG S L, WANG H F, GAI Y D, et al. Advances in research on the production of VFA by ruminants[J]. China Herbivore Science, 2019, 39(5): 46-49 (in Chinese). |
| [30] |
崔爽青. 营养素感应与绵羊瘤胃原虫细胞生长的协同作用研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2018. CUI S Q.Study on synergistic of nutrient sensing and cell growth in sheep rumen protozoa[D].Master's Thesis.Hohhot: Inner Mongolia Agricultural University, 2018.(in Chinese) |
| [31] |
李鹤琼, 刘强, 王聪, 等. 2-甲基丁酸对断奶前后犊牛瘤胃发酵、酶活及纤维分解菌菌群的影响[J]. 畜牧兽医学报, 2015, 46(12): 2218-2226. LI H Q, LIU Q, WANG C, et al. Effects of 2-methylbutyrate supplementation on rumen fermentation, enzyme activities and cellulolytic bacteria in pre-and post-weaning dairy calves[J]. Chinese Journal of Animal and Veterinary Sciences, 2015, 46(12): 2218-2226 (in Chinese). |
| [32] |
张牧州, 郝小燕, 项斌伟, 等. 玉米皮和大豆皮组合替代玉米和玉米秸秆对育肥羊生长性能和瘤胃代谢的影响[J]. 动物营养学报, 2020, 32(2): 765-774. ZHANG M Z, HAO X Y, XIANG B W, et al. Effects of replacing corn and corn straw with corn husk and soybean hulls combination on growth performance and rumen metabolism in fattening sheep[J]. Chinese Journal of Animal Nutrition, 2020, 32(2): 765-774 (in Chinese). |
| [33] |
NRC.Ruminant nitrogen usage[S].Washington, D.C.: National Academies Press, 1985.
|
| [34] |
刘焕. 奶牛瘤胃微生物非淀粉多糖酶的利用[J]. 中国乳业, 2014(12): 46-47. LIU H. Utilization of non starch polysaccharide enzyme from rumen microorganism of dairy cattle[J]. China Dairy, 2014(12): 46-47 (in Chinese). |
| [35] |
杨开伦, 许键, 余雄, 等. 绵羊瘤胃微生物胞外蛋白酶的动态及纯化[J]. 八一农学院学报, 1993, 16(3): 60-66. YANG K L, XU J, YU X, et al. Dynamics and purification of extracellular protease from rumen microorganisms of sheep[J]. Journal of Bayi Agricultural College, 1993, 16(3): 60-66 (in Chinese). |
| [36] |
李钰琪, 王彩蝶, 屯妮萨·麦提赛伊迪, 等. 醋酸棉酚对绵羊瘤胃微生物数量及消化代谢的影响[J]. 动物营养学报, 2019, 31(7): 3421-3430. LI Y Q, WANG C D, TUNISA M, et al. Effects of gossypol acetate on rumen microbial population and digestion and metabolism in sheep[J]. Chinese Journal of Animal Nutrition, 2019, 31(7): 3421-3430 (in Chinese). |
| [37] |
王晓东, 雒秋江, 臧长江, 等. 不同添加水平多聚甲醛对绵羊瘤胃微生物数量及消化酶活性的影响[J]. 中国畜牧兽医, 2019, 46(3): 719-731. WANG X D, LUO Q J, ZANG C J, et al. Effects of different supplemental doses of paraformaldehyde on the microorganism quantity and activities of digestive enzymes in the rumen of sheep[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(3): 719-731 (in Chinese). |
| [38] |
蔡娟. 口服高、低剂量福尔马林和祛原虫对绵羊瘤胃微生物数量和消化酶活性的影响[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2017. CAI J.Effects of oral administration with high and low dose of formalin and fauna-free on rumen microbial number and activities of digestive enzyme of sheep[D].Master's Thesis.Urumqi: Xinjiang Agricultural University, 2017.(in Chinese) |
| [39] |
杜健. 奶牛养殖技术[M]. 北京: 北京理工大学出版社, 2013. DU J. Dairy farming technology[M]. Beijing: Beijing Institute of Technology Press, 2013 (in Chinese). |
| [40] |
王加启, 吴克谦, 张倩, 等. 肉牛高效益饲养技术[M]. 北京: 金盾出版社, 2008. WANG J Q.High benefit feeding technology of beef cattle[M].Beijing: Jindun Publishing House, 2008.(in Chinese) |
| [41] |
李昭锋, 曹潇, 朱杰, 等. 细菌纤维素在植物细胞壁结构与功能研究中的应用及进展[J]. 食品科学, 2020, 41(19): 263-271. LI Z F, CAO X, ZHU J, et al. Advances in bacterial cellulose in the study of structure and function of plant cell wall[J]. Food Science, 2020, 41(19): 263-271 (in Chinese). |
| [42] |
孙盛楠, 林谦, 向海, 等. 不同长度的饲用苎麻青贮对黑山羊瘤胃发酵参数及纤维素酶活性的影响[J]. 动物营养学报, 2019, 31(1): 477-484. SUN S N, LIN Q, XIANG H, et al. Effects of different lengths of feeding-ramie silage on rumen fermentation parameters and cellulase activities of black goats[J]. Chinese Journal of Animal Nutrition, 2019, 31(1): 477-484 (in Chinese). |
| [43] |
刘春龙, 李忠秋, 孙海霞, 等. 纤毛虫对反刍动物瘤胃内环境指标、营养物质代谢的影响的研究[J]. 家畜生态, 2004, 25(3): 57-60. LIU C L, LI Z Q, SUN H X, et al. Effects of ciliate on rumen inner circumstance and metabolism of nutriment[J]. Journal of Domestic Animal Ecology, 2004, 25(3): 57-60 (in Chinese). |
| [44] |
巴桑珠扎, 李斌, 刘柳, 等. 西藏黄牛瘤胃微生物及瘤胃液物质特征值研究[J]. 畜牧兽医科学(电子版), 2019(5): 6-7. BASANG Z Z, LI B, LIU L, et al. Study on the characteristic values of rumen microbes and rumen fluid substance in Tibet yellow cattle[J]. Graziery Veterinary Sciences (Electronic Version), 2019(5): 6-7 (in Chinese). |
| [45] |
高爱武, 侯先志, 石彩霞, 等. 体外发酵条件下不同稀释率对牛瘤胃纤毛虫种属变化的影响[J]. 内蒙古农业大学学报, 2003, 24(4): 31-34. GAO A W, HOU X Z, SHI C X, et al. Effects of different dilution rate on protozoa population in rumen under conditions of external fermentation[J]. Journal of Inner Mongolia Agricultural University, 2003, 24(4): 31-34 (in Chinese). |
| [46] |
王帅, 贾琦珍, 陈根元, 等. 小花棘豆黄酮对瘤胃原虫和纤维素降解菌的影响[J]. 中国饲料, 2015(6): 11-13, 16. WANG S, JIA Q Z, CHEN G Y, et al. Effects of flavonoid from oxytropis glabra DC on rumen protozoa and cellulolytic bacteria in vivo[J]. China Feed, 2015(06): 11-13, 16 (in Chinese). |
| [47] |
方翟, 苏皮·赛迪, 吐尔逊阿依·赛买提, 等. 添加青绿饲料对塔里木马鹿瘤胃原虫数量的影响[J]. 黑龙江畜牧兽医, 2016(21): 210-213, 298-299. FANG D, SUPI S, TURSUNAY S, et al. Effect of adding green feed on the quantity of rumen protozoa in Tarim wapiti[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(21): 210-213, 298-299 (in Chinese). |
| [48] |
蔡娟, 雒秋江, 王选, 等. 口服福尔马林和祛原虫对绵羊瘤胃微生物群落和消化酶活性的影响[J]. 中国畜牧兽医, 2016, 43(10): 2578-2590. CAI J, LUO Q J, WANG X, et al. Effect of the oral formalin and fauna-free on the microbiocoenosis and activities of digestive enzymes in the rumen of sheep[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(10): 2578-2590 (in Chinese). |
| [49] |
崔爽青, 李胜利, 孙海洲, 等. 反刍动物瘤胃原虫的化学感知及信号通路研究进展[J]. 家畜生态学报, 2018, 39(11): 1-5. CUI S Q, LI S L, SUN H Z, et al. Advances in chemical sensing and signal transduction of ruminal protozoa in ruminants[J]. Journal of Domestic Animal Ecology, 2018, 39(11): 1-5 (in Chinese). |
| [50] |
DE LA FUENTE G, BELANCHE A, ABECIA L, et al. Rumen protozoal diversity in the spanish ibex (Capra pyrenaica hispanica) as compared with domestic goats (Capra hircus)[J]. European Journal of Protistology, 2009, 45(2): 112-120. |
| [51] |
CARBERRY C A, KENNY D A, HAN S, et al. Effect of phenotypic residual feed intake and dietary forage content on the rumen microbial community of beef cattle[J]. Applied and Environmental Microbiology, 2012, 78(14): 4949-4958. |
| [52] |
常维毅. 不同季节日粮组成对狍瘤胃微生物区系、瘤胃内环境及血清生化指标的影响[D]. 博士学位论文. 长春: 吉林大学, 2012. CHANG W Y.Effects of ration of different seasons on microbial flora and environment of rumen and biochemical indicators of serum for roe deer[D].Ph.D.Thesis.Changchun: Jilin University, 2012.(in Chinese) |
| [53] |
吐尔逊阿依·赛买提. 饲粮不同NDF水平对塔里木马鹿瘤胃内环境及原虫种群结构的影响[D]. 硕士学位论文. 阿拉尔: 塔里木大学, 2018. TURSUNAY S.Effects of different NDF levels on ruminal environment and rumen protozoan population structure of Tarim wapiti[D].Master's Thesis.Alar: Tarim University, 2018.(in Chinese) |
| [54] |
桂荣, 今井壮一. 关于中国内蒙古牛瘤胃纤毛虫种类构成的研究[J]. 畜牧兽医学报, 1989, 20(2): 168-175. GUI R, SOICHI I. Rumen ciliate protozoal fauna and composition of the cattle in Nei-Mongol, China[J]. Chinese Journal of Animal and Veterinary Sciences, 1989, 20(2): 168-175 (in Chinese). |
| [55] |
LIN B, HENDERSON G, ZOU C X, et al. Characterization of the rumen microbial community composition of buffalo breeds consuming diets typical of dairy production systems in Southern China[J]. Animal Feed Science and Technology, 2015, 207: 75-84. |
| [56] |
KITTELMANN S, JANSSEN P H. Characterization of rumen ciliate community composition in domestic sheep, deer, and cattle, feeding on varying diets, by means of PCR-DGGE and clone libraries[J]. FEMS Microbiology Ecology, 2011, 75(3): 468-481. |
| [57] |
SINGH K M, TRIPATHI A K, PANDYA P R, et al. Dasytricha dominance in Surti buffalo rumen revealed by 18S rRNA sequences and real-time PCR assay[J]. Current Microbiology, 2011, 63(3): 281-288. |
| [58] |
刘旗. 复合抗菌肽"态康利保"对山羊瘤胃纤毛虫种群结构及常见纤毛虫数量的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2018. LIU Q.Effects of compound antimicrobial peptides "Taikanglibao" on the community structure and the number of common ciliates population in the rumen of goats[D].Master's Thesis.Ya'an: Sichuan Agricultural University, 2018.(in Chinese) |




