2. 青海大学农牧学院, 西宁 810016;
3. 甘南藏族自治州畜牧工作站, 合作 747000
2. College of Agriculture and Animal Husbandry, Qinghai University, Xining 810016, China;
3. Gannan Tibetan Autonomous Prefecture Animal Husbandry Workstation, Hezuo 747000, China
牦牛(Bos grunniens)是长毛牛属中唯一生活在平均海拔3 000 m以上地区的特有牛种[1]。我国牦牛的饲养管理受分布地区艰苦的环境、落后的生产方式影响而处于滞后状态,牧民依靠天然放牧且较少进行补饲。随着科技的进步,牦牛的饲养方式也在发生转变,传统牧养已无法适应社会发展,牦牛饲养方式正由轮牧到全舍饲饲养转变。近年来,在农牧交错带推广牦牛季节性舍饲育肥被认为是缩短养殖周期、提高生产力和改良肉品质的主要途径[2]。陈科宇[3]针对麦洼牦牛在冬春两季不同饲养方式下的经济效益和生长性能进行了研究,发现冷季舍饲育肥组的体重极显著高于自然放牧组。动物机体生长发育受多种外在因素(饲养方式、圈舍条件、温度、营养水平等)以及动物自身(血液生化指标、酶、激素水平等)的影响,表现在体尺和体重的变化。阿依努尔·托合提等[4]研究了栓系和散栏这2种饲养方式对肉牛增重性能的影响,发现散栏饲养组的日增重比栓系饲养组提高了21.8%。饲粮能量利用率也是影响动物生产性能的重要因素,利用率的高低主要取决于饲粮能量水平[5]。李亚茹等[6]在冷季对饲喂不同能量水平饲粮的舍饲牦牛的生长性能进行了测定,结果表明,随着饲粮能量水平的变化,平均日增重也发生变化。反刍动物对营养物质的吸收与转化均离不开瘤胃[7]。在目前的研究中,饲粮被认为是影响瘤胃微生物区系的主要因素[8]。对瘤胃微生物区系进行研究,有助于认识瘤胃这个复杂的动态系统,在高效利用饲料、提高动物生产等方面具有重要意义。
因此,本试验参考国内外肉牛育肥经验,结合当地农牧交错带的实际条件,设计了栓系和散栏2种饲养方式和低、中、高3种饲粮能量水平,探究不同饲养方式和饲粮能量水平对牦牛生长性能、瘤胃发酵参数和瘤胃菌群的影响,以期为农牧交错带牦牛的饲养管理和牦牛产业合理的提质增效提供一定的理论依据。
1 材料与方法 1.1 试验设计采用3×2双因素试验设计,即低、中、高3种饲粮能量水平和栓系、散栏2种饲养方式,选取体重(269.75±35.46) kg、体型接近、健康状况良好的同龄段公牦牛60头,随机分为6组,分别为栓系低能组(TL组)、栓系中能组(TM组)、栓系高能组(TH组)、散栏低能组(CL组)、散栏中能组(CM组)、散栏高能组(CH)组,每组10头。按照我国《肉牛饲养标准》[9](NY/T 815—2004)中体重300 kg、日增重1 kg肉牛营养需求,以80%全株青贮玉米和20%小麦秸秆为粗饲料,以玉米、小麦麸、菜籽粕、小苏打、氯化钠、预混料为精料补充料原料,配制综合净能(NEmf)分别为5.51(低能量水平)、6.22(中能量水平)、6.94 MJ/kg(高能量水平)的3种试验饲粮,精料补充料组成及TMR营养水平见表 1。
|
|
表 1 精料补充料组成及TMR营养水平(干物质基础) Table 1 Composition of concentrate supplement and nutrient levels of TMR (DM basis) |
饲养试验在甘肃省临夏回族自治州八坊清河源公司进行,预试期15 d,正试期90 d。试验牛入舍前对牛舍进行全面消毒杀菌,所有参试牛进行常规体况检查,驱虫、免疫并编号。试验期间,每天认真观察牛的采食、饮水、反刍和排便等状况,并做好记录。各组牦牛每天定时(08:00和17:00)饲喂2次,每次每头牛饲喂4 kg全株青贮玉米、1 kg小麦秸秆和2 kg精料补充料,采用全混合日粮(TMR)饲喂方式,期间自由饮水,定期对牛栏进行打扫和消毒。
1.3 样品采集试验结束当天,每组随机选取3头牛,屠宰后采集瘤胃液,用于测定瘤胃发酵参数和瘤胃菌群组成与多样性。将采集的瘤胃液彻底混合并用4层纱布过滤,立即测定瘤胃pH;取约50 mL用于测定氨态氮(NH3-N)和挥发性脂肪酸(VFA)浓度;另取2 mL用于DNA的提取及下一步的测序分析。将瘤胃液分装后迅速投入液氮中,然后转移至-80 ℃冰箱保存,以备送检。
1.4 指标测定 1.4.1 生长性能测定分别于试验第1、30、60、90天进行体重测量,计算试验第1、2、3个月的增重;通过记录的采食量和增重数据,计算试验全期的平均日增重、干物质采食量和料重比。
1.4.2 瘤胃发酵参数测定瘤胃液pH使用pHSJ-3型pH测定仪测定。瘤胃液挥发性脂肪酸浓度使用安捷伦气相色谱仪(Agilent 7890A GC System,美国)采用气相色谱法测定,气相色谱仪内装氢火焰离子化检测器(FID),载气为高纯氮气,柱温箱参数:程序升温75~190 ℃,检测器参数:氢气流量30 mL/min,空气流量400 mL/min,氢火焰离子化检测器温度为300 ℃。瘤胃液氨态氮浓度采用Broderick等[10]的方法测定。
1.4.3 瘤胃微生物多样性使用AxyPrep Bacterial Genomic DNA Miniprep Kit DNA(南京建成生物工程研究所)试剂盒提取试验样品DNA,荧光分光光度计(NanoDrop 2000,美国)测定DNA浓度和纯度。使用1%的琼脂糖凝胶电泳检测DNA的质量。采用细菌V3~V4可变区通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA V3~V4可变区进行PCR扩增。PCR产物混合后利用2%琼脂糖凝胶回收PCR产物,AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,美国)纯化,2%琼脂糖凝胶电泳检测,并用QuantusTM Fluorometer(Promega, 美国)对回收产物进行定量检测。使用NEXTFLEX® Rapid DNA-Seq Kit建库,构建好的文库利用Illumina公司的MiSeq PE300/NovaSeq PE250平台进行测序(上海美吉生物医药科技有限公司)。
1.5 生物信息学分析测序结束后,用Flash 1.2.7进行reads拼接,Qiime 1.7.0进行tags质控过滤,Uchime algorithm去除嵌合体序列,根据barcode确定对应样品,去除barcode和引物序列,在97%的相似度下用Qiime 1.7.0将序列归为多个分类操作单元(operational taxonomic unit,OTU),对序列进行比对分析,挑选每个OTU中丰度最高的序列为代表序列,使用RDP Classifier 2.2进行物种注释,得到OTU的分类信息,利用Qiime 1.7.0和R software 4.0.2计算α多样性指数——Chao1、Shannon、Simpson、ACE指数及物种覆盖度(Coverage),统计各个样品每个OTU中的丰度信息,获得Unweight Unifrac距离矩阵,利用非加权平均(UPGMA)法进行聚类,利用R语言作图,同时对微生物群落进行Unifrac分析,判断不同样品遗传学上的距离远近,比较样品间的差异。
1.6 数据统计与分析试验数据经Excel 2010初步整理,再用SPSS 21.0进行一般线性模型(GLM)双因素方差分析,采用Duncan氏法进行多重比较,显著水平为P<0.05,数据均以平均值和均值标准误(SEM)的形式表示。
2 结果与分析 2.1 饲养方式和饲粮能量水平对牦牛生长性能的影响由表 2可知,在栓系饲养方式下,牦牛的终末体重和平均日增重均随饲粮能量水平的增加而升高,TH组显著高于TL和TM组(P<0.05);在散栏饲养方式下,牦牛的终末体重和平均日增重均随饲粮能量水平的增加呈现先升高后降低的趋势,CM组显著高于CL组(P<0.05)。在栓系饲养方式下,牦牛的料重比随饲粮能量水平的增加显著降低(P<0.05);在散栏饲养方式下,CM组牦牛的料重比最小,显著低于CL和CH组(P<0.05)。饲养方式和饲粮能量水平的交互作用对牦牛的终末体重和料重比具有显著影响(P<0.05)。
|
|
表 2 饲养方式和饲粮能量水平对牦牛生长性能的影响 Table 2 Effects of feeding model and dietary energy level on growth performance of yaks (n=10) |
由表 3可知,在栓系和散栏2种饲养方式下,瘤胃液pH均随饲粮能量水平的增加表现出下降的趋势,但差异不显著(P>0.05)。瘤胃液NH3-N浓度以CM组最低,显著低于CL、CH、TL和TH组(P<0.05),与TM组差异不显著(P>0.05)。在栓系和散栏2种饲养方式下,瘤胃液乙酸浓度均随饲粮能量水平的增加而显著降低(P<0.05)。在栓系饲养方式下,瘤胃液丙酸浓度随饲粮能量水平的增加而升高,但组间差异不显著(P>0.05);在散栏饲养方式下,瘤胃液丙酸浓度随饲粮能量水平的增加先升高而后降低,CM组显著高于CH和CL组(P<0.05)。在栓系饲养方式下,随着饲粮能量水平的增加,乙丙比显著升高(P<0.05)。
|
|
表 3 饲养方式和饲粮能量水平对牦牛瘤胃发酵参数的影响 Table 3 Effects of feeding model and dietary energy level on rumen fermentation parameters of yaks (n=10) |
18个样本下机数据经过优化后共得到1 014 202条优化序列。采用RDP classifier贝叶斯算法对97%相似度的OTU进行分类学分析,18个样本中共注释得到24个门,52个纲,116个目,194个科,377个属,772个种以及3 109个OTU。
维恩图(图 1)显示,6组之间共有1 683个OTU,CL组特有59个OTU,CM组特有34个OTU,CH组特有53个OTU,TL组特有16个OTU,TM组特有8个OTU,TH组特有10个OTU,表明各组OTU组成相似度较高,差异较小。
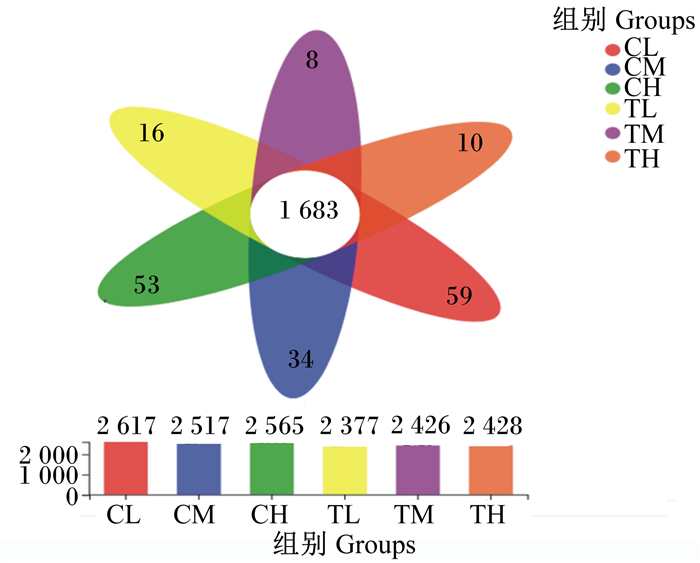
|
图 1 维恩图 Fig. 1 Venn graph |
样品稀释曲线一般用来说明样本的取样大小是否合理,通过稀释曲线,可以反映样本取样深度的情况。本试验采用多样性指数sobs(表征实际观测到的物种数目)作图,由图 2可知,各样本稀释曲线趋于平坦,说明测序量足够。
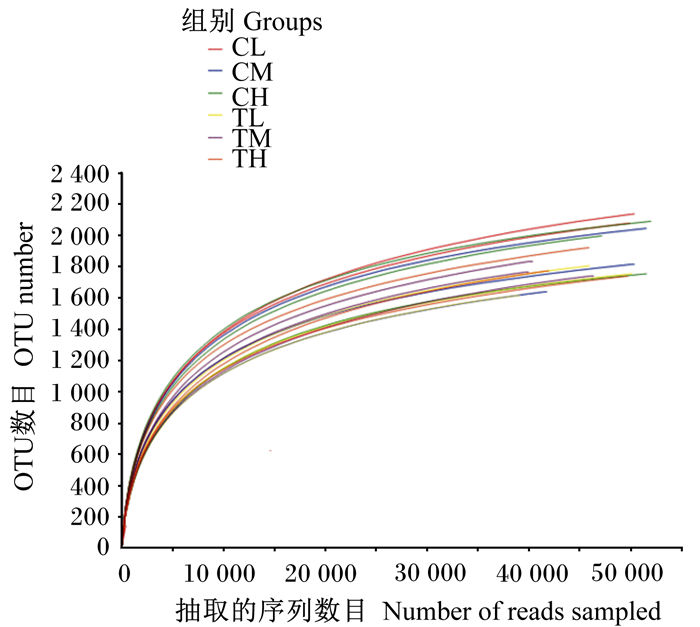
|
在97%序列相似性的基础上绘出的6个组共18个个体的稀释曲线。 Rarefaction curves of 18 individuals in 6 groups drawn on the basis of 97% sequence similarity. 图 2 稀释曲线 Fig. 2 Rarefaction curves |
牦牛瘤胃菌群α多样性分析结果(表 4)显示,在栓系饲养方式下,随着饲粮能量水平的提高,ACE和Chao1指数逐渐降低,TH组显著低于TL和TM组(P<0.05);在散栏饲养方式下,随着饲粮能量水平的提高,ACE和Chao1指数显著降低(P<0.05)。Coverage能较好地反映样本的测序深度,6组样本的Coverage均在0.99以上,说明本次测序结果能代表样本的真实情况。
|
|
表 4 牦牛瘤胃菌群α多样性分析 Table 4 α diversity analysis of rumen bacterial community of yaks |
由图 3-A和表 5可知,在门水平上,6个组的优势菌门均为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes),其次为杆状菌门(Patescibacteria)、放线菌门(Actinobacteria)、互养菌门(Synergistetes)和疣微菌门(Verrucomicrobia),但各优势菌门的相对丰度有所不同。在栓系饲养方式下,拟杆菌门的相对丰度随饲粮能量水平的增加而升高,TH组显著高于TL组(P<0.05);在散栏饲养方式下,CM组拟杆菌门的相对丰度最高,显著高于CH组(P<0.05),与CL组的差异不显著(P>0.05)。
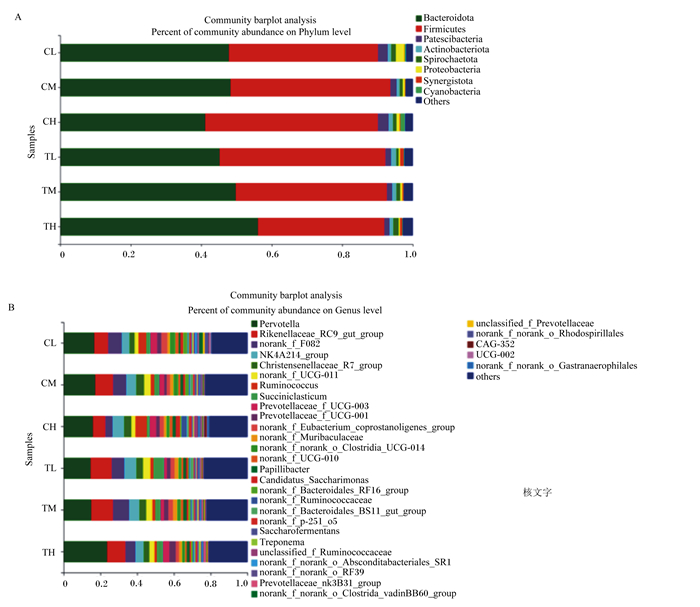
|
A:门水平phylum level。Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Patescibacteria:杆状菌门;Actinobacteria:放线菌门;Synergistetes:互养菌门;Verrucomicrobia:疣微菌门;Spirochaetae:螺旋体门;Proteobacteria:变形菌门;Others:其他。 B:属水平genus level。Prevotella:普雷沃氏菌属;Rikenellaceae_RC9_gut_group:理研菌科RC-9肠道群;Christensenellaceae_R-7_group:克里斯滕森菌科R-7群;Prevotellaceae_UCG-001:普雷沃氏菌科UCG-001;Papillibacter:乳杆菌属;Fretibacterium:傍小杆属;Lachnospiraceae_NK3A20:毛螺菌科NK3A20;Lachnospiraceae_XPB1014:毛螺菌科XPB1014;Butyrivibrio:丁酸弧菌属;Treponema:密螺旋体属;Roseburia:罗斯氏菌属;Lachnospiraceae_ND3007:毛螺菌科ND3007;Others:其他。 图 3 各组牦牛瘤胃菌群结构 Fig. 3 Bacterial structure in rumen of different groups |
|
|
表 5 牦牛瘤胃菌群门水平的组成 Table 5 Composition at phylum level of rumen bacterial community of yaks (n=10) |
由图 3-B和表 6可知,在属水平上,6个组的优势菌属均为普雷沃氏菌属(Prevotella)、理研菌科RC-9肠道群(Rikenellaceae_RC9_gut_group)、克里斯滕森菌科R-7群(Christensenellaceae_R-7_group)和norank_UCG-011,其相对丰度均在2%以上。在栓系饲养方式下,普雷沃氏菌属的相对丰度随饲粮能量水平的增加而升高,TH组的相对丰度显著高于TM和TL组(P<0.05);散栏饲养方式下,普雷沃氏菌属的相对丰度各组间差异不显著(P>0.05)。
|
|
表 6 牦牛瘤胃菌群属水平组成 Table 6 Composition at genus level of rumen bacterial community of yaks (n=10) |
本试验中,栓系组和散栏组牦牛的平均增重分别为58.73和67.87 kg,平均日增重分别为652.7和754.2 g/d,散栏组比栓系组高出15.6%。赵育国等[11]研究了栓系与散栏饲养方式对肉牛生长性能和营养物质表观消化率的影响,结果显示,与栓系组相比,散栏组肉牛采食量和日增重都有所提高。赵广永[12]结合动物生理特点分析认为肉牛的栓系饲养不利于其生长发育,不利于其对饲料的消化吸收和自身机体在冬天的御寒保暖。
本试验同时发现,在饲养的3个月中,各组牦牛的月增重均呈现先增加后降低的趋势,第3个月的增重最低。分析原因可能是由于第1个月各组牦牛被分配到新的养殖环境中,对当地的养殖环境如海拔、温度等表现出一定的应激,使得第1个月牦牛的增重小于第2个月;第2个月时牦牛已经适应了当地环境和饲粮结构,各组的整体增重高于第1个月,栓系组牦牛第1个月还保持着它原来的食欲,但在第2个月由于运动量减少,长时间导致胃肠蠕动减弱,消化代谢和吸收缓慢,第2个月散栏组的增重略高于栓系组;第3个月最冷,牦牛摄入的能量除了维持机体正常的生理活动,还需用于维持体温的恒定和皮下脂肪的生成等,因此第3个月的增重最少。
本试验中,在栓系饲养方式下,牦牛的平均日增重随着饲粮能量水平的升高而增加,各组间差异显著,与Brown等[13]的研究结果一致;在散栏饲养方式下,随着饲粮能量水平的升高,牦牛的平均日增重呈现出先增加后降低的趋势,以CM组的平均日增重最高。结合前人的研究,分析其原因可能是栓系相当于限制了牦牛活动空间,散栏牦牛采食后适当的运动更符合自然规律和动物机体生理条件,促进了牦牛对营养物质的消化吸收,因此散栏组的平均日增重优于栓系组。栓系组中,牦牛摄入的能量除了满足机体的正常工作以外还需部分能量御寒并转化为皮下脂肪,因此需摄入更多的能量,因此栓系组牦牛的平均日增重随着饲粮能量水平的升高而增加;在散栏组中,牦牛适当的运动可以促进胃肠道的蠕动和对营养物质的消化与利用,同时适当的运动还会加速骨骼肌产生热量用于抵御寒冷,因此适宜的饲粮能量水平就会产生较好的育肥效果,过高的饲粮能量水平反而会对消化代谢产生一定的负面影响,进而影响增重。
3.2 饲养方式和饲粮能量水平对牦牛瘤胃发酵参数的影响瘤胃液pH对瘤胃微生物活动以及自身健康非常重要,是反映瘤胃发酵水平的综合指标。正常情况下,反刍动物通过自身调节瘤胃内环境使瘤胃液pH维持在6~7的适宜范围内[14]。饲粮的精粗比和营养水平是影响瘤胃液pH的主要因素。王鸿泽[15]在牦牛上的研究发现,将饲粮能量水平由5.32 MJ/kg降到3.72 MJ/kg,瘤胃液pH由6.75降到6.67。徐俊等[16]通过体外发酵试验研究了不同饲粮中性洗涤纤维(NDF)水平对瘤胃发酵的影响,得到了36% NDF组瘤胃液pH显著高于32% NDF组的结果。本试验中,各组牦牛瘤胃液pH在6.34~6.78内随着饲粮能量水平的增加而降低,这与前人的研究结果相一致,原因可能是较高能量水平饲粮的NDF和酸性洗涤纤维(ADF)含量较低。
NH3-N在瘤胃中的浓度保持着动态平衡,NH3-N浓度是评价瘤胃发酵的重要指标,其在一定程度上反映了反刍动物瘤胃内含氮物质的发酵和吸收速率[17]。研究表明,瘤胃液NH3-N浓度的适宜范围为6~30 mg/dL[18]。本试验中,各组牦牛瘤胃液NH3-N浓度均处在正常范围之中。万发春等[19]在利杂牛上的研究表明,随着饲粮能量水平的增加,瘤胃液NH3-N浓度显著降低。王斌星等[20]比较了不同能量水平饲粮对牦牛瘤胃发酵的影响,结果显示,中能组牦牛瘤胃液中总挥发性脂肪酸(TVFA)浓度最高,NH3-N浓度最低。本试验结果与王斌星等[20]的报道相一致,中能组牦牛瘤胃液NH3-N浓度低于低能组和高能组,说明中能组具有较其他2组更好的能氮平衡度,可促进微生物蛋白(MCP)的合成和氮的利用;此外,饲喂相同的中能量水平饲粮时,散栏饲养方式下牦牛瘤胃液NH3-N浓度要高于栓系饲养方式下牦牛,因此,散栏饲养方式下中能量组牦牛相比于其他组牦牛具有较好的育肥效果。
反刍动物的瘤胃微生物可将饲料中的纤维降解并转化为挥发性脂肪酸,为机体提供70%~80%的能量需求[21]。瘤胃液中的乙酸、丙酸、丁酸是挥发性脂肪酸的主要成分[22]。Li等[23]在肉牛上的研究显示,高能量水平饲粮降低了瘤胃液中乙酸的比例,提高了丙酸的比例。本研究结果显示,随饲粮能量水平的增加,牦牛瘤胃液丙酸浓度有所提高,与前人研究结果一致。这是因为低能量水平饲粮中,NDF和ADF的含量较高,非可溶性碳水化合物含量较高,瘤胃发酵产生的乙酸较多;本试验中的能量饲料主要为玉米,玉米中含有较多的淀粉,高能量水平饲粮中玉米比例增加提高了淀粉的含量,淀粉属于易消化的可溶性碳水化合物,此时瘤胃发酵产生的丙酸也相应增加。丙酸作为糖异生的主要来源,约有27%的葡萄糖源自丙酸合成,瘤胃液中丙酸浓度越高意味着反刍动物可以得到更多的能量用于生长。本试验中,CM组瘤胃液丙酸浓度最高,说明CM组牦牛可以从饲粮中得到更多的能量,因此CM组牦牛拥有最好的育肥效果。
3.3 饲养方式和饲粮能量水平对牦牛瘤胃菌群的影响本研究通过Illumina HiSeq测序平台研究了饲养方式和饲粮能量水平对牦牛瘤胃菌群的影响,试验得到的稀释曲线已到达平台期,表明样本的测序量和测序深度合理,测序结果可以进行后续的研究。
ACE和Chao1指数可反映微生物的丰度。在本试验中,随着饲粮能量水平的增加,栓系和散栏2种饲养方式下牦牛的ACE和Chao1指数均显著降低。这说明不同的饲粮能量水平会影响牦牛瘤胃菌群的相对丰度,且饲粮能量水平的提高会降低瘤胃菌群的相对丰度,这与前人的研究结果[24]相符;但是Shannon和Simpson指数没有显著变化,这说明在栓系和散栏2种饲养方式下设计的饲粮能量水平差异没有影响到牦牛瘤胃菌群的多样性[25]。
对于反刍动物瘤胃菌群多样性及结构特性,已有研究指出,拟杆菌门和厚壁菌门是瘤胃菌群中占比最高的门分类细菌[26]。本试验中共有24个门被鉴定出,以拟杆菌门、厚壁菌门和杆状菌门3个优势菌门为主导,各菌门在各组间的相对丰度也有所不同。拟杆菌门作为第1优势菌门在栓系组中的相对丰度为50.44%,显著高于散栏组中的43.50%,推测可能是由于栓系限制了牦牛的自由活动,使得牦牛胃肠道的蠕动及对营养物质的消化吸收速率减慢,拟杆菌门作为瘤胃中的主导菌门,因此就需要相对丰度更高的拟杆菌门参与此过程。
在栓系饲养方式下,拟杆菌门的相对丰度随着饲粮能量水平的升高而增加;在散栏饲养方式下,拟杆菌门的相对丰度随饲粮能量水平的升高呈现出先增加后降低的趋势。分析原因可能是因为高能量水平饲粮中玉米所占的比例较高,拟杆菌门的主要作用是与复杂的大分子物质相结合,将复杂的大分子有机物降解,如将碳水化合物降解为单糖等,因此在栓系条件下拟杆菌门的相对丰度随着饲粮能量水平的增加而升高;散栏饲养的牛拥有良好的自由活动空间,活动量的增加加快了其对营养物质的吸收利用,因此散栏饲养方式下牦牛的育肥效果更佳,但过高的饲粮能量水平也会对动物的消化和代谢产生一定的负面影响,进而影响增重,因此散栏饲养方式下高能组拟杆菌门的相对丰度就略低于中能组和低能组。
本试验在属水平上共有377个菌属被鉴定出,普雷沃氏菌属和理研菌科RC-9肠道群是已知分类菌属中占比最高的菌属(二者相对丰度之和约占28%),克里斯滕森菌科R-7群和norank_UCG-011的相对丰度也均在2%以上。张红涛[27]研究荷斯坦后备牛瘤胃菌群组成时发现,普雷沃氏菌属和琥珀酸菌属是瘤胃中的优势菌属。高雨飞等[28]通过测序发现锦江牛瘤胃细菌在属水平上的优势菌属是普雷沃氏菌属、帕拉普氏菌属。本试验结果与前人的不完全一致,推测原因可能是由于品种、年龄、饲粮营养水平、饲养管理等不同导致的,但通过上述研究结果可知普雷沃氏菌是反刍动物瘤胃中广泛存在和数量最多的菌属,与Sharma等[29]的研究结果一致。在本试验中,栓系组普雷沃氏菌属的相对丰度随饲粮能量水平的升高而增加,分析原因可能是由于本试验饲粮配方中的能量饲料主要为玉米,玉米在畜牧业生产中被大量利用的主要原因是玉米中的淀粉含量较高,有研究表明可分离培养的普雷沃氏菌中,一部分具有降解蛋白质和淀粉的功能;另一部分具有发酵纤维二糖、葡萄糖和果糖的能力[30],因此在栓系组中普雷沃氏菌属的相对丰度随能量水平的升高而增加。在散栏组中,活动量的增加使得营养物质可以更好地被吸收利用,育肥效果更佳,但过高的饲粮能量水平也可能对牦牛的消化功能产生一定的负面影响,因此散栏饲养方式下高能组普雷沃氏菌属的相对丰度低于中能组。
4 结论不同饲养方式和饲粮能量水平会对牦牛生长性能、瘤胃发酵参数和瘤胃菌群组成产生一定的影响,总体上散栏饲养方式优于栓系饲养方式。综合本试验所得结果,散栏饲养方式下饲粮NEmf为6.22 MJ/kg时是较适宜进行牦牛冷季育肥的条件。
| [1] |
LESLIE D M, Jr, SCHALLER G B. Bos grunniens and Bos mutus (Artiodactyla: Bovidae)[J]. Mammalian Species, 2009, 836(4): 1-17. |
| [2] |
吴晓云, 梁春年, 姚喜喜, 等. 舍饲育肥对阿什旦牦牛胴体性状和肉品质的影响[J]. 中国草食动物科学, 2020, 40(4): 36-39. WU X Y, LIANG C N, YAO X X, et al. Effect of stall feeding and fattening on carcass traits and meat quality of Ashdan yak[J]. China Herbivore Science, 2020, 40(4): 36-39 (in Chinese). |
| [3] |
陈科宇. 麦洼牦牛冷季舍饲育肥经济效益分析[D]. 硕士学位论文. 雅安: 四川农业大学, 2018: 32-33. CHEN K Y. Analysis of economic benefits of feeding and fattening of Maiwa yaks in cold season[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2018.32-33. (in Chinese) |
| [4] |
阿依努尔·托合提, 郭同军, 吐尔洪·阿木提, 等. 散栏与栓系两种不同饲养方式对西门塔尔牛生产性能的影响[J]. 新疆农业科学, 2014, 51(11): 2111-2116. AYINUER T, GUO T J, YU X, et al. Effects of two different feeding methods, free-stalling and tethering on Simmental performance[J]. Xinjiang Agricultural Science, 2014, 51(11): 2111-2116 (in Chinese). |
| [5] |
牛化欣, 胡宗福, 张适, 等. 饲粮能量水平和养殖环境温湿指数对育肥肉牛生长性能、营养物质表观消化率和血清生化指标的影响[J]. 动物营养学报, 2020, 32(7): 3190-3198. NIU H X, HU Z F, ZHANG S, et al. Effects of dietary energy level and temperature and humidity index of breeding environment on growth performance, apparent digestibility of nutrients and serum biochemical indexes of fattening beef cattle[J]. Chinese Journal of Animal Nutrition, 2020, 32(7): 3190-3198 (in Chinese). |
| [6] |
李亚茹, 郝力壮, 刘书杰, 等. 冷季不同能量水平对生长期舍饲牦牛生长性能及血液生化指标的影响[J]. 黑龙江畜牧兽医, 2015(11): 222-225. LI Y R, HAO L Z, LIU S J, et al. Effects of different energy levels in cold season on growth performance and blood biochemical indexes of yak fed in house during growing period[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(11): 222-225 (in Chinese). |
| [7] |
孙国平. 两种育肥方式下绒山羊瘤胃发酵及几种瘤胃微生物数量的比较研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2013: 1-2. SUN G P. Comparison of rumen fermentation and the quantity of several rumen microorganisms in cashmere goats under two fattening methods[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2013: 1-2. (in Chinese) |
| [8] |
韩旭峰. 日龄、日粮精粗比对陕北白绒山羊瘤胃微生物区系影响的研究[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2015: 9-10. HAN X F, Study on the influence of day age and dietary concentrate to forage ratio on rumen microflora of Shaanbei white cashmere goats[D]. Ph. D. Thesis. Yangling: North West Agricultural and Forest University, 2015: 9-10. (in Chinese) |
| [9] |
中华人民共和国农业部. NY/T 815—2004肉牛饲养标准[S]. 北京: 中国农业出版社, 2004. Ministry of Agriculture of the People's Republic of China. NY/T 815—2004 Beef cattle breeding standards[S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [10] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63(1): 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [11] |
赵育国, 史彬林, 闫素梅, 等. 拴系与散栏饲养方式对肉牛增重及营养物质消化影响的对比试验[J]. 畜牧与兽医, 2012, 44(11): 41-43. ZHAO Y G, SHI B B, YAN S M, et al. A comparative experiment on the effects of tethered and free-stall feeding methods on beef cattle's weight gain and nutrient digestion[J]. Journal of Animal Science and Veterinary Medicine, 2012, 44(11): 41-43 (in Chinese). |
| [12] |
赵广永. 肉牛拴系饲养不科学[J]. 中国农村科技, 1998(9): 28. ZHAO G Y. Beef cattle tethered feeding is unscientific[J]. China Rural Science and Technology, 1998(9): 28 (in Chinese). |
| [13] |
BROWN L D, LASSITER C A. Protein-energy ratios for dairy calves[J]. Journal of Dairy Science, 1962, 45(11): 1353-1356. DOI:10.3168/jds.S0022-0302(62)89625-8 |
| [14] |
NAGARAJA T G, TITGEMEYER E C. Ruminal acidosis in beef cattle: the current microbiological and nutritional outlook[J]. Journal of Dairy Science, 2007, 90(Suppl.1): E17-E38. |
| [15] |
王鸿泽. 日粮能量水平对舍饲育肥牦牛生产性能、瘤胃发酵及肌内脂肪代谢的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2015: 18. WANG H Z. Effects of dietary energy level on production performance, rumen fermentation and intramuscular fat metabolism of fattening yak[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2015: 18. (in Chinese) |
| [16] |
徐俊, 侯玉洁, 赵国琦, 等. 不同蛋白和中性洗涤纤维水平对瘤胃发酵、消化和微生物蛋白合成的影响[J]. 中国畜牧杂志, 2013, 49(7): 43-48. XU J, HOU Y J, ZHAO G Q, et al. Effects of different protein and neutral detergent fiber levels on rumen fermentation, digestion and microbial protein synthesis[J]. Journal of China Husbandry, 2013, 49(7): 43-48 (in Chinese). |
| [17] |
SATTER L D, SLYTER L L. Effect of ammonia concentration on rumen microbial protein production in vitro[J]. British Journal of Nutrition, 1974, 32(2): 199-208. DOI:10.1079/BJN19740073 |
| [18] |
PRESTON R L, SCHNAKENBERG D D, PFANDER W H. Protein utilization in ruminants: Ⅰ.Blood urea nitrogen as affected by protein intake[J]. The Journal of Nutrition, 1965, 86(3): 281-288. DOI:10.1093/jn/86.3.281 |
| [19] |
万发春, 吴乃科, 宋增福, 等. 不同能量水平对肉牛瘤胃代谢的影响研究[J]. 山东农业大学学报(自然科学版), 2003, 34(1): 54-58, 63. WAN F C, WU N K, SONG Z F, et al. Effects of different energy levels on rumen metabolism of beef cattle[J]. Journal of Shandong Agricultural University (Natural Science), 2003, 34(1): 54-58, 63 (in Chinese). |
| [20] |
王斌星, 陈光吉, 郭春华, 等. 能量水平对舍饲育肥牦牛生长性能、屠宰性能、瘤胃发酵参数和瘤胃微生物数量的影响[J]. 中国畜牧兽医, 2017, 44(2): 469-475. WANG B X, CHEN G J, GUO C H, et al. Effects of energy level on growth performance, slaughter performance, rumen fermentation parameters and rumen microorganism quantity of fattening yaks[J]. Journal of China Animal Husbandry and Veterinary Medicine, 2017, 44(2): 469-475 (in Chinese). |
| [21] |
VAN HOUTERT M F J. The production and metabolism of volatile fatty acids by ruminants fed roughages: a review[J]. Animal Feed Science and Technology, 1993, 43(3/4): 189-225. |
| [22] |
SHI F H, FANG L, MENG Q X, et al. Effects of partial or total replacement of maize with alternative feed source on digestibility, growth performance, blood metabolites and economics in limousin crossbred cattle[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(10): 1443-1451. |
| [23] |
LI L Y, HE Y, RAHMAN M A U, et al. Effects of different dietary energy and rumen-degradable protein levels on rumen fermentation, nutrients apparent digestibility and blood biochemical constituents of Chinese crossbred yellow bulls[J]. Pakistan Veterinary Journal, 2014, 34(3): 367-371. |
| [24] |
ZHOU Z W, TU J, ZHU Z J. Advancing the large-scale CCS database for metabolomics and lipidomics at the machine-learning era[J]. Current Opinion in Chemical Biology, 2018, 42: 34-41. |
| [25] |
ISHAQ S L, ALZAHAL O, WALKER N, et al. An investigation into rumen fungal and protozoal diversity in three rumen fractions, during high-fiber or grain-induced sub-acute ruminal acidosis conditions, with or without active dry yeast supplementation[J]. Frontiers in Microbiology, 2017, 8: 1943. |
| [26] |
ZHANG R Y, YE H M, LIU J H, et al. High-grain diets altered rumen fermentation and epithelial bacterial community and resulted in rumen epithelial injuries of goats[J]. Applied Microbiology and Biotechnology, 2017, 101(18): 6981-6992. |
| [27] |
张红涛. 不同玉米青贮水平对荷斯坦后备牛瘤胃液微生物组及其代谢组的影响[D]. 博士学位论文. 北京: 中国农业大学, 2017: 24-25. ZHANG H T. Effects of different corn silage levels on the microbiome and metabolome of rumen juice of Holstein reserve cattle[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2017: 24-25. (in Chinese) |
| [28] |
高雨飞, 欧阳克蕙, 瞿明仁, 等. 利用MiSeq测序技术分析锦江牛瘤胃细菌多样性[J]. 动物营养学报, 2016, 28(1): 244-248. GAO Y F, OUYANG K H, QU M R, et al. Analysis of rumen bacterial diversity in Jinjiang cattle using MiSeq sequencing technology[J]. Chinese Journal of Animal Nutrition, 2016, 28(1): 244-248. |
| [29] |
SHARMA A, PRASAD S, SINGH Y, et al. Effect of polyherbal preparation supplementation on immunity and udder health of periparturient Karan-Fries crossbred dairy cows[J]. Journal of Applied Animal Research, 2014, 42(2): 217-221. |
| [30] |
AVGUSTIN G, WALLACE R J, FLINT H J. Phenotypic diversity among ruminal isolates of Prevotella ruminicola: proposal of Prevotella brevis sp. nov., Prevotella bryantii sp. nov., and Prevotella albensis sp. nov.and redefinition of Prevotella ruminicola[J]. International Journal of Systematic Bacteriology, 1997, 47(2): 284-288. |




