2. 江西省红壤丘陵区农业环境污染防控重点实验室, 吉安 343009;
3. 井冈山大学生命科学学院, 吉安 343009
2. Key Laboratory of Agricultural Environmental Pollution Prevention and Control in Red Soil Hilly Region of Jiangxi Province, Jinggangshan University, Ji'an 343009, China;
3. School of Life Sciences, Jinggangshan University, Ji'an 343009, China
断奶期是幼龄哺乳动物“早期断奶综合征”发生的高风险期[1-3]。研究发现,仔猪常在断奶期间出现肠道菌群结构发生明显变化,是引起疾病发生的主要病因之一[4-6]。动物肠道内数量庞大的菌群对肠道健康和宿主健康发挥关键重要作用,其可与宿主进行“信息”交换,能影响宿主肠道的生长、发育、营养物质吸收和免疫力[7]。
近年来,抗生素在动物饲料的长期使用和滥用也带来了诸多负面影响,寻找天然产物中的有效成分作为绿色饲料添加剂在动物生产中应用越来越广泛。在饲粮中添加葡萄籽原花青素可显著改善生长猪结肠形态,降低微生物的多样性,富集产短链脂肪酸的菌群[8]。金娜等[9]研究发现,饲粮中添加枸杞多糖可提高育肥猪肠道菌群的丰富度和多样性,能建立更健康的肠道菌群结构。马齿苋多糖(Portulaca oleracea L. polysaccharide,POP)是马齿苋的主要活性成分之一,有抗氧化、抗衰老、免疫调节和抗肿瘤等活性,同时又是一种安全、高效、广谱的抗菌剂[10-14]。马齿苋是马齿苋科植物马齿苋的全草,性寒,味甘酸,入心脏、肝脏、脾脏、大肠,《食疗本草》记载用马齿苋煮粥可达到“止痢、治腹痛”的食疗效果[15]。研究表明,POP对金黄色葡萄球菌、大肠杆菌和痢疾杆菌有明显的抑制作用,其中对痢疾杆菌抑制效果最为明显,但对绿脓杆菌抑制效果不明显[16-17]。POP可通过促进肠道正常菌群生长、调整菌群失调来改善林可霉素建立的肠道微生态失调,使动物肠道维持稳态,进而达到防治感染的作用,是理想的中药微生态调节剂[18]。
目前,已有研究者关注POP在动物保健促生长方面的作用并开始尝试应用,如葛剑等[19]研究发现,POP可提高雏鸡生长性能和饲料转化率;李进杰等[20]发现POP可以改善断奶仔猪的生长性能,降低腹泻率。本课题组前期研究也发现,POP可改善断奶SD大鼠生长性能、促进肠道发育,但未进一步探究POP对动物肠道菌群的影响[21]。因此,本研究将POP作为断奶SD大鼠的饲料添加剂,探讨其对断奶大鼠肠道菌群结构和多样性的影响,为POP在幼龄哺乳动物饲料添加应用上提供参考。
1 材料与方法 1.1 试验动物与试剂无特定病原体(SPF)级SD雄性断奶大鼠30只,(21±1)日龄,购自湖南斯莱克景达试验动物有限公司[许可证号: SCXK(湘)2016—0002];POP,纯度≥50%(批号: 20180123),购自兰州某生物科技有限公司;E.Z.N.A.® Stool DNA Kit试剂盒(Omega公司,美国);AxyPrep PCR Cleanup Kit试剂盒(Invitrogen公司,美国);Quant-iT PicoGreen dsDNA Assay Kit试剂盒(Invitrogen公司;美国);MiSeq Reagent Kit试剂盒(Illumina公司,美国);16S rRNA可变区(V3~V4)引物338F-806R(杭州联川生物技术股份有限公司)。
1.2 试验仪器5424离心机(Eppendorf公司,德国)、冷冻离心机(Beckman Coulter公司,美国)、DK-8D恒温水浴锅(上海博迅实业有限公司)、旋涡振荡仪(太仓华利达实验设备有限公司)、REPS300电泳仪(上海天能科技有限公司)、Tanon-2500凝胶成像仪(上海天能科技有限公司)、A200基因扩增仪(杭州朗基科学仪器有限公司)、DW-HL388超低温冷冻储存箱(中科美菱低温科技有限责任公司)、Qubit4.0荧光定量仪(Thermo Scientific公司,美国)、Illumina MiSeq测序系统(Illumina公司,美国)。
1.3 动物分组及饲养将大鼠随机分为3组,每组10只,单笼饲养。对照组(Con组)大鼠灌胃2 mL生理盐水,POP低剂量组(LD组)与POP高剂量组(HD组)大鼠分别按照100、200 mg/kg BW的剂量灌胃POP(溶于2 mL生理盐水),每日1次,连续28 d。各组均给予大鼠基础饲粮,其组成及营养水平见表 1,自由饮水。正式试验前,动物适应性饲养3 d。养殖试验在井冈山大学动物饲养中心进行,温度维持在(23±1) ℃,相对湿度约为40%,12 h白天与12 h黑夜模式。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验结束时,随机处死每组6只大鼠,采集结肠内容物,装入无菌EP管中,迅速放入液氮速冻,-80 ℃低温冰箱保存待测。
1.5 DNA提取和PCR扩增根据粪便微生物DNA提取试剂盒说明书进行总DNA提取,用琼脂糖凝胶电泳检测DNA的质量和浓度,将样品稀释至浓度为1 ng/μL,然后对16S rRNA可变区(V3~V4)进行PCR扩增(引物为F: 5′-ACTCCTACGGGAGGCAGCAG-3′和R: 5′-GGACTACHVGGGTWTCTAAT-3′)。PCR扩增产用2%琼脂糖凝胶电泳进行检测,回收目标片段。Quant-iT PicoGreen dsDNA Assay Kit对纯化的PCR产物进行建库,将构建好的文库经过Qubit定量和文库检测合格后,用MiSeq测序仪进行2×300 bp的双端测序(委托杭州联川生物技术股份有限公司完成)。
1.6 生物信息分析采用FLASH(v1.2.8)软件,根据双端序列overlap关系,将序列拼接(merge)成长的tag,并将序列上建库引入的barcode和引物序列去除,然后采用Vsearch(v2.3.4)过滤嵌合体。预处理之后的cleandata使用Vsearch将序列相似性大于97%的clean tags定为一个操作分类单元(OTUs),挑选最佳的centroids(位于几何中心)序列作为该OTU的代表序列。使用QIIME(v1.8.0)分析α多样性以及β多样性。使用blast进行序列比对,将OTU代表序列与RDP以及NCBI-16S数据库对每个代表性序列进行物种注释。其他图片均是使用R包(V3.2.5)实现。
1.7 数据处理与分析数据经Excel 2007整理后,SPSS 19.0统计软件处理,进行单因素方差分析并进行组间差异显著性比较,采用线性判别分析(LEfSe)效应大小与t-test分析比较组间差异显著的物种,宏基因组图谱统计分析软件(STAMP)对京都基因与基因组百科全书(KEGG)进行显著性差异分析,以P < 0.05为差异有统计学意义。
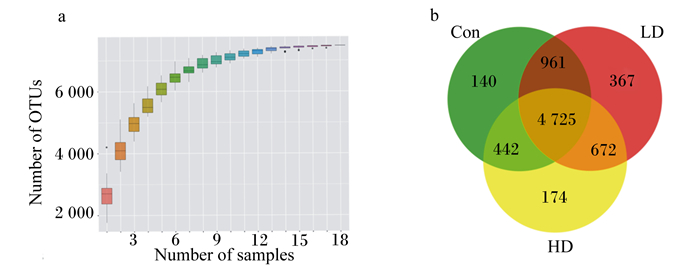
2 结果与分析 2.1 测序质量评估及物种注释分析由图 1-a可知,试验中各样本平均得到7 481个OTUs;当样本量增加至18时,很少有新的OTUs出现,提示测序深度足够、数据量渐进合理和样本量足够。通过3组样本聚类得到的OTUs差异韦恩图(1-b)可见,3组共有4 725个相同的OTUs,其中Con组有140个特征OTUs,LD组有367个特征OTUs,HD组有174个特征OTUs。
|
a:物种累积箱形图;b:分组OTUs韦恩图。 Number of OTUs: 操作分类单元数量;Number of samples: 样本数;Con: 对照组control group;LD: POP低剂量组POP low-dose group;HD: POP高剂量组POP high-dose group。下图同。The same as below. a: species accumulation box chart; b: Venn diagrams of OTUs. 图 1 测序质量及物种注释分析 Fig. 1 Sequencing quality and species annotation analysis |
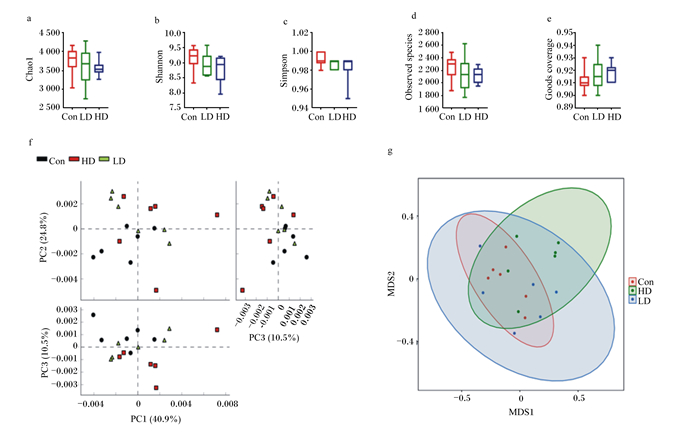
本试验通过Chao1、Observed_species、Goods_coverage、Shannon、Simpson指数来分析菌群的α多样性。由图 2-a至图 2-d可知,POP添加组断奶大鼠Chao1、Observed species、Shannon、Simpson指数相对于Con组大鼠均下降,但没有统计学差异(P>0.05),结果表明,试验组与对照组大鼠肠道微生物菌群有相似的整体多样性。由图 2-f可见,各组样本测序覆盖率均在0.90以上,说明样本中序列没有被测出的概率较低,测序深度足够,提示本次测序结果能代表样本的真实情况。通过主成分分析(PCA)和非度量多维尺度分析(NMDS)来评估菌群的β多样性,如图 2-f所示,PCA评分图显示了Con、LD和HD组之间的相似性和差异性,其中前3个分量解释了总差异性的76.2%(PC1、PC2和PC3分别为40.9%、24.8%、10.5%)(P=0.008);Con组与HD组组内样本的聚类效果较好,组间微生物明显分开;LD组组内样本差异较大,与Con组差异小;未加权的NMDS也可见相似的结果(图 2-g)。
|
图a至图e:α多样性分析;图f至图g: β多样性分析。Figures a to e: analysis of alpha-diversity; figures f to g: analysis of beta-diversity. Chao1:Chao1指数Chao1 index; Observed_species: Observed_species指数Observed_species index; Goods_coverage: Goods_coverage指数Goods_coverage index; Shannon: Shannon指数Shannon index; Simpson: Simpson指数Simpson index; PC1:主成分1 principal component 1; PC2:主成分2 principal component 2; PC3:主成分3 principal component 3;MDS1: 多维尺度1 multidimensional scaling 1; MDS2: 多维尺度2 multidimensional scaling 2。 图 2 菌群多样性分析 Fig. 2 Analysis of bacterial diversity |
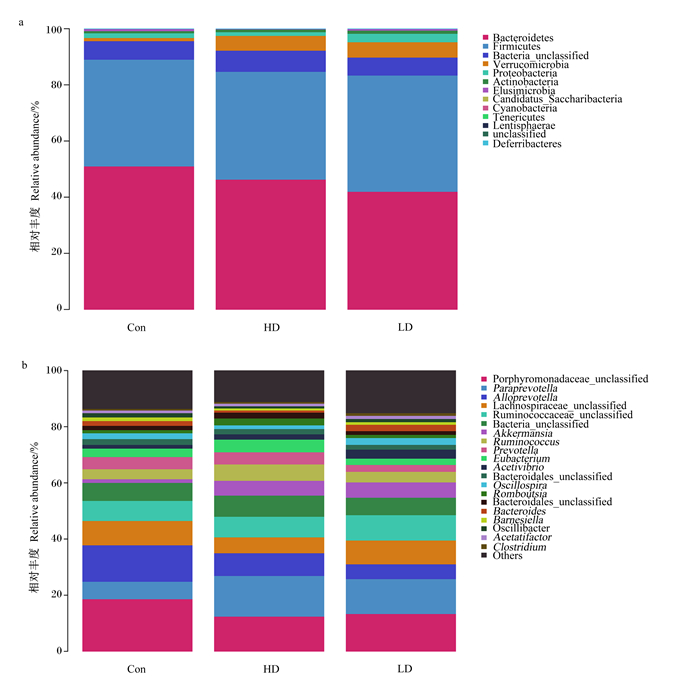
根据物种注释结果,在门水平上各组优势菌门均为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes);二者的比值(F/B)在Con组为0.79,LD组上调为0.99,HD组上调为0.93(表 2);与Con组相比,HD组的软璧菌门(Tenericutes)相对丰度显著降低(P=0.02)。由图 3-b可见,在属水平上,Con组优势菌属为未分类紫单胞菌科(Porphyromonadaceae_unclassified)和阿洛-普氏菌属(Alloprevotella);POP组的优势菌属为未分类紫单胞菌科和帕拉-普氏菌属(Paraprevotella)。
|
|
表 2 各组大鼠F/B值 Table 2 F/B value of rats in each group |
|
图a:前10门水平相对丰度构成图;图b:前20属水平相对丰度构成图。Fig.a: chart of the relative abundance of the first 10 phyla;Fig.b: relative abundance composition of the first 20 genera。Bacteroidetes: 拟杆菌门;Firmicutes: 厚壁菌门;Bacteria_unclassified: 未分类_细菌;Verrucomicrobia: 疣微菌门;Proteobacteria: 变形菌门;Actinobacteria: 放线菌门;Elusimicrobia: 迷踪菌门;Candidatus_Saccharibacteria: 暂定种_糖化细菌;Cyanobacteria: 蓝藻门;Tenericutes: 软璧菌门;Lentisphaerae: 黏胶球形菌门;unclassified: 未分类;Deferribacteres: 脱铁杆菌门;Porphyromonadaceae_unclassified: 未分类_紫单胞菌科;Paraprevotella: 帕拉-普氏菌属;Alloprevotella: 阿洛-普氏菌属;Lachnospiraceae_unclassified: 未分类_毛螺旋菌科;Ruminococcaceae_unclassified: 未分类_瘤胃球菌科;Akkermansia: 艾克曼菌属;Ruminococcus: 瘤胃球菌属;Prevotella: 普氏菌属;Eubacterium: 优杆菌属;Acetivibrio: 醋弧菌属;Oscillospira: 颤螺旋菌属;Romboutsia: 罗姆布茨菌属;Bacteroides: 拟杆菌属;Oscillibacter: 颤杆菌科;Acetatifactor: 产醋酸菌属;Clostridium: 梭菌属;Others: 其他。 图 3 菌群在门与属分类水平上相对丰度 Fig. 3 Relative abundance of flora at phylum and genus levels |
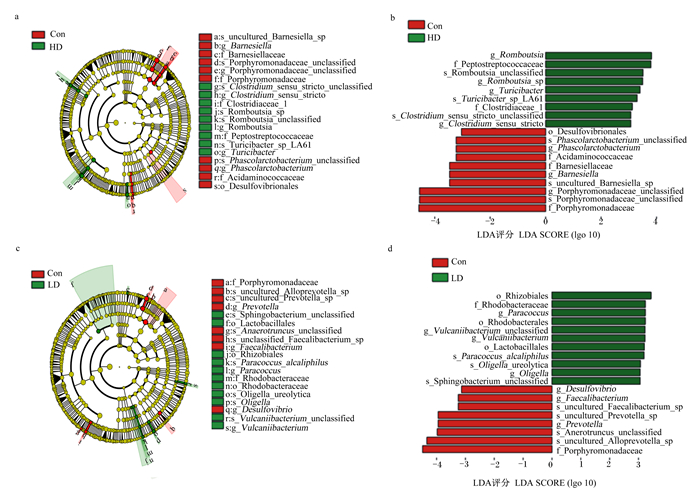
为了鉴定与POP相关的特定菌群,本试验采用LEfSe方法比较了Con组和POP补充组的粪便微生物区系。图 4-a和图 4-c显示了代表粪便微生物和优势细菌结构的包层图,图 4-b和图 4-d显示了2个组间差异最大的分类群,补充了POP能显著提高断奶大鼠的乳杆菌目(Lactobacillales)、罗姆布茨菌种(Romboutsia)和梭菌属_sensu_stricto (Clostridium_sensu_stricto)等相对丰度(P < 0.05),显著降低普氏菌属(Prevotella)、紫单胞菌科(Porphyromonadaceae)和粪杆菌属(Faecalibacterium)等相对丰度(P < 0.05)。
|
图a、图b:LEfSe分析Con组和HD组16S rRNA序列的进化分支图及LDA评分高于3的物种评分图。图c、图d:LEfSe分析Con组和LD组16S rRNA序列的进化分支图及LDA评分高于3的物种评分图。Fig.a and Fig.b: taxonomic cladogram derived from LEfSe analysis of 16S rRNA sequences and LAD score plot of bacterial taxa with LDA scores higher than 3 in the Con group and the HD group. Fig.c and Fig.d: taxonomic cladogram derived from LEfSe analysis of 16S rRNA sequences and LAD score plot of bacterial taxa with LDA scores higher than 3 in the Con group and the LD group. s_uncultured_Barnesiella_sp: 未培养的紫单胞菌种;g_Barnesiella: 紫单胞菌属;f_Barnesiellaceae: 巴氏杆菌科;f_Porphyromonadaceae: 紫单胞菌科;f_Clostridiaceae_1:梭菌科_1;g_Clostridium_sensu_stricto: 梭菌属_sensu_stricto;s_Romboutsia_sp: 罗姆布茨菌种_sp;f_Peptostreptococcaceae: 消化链球菌科;g_Turicibacter: 苏黎世杆菌属;s_Turicibacter_sp_LA61:苏黎世杆菌种_sp_LA61;g_Phascolarctobacterium: 考拉杆菌属;f_Acidaminococcaceae: 氨基酸球菌科;o_Desulfovibrionales: 脱硫弧菌目;o_Lactobacillales: 乳杆菌目;s_Sphingobacterium_unclassified: 未分类_鞘细菌;g_Faecalibacterium: 粪杆菌属;s_Anaerotruncus_unclassified: 未分类_厌氧干菌属;o_Rhizobiales: 根瘤菌目;g_Paracoccus: 副球菌属;s_Paracoccus_alcaliphilus: 副球菌属_alcaliphilus;o_Rhodobacterales: 红杆菌目;f_Rhodobacteraceae: 红杆菌科;g_Oligella: 寡源杆菌属;s_Oligella_ureolytica: 解脲寡源杆菌种;g_Desulfovibrio: 脱硫弧菌属;g_Vulcaniibacterium: 硫化杆菌属。 图 4 LEfSe分析断奶大鼠肠道标志性的菌群 Fig. 4 LEfSe analysis of key of gut microbiota in weaned rats |
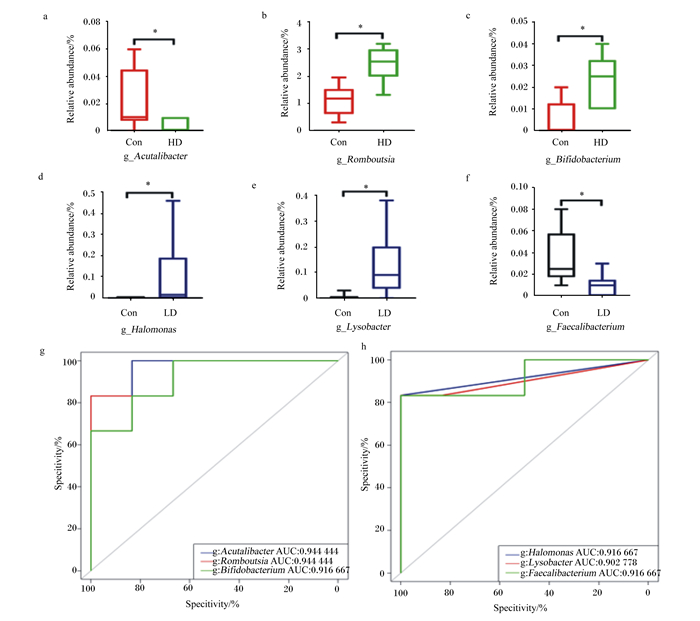
用ROC曲线分析法来评估几种相对丰度有差异性的菌属作为POP对受试大鼠影响的值。由图 5-a~图 5-f可见,补充POP可显著增加双歧杆菌属(Bifidobacterium)、罗姆布茨菌属、盐单胞菌属和溶杆菌属的相对丰度(P < 0.05),显著降低针状杆菌属和粪杆菌属相对丰度(P < 0.05)。通过ROC曲线下的面积(AUC)可知,与高剂量受试大鼠最密切相关的属是双歧杆菌属(AUC=0.917)、罗姆布茨菌属(AUC=0.944)和针状杆菌属(AUC=0.944) (图 5-g);与低剂量受试大鼠最密切相关的属是盐单胞菌属(AUC=0.917)、溶杆菌属(AUC=0.903)和粪杆菌属(AUC=0.917) (图 5-h)。试验结果提示,以上菌属可能是POP促进断奶大鼠肠道菌群稳态的潜在标志物。
|
图a~图f:马齿苋多糖添加组与对照组的之间相对丰度有差异性的菌属。图g:罗姆布茨菌属、针状杆菌属和双歧杆菌属的ROC曲线分析。图h:盐单胞菌属、溶杆菌属和粪杆菌属的ROC曲线分析。Fig.a to Fig.f: differences of relative abundances of genus between the polysaccharide supplemental group and the control group. Fig.g: ROC analysis of Romboutsia, Acutalibacter and Bifidobacterium. Fig.h: ROC analysis of Halomonas, Lysobacter and Faecalibacterium. Relative abundance: 相对丰度; Specitivity: 特异性; Sensitivity: 灵敏度。*表示差异显著(P < 0.05)。*mean significant difference (P < 0.05);g-Acutalibacter 针状杆菌属; g-Romboutsia罗姆布茨菌属; g-Bifidobacreium双歧杆菌属; g-Halomonas盐单胞菌属; g-Lysobacter溶杆菌属; g-Faecalibacterium粪杆菌属。 图 5 差异菌属和ROC曲线分析图 Fig. 5 Analysis graphs of different bacteria and ROC curve |
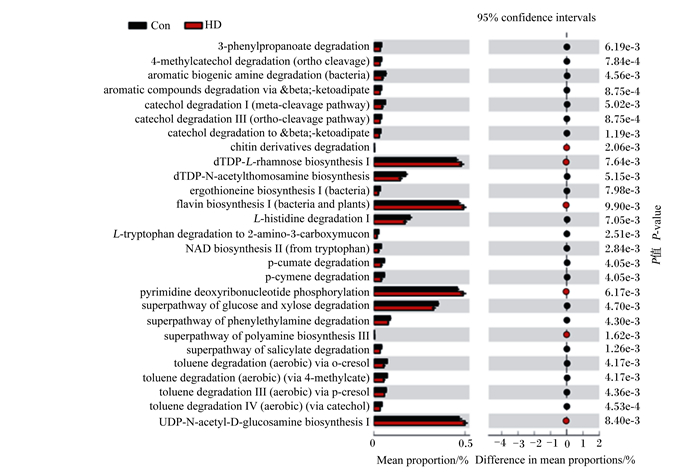
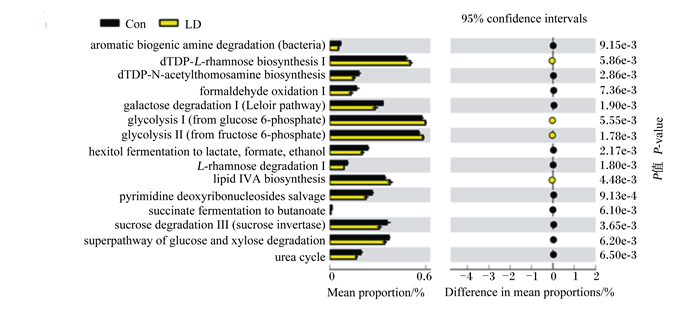
基于已测大鼠肠道中的细菌基因组的16S rDNA全长序列,依据KEGG数据库,用隐性状态重建进行群落系统进化研究(PICRUSt)法对菌群代谢功能进行预测。由图 6、图 7可见,Con组与POP组在核苷酸代谢、维生素代谢、碳水化合物的生物合成与代谢和脂质代谢存在显著性差异。Con组在糖化合物降解通路上的相对占比更高,这表明断奶大鼠在补充POP后肠道菌群结构变化对其参与的物质代谢产生影响。
|
Mean proportion: 平均比例; Difference in mean proportions: 平均比例差异; 95% confidence intervals: 95%置信区间。下图同。The same as below. 3-phenylpropanoate degradation: 3-苯丙酸盐降解;4-methylcatechol degradation (ortho cleavage): 4-甲基邻苯二酚降解(邻位裂解);aromatic biogenic amine degradation (bacteria): 芳香族生物胺降解(细菌);aromatic compounds degradation via & beta; -ketoadipate: 芳香族化合物降解;catechol degradation Ⅰ (meta-cleavage pathway): 儿茶酚降解Ⅰ(间裂途径);catechol degradation Ⅲ (ortho-cleavage pathway): 邻苯二酚降解Ⅲ(邻位裂解途径);catechol degradation to & beta; -ketoadipate: 儿茶酚降解为β-己二酸酮;chitin derivatives degradation: 甲壳素衍生物降解;dTDP-L-rhamnose biosynthesis Ⅰ: dTDP-L-鼠李糖生物合成Ⅰ;dTDP-N-acetylthomosamine biosynthesis: dTDP-N-乙酰氨基乙醇生物合成;ergothioneine biosynthesis Ⅰ (bacteria): 麦角新碱生物合成Ⅰ(细菌);flavin biosynthesis Ⅰ (bacteria and plants): 黄素生物合成Ⅰ(细菌和植物);L-histidine degradation Ⅰ: L-组氨酸降解Ⅰ;L-tryptophan degradation to 2-amino-3-carboxymucon: L-色氨酸降解为2-氨基-3-羧黏蛋白;NAD biosynthesis Ⅱ (from tryptophan): NAD生物合成Ⅱ(来自色氨酸);p-cumate degradation: 异丙酸盐降解;p-cymene degradation: 对甲苯降解;pyrimidine deoxyribonucleotide phosphorylation: 嘧啶脱氧核苷酸磷酸化;superpathway of glucose and xylose degradation: 葡萄糖和木糖降解通路;superpathway of phenylethylamine degradation: 苯乙胺降解通路;superpathway of polyamine biosynthesis Ⅲ: 多胺生物合成Ⅲ通路;superpathway of salicylate degradation: 水杨酸降解通路;toluene degradation (aerobic) via o-cresol/4-methylcate/p-cresol/catechol: 甲苯降解(需氧)通过邻甲酚/4-甲基甲酸酯/对甲酚/儿茶酚;UDP-N-acetyl-D-glucosamine biosynthesis Ⅰ: UDP-N-乙酰-D-氨基葡萄糖生物合成Ⅰ。 图 6 Con组和HD组的差异分析图 Fig. 6 Differential analysis diagram of Con group and HD group |
|
aromatic biogenic amine degradation (bacteria): 芳香族生物胺降解(细菌);dTDP-L-rhamnose biosynthesis Ⅰ: dTDP-L-鼠李糖生物合成Ⅰ;dTDP-N-acetylthomosamine biosynthesis: dTDP-N-乙酰氨基乙醇生物合成;formaldehyde oxidation Ⅰ: 甲醛氧化Ⅰ;galactose degradation Ⅰ (Leloir pathway): 半乳糖降解Ⅰ(Leloir途径);glycolysis Ⅰ (from glucose 6-phosphate)/Ⅱ (from fructose 6-phosphate): 糖酵解Ⅰ(来自葡萄糖6-磷酸)/Ⅱ(来自果糖6-磷酸);hexitol fermentation to lactate, formate, ethanol: 己糖醇发酵生产乳酸、甲酸、乙醇;L-rhamnose degradation Ⅰ: L-鼠李糖降解Ⅰ;lipid IVA biosynthesis: 脂质IVA生物合成;pyrimidine deoxyribonucleosides salvage: 嘧啶脱氧核苷补偿;succinate fermentation to butanoate琥珀酸发酵到丁酸;sucrose degradation Ⅲ (sucrose invertase): 蔗糖降解Ⅲ(蔗糖转化酶);urea cycle: 尿素循环。 图 7 Con组和LD组的差异分析图 Fig. 7 Differential analysis diagram of Con group and LD group |
本研究通过Illumina MiSeq测序平台的16S rRNA测序技术检测饲喂POP后断奶SD大鼠肠道菌群结构的变化,并对菌群信息进行了进一步的分析。
动物肠道内定植了数量庞大的微生物菌群,菌群稳态对机体的生理功能具有重要的影响[22]。肠道菌群多样性与肠道稳态又密切相关,有研究发现菌群多样性指数越高,菌群区系平衡越不易被破坏[23]。本试验结果发现,POP组与Con组之间肠道菌群整体多样性没有差异;但POP组的特征OTUs多于Con组,组间的β多样性有差异性。这表明饲喂POP未破坏断奶大鼠肠道微生物多样性,但可促进特征菌群数量的增加,改变菌群结构。
在人的肠道菌群中,厚壁菌门和拟杆菌门是优势菌门,两者可占菌群数量的90%以上;本研究结果也发现使用大鼠优势菌门与人相似,均以厚壁菌门和拟杆菌门为主。由表 2可知,POP能提升厚壁菌门相对丰度和降低拟杆菌门相对丰度,这可能与厚壁菌门富含淀粉、半乳糖及丁酸等代谢酶、有助于促进机体对能量的吸收及脂肪的沉积有关[24]。Turnbaugh等[25]发现,相对正常小鼠,肥胖小鼠的拟杆菌门的数量减少50%,厚壁菌门数量增加。另外,饲喂了高剂量POP的断奶大鼠肠道中的软璧菌门相对丰度显著下降。支原体、螺原体、脲原体和植原体是软璧菌门典型物种,软璧菌门的细菌通常对机体无害。有研究发现,一种食草能力强的短角蝗虫中的软璧菌门是优势菌门[26];Kang等[27]研究发现喂食高脂饮食的小鼠肠道肠道中的软璧菌门数量减少。本课题组已发表的研究数据发现,饲喂了POP的断奶大鼠血清中的蛋白质、胆固醇和葡萄糖含量显著提高,肠道绒毛发育更好,料重比却显著降低[21]。以上结果说明POP可能通过改变肠道菌群结构,提升从饲粮中获得能量的能力进而促进生长发育。
双歧杆菌、乳酸杆菌等有益菌能与肠道上皮细胞保持和谐共生的关系,它与肠壁紧密结合从而形成了一道生物膜保护屏障以阻止有害菌的入侵[28]。研究发现,双歧杆菌的抑菌作用主要通过竞争营养与黏附位点、加强机体免疫力等途径,对肠道致病菌的黏附和繁殖起到拮抗作用以及阻断致病途径[29]。本试验结果显示,饲喂POP能显著增加断奶大鼠肠道双歧杆菌和乳酸杆菌的相对丰度,这与克里斯等[30]研究发现POP显著提高衰老小鼠肠道双歧杆菌和乳酸杆菌数量结果一致。有报道指出,罗姆布茨菌属表现出益生性[31],针状杆菌属可通过胆汁酸氧化途径参与机体胆汁酸的代谢[32],溶杆菌属有增加产乳酶活性及抑菌效果[33-34],盐单胞菌属相对丰度与仔猪血清白蛋白(ALB)及尿素氮(UN)含量显著正相关[35]。本研究结果可见,饲喂POP后,断奶大鼠肠道菌群中的罗姆布茨菌属、盐单胞菌属和溶杆菌属的相对丰度显著增加,针状杆菌属相对丰度显著降低。粪杆菌属细菌广泛存在人体肠道中,在下一代益生菌或生物治疗药物方面有潜在开发前景[36]。从试验结果可知,饲喂低剂量的POP显著降低粪杆菌属相对丰度,而饲喂高剂量的POP未见对粪杆菌属相对丰度的影响,由此推荐断奶大鼠肠道中粪杆菌属相对丰度对POP剂量可能比较敏感。
PICRUSt功能预测是以KEGG数据库对组间功能差异进行分析,准确率较高,尤其对于肠道微生物菌群功能准确性可达95%[37]。本试验PICRUSt分析结果表明,POP可以改变断奶大鼠肠道菌群结构影响机体的代谢功能,主要包括核苷酸代谢、维生素代谢、碳水化合物的生物合成与代谢和脂质代谢。外源性核苷酸是幼龄动物生长发育不可缺少的营养成分,研究表明,哺乳动物乳汁中含有丰富的核苷酸[38]。双歧杆菌能够酸化肠道内环境,抑制腐败菌和病原菌的生长,产生维生素和氨基酸,为机体提供必需的营养[39]。肠道菌群可以通过各种途径参与能量及脂类代谢,促使肝脏脂肪酸和甘油三酯的存储[40]。维生素代谢与机体能量代谢及肠道菌群尤其是乳杆菌属的生长密切相关,核黄素通过参与催化乙酸-CoA的还原及琥珀酸-CoA的转化参与能量代谢[37]。通过PICRUSt结果分析发现,POP能提升dTDP-L-鼠李糖生物合成、黄素生物合成Ⅰ(细菌与植物)、嘧啶脱氧尿苷磷酸化、UDP-N-乙酰-D-葡糖胺生物合成Ⅰ、糖酵解Ⅰ(葡萄糖6-磷酸)、糖酵解Ⅱ(果糖6-磷酸)、脂质IVA生物合成的菌群基因功能。但是,某一种菌群与具体代谢通路如何相互作用还有待进一步研究。
4 结论给予POP可增加断奶大鼠肠道双歧杆菌、乳酸杆菌和罗姆布茨菌等益生菌的相对丰度,从而优化肠道菌群平衡,建立更健康的肠道菌群结构。POP是提升断奶大鼠相关核苷酸代谢、碳水化合物的生物合成与代谢、维生素代谢和脂质代谢通路菌群基因功能的潜在添加剂,为POP在幼龄哺乳动物饲料添加应用上提供科学依据。
| [1] |
SONG P X, ZHANG R J, WANG X X, et al. Dietary grape-seed procyanidins decreased postweaning diarrhea by modulating intestinal permeability and suppressing oxidative stress in rats[J]. Journal of Agricultural and Food Chemistry, 2011, 59(11): 6227-6232. DOI:10.1021/jf200120y |
| [2] |
林秋敏, 赖宝色, 林伯全, 等. 自拟复方中草药添加剂在断奶仔猪中的应用[J]. 中国畜牧兽医文摘, 2014, 30(1): 161-162. LIN Q M, LAI B S, LIN B Q, et al. Application of self-prepared compound Chinese herbal medicine additive in weaned piglets[J]. Chinese Animal Husbandry and Veterinary Abstracts, 2014, 30(1): 161-162 (in Chinese). |
| [3] |
鄢雅丽. 病毒与细菌表观型腹泻对断奶仔猪肠道菌群及紧密连接的影响[D]. 硕士学位论文. 南昌: 南昌大学, 2018: 11-13. YAN Y L. Effects of viral and bacterial porcine epidemic diarrhea on intestinal flora and tight junctions in weaned piglets[D]. Master's Thesis. Nanchang: Nanchang University, 2018: 11-13. (in Chinese) |
| [4] |
SU Y, YAO W, PEREZ-GUTIERREZ O N, et al. Changes in abundance of Lactobacillus spp. and Streptococcus suis in the stomach, jejunum and ileum of piglets after weaning[J]. FEMS Microbiology Ecology, 2008, 66(3): 546-555. DOI:10.1111/j.1574-6941.2008.00529.x |
| [5] |
MATHEW A G, FRANKLIN M A, UPCHURCH W G, et al. Influence of weaning age on ileal microflora and fermentation acids in young pigs[J]. Nutrition Research, 1996, 16(5): 817-827. DOI:10.1016/0271-5317(96)00074-7 |
| [6] |
BARROW P A, BROOKER B E, FULLER R, et al. The aetiology of diarrhoea in pigs weaned at two days of age[J]. Research in Veterinary Science, 1979, 27(1): 52-58. DOI:10.1016/S0034-5288(18)32859-5 |
| [7] |
YANG Y X, DAI Z L, ZHU W Y. Important impacts of intestinal bacteria on utilization of dietary amino acids in pigs[J]. Amino Acids, 2014, 46(11): 2489-2501. DOI:10.1007/s00726-014-1807-y |
| [8] |
孙晓江, 闫慧诗, 张俊兰, 等. 葡萄籽原花青素对生长猪生长性能、结肠形态和微生物的影响[J]. 中国畜牧杂志, 2020, 56(12): 139-144, 152. WEN Z G, WU X Z, QI Z G, et al. Effect of rubber seed oil on laying performance, intestinal morphological structure, and immune function in LPS-induced laying hens[J]. Chinese Journal of Animal Science, 2020, 56(12): 139-144, 152 (in Chinese). |
| [9] |
金娜, 邹闻书, 高倩, 等. 枸芪多糖对育肥猪肠道菌群多样性及组成的影响[J]. 动物营养学报, 2019, 31(9): 4033-4043. JIN N, ZOU W S, GAO Q, et al. Effects of Gou-Qi polysaccharides on intestinal microbial diversity and composition of growing-finishing pigs[J]. Chinese Journal of Animal Nutrition, 2019, 31(9): 4033-4043 (in Chinese). |
| [10] |
吴荣昆, 黄小流, 刘美金, 等. 井冈山马齿苋多糖的体外抗氧化作用及总糖含量测定[J]. 井冈山大学学报(自然科学版), 2016, 37(2): 102-106. WU R K, HUANG X L, LIU M J, et al. In vitro antioxidative effect and determination of polysaccharides from Portulaca oleracea in Jinggangshan mountain[J]. Journal of Jinggangshan University (Natural Science), 2016, 37(2): 102-106 (in Chinese). DOI:10.3969/j.issn.1674-8085.2016.02.021 |
| [11] |
梁彦, 吕艳荣. 马齿苋多糖的抗衰老作用[J]. 江苏农业科学, 2014, 42(4): 270-272. LIANG Y, LV Y R. Anti-aging effect of polysaccharide from Portulaca oleracea L.[J]. Jiangsu Agricultural Sciences, 2014, 42(4): 270-272 (in Chinese). DOI:10.3969/j.issn.1002-1302.2014.04.102 |
| [12] |
陶贵斌, 何慧楠, 李雪惠, 等. 马齿苋多糖体外免疫调节活性研究[J]. 食品研究与开发, 2017, 38(17): 176-179. TAO G B, HE H N, LI X H, et al. The study of immunoregulatory activity in vitro of Purslane polysaccharides[J]. Food Research and Development, 2017, 38(17): 176-179 (in Chinese). DOI:10.3969/j.issn.1005-6521.2017.17.039 |
| [13] |
牛广财, 李世燕, 朱丹, 等. 马齿苋多糖POPⅡ和POPⅢ的抗肿瘤及提高免疫力作用[J]. 食品科学, 2017, 38(3): 201-205. NIU G C, LI S Y, ZHU D, et al. Antitumor and immunoenhancing effects of polysaccharides POP Ⅱ and POP Ⅲ from Portulace oleracea L.[J]. Food Science, 2017, 38(3): 201-205 (in Chinese). |
| [14] |
张海艳, 郑玲. 马齿苋多糖的提取及体外抗菌活性[J]. 江苏农业科学, 2011, 39(5): 413-415. ZHANG H Y, ZHENG L. Extraction and in vitro antibacterial activity of polysaccharide from Purslane oleracea[J]. Jiangsu Agricultural Sciences, 2011, 39(5): 413-415 (in Chinese). DOI:10.3969/j.issn.1002-1302.2011.05.169 |
| [15] |
秦月雯, 侯金丽, 王萍, 等. 马齿苋"成分-活性-中药功效-疾病"研究进展及关联分析[J]. 中草药, 2020, 51(7): 1924-1938. QIN Y W, HOU J L, WANG P, et al. Research progress and correlation analysis on "phytochemistry-pharmacological effects-CMM efficacy-diseases" of Portulaca oleracea[J]. Chinese Traditional and Herbal Drugs, 2020, 51(7): 1924-1938 (in Chinese). |
| [16] |
杨淑芬, 刘虎, 方热军. 马齿苋多糖在动物生产中的应用研究[J]. 饲料与畜牧, 2015(11): 42-44. YANG S F, LIU H, FANG R J. The study of the application of polysaccharide from Portulaca oleracea in animal production[J]. Feed and Animal Husbandry, 2015(11): 42-44 (in Chinese). |
| [17] |
库尔班·吾斯曼, 穆赫塔尔·伊米尔艾山, 帕提古丽·伊米尔艾山. 马齿苋子中多糖的提取分离及抑菌活性研究[J]. 食品研究与开发, 2009, 30(7): 28-30. OSMAN K, IMERHASAN M, IMERHASAN P. Extraction and bacteriostatic activites of polysaccharide in seed of Portulaca oleracea L. [J]. Food Research and development, 2009, 30(7): 28-30. (in Chinese) |
| [18] |
胡新俊, 李春香, 王广, 等. 马齿苋多糖对肠道微生态失调小鼠的调整作用研究[J]. 中国微生态学杂志, 2010, 22(9): 781-783. HU X J, LI C X, WANG G, et al. Effects of Portulaca polysaccharide on the dysbacteria in intestinal tract of mice[J]. Chinese Journal of Microecology, 2010, 22(9): 781-783 (in Chinese). |
| [19] |
葛剑, 杨翠军, 孙茂红. 马齿苋多糖对雏鸡生长性能、血液代谢激素和血脂的影响[J]. 中国粮油学报, 2013, 28(2): 87-92. GE J, YANG C J, SUN M H. Effects of Portulaca oleracea polysaccharide on growth performance, blood hormones secretion and serum lipid of chicken[J]. Journal of the Chinese Cereals and Oils Association, 2013, 28(2): 87-92 (in Chinese). DOI:10.3969/j.issn.1003-0174.2013.02.019 |
| [20] |
李进杰, 蒋明琴, 王汝都, 等. 马齿苋多糖对断奶仔猪生长性能的影响[J]. 当代畜牧, 2015(15): 27-29. LI J J, JIANG M Q, WANG R D, et al. Eeffect of purslane polysaccharide on growth performance of weaned piglets[J]. Contemporary Animal Husbandry, 2015(15): 27-29 (in Chinese). |
| [21] |
黄小流, 颜小星, 张童童, 等. 马齿苋多糖对早期断奶大鼠生长性能、血清生化指标和肠道形态的影响[J]. 动物营养学报, 2019, 31(4): 1773-1780. HUANG X L, YAN X X, ZHANG T T, et al. Effects of polysaccharides from Portulaca oleracea L. on growth performance, serum biochemical indices and intestinal morphology of early-weaned rats[J]. Chinese Journal of Animal Nutrition, 2019, 31(4): 1773-1780 (in Chinese). |
| [22] |
陈奥运, 吴明谦, 孟伯龙, 等. 枯草芽孢杆菌与乳酸杆菌联合应用对断奶仔猪肠道菌群的影响[J]. 畜牧与兽医, 2017, 49(4): 61-64. CHEN A Y, WU M Q, MENG B L, et al. Effects of joint application of Bacillus subtilis and Lactobacilli on intestinal flora in weaned piglets[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(4): 61-64 (in Chinese). |
| [23] |
FORNO E, ONDERDONK A B, MCCRACKEN J, et al. Diversity of the gut microbiota and eczema in early life[J]. Clinical and Molecular Allergy, 2008, 6: 11. DOI:10.1186/1476-7961-6-11 |
| [24] |
MURPHY E F, COTTER P D, HEALY S, et al. Composition and energy harvesting capacity of the gut microbiota: relationship to diet, obesity and time in mouse models[J]. Gut, 2010, 59(12): 1635-1642. DOI:10.1136/gut.2010.215665 |
| [25] |
TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [26] |
MURATORE M, PRATHER C, SUN Y. The gut bacterial communities across six grasshopper species from a coastal tallgrass prairie[J]. PLoS One, 2020, 15(1): e0228406. DOI:10.1371/journal.pone.0228406 |
| [27] |
KANG S S, JERALDO P R, KURTI A, et al. Diet and exercise orthogonally alter the gut microbiome and reveal independent associations with anxiety and cognition[J]. Molecular Neurodegeneration, 2014, 9: 36. DOI:10.1186/1750-1326-9-36 |
| [28] |
李忠浩, 秦睿玲, 马旭平. 功能性寡糖对肉鸡盲肠微生物影响的Meta分析[J]. 畜牧与兽医, 2020, 52(7): 59-63. LI Z H, QIN R L, MA X P. Meta-analysis of functional oligosaccharide on cecal microorganisms in broilers[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(7): 59-63 (in Chinese). |
| [29] |
AOKI R, KAMIKADO K, SUDA W, et al. A proliferative probiotic Bifidobacterium strain in the gut ameliorates progression of metabolic disorders via microbiota modulation and acetate elevation[J]. Scientific Reports, 2017, 7: 43522. DOI:10.1038/srep43522 |
| [30] |
克里斯, 郭建状, 冯澜, 等. 马齿苋多糖对衰老小鼠肠道微生态调节作用的研究[J]. 中国微生态学杂志, 2012, 24(3): 233-235. COLLINS, GUO J Z, FENG L, et al. The role of Portulaca oleracea polysaccharide in regulating intestinal micro flora in aged mice[J]. Chinese Journal of Microecology, 2012, 24(3): 233-235 (in Chinese). |
| [31] |
冯丹, 张民扬, 田时祎, 等. 壳聚糖螯合锌对大肠杆菌攻毒断奶大鼠回肠菌群结构及代谢产物的影响[J]. 畜牧与兽医, 2020, 52(11): 48-54. FENG D, ZHANG M Y, TIAN S Y, et al. Effects of chitosan-chelated zinc on ileal microbial community and metabolites in weaned rats challenged with Escherichia coli[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(11): 48-54 (in Chinese). |
| [32] |
MARION S, DESHARNAIS L, STUDER N, et al. Biogeography of microbial bile acid transformations along the murine gut[J]. Journal of Lipid Research, 2020, 61(11): 1450-1463. DOI:10.1194/jlr.RA120001021 |
| [33] |
龙承星. 七味白术散对菌群失调腹泻小鼠肠道黏膜细菌及乳糖酶基因多样性的影响[D]. 博士学位论文. 长沙: 湖南中医药大学, 2019. LONG C X. Effects of Qiweibaishu powder on intestinal mucosa bacteria and bacterial lactase gene diversity from dysbacterial diarrhea mice[D]. Ph. D. Thesis. Changsha: Hunan University of Chinese Medicine, 2019. (in Chinese) |
| [34] |
陈志红, 王明兹, 陈必链, 等. 溶杆菌属及其活性物质研究与应用进展[J]. 农产品加工, 2013(1): 5-10. CHEN Z H, WANG M Z, CHEN B L, et al. The progress of research and application on Lysobacter and its bioactive compounds[J]. Farm Products Processing, 2013(1): 5-10 (in Chinese). |
| [35] |
张峰. 肠道菌群的日粮铜水平响应对大鼠和苏淮哺乳仔猪生长及机体健康的影响[D]. 博士学位论文. 南京: 南京农业大学, 2017. ZHANG F. Intestinal microbiota in response to dietary copper levels affecting the growth and health of rats and Suhuai suckling piglets[D]. Ph. D. Thesis. Nanjing: Nanjing Agricultural University, 2017. (in Chinese) |
| [36] |
DE FILIPPIS F, PASOLLI E, ERCOLINI D. Newly explored Faecalibacterium diversity is connected to age, lifestyle, geography, and disease[J]. Current Biology, 2020, 30(24): 4932-4943. DOI:10.1016/j.cub.2020.09.063 |
| [37] |
高婷婷, 李海燕, 李媛, 等. 慢性肾炎大鼠的肠道菌群变化[J]. 中国微生态学杂志, 2019, 31(12): 1378-1384, 1388. GAO T T, LI H Y, LI Y, et al. Intestinal flora changes in chronic kidney disease rats[J]. Chinese Journal of Microecology, 2019, 31(12): 1378-1384, 1388 (in Chinese). |
| [38] |
李彪, 吴信, 张彬, 等. 尿苷酸的营养代谢与生理功能研究进展[J]. 动物营养学报, 2019, 31(6): 2487-2494. LI B, WU X, ZHANG B, et al. Research progresses on nutrition metabolism and physiological function of uridine monophosphate[J]. Chinese Journal of Animal Nutrition, 2019, 31(6): 2487-2494 (in Chinese). |
| [39] |
刘昭曦, 王禄山, 陈敏. 肠道菌群多糖利用及代谢[J/OL]. 微生物学报: 1-15[2021-05-11]. https://doi.org/10.13343/j.cnki.wsxb.20200478. LIU Z X, WANG L S, CHEN M. Glycan utilization and metabolism by gut microbiota[J]. Acta Microbiologica Sinica: 1-15[2021-05-11]. https://doi.org/10.13343/j.cnki.wsxb.20200478. (in Chinese) |
| [40] |
刘彩虹, 张和平. 肠道菌群与肠道内营养物质代谢的相互作用[J]. 中国乳品工业, 2014, 42(5): 33-36, 57. LIU C H, ZHANG H P. Research on the interaction of intestinal flora and intestinal nutrient metabolism[J]. Dairy Industry, 2014, 42(5): 33-36, 57 (in Chinese). |




