2. 广东海洋大学滨海农学院, 湛江 524088
2. College of Agricultural, Guangdong Ocean University, Zhanjiang 524088, China
20世纪80年代时,罗伊氏乳杆菌(Lactobacillus reuteri,L. Reuteri)被误认为发酵乳杆菌(Lactobacillus fermentum,L. fermentum)中的一种。后来由Kandler等[1]鉴定为新的菌种,并命名为“reuteri”。L. Reuteri普遍存在于自然环境中,已经可以从人、鼠、猪和鸡等粪便中分离。一直以来,对于L. Reuteri的研究发现,其作为一种益生菌可以在肠道发挥有效作用,改善肠道健康、增强动物免疫能力、提高动物生长性能和有效保护肠道健康,且作为抗生素的潜在替代物应用于畜禽生产,但具体作用机制尚未明确。本文综述了L. Reuteri的生物学特性,以及在肠道黏膜的机械/物理屏障、化学屏障、生物屏障和免疫屏障4个方面的作用机制及其对畜禽动物机体的影响,为L. Reuteri更好地应用于生产实际提供科学参考。
1 L. Reuteri的概述L. Reuteri是一种过氧化氢酶阴性、革兰氏阳性、不产芽孢、专性异型发酵细菌,能发酵己糖生成二氧化碳、乙酸、乙醇和DL-乳酸等产物。L. Reuteri耐胃酸和胆汁能力强,是少有的以消化道作为天然寄居地的益生菌,动物出生后就能在其肠道定植[2]。作为肠道菌群中的一员,起着维护肠道微生物菌群结构的稳定、增强机体对疫苗的应答[3]、预防胃肠道感染等重要作用。王志林等[4]从健康的断奶仔猪粪便中分离出猪源L. Reuteri,体内试验发现,L. Reuteri可提高断奶仔猪采食量、平均日增重(ADG),降低料重比,提高饲料养分消化率,降低血清尿素氮含量,还可以降低腹泻率[5]。有研究发现,L. Reuteri LR1可以改善断奶仔猪的生长性能和肠道形态[6]。此外,L. Reuteri可以提高家禽的生长性能[7],增加鸡的体重,提高免疫功能[8]。
2 肠黏膜屏障肠道是动物机体最大的器官,主要作用是消化和吸收饲料中的营养成分。肠道管壁将机体内组织与外界环境隔开,管壁上的黏膜层像一道屏障一样,防止肠腔中有毒物质和致病微生物入侵,因此完整的肠黏膜形态结构是保证肠道发挥一切正常生理功能的重要前提。一般可将肠黏膜屏障划分为机械/物理屏障、化学屏障、生物屏障和免疫屏障[9-10]。它们之间互相联系,共同维持肠道的完整性和稳定性[11]。
2.1 物理屏障肠道的物理屏障是由黏液层和肠上皮细胞(intestinal epithelial cells,IECs)共同组成的,又称黏膜机械屏障[12]。黏液层是上皮细胞和肠腔内环境物质交换的媒介,限制细菌与肠上皮细胞接触,也为菌群提供营养和黏附位点,是机械屏障中不可或缺的组成部分。黏蛋白由黏液素1、黏液素2等组成,还含有分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA),可有效抵御病原菌的侵入,黏液润滑肠壁,隔绝病原菌和肠上皮细胞,保护上皮细胞免受损伤[13]。黏液层下是上皮细胞,其间隙之间有紧密连接蛋白(tight junctions,TJs)结构。TJs一旦受损,上皮细胞间的通透性就会增高,有害物质经过肠黏膜和上皮细胞间进入体循环,引起肠道感染及全身性反应。黏膜的机械屏障阻断肠腔内的细菌位移,减少肠腔内细菌与宿主炎性免疫细胞相互作用。
2.2 化学屏障肠黏膜化学屏障是由胃肠道分泌的消化液、溶菌酶、糖蛋白、抗菌肽和肠道菌群产生短链脂肪酸等化学物质组成[14]。胃中的酸性环境能杀灭胃内的细菌,减少细菌在胃肠道黏附和定植。胆酸可以降解内毒素分子,防止被肠道吸收造成机体中毒。潘氏细胞分泌的防御素是广谱的抗菌物质。溶菌酶可破坏细菌细胞壁使其裂解,黏液中的补体成分可增强溶菌酶和免疫球蛋白的抗菌作用。这些化学物质都成了防止细菌毒素扩散的化学屏障。
2.3 生物屏障黏膜生物屏障即肠道正常菌群[15],它们通过磷壁酸与黏膜上皮细胞结合形成微生物膜,抑制有害菌的生长[16]。正常菌群在不破坏上皮细胞的基础上定植于肠道表面,形成一道生物屏障[17]。肠道各菌群之间存在相互依赖和相互制约的关系,共同维持肠道蠕动。优势菌群对宿主发挥生理作用,占据黏膜的深层,地位相当稳固,又称益生菌[18]。如乳酸杆菌通过可竞争性占位抑制肠道条件致病菌,提高益生菌群比例,维持肠道微生态稳定[19]。同时,乳酸杆菌产生乳酸(lactic acid,LA)等物质,改变pH,增加肠道内有益菌群的数量[20]。此外,肠黏膜的生物屏障与致病菌竞争营养物质,使机体产生非特异性抗体和激活吞噬细胞活性,以阻止细菌侵袭。
2.4 免疫屏障肠道黏膜内含有大量淋巴组织,能够产生大量的抗体。肠黏膜免疫屏障是肠道相关淋巴组织(gut associated lymphoid tissue,GALT)及其所分泌的sIgA和细胞因子所组成的免疫屏障[21]。弥散性淋巴细胞和组织样淋巴组织形成了GALT,前者主要是散在黏膜固有层及上皮细胞层内的淋巴细胞及腔内淋巴细胞,后者主要是派尔集合淋巴结、肠系膜淋巴结及孤立淋巴细胞。GALT主要分布在淋巴结、固有层和肠上皮细胞间,具有邻近各种抗原的特点。固有层内有大量的淋巴细胞,包括巨噬细胞、自然杀伤(natural killer,NK)细胞、淋巴因子激活的杀伤(lymphokine-activated killer,LAK)细胞和肥大细胞。另外,在黏膜淋巴结的滤泡相关上皮中有一种M细胞,表面的褶皱可协助抗原快速转运,是肠道细菌和其他抗原物质至基底淋巴细胞组织发生免疫反应的门户[22]。
3 L. Reuteri对肠黏膜屏障的调节作用 3.1 L. Reuteri对物理屏障的调节作用 3.1.1 促进黏蛋白分泌,增加黏液层厚度L. Reuteri促进肠黏膜发育,改善肠道形态结构。饲喂L. Reuteri的仔猪感染F4+ ETEC后,十二指肠绒毛组织松散程度大有改善,炎性细胞浸润减少,杯状细胞死亡较少,肠隐窝受损现象有所缓解[23]。Yi等[24]发现,L. Reuteri LR1降低了肠毒素性大肠杆菌K88诱导的IPEC-1细胞单层通透性增加,并减少了IPEC-1细胞中大肠菌的黏附和侵袭。Ahl等[25]发现,L. Reuteri R2LC和4659可以通过增加结肠黏液层的厚度,减少肠腔细菌与肠上皮细胞的接触而防止炎症的发生,增强了肠黏膜的机械屏障。杨凤娟等[26]研究表明,L. Reuteri能通过增加仔猪回肠杯状细胞数量来促进黏液分泌。郑雨星[27]发现,L. Reuteri Re3干预后可显著提高黏蛋白2的转录水平,从而缓解了葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎炎症反应。
3.1.2 促进肠细胞增殖肠上皮细胞增殖与凋亡的平衡维持着机械屏障的动态平衡。L. Reuteri可暂时性地激活原代肠上皮细胞并促进肠上皮细胞迁移和增殖,使它们快速周转;而细胞快速周转是针对侵袭性细菌、寄生虫和病毒的宿主防御机制,用于排除来自上皮的感染细胞和病原体。研究表明,L. Reuteri LET 210能减少体内含有麦胚凝集素的鸡肠道上皮细胞的死亡[28]。L. Reuteri通过提高小鼠结肠中的富含亮氨酸重复单位的G蛋白偶联受体5的转录水平来促进损伤后结肠的干细胞生成,加快肠道隐窝细胞的增殖[29]。对于感染了轮状病毒的新生小鼠,L. Reuteri 17938能增加其肠道绒毛高度,促进肠细胞增殖[30]。
3.1.3 提高紧密连接蛋白表达量紧密连接通过紧密连接蛋白-1(ZO-1)与跨膜蛋白的相互作用,在维持膜屏障功能和完整性方面发挥重要作用。L. Reuteri LR1能防止IPEC-1细胞由于肠毒性大肠杆菌ETECK88感染引起的ZO-1破坏。L.Reuteri LR1还存在TLR2信号传导途径,即乳杆菌的细胞壁成分——脂肪酸磷酸通过蛋白激酶C(protein kinase C,PKC)激活来增强ZO-1相关肠上皮屏障的完整性[31]。Yang等[32]发现L. ReuteriI5007能防止脂多糖诱导的肠道紧密连接蛋白表达降低,显著提高小鼠空肠和回肠上皮闭合蛋白-1(Claudin-1)、闭锁蛋白(Occludin)和ZO-1的蛋白表达量。此外,L. Reuteri能阻止IPEC-J2细胞中肠毒素性大肠杆菌诱导的细胞活力和跨膜电阻(TEER)值降低和紧密连接蛋白的破坏,从而保护肠道屏障[33]。
3.2 L. Reuteri对化学屏障的调节作用 3.2.1 降低肠道pHL. Reuteri通过共凝聚作用降低pH和过氧化氢含量,显著抑制真菌和大肠杆菌等有害菌的生长,促进肠道菌群平衡来维持肠道健康[34]。另外,L. Reuteri使肠道中挥发性脂肪酸(volatile fatty acid,VFA)的合成增强[35],降低肠道pH。L. Reuteri I5007将大肠中的葡萄糖酸(gluconic acid,GA)发酵成丁酸(butyric acid,BA),增加结肠内容物中BA和回肠LA的含量[20],VFA还能给上皮细胞提供能量,改变细菌细胞膜的通透性来抑制致病菌的生长。
3.2.2 增加防御肽的表达L. Reuteri通过增加结肠内容物中短链脂肪酸的含量以及结肠短链脂肪酸受体发挥作用,从而促进肠上皮细胞中防御肽的表达。L. Reuteri促进空肠中防御素(pBD)-2和结肠中pBD-2、pBD-3、pBD-114和pBD-129 mRNA相对表达量[36],显著改善肠道黏膜的免疫功能。L. Reuteri可通过改变蛋白质的结合位点,从而改变其他菌株的黏附特性,例如,L. Reuteri DSM20016来源的生物表面活性剂是变形链球菌ATCC35668中葡糖基转移酶和果糖基转移酶的有效抑制剂,通过下调其中黏附肠道的3种关键基因水溶性葡聚糖(gtfB)、水溶性和不溶性葡聚糖(gtfC)、细胞核受体(ftf)的表达,抑制变形链球菌ATCC35668在肠道的定植[37]。
3.2.3 调节血清中化学物质L. Reuteri DSM 17938上调与尿素循环、三羧酸循环、蛋氨酸甲基化和多胺途径有关的血浆代谢产物,并且通过增加小鼠体内色氨酸代谢物和嘌呤核苷腺苷的水平来增强对炎症刺激的耐受性。N-乙酰鸟氨酸是肠道谷氨酰胺和谷氨酸合成微生物瓜氨酸和精氨酸途径的中间物质。L. Reuteri DSM 17938可提高N-乙酰鸟氨酸的含量,它是肠道谷氨酰胺和谷氨酸合成微生物瓜氨酸和精氨酸途径的中间物质。大多数哺乳动物的肠上皮细胞可以从谷氨酸、谷氨酰胺和脯氨酸生成瓜氨酸,而瓜氨酸在肝脏外组织中被转化为精氨酸。血清中瓜氨酸含量升高,精氨酸的内源性产量也随之增加,促进肌肉蛋白质合成,谷氨酰胺和精氨酸对肠黏膜的完整性和恢复至关重要[38]。
3.3 L. Reuteri对生物屏障的调节作用 3.3.1 调节肠道菌群作为肠道内的优势菌群,L. Reuteri在幼年动物肠道内定植,与病原菌竞争营养物质,菌体与其他有益菌的黏附组成肠上皮的生物屏障,通过空间障碍、竞争性抑制靶向细胞上的附着位点或者微菌落扩散共同抵御病原菌的侵袭。经证实,L. Reuteri具有抑制幽门螺氏杆菌(Helicobacter pylori,HP)与糖脂受体的结合,阻止Asialo-GM1和硫酸酯(sufonic acidester,SA)的结合[39],抑制病原菌与肠道上皮细胞的结合。相反,L. Reuteri促进分段丝状细菌(segmented filamentous bacteria,SFB)在肠道的生长。在小鼠体内,SFB诱导强烈的免疫球蛋白A(IgA)反应和固有层CD4+的募集和激活,影响T细胞与上皮内CD8+T淋巴细胞的数量,在肠先天免疫的成熟过程中起着关键作用[38]。所以,L. Reuteri喂养母鼠会增加子鼠肠道中有益菌数量,调节性T细胞的百分比随之增大。在断奶仔猪饲粮中加入L. Reuteri能增加粪便中小杆菌属和光杆菌属细菌的丰度[40]。L. Reuteri不仅能产生抑菌物质,还可以增强其他益生菌产生抑菌物质的能力。当L. Reuteri KLDS1.0736与植物乳杆菌KLDS1.0391共培养时,与单独培养时相比,抑菌圈直径和细菌素合成量显著增加,抑菌活性也有所增强[41]。
3.3.2 产生黏附素L. Reuteri的黏附作用是通过菌体表面分泌的一种蛋白质或糖蛋白——黏附素(adhesin)与宿主黏液层或上皮细胞受体之间相互作用完成的。不同菌株的L. Reuteri产生的黏附素也不同,L. Reuteri NCIB 11951产生的黏附素为胶原结合蛋白[42],L. Reuteri 1063产生的黏附素为麦芽糖结合蛋白[43],L. Reuteri 100-23产生的黏附素为高分子质量表面蛋白[44]。这些黏附素可以促进包括L. Reuteri等有益菌在肠道的定植。
3.3.3 独特的生物活性L. Reuteri独特之处在于它能产生一种非蛋白质类广谱活性的抑菌物质罗伊氏菌素,能抑制埃希氏菌、沙门氏菌和志贺氏菌等细菌的生长,当其浓度达到15~30 μg/mL时,抑制革兰氏阳性菌和革兰氏阴性菌,甚至酵母菌、真菌和原生动物的生长[3]。L. Reuteri还能产生Reutericin 6、Reutericyclin、胞外多糖等抑菌物质,Reutericyclin是一种广谱的抗菌物质[45]。
3.4 L. Reuteri对免疫屏障的调节作用 3.4.1 细菌酶的“抗组胺”作用L. Reuteri有抗组胺的作用,通过减少PKC介导的哺乳动物细胞信号来抑制肠道1型组胺介导的促炎反应。L. Reuteri分泌一种细菌酶——二酰基甘油激酶(diacylglycerol kinases,DGK),与肠道脂代谢关系密切,将哺乳动物的磷酸二酰基甘油(diacylglycerol,DAG)转化为磷脂(phosphatidic acid,PA)。DGK抑制1型组胺受体下游PKC的磷酸化,由L. Reuteri 6475分泌的DGK可能与上皮DAG脂质信号相互作用,从而抑制促炎1型组胺受体,激活抗炎组胺2型受体信号传导。最终,PKC磷酸化水平的降低可能减弱核因子-κB(nuclear factor-kappa B,NF-κB)信号转导和抑制黏膜炎症从而维护肠道免疫稳态[46]。
3.4.2 增强巨噬细胞吞噬作用巨噬细胞作为天然免疫和适应性免疫的重要组成部分,能在短时间内吞噬和清除大部分入侵的病原体。巨噬细胞通过产生一氧化氮和活性氧等效应物,以及分泌促炎细胞因子,诱导炎症和细胞毒性来防止病原体的入侵。一氧化氮是重要的内部和细胞间调节分子,杀死病毒感染的细胞、肿瘤细胞和寄生性病原体,且在某些病毒感染中有抗病毒作用[47],被认为是先天防御机制的第2道防线。巨噬细胞在炎症反应中诱导产生一氧化氮合酶,导致感染后一氧化氮含量升高[48]。L. Reuteri通过参与激活巨噬细胞,增强其吞噬能力和杀死细胞内细菌的能力,同时促进感染鼠伤寒沙门氏菌(Salmonella typhimurium,ST)小鼠的巨噬细胞中一氧化氮的分泌,进而加强了L. Reuteri对ST感染的小鼠的保护作用,并减少小鼠体内的细菌负荷,加强肠黏膜的免疫功能[49]。
3.4.3 参与调控炎症反应Toll样受体(Toll-like receptor,TLR)是天然免疫细胞和其他细胞或组织表面最重要的模式识别受体,肠道的先天性免疫和适应性免疫依靠其完成[50]。TLR介导的NF-κB信号转导和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导是调节由刺激触发的宿主炎症的重要途径。NF-κB在免疫和炎症反应中具有重要作用,NF-κB的失调可导致促炎性细胞因子过度生成,微生物已经被证实具有调节NF-κB信号通路活性的能力。L. Reuteri可以分泌γ-谷氨酰半胱氨酸,γ-谷氨酰半胱氨酸可进入肠上皮细胞并调节上皮细胞因子的产生,它通过抑制活性氧和NF-κB起作用,减少白细胞介素(IL)-8的产生[51]。L. Reuteri对免疫反应具有积极作用,使用低剂量就能提高T淋巴细胞数量和IL-12水平。L. ReuteriDSM 17938和ATCCPTA 4659通过下调TLR4的表达,降低NF-κB的转录,从而抑制试验性肠炎症反应[52]。革兰氏阳性菌细胞壁的肽聚糖会被TLR2识别,TLR2的激活可以促进促炎和抗炎细胞因子,研究表明,L.Reuteri DSM17938通过激活TLR2,进而发挥对坏死性小肠结肠炎(necrotizing enterocolitis,NEC)的保护作用[53]。
3.4.4 参与调控T细胞Treg的免疫抑制机制包括细胞因子依赖性和非依赖性途径。在细胞因子依赖性途径中,IL-10和TGF-β是抑制过度免疫反应的主要细胞因子。L. Reuteri是一种功能性益生菌,能够诱导针对食物过敏的肠道免疫耐受。研究表明,肠分泌IL-10的CD103+DCs和功能性Treg细胞是由L.Reuteri诱导的,这可能维持免疫耐受并抵消异常的免疫反应[54]。Hoang等[53]研究发现,L.ReuteriDSM 17938可改善NEC的症状和降低其发病率,并增加肠道黏膜中TregCD4+FOXP3+的百分比。在之后的研究中,Hoang等[55]发现L.ReuteriDSM 17938可以通过增加肠道黏膜中Treg的数量,减轻NEC的严重程度和降低其发生率。TGF-β下调单核细胞与巨噬细胞中一些炎性细胞因子的表达,在诱导CD4+ T细胞向诱导性免疫调节T细胞转变时发挥重要作用,而L. Reuteri LR1提高断奶仔猪回肠中IL-22和TGF-β的表达[5]。
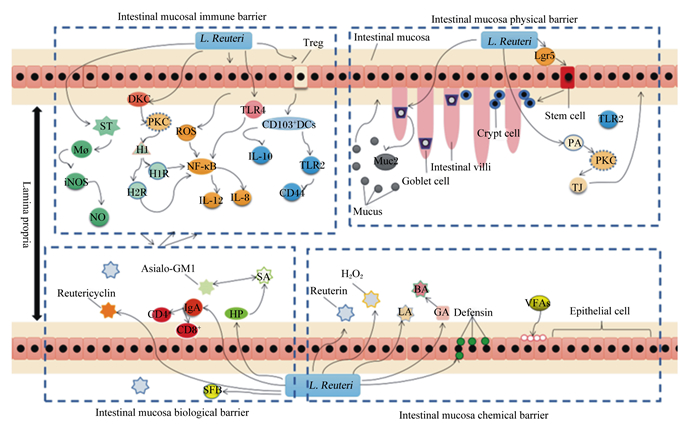
4 小结综上所述,L. Reuteri具有很好地保护和改善肠道屏障功能的作用,是通过影响微生物之间的关系、黏液层厚度、肠上皮细胞及之间的紧密连接蛋白、有机酸和抗菌肽的产生、免疫相关因子和免疫细胞来发挥作用(图 1)。研究L. Reuteri与肠道屏障之间的关系对动物乃至人类健康具有重要意义。以往的研究主要从分子和细胞水平阐述L. Reuteri调节肠道屏障的机制,而近年来流行的基因组学、蛋白质组学和代谢组学手段或更有助于更全面地解析复杂的体内环境下L. Reuteri的作用机制。由于L. Reuteri具有预防和减轻腹泻、调节肠道微生物和免疫功能,在饲料抗生素禁用的环境下,作为畜禽生产中的一种有效饲料添加剂应用前景广阔。
|
Intestinal mucosal immune barrier: 肠黏膜免疫屏障;Intestinal mucosa physical barrier: 肠黏膜物理屏障;Intestinal mucosa biological barrier: 肠黏膜生物屏障;Intestinal mucosa chemical barrier: 肠黏膜化学屏障;Intestinal mucosa: 肠黏膜;Epithelial cell: 上皮细胞;Lamina propria: 固有层;Goblet cell: 杯状细胞;Crypt cell: 隐窝细胞;Stem cell: 干细胞;Intestinal villi: 肠道绒毛;Defensin: 防御素;H2O2: 过氧化氢;ST:鼠伤寒沙门氏菌Salmonella typhimurium;Mø:巨噬细胞macrophages;iNOS:一氧化氮合成酶nitric oxide synthase;NO:一氧化氮nitric oxide;DGK:二酰基甘油激酶diacylglycerol kinases;PKC:蛋白激酶C protein kinase C;H1:1型组胺histamine 1;H1R:促炎1型组胺受体proinflammatory type 1 histamine receptor;H2R:抗炎组胺2型受体anti-inflammatory histamine type 2 receptor;NF-κB:核因子-κB nuclear factor-kappa B;ROS:活性氧reactive oxygen species;IL-8:白细胞介素-8 interleukin-8;IL-10:白细胞介素-10 interleukin-10;IL-12:白细胞介素-12 interleukin-12;Treg:调节性T细胞regulatory T cells;TLR2:Toll样受体2 Toll-like receptor 2;TLR4:Toll样受体4 Toll-like receptor 4;Mucus:黏液;Muc2:黏蛋白2;PA:磷脂hosphatidic;PKC:蛋白激酶C protein kinase C;TJ:紧密连接蛋白tight junction protein;Lgr5;糖蛋白激素受体5 glycoprotein hormone receptor 5;Reutericyclin:重环素;IgA:免疫球蛋白A immunoglobulin A;SFB:分段丝状细菌segmented filamentous bacteria;HP:幽门螺氏杆菌helicobacter pylori;SA:硫酸酯sufonic acidester;Ganglio-N-tetraosylceramide: 甘利奥-N-四甲基神经酰胺;Reuterin:重子宫素;LA:乳酸lactic acid;BA:丁酸butyric acid;GA:葡萄糖酸gluconic acid;VFAs:挥发性脂肪酸volatile fatty acids;CD103+DCs:树突状细胞CD 103+子集;CD4+:CD4+T细胞。 图 1 L. Reuteri对肠黏膜屏障的调节途径 Fig. 1 Regulatory pathway of L. Reuteri on intestinal mucosal barrier |
| [1] |
KANDLER O, STETTER K O, KÖHI R. Lactobacillus reuteri sp.nov., a new species of heterofermentative lactobacilli[J]. Zentralblatt Für Bakteriologie I.abt.Originale C Allgemne Angewandte Und Kologische Mikrobiologie, 1980, 1(3): 264-269. DOI:10.1016/S0172-5564(80)80007-8 |
| [2] |
NAITO S, HAYASHIDANI H, OGAWA M. Development of intestinal lactobacilli in normal piglets[J]. The Journal of Applied Bacteriology, 1995, 79(2): 230-236. DOI:10.1111/j.1365-2672.1995.tb00940.x |
| [3] |
张如春, 司华哲, 陈双双, 等. 罗伊氏乳杆菌在畜禽生产中应用的研究进展[J]. 动物营养学报, 2019, 31(3): 1031-1036. ZHANG R C, SI H Z, CHEN S S, et al. Research progress on application of Lactobacillus reuteri in livestock husbandry[J]. Chinese Journal of Animal Nutrition, 2019, 31(3): 1031-1036 (in Chinese). |
| [4] |
王志林, 陈庄, 廖玲, 等. 猪源罗伊氏乳酸杆菌培养条件优化及其冻干保护剂筛选[J]. 广东农业科学, 2012, 39(19): 151-153. WANG Z L, CHEN Z, LIAO L, et al. Optimization of fermentation conditions and selection of the cryoprotectants of Lactobacillus reuteri from piglet[J]. Guangdong Agricultural Sciences, 2012, 39(19): 151-153 (in Chinese). DOI:10.3969/j.issn.1004-874X.2012.19.047 |
| [5] |
杨广达. 罗伊氏乳杆菌LR1对断奶仔猪生长性能、肠道屏障功能和氨基酸转运的影响[D]. 硕士学位论文. 广州: 华南农业大学, 2018. YANG G D. The effect of Lactobacillus reuteri LR1 on pig growth performance, intestinal barrier function and amino acid transport[D]. Master's Thesis. Guangzhou: South China Agricultural University, 2018. (in Chinese) |
| [6] |
YI H B, WANG L, XIONG Y X, et al. Effects of Lactobacillus reuteri LR1 on the growth performance, intestinal morphology, and intestinal barrier function in weaned pigs[J]. Journal of Animal Science, 2018, 96(6): 2342-2351. DOI:10.1093/jas/sky129 |
| [7] |
REUBEN R C, ROY P C, SARKAR S L, et al. Isolation, characterization, and assessment of lactic acid bacteria toward their selection as poultry probiotics[J]. BMC Microbiology, 2019, 19(1): 253. DOI:10.1186/s12866-019-1626-0 |
| [8] |
SURESHKUMAR S, JUNG S K, KIM D, et al. Oral administration of Lactobacillus reuteri expressing a 3D8 single-chain variable fragment (scFv) enhances chicken growth and conserves immune homeostasis[J]. 3 Biotech, 2019, 9(7): 282. DOI:10.1007/s13205-019-1811-8 |
| [9] |
黄怡. 屎肠球菌EF1对仔猪小肠黏膜屏障功能的影响[D]. 博士学位论文. 杭州: 浙江大学, 2012. HUANG Y. Effect of Enterococcus faecium EF1 on small intestinal mucosa barrier functions of piglets[D]. Ph. D. Thesis. Zhejiang: Zhejiang University, 2012. (in Chinese) |
| [10] |
武庆斌, 郑跃杰, 黄永坤. 儿童肠道菌群基础与临床[M]. 北京: 科学出版社, 2012. WU Q B, ZHENG Y J, HUANG Y K. Basic and clinical aspects of children's intestinal flora[M]. Beijing: Science Press, 2012 (in Chinese). |
| [11] |
HAMMER A M, MORRIS N L, EARLEY Z M, et al. The first line of defense: the effects of alcohol on post-burn intestinal barrier, immune cells, and microbiome[J]. Alcohol Research: Current Reviews, 2015, 37(2): 209-222. |
| [12] |
HARTMANN P, CHEN P, WANG H J, et al. Deficiency of intestinal mucin-2 ameliorates experimental alcoholic liver disease in mice[J]. Hepatology, 2013, 58(1): 108-119. DOI:10.1002/hep.26321 |
| [13] |
BOLLINGER R R, EVERETT M L, WAHL S D, et al. Secretory IgA and mucin-mediated biofilm formation by environmental strains of Escherichia coli: role of type 1 pili[J]. Molecular Immunology, 2006, 43(4): 378-387. DOI:10.1016/j.molimm.2005.02.013 |
| [14] |
翟双双. 肠道黏膜屏障机能及其调控研究进展[J]. 现代畜牧兽医, 2014(7): 54-58. ZHAI S S. Progress on function and regulation of the intestinal mucosal barrier[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2014(7): 54-58 (in Chinese). DOI:10.3969/j.issn.1672-9692.2014.07.016 |
| [15] |
HOOPER L V, XU J, FALK P G, et al. A molecular sensor that allows a gut commensal to control its nutrient foundation in a competitive ecosystem[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(17): 9833-9838. DOI:10.1073/pnas.96.17.9833 |
| [16] |
RIEHL T E, ALVARADO D, EE X, et al. Lactobacillus rhamnosus GG protects the intestinal epithelium from radiation injury through release of lipoteichoic acid, macrophage activation and the migration of mesenchymal stem cells[J]. Gut, 2019, 68(6): 1003-1013. DOI:10.1136/gutjnl-2018-316226 |
| [17] |
TUOMOLA E M, OUWEHAND A C, SALMINEN S J. The effect of probiotic bacteria on the adhesion of pathogens to human intestinal mucus[J]. FEMS Immunology and Medical Microbiology, 1999, 26(2): 137-142. DOI:10.1111/j.1574-695X.1999.tb01381.x |
| [18] |
BEHNSEN J, RAFFATELLU M. Keeping the peace: aryl hydrocarbon receptor signaling modulates the mucosal microbiota[J]. Immunity, 2013, 39(2): 206-207. DOI:10.1016/j.immuni.2013.08.012 |
| [19] |
吴小南, 陈忠龙, 陈洁, 等. 发酵莲子乳对小鼠肠黏膜屏障保护作用[J]. 中国公共卫生, 2008(6): 675-677. WU X N, CHEN Z L, CHEN J, et al. Protection effect of lotus-seed milk fermented production on intestinal mucosal barrier of mice[J]. Chinese Journal of Public Health, 2008(6): 675-677 (in Chinese). DOI:10.3321/j.issn:1001-0580.2008.06.021 |
| [20] |
HOU C, LIU H, ZHANG J, et al. Intestinal microbiota succession and immunomodulatory consequences after introduction of Lactobacillus reuteri I5007 in neonatal piglets[J]. PLOS One, 2015, 10(3): e0119505. DOI:10.1371/journal.pone.0119505 |
| [21] |
NEISH A S. Mucosal immunity and the microbiome[J]. Annals of the American Thoracic Society, 2014, 11(Suppl.1): S28-S32. |
| [22] |
CHOUDHRY M A, RANA S N, KAVANAUGH M J, et al. Impaired intestinal immunity and barrier function: a cause for enhanced bacterial translocation in alcohol intoxication and burn injury[J]. Alcohol, 2004, 33(3): 199-208. DOI:10.1016/j.alcohol.2004.05.004 |
| [23] |
赵东方. 罗伊氏乳酸杆菌的分离鉴定及其抵抗仔猪感染F4+ETEC效果的分析[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2019.6. ZHAO D F. Isolation and identification of Lactobacillus reuteri and its affection on F4+ETEC infection in piglets[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2019.6. (in Chinese) |
| [24] |
YI H, WANG L, XIONG Y, et al. Lactobacillus reuteri LR1 improved expression of genes of tight junction proteins via the MLCK pathway in IPEC-1 cells during infection with enterotoxigenic Escherichia coli K88[J]. Mediators of Inflammation, 2018, 2018: 6434910. |
| [25] |
AHL D, LIU H, SCHREIBER O, et al. Lactobacillus reuteri increases mucus thickness and ameliorates dextran sulphate sodium-induced colitis in mice[J]. Acta Physiologica, 2016, 217(4): 300-310. DOI:10.1111/apha.12695 |
| [26] |
杨凤娟, 曾祥芳, 谯仕彦. 罗伊氏乳杆菌I5007对新生仔猪肠道形态、二糖酶活性和紧密连接蛋白表达的影响[J]. 中国农业科学, 2014, 2(2): 4506-4515. YANG F J, ZENG X F, QIAO S Y. Effect of Lactobacillus reuteri I5007 on intestinal morphology, disaccharidase activity and tight junction protein expression in newborn piglets[J]. Scientia Agricultura Sinica, 2014, 2(22): 4506-4515 (in Chinese). DOI:10.3864/j.issn.0578-1752.2014.22.016 |
| [27] |
郑雨星. 鼠李糖乳杆菌和罗伊氏乳杆菌对DSS诱导的小鼠结肠炎的缓解作用及机制分析[D]. 硕士学位论文. 无锡: 江南大学, 2020. ZHENG Y X. Analysis of the effect and mechanisms on DSS-induced colitis in mice by different species of Lactobacillus[D]. Master's Thesis. Wuxi: Jiangnan University, 2020. (in Chinese) |
| [28] |
BABOT J D, ARGAÑARAZ M E, LORENZO-PISARELLO M J, et al. Lactic acid bacteria isolated from poultry protect the intestinal epithelial cells of chickens from in vitro wheat germ agglutinin-induced cytotoxicity[J]. British Poultry Science, 2017, 58(1): 76-82. DOI:10.1080/00071668.2016.1251574 |
| [29] |
PREIDIS G A, SAULNIER D M, BLUTT S E, et al. Probiotics stimulate enterocyte migration and microbial diversity in the neonatal mouse intestine[J]. FASEB Journal, 2012, 26(5): 1960-1969. DOI:10.1096/fj.10-177980 |
| [30] |
PREIDIS G A, SAULNIER D M, BLUTT S E, et al. Host response to probiotics determined by nutritional status of rotavirus-infected neonatal mice[J]. Journal of Pediatric Gastroenterology and Nutrition, 2012, 55(3): 299-307. DOI:10.1097/MPG.0b013e31824d2548 |
| [31] |
WANG Z, WANG L, CHEN Z, et al. In vitro evaluation of swine-derived lactobacillus reuteri: probiotic properties and effects on intestinal porcine epithelial cells challenged with enterotoxigenic Escherichia coli K88[J]. Journal of Microbiology and Biotechnology, 2016, 26(6): 1018-1025. DOI:10.4014/jmb.1510.10089 |
| [32] |
YANG F J, WANG A N, ZENG X F, et al. Lactobacillus reuteri I5007 modulates tight junction protein expression in IPEC-J2 cells with LPS stimulation and in newborn piglets under normal conditions[J]. BMC Microbiology, 2015, 15: 32. DOI:10.1186/s12866-015-0372-1 |
| [33] |
TSUKITA S, FURUSE M, ITOH M. Multifunctional strands in tight junctions[J]. Nature Reviews Molecular Cell Biology, 2001, 2(4): 285-293. DOI:10.1038/35067088 |
| [34] |
雷清芝, 汪思凡, 殷桦娟, 等. 罗伊氏乳杆菌LP4对东方蜜蜂成年工蜂存活率, 肠道菌群结构和抗菌肽mRNA表达量的影响[J]. 云南农业大学学报(自然科学), 2020, 35(5): 796-803. LEI Q Z, WANG S F, YAN H J, et al. Effects of Lactobacillus reuteri LP4 on the survival rate, intestinal microbiota composition and gut antimicrobial peptide gene expression in adult workers of Apis cerana Fabricius[J]. Journal of Yunnan Agricultural University (Natural Science), 2020, 35(5): 796-803 (in Chinese). |
| [35] |
LI S Q, QI C, ZHU H L, et al. Lactobacillus reuteri improves gut barrier function and affects diurnal variation of the gut microbiota in mice fed a high-fat diet[J]. Food Funct, 2019, 10(8): 4705-4715. DOI:10.1039/C9FO00417C |
| [36] |
侯成立. 罗伊氏乳杆菌全基因组序列分析及其调节仔猪肠黏膜免疫功能的研究[D]. 博士学位论文. 北京: 中国农业大学, 2015. HOU C L. Whole genome sequence analysis of Lactobacillus reuteri and its regulation in intestinal mucosal immunity of piglets[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2015. (in Chinese) |
| [37] |
SALEHI R, SAVABI O, KAZEMI M, et al. Effects of Lactobacillus reuteri-derived biosurfactant on the gene expression profile of essential adhesion genes (gtfB, gtfC and ftf) of Streptococcus mutans[J]. Advanced Biomedical Research, 2014, 3: 169. DOI:10.4103/2277-9175.139134 |
| [38] |
LIU Y Y, TIAN X J, HE B K, et al. Lactobacillus reuteri DSM 17938 feeding of healthy newborn mice regulates immune responses while modulating gut microbiota and boosting beneficial metabolites[J]. American Journal of Physiology: Gastrointestinal and Liver Physiology, 2019, 317(6): G824-G838. DOI:10.1152/ajpgi.00107.2019 |
| [39] |
MUKAI T, ASASAKA T, SATO E, et al. Inhibition of binding of Helicobacter pylori to the glycolipid receptors by probiotic Lactobacillus reuteri[J]. FEMS Immunology and Medical Microbiology, 2002, 32(2): 105-110. DOI:10.1111/j.1574-695X.2002.tb00541.x |
| [40] |
YANG Y, GALLE S, LE M H A, et al. Feed fermentation with reuteran-and levan-producing Lactobacillus reuteri reduces colonization of weanling pigs by enterotoxigenic Escherichia coli[J]. Applied and Environmental Microbiology, 2015, 81(17): 5743-5752. DOI:10.1128/AEM.01525-15 |
| [41] |
满丽莉, 孟祥晨, 赵日红. 部分乳酸菌对植物乳杆菌KLDS1.0391细菌素合成的诱导作用[J]. 食品科学, 2013, 34(7): 180-184. MAN L L, MENG X C, ZHAO R H. Induction of bacteriocin synthesis in Lactobacillus plantarum KLDS 1.0391 by some lactic acid bacteria strains[J]. Food Science, 2013, 34(7): 180-184 (in Chinese). |
| [42] |
ROOS S, ALELJUNG P, ROBERT N, et al. A collagen binding protein from Lactobacillus reuteri is part of an ABC transporter system?[J]. FEMS Microbiology Letters, 1996, 144(1): 33-38. DOI:10.1111/j.1574-6968.1996.tb08505.x |
| [43] |
ROOS S, JONSSON H. A high-molecular-mass cell-surface protein from Lactobacillus reuteri 1063 adheres to mucus components[J]. Microbiology, 2002, 148(Pt.2): 433-442. |
| [44] |
WALTER J, CHAGNAUD P, TANNOCK G W, et al. A high-molecular-mass surface protein (Lsp) and methionine sulfoxide reductase B (MsrB) contribute to the ecological performance of Lactobacillus reuteri in the murine gut[J]. Applied and Environmental Microbiology, 2005, 71(2): 979-986. DOI:10.1128/AEM.71.2.979-986.2005 |
| [45] |
YANG K M, KIM J S, KIM H S, et al. Lactobacillus reuteri AN417 cell-free culture supernatant as a novel antibacterial agent targeting oral pathogenic bacteria[J]. Scientific Reports, 2021, 11(1): 1631. DOI:10.1038/s41598-020-80921-x |
| [46] |
GANESH B P, HALL A, AYYASWAMY S, et al. Diacylglycerol kinase synthesized by commensal Lactobacillus reuteri diminishes protein kinase C phosphorylation and histamine-mediated signaling in the mammalian intestinal epithelium[J]. Mucosal Immunology, 2018, 11(2): 380-393. DOI:10.1038/mi.2017.58 |
| [47] |
RAJARAM K, NELSON D E. Chlamydia muridarum infection of macrophages elicits bactericidal nitric oxide production via reactive oxygen species and cathepsin B[J]. Infection and Immunity, 2015, 83(8): 3164-3175. DOI:10.1128/IAI.00382-15 |
| [48] |
YADAV S, PATHAK S, SARIKHANI M, et al. Nitric oxide synthase 2 enhances the survival of mice during Salmonella typhimurium infection-induced sepsis by increasing reactive oxygen species, inflammatory cytokines and recruitment of neutrophils to the peritoneal cavity[J]. Free Radical Biology & Medicine, 2018, 116: 73-87. |
| [49] |
JIANG P P, YANG W T, JIN Y B, et al. Lactobacillus reuteri protects mice against Salmonella typhimurium challenge by activating macrophages to produce nitric oxide[J]. Microbial Pathogenesis, 2019, 137: 103754. DOI:10.1016/j.micpath.2019.103754 |
| [50] |
宋厚盼, 陈小娟, 曾梅艳, 等. 黄芪建中汤对大鼠十二指肠溃疡及TLR-2介导的肠黏膜免疫屏障的影响[J]. 中国药理学通报, 2019, 35(8): 1172-1178. SONG H P, CHEN X J, ZENG M Y, et al. Effects of Huangqi jianzhong decoction on duodenal ulcer and TLR-2 mediated intestinal mucosal immune barrier in rats[J]. Chinese Pharmacological Bulletin, 2019, 35(8): 1172-1178 (in Chinese). DOI:10.3969/j.issn.1001-1978.2019.08.026 |
| [51] |
RUAN W, ENGEVIK M A, CHANG-GRAHAM A, et al. 479 pro-inflammatory driven reactive oxygen species is suppressed by Lactobacillus reuteri in vitro in human intestinal epithelial cells and in vivo in mouse colitis models[J]. Gastroenterology, 2020, 158(6): S93. |
| [52] |
LIU Y Y, FATHEREE N Y, MANGALAT N, et al. Lactobacillus reuteri strains reduce incidence and severity of experimental necrotizing enterocolitis via modulation of TLR4 and NF-κB signaling in the intestine[J]. American Journal of Physiology: Gastrointestinal and Liver Physiology, 2012, 302(6): G608-G617. DOI:10.1152/ajpgi.00266.2011 |
| [53] |
HOANG T K, HE B K, WANG T, et al. Protective effect of Lactobacillus reuteri DSM 17938 against experimental necrotizing enterocolitis is mediated by Toll-like receptor 2[J]. American journal of physiology. Gastrointestinal and liver physiology, 2018, 315(2): G231-G240. DOI:10.1152/ajpgi.00084.2017 |
| [54] |
HUANG C H, LIN Y C, JAN T R. Lactobacillus reuteri induces intestinal immune tolerance against food allergy in mice[J]. Journal of Functional Foods, 2017, 31: 44-51. DOI:10.1016/j.jff.2017.01.034 |
| [55] |
HOANG T K, LIU Y Y, HE B K, et al. 1054-Toll-like receptor 2 plays a key role in protection against severe necrotizing enterocolitis by Lactobacillus reuteri Dsm 17938[J]. Gastroenterology, 2018, 154(6): S199-S200. |




