2. 江西省赣州市畜牧研究所, 赣州 341000
2. Ganzhou Institute of Animal Husbandry, Ganzhou 341000, China
肝脏是仔猪最重要的代谢器官之一,是其糖脂代谢的中心场所,对新生仔猪糖脂代谢和线粒体功能有重要作用。子代机体代谢状况极易受母体妊娠期膳食的影响。据报道,母猪妊娠饲粮中添加150 g/t核苷酸显著上调新生仔猪肝脏脂肪酸去饱和酶1(FADS1)、激素敏感脂肪酶(HSL)等与能量相关基因的mRNA的表达量,提高新生仔猪血清总胆固醇(TC)和低密度脂蛋白含量,提高新生仔猪成活率[1]。Xie等[2]研究发现,母猪妊娠饲粮中添加30 mg/kg壳寡糖显著上调其后代断奶仔猪肝脏磷酸烯醇式丙酮酸羧激酶(PEPCK)-C、PEPCK-M和葡萄糖-6-磷酸酶(G6PC)mRNA表达量,促进后代仔猪肝脏糖异生,从而提高哺乳仔猪生长速度。这表明母猪妊娠期营养状况在后代生长和发育中起着至关重要的作用。近年来有关母猪饲粮中添加甲基供体对后代影响的研究成为热点[3]。研究发现,母猪妊娠饲粮中添加甲基供体可提高新生仔猪初生重和生长速度[4],甚至后代猪上市时的肉品质[5]。牟道临[6]发现,母猪妊娠饲粮中添加甲基供体可降低仔猪肝脏丙二醛(MDA)含量。甲基供体还可以调节线粒体代谢。Liu等[7]研究表明,母猪妊娠饲粮中添加甲基供体显著提高断奶仔猪肝脏线粒体DNA(mtDNA)含量,改善线粒体功能。王誉博等[8]报道,叶酸可以修复线粒体损伤,影响mtDNA的稳定性,在细胞存活中发挥重要作用。本实验室前期研究结果表明,母猪妊娠饲粮中添加甲基供体显著提高仔猪断奶时的窝重和1~24日平均日增重,促进新生仔猪肌肉发育[9]。目前有关母猪妊娠饲粮中添加甲基供体对新生仔猪肝脏糖脂代谢和线粒体功能的影响尚未见报道。因此,本试验旨在研究母猪妊娠饲粮中添加甲基供体对新生仔猪肝脏糖脂代谢和线粒体功能的影响,以期为改善新生仔猪能量代谢和仔猪活力提供理论依据和实践参考。
1 材料与方法 1.1 试验材料甲基供体包括叶酸(西格玛-奥尔德里奇,美国,纯度≥97%)、L-蛋氨酸(希杰集团,马来西亚,纯度≥99%)、维生素B12(西格玛-奥尔德里奇,美国,纯度≥98%)、维生素B6(江西天新药业,纯度≥98%)和胆碱(恩贝集团有限公司,氯化胆碱,纯度=60%)。
1.2 试验动物与试验设计试验选取54头平均体重为(102.8±6.3) kg的“杜洛克×二花脸”初胎母猪,用杜洛克纯种公猪精液人工授精后均分为2组,分别饲喂基础饲粮(对照组)和添加甲基供体的基础饲粮(甲基供体组)。配种30 d后超声检查确定是否妊娠,11头母猪因妊娠失败被淘汰,最终对照组妊娠母猪数为21头,甲基供体组妊娠母猪数为22头。甲基供体组饲粮中甲基供体添加量参照文献[10-11]设定,具体添加量如下:4 700 mg/kg L-蛋氨酸、16.3 mg/kg叶酸、2 230 mg/kg胆碱、1 180 mg/kg维生素B6和0.15 mg/kg维生素B12。试验从母猪人工授精后开始至分娩结束,妊娠期母猪单栏饲养,自由饮水,每天饲喂2次(08:00和14:00),妊娠第1~80天饲喂量为2.28 kg/d,第81~90天饲喂量为2.4 kg/d,第90天至分娩饲喂量为3.0 kg/d。妊娠第110天转至分娩舍。母猪妊娠期基础饲粮组成及营养水平参考文献[9]。
1.3 样品采集母猪分娩结束后,对新生仔猪进行称重。每组选取8窝,每窝选取1头体重接近窝平均体重的仔猪(每组共选取8头仔猪)屠宰,测定新生仔猪内脏器官重量,并采集肝脏,分装于冻存管后液氮冻存,待样品采集结束后,将样品转移至-80 ℃冰箱保存待测肝脏糖脂代谢和线粒体功能指标。
1.4 指标测定 1.4.1 肝脏糖脂代谢和能量代谢指标采用试剂盒法测定肝脏中糖原(Gly)、甘油三酯(TG)、TC、低密度脂蛋白胆固醇(LDL-C)、蛋白质含量及PEPCK、琥珀酸脱氢酶(SDH)活性,所用试剂盒购自南京建成生物工程研究所,其中PEPCK、SDH活性采用分光光度计(UV-5100,上海精密仪表有限公司)测定,其他指标均采用全自动多功能酶标仪(SpectraMax-190,Molecular Devices,美国)测定。
肝脏中三磷酸腺苷(ATP)、氧化型辅酶Ⅰ(NAD+)、还原型辅酶Ⅰ(NADH)含量按照相应试剂盒(苏州科铭生物技术有限公司)使用说明书测定,肝脏柠檬酸合酶(CS)和G6PC活性使用酶联免疫吸附测定(ELISA)试剂盒(上海酶联生物科技有限公司)测定。
1.4.2 肝脏mtDNA含量使用DNA提取试剂盒(D111-01,北京康润诚业生物科技有限公司)提取肝脏总DNA。通过测定线粒体编码基因线粒体色素b(Cyt b)与细胞核编码基因18S rRNA比值计算mtDNA含量。
1.4.3 实时荧光定量PCR利用Primer 5.0软件进行引物设计,由华大集团合成,引物序列见表 1。采用试剂盒(ER501,北京全式金生物技术有限公司)提取肝脏总RNA。样品RNA完整性、质量和纯度用1%琼脂糖凝胶电泳和核酸/蛋白质自动分析仪检测。使用RT Master Mix试剂盒(AE311,北京全式金生物技术有限公司)将RNA反转录成cDNA。参考SYBR Green Master Mix试剂盒(AQ141,北京全式金生物技术有限公司)使用说明书在荧光定量PCR仪(CFX ConnectTM Optics Module,Bio-Rad,美国)上进行实时荧光定量PCR检测。试验采用20 μL的反应体系,每次反应重复进行3次。反应程序参考Livak等[12],以磷酸甘油醛脱氢酶(GAPDH)为参比基因,使用2-ΔΔCt计算目的基因的mRNA相对表达量。
|
|
表 1 实时荧光定量PCR引物序列 Table 1 Primer sequences used for quantitative real-time PCR |
根据蛋白提取试剂盒(BC3710,北京索莱宝科技有限公司)说明书提取肝脏组织中的总蛋白质。用BCA蛋白检测试剂盒(DQ111-01,北京全式金生物技术有限公司)测定样品蛋白质浓度。配制分离胶浓度为10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶(AR0138,武汉博士德生物工程有限),通过SDS-PAGE对目的蛋白进行分离,然后将蛋白质印迹转移至聚偏二氟乙烯(PVDF)膜上。使用5%脱脂牛奶室温封闭1.5 h,4 ℃将一抗(PEPCK1,1 ∶ 1 000,16754-1-AP,武汉三鹰生物技术有限公司;G6PC抗体,1 ∶ 1 000,ab83690,Abcam,美国)孵育过夜;第2天用TBST洗膜3次,每次5 min,然后用羊抗兔抗体(SA00001-2,武汉三鹰生物技术有限公司)室温孵育2 h后,采用特超敏ECL化学发光试剂盒(DW101-01,北京全式金生物技术有限公司)进行化学发光1 min后,将膜转至在凝胶成像照相仪上成像,曝光拍照,用Image J进行灰度值分析目的蛋白相对表达量。
1.5 数据统计与分析数据采用SPSS 22.0统计软件进行独立样本t检验,以P < 0.05为差异显著性判断标准,0.05≤P < 0.10为有升高或降低趋势判断标准。所有数据均以“平均值+标准误”表示。
2 结果与分析 2.1 新生仔猪内脏器官重量由表 2可知,与对照组相比,母猪妊娠饲粮中添加甲基供体后对新生仔猪个体重、肺脏和肾脏重量无显著影响(P>0.05),但显著提高了新生仔猪脾脏重量(P < 0.05),且有提高新生仔猪肝脏、心脏和肾上腺重量的趋势(0.05≤P < 0.10)。
|
|
表 2 母猪妊娠饲粮中添加甲基供体对新生仔猪内脏器官重量的影响 Table 2 Effects of methyl-donor supplementation in diets for pregnant sows on visceral organ weight of newborn piglets (n=8) |
由表 3可知,与对照组相比,母猪妊娠饲粮中添加甲基供体显著提高了新生仔猪肝脏中Gly含量以及PEPCK和G6PC活性(P < 0.05),而显著降低了新生仔猪肝脏中TG和TC含量(P < 0.05)。
|
|
表 3 母猪妊娠饲粮中添加甲基供体对新生仔猪肝脏糖脂代谢指标的影响 Table 3 Effects of methyl-donor supplementation in diets for pregnant sows on hepatic glycolipid metabolism indices of newborn piglets (n=8) |
由表 4可知,与对照组相比,母猪妊娠饲粮中添加甲基供体显著提高了新生仔猪肝脏中NAD+含量、NAD+/NADH的比值以及CS和SDH活性(P < 0.05)。
|
|
表 4 母猪妊娠饲粮中添加甲基供体对新生仔猪肝脏能量代谢指标的影响 Table 4 Effects of methyl-donor supplementation in diets for pregnant sows on hepatic energy metabolism indices of newborn piglets (n=8) |
如图 1所示,与对照组相比,母猪妊娠饲粮中添加甲基供体显著上调了新生仔猪肝脏丙酮酸羧化酶(PC)、PEPCK1、PEPCK2、果糖二磷酸酶1(FBP1)和G6PC mRNA相对表达量(P < 0.05),且显著上调了新生仔猪肝脏PEPCK1和G6PC蛋白相对表达量(P < 0.05)。
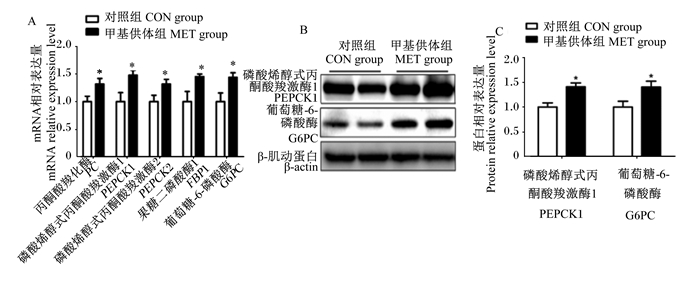
|
*表示甲基供体组与对照组之间存在显著差异(P < 0.05)。下图同。 * mean that there was a significant difference between MET group and CON group (P < 0.05). The same as below. 图 1 母猪妊娠饲粮中添加甲基供体对新生仔猪肝脏糖异生相关基因mRNA和蛋白相对表达量的影响 Fig. 1 Effects of methyl-donor supplementation in diets for pregnant sows on relative mRNA and protein relative expression levels of hepatic genes related to gluconeogenesis of newborn piglets (n=8) |
如图 2所示,与对照组相比,母猪妊娠饲粮中添加甲基供体显著下调新生仔猪肝脏脂肪酸合成相关基因[CCAAT/增强子结合蛋白α(C/EBPα)、固醇调节元件结合蛋白-1C(SREBP-1C)、乙酰辅酶A羧化酶(ACC)、硬脂酰辅酶A去饱和酶(SCD)和过氧化物酶体增殖物激活受体γ(PPARγ)]mRNA相对表达量(P < 0.05),而显著上调了新生仔猪肝脏脂质氧化相关基因[过氧化物酶体增殖物激活受体α(PPARα)、脂蛋白脂酶(LPL)和脂肪酸结合蛋白(FABP)]mRNA相对表达量(P < 0.05)。
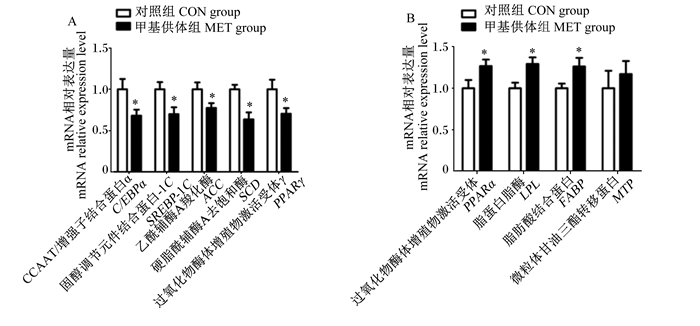
|
图 2 母猪妊娠饲粮中添加甲基供体对新生仔猪肝脏脂质代谢相关基因mRNA相对表达量的影响 Fig. 2 Effects of methyl-donor supplementation in diets for pregnant sows on mRNA relative expression levels of hepatic genes related to lipid metabolism of newborn piglets (n=8) |
如图 3所示,与对照组相比,母猪妊娠饲粮中添加甲基供体显著上调了新生仔猪肝脏过氧化物酶体增殖物激活受体γ辅激活因子-1α(PGC-1α)、沉默调节蛋白1(SIRT1)、细胞核呼吸因子-1(NRF-1)和线粒体转录因子A(Tfam)mRNA相对表达量(P < 0.05),同时还显著上调了新生仔猪肝脏细胞色素c氧化酶亚基Ⅳ(COX4)、Cyt c和CS mRNA相对表达量(P < 0.05),并显著提高了新生仔猪肝脏mtDNA含量(P < 0.05)。
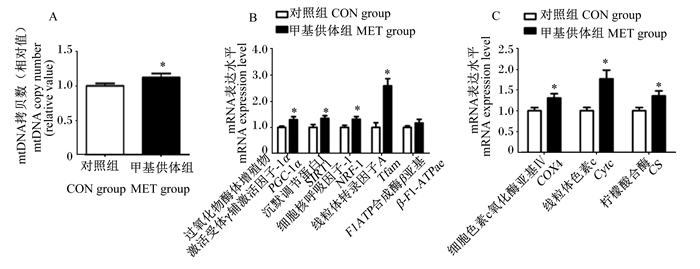
|
图 3 母猪妊娠饲粮中添加甲基供体对新生仔猪肝脏线粒体功能相关基因mRNA相对表达量的影响 Fig. 3 Effects of methyl-donor supplementation in diets for pregnant sows on mRNA relative expression levels of hepatic genes related to mitochondrial function of newborn piglets (n=8) |
发育中的胎儿极易受母体营养的影响。研究表明,给母体补充甲基供体可调节后代的生长发育和健康状态[13]。Fekete等[14]研究发现,给妊娠母体补充甲基供体(叶酸)可提高新生儿体重。而Liu等[7]报道,给母体补充叶酸并不影响宫内发育迟缓(IUGR)仔猪的体重。在本研究中,所配制基础饲粮营养水平满足或超过NRC(2012)推荐的妊娠母猪营养需要量,以探究在满足母猪营养需要量的基础上额外添加甲基供体是否会对后代新生仔猪产生影响,结果发现,母猪妊娠饲粮中添加甲基供体并不影响新生仔猪个体重和肝脏重量。
糖异生是专用于从非己糖前体合成葡萄糖的代谢途径,在禁食或应激状态下可维持机体葡萄糖稳态[15]。新生仔猪可通过糖异生来抵抗分娩压力,因此,糖异生对新生仔猪的存活具有重要意义[16-17]。肝脏糖异生的关键限速酶是PEPCK、G6PC、PC和FBP1。在本研究中,母猪妊娠饲粮中添加甲基供体可显著提高新生仔猪肝脏中Gly含量以及PEPCK和G6PC活性。肝脏中Gly含量升高表明肝脏糖异生途径可能被激活,这与其他学者研究结果[18-19]一致。母猪妊娠饲粮中添加甲基供体还显著上调了新生仔猪肝脏PEPCK和G6PC mRNA和蛋白相对表达量,与肝脏PEPCK和G6PC活性结果相对应。由此可知,母体妊娠饲粮中添加甲基供体可促进新生仔猪肝脏糖异生。
新生仔猪依靠体内的能量储备来维持生命活动,肝脏作为能量供应的重要器官,在脂质代谢和线粒体功能中起着重要作用。在本研究中,母猪妊娠饲粮中添加甲基供体显著降低了新生仔猪肝脏中TG和TC含量,表明甲基供体对机体健康有积极作用,这一结果与他人研究结果[20-21]一致。在本试验中,母猪妊娠饲粮中添加甲基供体显著降低了肝脏中TG含量,并显著下调了肝脏SREBP-1C和SCD mRNA相对表达量,这表明在母猪妊娠饲粮中添加甲基供体可通过降低新生仔猪肝脏脂肪酸合成,从而减少其肝脏中脂质的积累。PPARγ在脂肪生成中有着重要的作用[22]。本研究结果显示,母猪妊娠饲粮中添加甲基供体显著降低了新生仔猪肝脏PPARγ mRNA相对表达量。由此可知,母猪妊娠饲粮中添加甲基供体促进了新生仔猪肝脏脂质代谢。
线粒体是细胞能量代谢的主要部位,其在脂肪氧化中起着关键作用。本试验结果显示,母猪妊娠饲粮中添加甲基供体显著提高了新生仔猪肝脏ATP和mtDNA含量,提高了新生仔猪肝脏能量的储备。这一发现与他人研究结果[23]一致。CS是三羧酸循环中的限速酶,可调节机体能量代谢[24]。SDH是三羧酸循环中唯一的一个结合于线粒体内膜的多亚基酶,可为细胞线粒体需氧和产能的呼吸链提供电子,是线粒体的标志酶[25]。在本试验中,母猪妊娠饲粮中添加甲基供体显著提高了新生仔猪肝脏中CS和SDH活性。线粒体生物发生和能量消耗主要受PGC-1α调节。有研究表明,叶酸可上调PGC-1α mRNA表达,缓解自由基导致的线粒体失活和破裂[26]。本研究结果显示,母猪妊娠饲粮中添加甲基供体显著上调了新生仔猪肝脏PGC-1α mRNA相对表达量,同时显著上调了其下游靶基因NRF-1和Tfam mRNA相对表达量。SIRT1活性受NAD+/NADH的比值调节[27]。在本试验中,母猪妊娠饲粮中添加甲基供体显著提高了新生仔猪肝脏NAD+/NADH的比值,这可能与线粒体呼吸效率上升有关。甲基供体可刺激仔猪肝脏中SIRT1表达,提高NADH的氧化分解,促进肝脏中NAD+含量及NAD+/NADH的比值升高。由此可知,母猪妊娠饲粮中添加甲基供体促进了新生仔猪线粒体生物合成。
4 结论母猪妊娠饲粮中添加甲基供体可抑制新生仔猪肝脏脂质累积,促进新生仔猪糖异生,改善新生仔猪肝脏糖脂代谢和线粒体功能。
| [1] |
GAO L M, LIU Y L, ZHOU X H, et al. Maternal supplementation with uridine influences fatty acid and amino acid constituents of offspring in a sow-piglet model[J]. British Journal of Nutrition, 2020, 14: 1-14. |
| [2] |
XIE C Y, GUO X Y, LONG C M, et al. Supplementation of the sow diet with chitosan oligosaccharide during late gestation and lactation affects hepatic gluconeogenesis of suckling piglets[J]. Animal Reproduction Science, 2015, 159: 109-117. DOI:10.1016/j.anireprosci.2015.06.004 |
| [3] |
XU L, HUANG D P, HU Q L, et al. Betaine alleviates hepatic lipid accumulation via enhancing hepatic lipid export and fatty acid oxidation in rats fed with a high-fat diet[J]. British Journal of Nutrition, 2015, 113(12): 1835-1843. DOI:10.1017/S0007114515001130 |
| [4] |
JIN C, ZHUO Y, WANG J, et al. Methyl donors dietary supplementation to gestating sows diet improves the growth rate of offspring and is associating with changes in expression and DNA methylation of insulin-like growth factor-1 gene[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(5): 1340-1350. DOI:10.1111/jpn.12933 |
| [5] |
王军. 母猪妊娠期营养水平和甲基供体对后代生长性能和肉品质的影响及其机制研究[D]. 博士学位论文. 雅安: 四川农业大学, 2017. WANG J. Effect of dietary nutrient levels and methyl donor supplementation to sows during gestation on the growth performance and meat quality of the offspring and the underlying mechanism[D]. Ph. D. Thesis. Ya'an: Sichuan Agricultural University, 2017. (in Chinese) |
| [6] |
牟道临. 母猪妊娠期日粮添加甲基供体对繁殖性能和抗氧化能力的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2017. MOU D L. Effect of methyl donor supplementation during gestation in sows on reproductive performance and antioxidative ability of sows and offspring[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2017. (in Chinese) |
| [7] |
LIU J B, YU B, MAO X B, et al. Effects of intrauterine growth retardation and maternal folic acid supplementation on hepatic mitochondrial function and gene expression in piglets[J]. Archives of Animal Nutrition, 2012, 66(5): 357-371. DOI:10.1080/1745039X.2012.710084 |
| [8] |
王誉博, 常韶燕, 王硕文, 等. 叶酸与线粒体关系研究进展[J]. 临床军医杂志, 2020, 48(4): 464-468. WANG Y B, CHANG S Y, WANG S W, et al. Research progress on the relationship between folic acid and mitochondria[J]. Clinical Journal of Medical Officer, 2020, 48(4): 464-468 (in Chinese). |
| [9] |
HE Q, ZOU T D, CHEN J, et al. Maternal methyl-donor micronutrient supplementation during pregnancy promotes skeletal muscle differentiation and maturity in newborn and weaning pigs[J]. Frontiers in Nutrition, 2020, 7: 609022. DOI:10.3389/fnut.2020.609022 |
| [10] |
GUAY F, MATTE J J, GIRARD C L, et al. Effect of folic acid and glycine supplementation on embryo development and folate metabolism during early pregnancy in pigs[J]. Journal of Animal Science, 2002, 80(8): 2134-2143. |
| [11] |
OSTER M, NUCHCHANART W, TRAKOOLJUL N, et al. Methylating micronutrient supplementation during pregnancy influences foetal hepatic gene expression and IGF signalling and increases foetal weight[J]. European Journal of Nutrition, 2016, 55(4): 1717-1727. DOI:10.1007/s00394-015-0990-2 |
| [12] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [13] |
CALDWELL P T, MANZIELLO A, HOWARD J, et al. Gene expression profiling in the fetal cardiac tissue after folate and low-dose trichloroethylene exposure[J]. Birth Defects Research Part A: Clinical and Molecular Teratology, 2010, 88(2): 111-127. DOI:10.1002/bdra.20631 |
| [14] |
FEKETE K, BERTI C, TROVATO M, et al. Effect of folate intake on health outcomes in pregnancy: a systematic review and meta-analysis on birth weight, placental weight and length of gestation[J]. Nutrition Journal, 2012, 11(1): 75. DOI:10.1186/1475-2891-11-75 |
| [15] |
LEGOUIS D, FAIVRE A, CIPPÀ P E, et al. Renal gluconeogenesis: an underestimated role of the kidney in systemic glucose metabolism[J]. Nephrology, Dialysis, Transplantation, 2020. DOI:10.1093/ndt/gfaa302 |
| [16] |
THEIL P K, CORDERO G, HENCKEL P, et al. Effects of gestation and transition diets, piglet birth weight, and fasting time on depletion of glycogen pools in liver and 3 muscles of newborn piglets[J]. Journal of Animal Science, 2011, 89(6): 1805-1816. DOI:10.2527/jas.2010-2856 |
| [17] |
KORNHAUSER D, ADAM P A J, SCHWARTZ R. Glucose production and utilization in the newborn puppy[J]. Pediatric Research, 1970, 4(2): 120-128. DOI:10.1203/00006450-197003000-00002 |
| [18] |
HANSEN A V, LAURIDSEN C, SØRENSEN M T, et al. Effects of nutrient supply, plasma metabolites, and nutritional status of sows during transition on performance in the next lactation[J]. Journal of Animal Science, 2012, 90(2): 466-480. DOI:10.2527/jas.2011-3984 |
| [19] |
ANTRASFERRY J, LEBIGOT G, ROBIN P, et al. Stimulation of phosphoenolpyruvate carboxykinase gene expression by fatty acids[J]. Biochemical and Biophysical Research Communications, 1994, 203(1): 385-391. DOI:10.1006/bbrc.1994.2194 |
| [20] |
LIU Y L, SHEN J, YANG X, et al. Folic acid reduced triglycerides deposition in primary chicken hepatocytes[J]. Journal of Agricultural and Food Chemistry, 2018, 66(50): 13162-13172. DOI:10.1021/acs.jafc.8b05193 |
| [21] |
CAI D M, WANG J J, JIA Y M, et al. Gestational dietary betaine supplementation suppresses hepatic expression of lipogenic genes in neonatal piglets through epigenetic and glucocorticoid receptor-dependent mechanisms[J]. Biochimica et Biophysica Acta: Molecular and Cell Biology of Lipids, 2016, 1861(1): 41-50. DOI:10.1016/j.bbalip.2015.10.002 |
| [22] |
BARAK Y, NELSON M C, ONG E S, et al. PPARγ is required for placental, cardiac, and adipose tissue development[J]. Molecular Cell, 1999, 4(4): 585-595. DOI:10.1016/S1097-2765(00)80209-9 |
| [23] |
ZHANG L F, QI Y L, ALUO Z, et al. Betaine increases mitochondrial content and improves hepatic lipid metabolism[J]. Food and Function, 2019, 10(1): 216-223. DOI:10.1039/C8FO02004C |
| [24] |
史红超, 苏铁柱. 三羧酸循环及其影响因素对运动能力的影响[J]. 辽宁体育科技, 2011, 33(3): 45-47,50. SHI H C, SU T Z. The influence of tricarboxylic acid cycle and its influencing factors on exercise ability[J]. Liaoning Sport Science and Technology, 2011, 33(3): 45-47,50 (in Chinese). DOI:10.3969/j.issn.1007-6204.2011.03.013 |
| [25] |
王艳玲, 尚敏敏, 张紊玮, 等. 假单胞菌YL11对扩展青霉的抑制作用及其机理初探[J]. 微生物学通报, 2019, 46(5): 1081-1091. WANG Y L, SHANG M M, ZHANG W W, et al. Initial study on inhibition of Penicillium expansum by Pseudomonas sp.YL11 and mechanism[J]. Microbiology China, 2019, 46(5): 1081-1091 (in Chinese). |
| [26] |
ZHANG Y, KATO H, SATO H, et al. Folic acid-mediated mitochondrial activation for protection against oxidative stress in human dental pulp stem cells derived from deciduous teeth[J]. Biochemical and Biophysical Research Communications, 2019, 508(3): 850-856. DOI:10.1007/s11356-019-05837-0 |
| [27] |
张昊. IUGR仔猪肝脏损伤与线粒体功能紊乱的机制研究及白藜芦醇的保护作用[D]. 博士学位论文. 南京: 南京农业大学, 2017. ZHANG H. Study of underlying mechanism of the hepatic damage and mitochondrial dysfunction of IUGR piglets and the protective effects by resveratrol[D]. Ph. D. Thesis. Nanjing: Nanjing Agricultural University, 2017. (in Chinese) |




