2. 中国科学院大学, 北京 100049;
3. 山东祥维斯生物科技股份有限公司, 潍坊 261000
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Sunwin Biotech Shandong Co., Ltd., Weifang 261000, China
甜菜碱由甘氨酸和3个甲基基团组成,主要存在于虾、甜菜和全谷物等食物中[1],也可由体内的胆碱经胆碱脱氢酶介导氧化而来。大多数研究认为,甜菜碱是甲基的可靠来源,可替代胆碱和蛋氨酸在动物营养中的作用[2]。作为一种有机渗透剂,甜菜碱在大多数组织中蓄积,可改善宿主的肠道功能[3]。甜菜碱在转甲基化反应中通过提供甲基增加肌酸生成,可保护新生儿大脑免受分娩引起的缺氧[4];在细胞初始分裂时作为渗透保护剂,在囊胚中作为甲基供体,对胚胎发挥有益作用[5]。
哺乳动物的胃肠道中栖息着复杂多样的肠道菌群,可参与宿主的营养代谢、免疫反应和生长发育[6]。另外,肠道菌群的代谢产物可作为肠道细胞的能量底物,在机体中发挥抗炎作用[7]。有研究发现,宿主不同生理状态、合生元添加或饮食成分改变等均会影响肠道微生物的群落结构[8]。妊娠-哺乳期饲粮添加合生元可显著改善母猪的脂质代谢,增加妊娠后期肠道菌群多样性和柔膜菌门(Tenericutes)相对丰度,这有利于缓解机体妊娠期炎症,促进胎儿的健康发育[9]。笔者前期研究发现,饲粮添加甜菜碱盐酸盐可显著增加巴马香猪初乳中乳蛋白含量,改善其血浆代谢产物含量,增加断奶仔猪数量[10]。但是,肠道菌群是否介导了甜菜碱盐酸盐的上述作用仍不清楚。因此,本文进一步研究了妊娠-哺乳期饲粮添加甜菜碱盐酸盐对巴马香猪粪便菌群组成及其代谢产物含量的影响,为其在母猪生产中的应用提供依据。
1 材料与方法 1.1 试验设计与饲养管理动物饲养试验于2018年8月至2019年2月在湖南省常德市石门县汉唐农业有限公司猪场开展。选取3~7胎次刚配种的巴马香猪40头,随机分为2组,每组20头,单栏饲养,分娩前1周转至产房。对照组饲喂基础饲粮,试验组在基础饲粮中添加3.5 kg/t甜菜碱盐酸盐(纯度为95%)。母猪配种后饲喂妊娠母猪饲粮,妊娠第105天至断奶饲喂哺乳母猪饲粮。基础饲粮营养水平参照我国《猪饲养标准》(NY/T 65—2004),预混料参照NRC(2012)母猪营养需求,基础饲粮组成及营养水平同高乾坤等[10]。试验期为母猪配种后第3天至分娩后第21天。对照组中,3、4、5、6和7胎次的母猪分别有6、3、5、4和2头;试验组中,3、4、5、6和7胎次的母猪分别有5、4、4、4和3头。试验期间,对照组母猪返情4头,正常分娩16头;试验组母猪返情4头,流产1头,正常分娩15头。其他饲养管理均按商业养猪场规范操作。
1.2 样品采集与处理分别于母猪妊娠第105天和哺乳第21天采集母猪新鲜粪便样品,-20 ℃保存,用于微生物测序及其代谢产物含量测定。
1.3 母猪粪便微生物DNA提取与16S rDNA测序将粪便样品解冻,均匀混合后取0.200 0 g左右,根据Fast DNA SPIN Extraction Kits(MP Biomedicals公司,美国)说明书抽提粪便总DNA,利用NanoDrop 1000分光光度计(Thermo Fisher Scientific公司,美国)检测DNA浓度和纯度;用338F(5’-GCACCTAAYTGGGYDTAAAGNG-3’)和806R(5’-TACNVGGGTATCTAATCC-3’)引物对V3~V4可变区进行PCR扩增,扩增程序为:98 ℃预变性2 min,25个循环(98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸5 min。扩增体系为25 μL:5 μL 5×缓冲液,5 μL 5×High-Fidelity GC缓冲液,2 μL dNTPs(2.5 mmol/L),1 μL上、下游引物(10 μmol/L),0.25 μL High-Fidelity DNA聚合酶(5 U/μL),2 μL DNA模板,8.75 μL ddH2O。PCR扩增片段利用Agencourt AMPure Beads(Beckman Coulter公司,美国)纯化和PicoGreen dsDNA试剂盒(Invitrogen公司,美国)定量,用1.2%琼脂糖凝胶电泳检验PCR扩增结果,于Illumina MiSeq平台进行双端测序(2×300 bp,上海派森诺有限公司)。
1.4 母猪粪便代谢产物含量测定准确称取粪便样品,利用气相色谱仪(Agilent公司,7890A,美国)测定其中短链脂肪酸(SCFA,包括乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸)含量[11],利用高效液相色谱仪(Agilent公司,1260,美国)分析生物胺(包括色胺、腐胺、尸胺、酪胺和亚精胺)、吲哚和粪臭素含量[11]。
1.5 生物信息学与差异显著性分析将测序得到的PE reads进行去引物、质量过滤和拼接。利用QIIME软件调用UCLUS序列比对工具对质控后得到的有效序列在97%序列相似度下聚类,得到操作分类单元(OTU)代表序列,并将其与GreenGene数据库(http://greengenes.lbl.gov/cgi-bin/nph-index.cgi)[12]的模板序列相比对,获取每个OTU对应的分类学信息。基于以上获得的OTU信息,调用QIIME软件alpha_diversity.py命令分析样品的alpha多样性指数,即ACE、Chao1、Shannon和Simpson指数;并在门和属水平上聚类分析样品物种组成和相对丰度。利用PICRUSt软件对粪便微生物群落进行功能预测,通过KEGG Pathway菌群丰度分析,筛选具有显著差异功能的粪便菌群。
试验数据用Excel 2010初步整理后,利用SPSS 22.0软件进行单因素方差分析(ANOVA),数据以“平均值±标准误”表示。利用Metastats软件(http://metastats.cbcb.umd.edu/)分析肠道微生物相对丰度变化,利用R软件ggplot2和pheatmap程序以及GraphPad Prism V.7.0软件作图。P < 0.05表示差异显著,0.05≤P < 0.10表示有变化趋势。
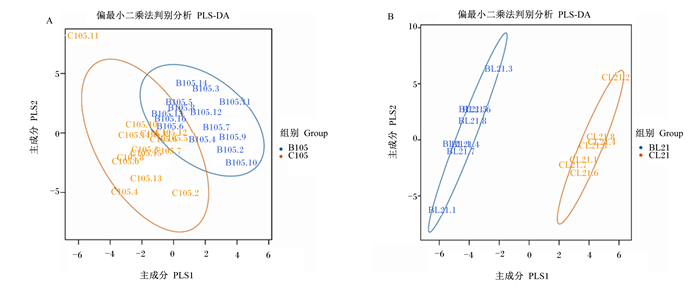
2 结果 2.1 母猪粪便微生物多样性的变化由表 1可知,与对照组相比,饲粮添加甜菜碱盐酸盐显著增加了哺乳第21天母猪粪便微生物Chao1和ACE指数(P < 0.05)。由图 1可知,甜菜碱盐酸盐组与对照组母猪粪便菌群结构明显聚成两大类群。
|
|
表 1 妊娠-哺乳期饲粮添加甜菜碱盐酸盐对母猪粪便微生物alpha多样性的影响 Table 1 Effects of dietary betaine hydrochloride supplementation on fecal microbiota alpha diversity of sows during pregnancy and lactation |
|
B105:妊娠第105天甜菜碱盐酸盐组Betaine hydrochloride group of day 105 of pregnancy;C105:妊娠第105天对照组Control group of day 105 of pregnancy;BL21:哺乳第21天甜菜碱盐酸盐组Betaine hydrochloride group of day 21 of lactation;CL21:哺乳第21天对照组Control group of day 21 of lactation。 图 1 妊娠-哺乳期饲粮添加甜菜碱盐酸盐对母猪粪便微生物beta多样性的影响 Fig. 1 Effects of dietary betaine hydrochloride supplementation on fecal microbiota beta diversity of sows during pregnancy and lactation |
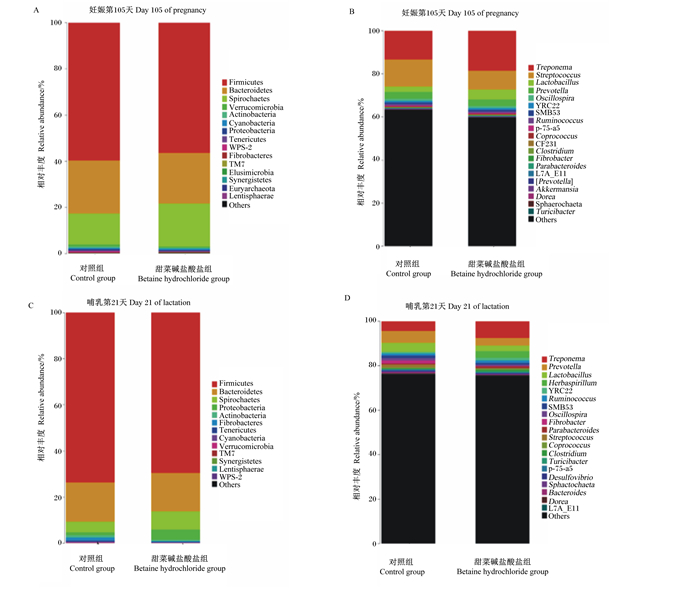
由图 2可知,厚壁菌门、拟杆菌门、密螺旋体门和疣微菌门为妊娠期母猪粪便菌群的主要优势菌门(图 2-A),密螺旋体属、链球菌属、乳酸菌属和普氏菌属为妊娠期母猪粪便菌群的主要优势菌属(图 2-B)。厚壁菌门、拟杆菌门、螺旋体门和变形菌门为哺乳期母猪粪便菌群的主要优势菌门(图 2-C),密螺旋体属、普氏菌属、乳酸菌属和草螺旋菌属为哺乳期母猪粪便菌群的主要优势菌属(图 2-D)。
|
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Spirochaetes:螺旋体门;Verrucomicrobia:疣微菌门;Actinobacteria:放线菌门;Cyanobacteria:蓝藻菌门;Proteobacteria:变形菌门;Tenericutes:柔膜菌门;Fibrobacteres:纤维杆菌门;Elusimicrobia:迷踪菌门;Synergistetes:未分类的酸杆菌门;Euryarchaeota:广古菌门;Lentisphaerae:黏胶球形菌门;Treponema:密螺旋体属;Streptococcus:链球菌属;Lactobacillus:乳酸菌属;Prevotella:普式菌属;Oscillospira:颤螺菌属;Ruminococcus:瘤胃球菌属;Coprococcus:粪球菌属;Clostridium:梭菌属;Fibrobacter:纤维杆菌属;Parabacteroides:副杆菌属;[Prevotella]:未分类的普氏菌属;Akkermansia:阿克曼菌属;Dorea:多尔氏菌属;Turicibacter:苏黎世杆菌属;Herbaspirillum:草螺菌属;Desulfovibrio:脱硫弧菌属;Bacteroides:拟杆菌属;Others:其他菌属。 图 2 妊娠-哺乳期饲粮添加甜菜碱盐酸盐对母猪粪便微生物组成的影响 Fig. 2 Effects of dietary betaine hydrochloride supplementation on fecal microbiota composition of sows during pregnancy and lactation |
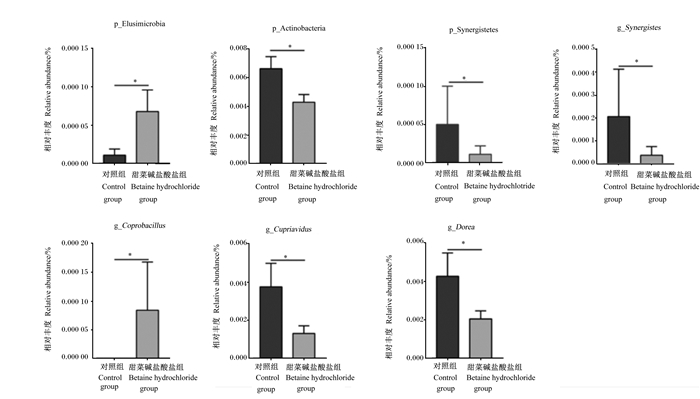
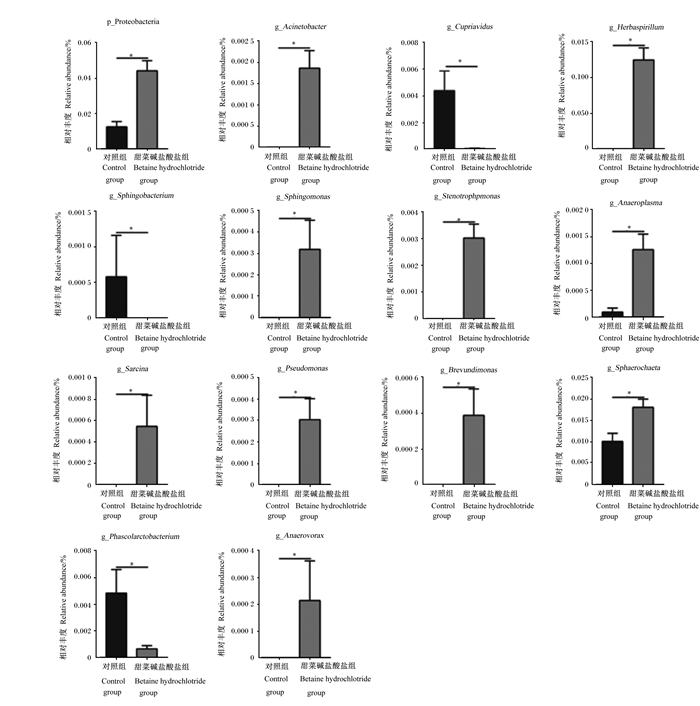
由图 3可知,与对照组相比,妊娠第105天时,饲粮添加甜菜碱盐酸盐显著增加了迷踪菌门和粪芽孢菌属相对丰度(P < 0.05),显著降低了放线菌门、未分类的酸杆菌门、贪铜菌属、多尔氏菌属和互养菌属相对丰度(P < 0.05)。由图 4可知,与对照组相比,哺乳第21天时,饲粮添加甜菜碱盐酸盐显著增加了不动杆菌属、厌氧原体属、优杆菌属、短波单胞菌、草螺旋菌属、假单胞菌属、八联球菌属、假平胞菌属、寡养单胞菌和变形菌门相对丰度(P < 0.05),显著降低了贪铜菌属、考拉杆菌属、Sphaerochaeta和鞘氨醇杆菌相对丰度(P < 0.05)。
|
p_Elusimicrobia:迷踪菌门;p_Actinobacteria:放线菌门;p_Synergistetes:未分类的酸杆菌门;g_Synergistes:互养菌属;g_Coprobacillus:粪芽孢菌属;g_Cupriavidus:贪铜菌属;g_Dorea:多尔氏菌属。 *表示与对照组差异显著(P < 0.05)。下图同。* mean significant difference compared with the control group (P < 0.05). The same as below. 图 3 饲粮添加甜菜碱盐酸盐对妊娠第105天母猪粪便差异菌群相对丰度的影响 Fig. 3 Effects of dietary betaine hydrochloride supplementation on fecal differential microbiota relative abundance of sows at day 105 of pregnancy |
|
p_Proteobacteria:变形菌门;g_Acinetobacter:不动杆菌属;g_Herbaspirillum:草螺旋菌属;g_Phascolarctobacterium:考拉杆菌属;g_Sphingomonas:假平胞菌属;g_Stenotrophpmonas:寡养单胞菌;g_Anaeroplasma:厌氧原体属;g_Sarcina:八联球菌属;g_Pseudomonas:假单胞菌属;g_Brevundimonas:短波单胞菌;g_Anaerovorax:优杆菌属;g_Sphingobacterium:鞘氨醇杆菌。 图 4 饲粮添加甜菜碱盐酸盐对哺乳第21天母猪粪便差异菌群相对丰度的影响 Fig. 4 Effects of dietary betaine hydrochloride supplementation on fecal differential microbiota relative abundance of sows at day 21 of lactation |
由表 2可知,与对照组相比,甜菜碱盐酸盐组母猪妊娠第105天粪便中尸胺含量显著增加(P < 0.05),粪便中乙酸(P=0.054)、直链脂肪酸(P=0.075)和总SCFA(P=0.09)含量呈升高趋势;哺乳第21天粪便中腐胺、亚精胺和粪臭素含量显著增加(P < 0.05)。
|
|
表 2 妊娠-哺乳期饲粮添加甜菜碱盐酸盐对母猪粪便代谢产物含量的影响 Table 2 Effects of dietary betaine hydrochloride supplementation on fecal metabolite contents of sows during pregnancy and lactation |
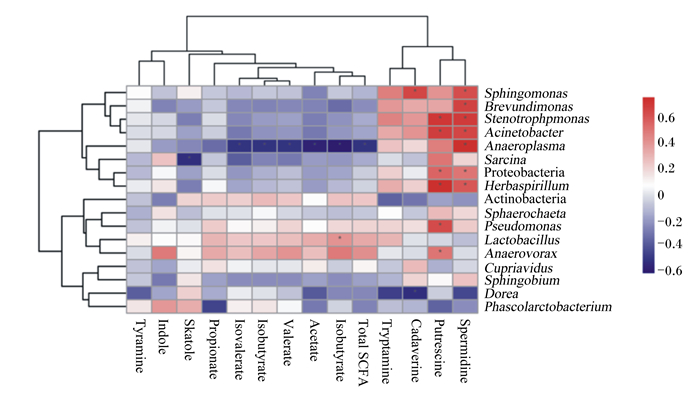
由图 5可知,皮尔曼相关性分析发现,粪便假平胞菌属、短波单胞菌、寡养单胞菌、不动杆菌属、厌氧原体属、变形菌门和草螺旋菌属相对丰度与亚精胺含量呈显著正相关(P < 0.05),寡养单胞菌、不动杆菌属、变形菌门、草螺旋菌属、假单胞菌属和优杆菌属相对丰度与腐胺含量呈显著正相关(P < 0.05),厌氧原体属相对丰度与异戊酸和异丁酸含量呈显著负相关(P < 0.05)。
|
Sphingomonas:假平胞菌属;Brevundimonas:短波单胞菌;Stenotrophpmonas:寡养单胞菌;Acinetobacter:不动杆菌属;Anaeroplasma:厌氧原体属;Sarcina:八联球菌属;Proteobacteria:变形菌门;Herbaspirillum:草螺旋菌属;Actinobacteria:放线菌门;Pseudomonas:假单胞菌属;Lactobacillus:乳酸菌属;Anaerovorax:优杆菌属;Cupriavidus:贪铜菌属;Sphingobacterium:鞘氨醇杆菌属;Dorea:多尔氏菌属;Phascolarctobacterium:考拉杆菌属;Acetate:乙酸;Propionate:丙酸;Butyrate:丁酸;Valerate:戊酸;Total SCFA:总短链脂肪酸;Isobutyrate:异丁酸;Isovalerate:异戊酸;Tryptamine:色胺;Putrescine:腐胺;Cadaverine:尸胺;Tyramine:酪胺;Spermidine:亚精胺;Indole:吲哚;Skatole:粪臭素。 *:显著相关significantly correlation (P < 0.05)。 图 5 妊娠-哺乳母猪粪便差异菌群与代谢产物的相关性 Fig. 5 Correlation between fecal differential microbiota and their metabolites in sows during pregnancy and lactation |
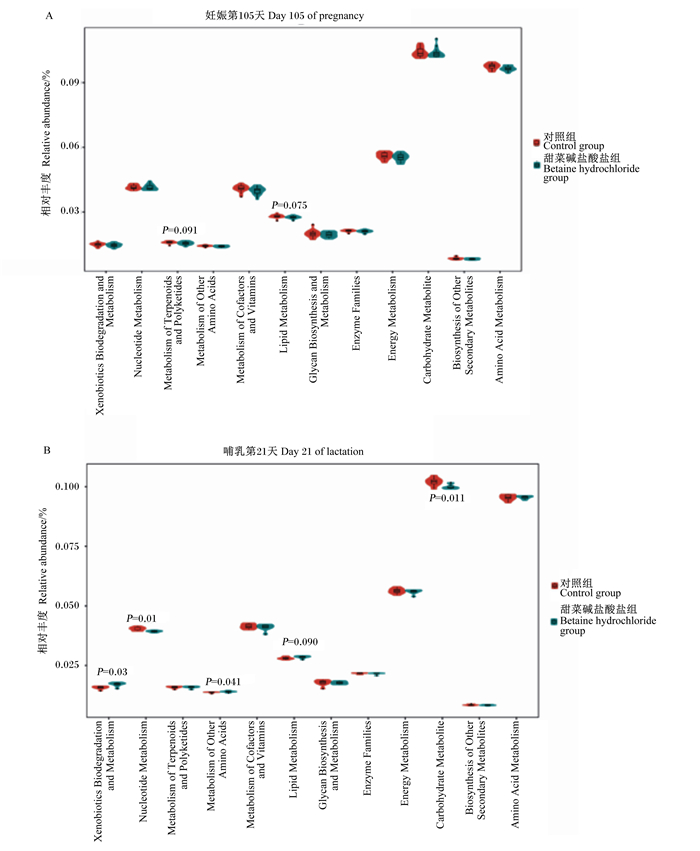
由图 6可知,与对照组相比,饲粮添加甜菜碱盐酸盐后,妊娠第105天母猪粪便微生物有3条通路显著富集,即核苷酸代谢、糖生物合成与代谢和酶家族;哺乳第21天母猪粪便微生物有4条通路显著富集,即异生素生物降解和代谢、萜类和多酮类代谢、其他氨基酸代谢和脂代谢。
|
Xenobiotics Biodegradation and Metabolism:异生素生物降解和代谢;Nucleotide Metabolism:核苷酸代谢;Metabolism of Terpenoids and Polyketides:萜类和多酮类代谢;Metabolism of Other Amino Acids:其他氨基酸代谢;Metabolism of Cofactors and Vitamins:辅酶因子和维生素代谢;Lipid Metabolism:脂代谢;Glycan Biosynthesis and Metabolism:糖生物合成与代谢;Enzyme Families:酶家族;Energy Metabolism:能量代谢;Carbohydrate Metabolite:碳水化合物代谢;Biosynthesis of Other Secondary Metabolites:其他次级代谢产物的合成;Amino Acid Metabolism:氨基酸代谢。 图 6 妊娠-哺乳母猪粪便微生物的功能差异 Fig. 6 Difference of fecal microbiota function of sows during pregnancy and lactation |
微生物多样性对于维持肠道微生物群落的稳定和改善宿主的健康状况起着至关重要的作用,微生物多样性降低,提示宿主肠道菌群发生紊乱[13]。Chen等[14]研究发现,甜菜碱盐酸盐可显著增加急性肝功能衰竭小鼠的肠道菌群多样性,缓解机体炎症。本研究发现,饲粮添加甜菜碱盐酸盐增加了哺乳第21天母猪粪便菌群alpha多样性,提示甜菜碱盐酸盐可改善哺乳期母猪的肠道健康,有助于维持其正常泌乳活动。此外,妊娠-哺乳期间母猪粪便菌群结构发生了显著变化,提示肠道微生物组成可能与妊娠与分娩期间的机体代谢有关。
现有研究发现,厚壁菌门和拟杆菌门是妊娠-哺乳期母猪的优势菌门[4],与本研究结果一致。基因组研究表明,一些属于迷踪菌门的菌群可发酵葡萄糖[15],其相对丰度增加可促进玉米秸秆释放出更多的含糖物质[16]。由普雷沃氏菌科和粪球菌属产生的SCFA可增加杯状细胞数量,防止毒素入侵宿主[17]。本研究中,饲粮添加甜菜碱盐酸盐显著增了妊娠第105天母猪粪便迷踪菌门和粪球菌属相对丰度,提示甜菜碱盐酸盐可通过影响肠道菌群结构来改善其糖脂代谢,增强机体免疫功能。厌氧原体属作为微生物区系中的关键抗炎成分[18],可通过调节转化生长因子-β(TGF-β)和免疫球蛋白A(IgA)的产生预防肠道炎症[19]。在本研究中,饲粮添加甜菜碱盐酸盐显著增加了哺乳第21天母猪粪便厌氧原体属相对丰度,提示甜菜碱盐酸盐可能通过增加机体肠道菌群相对丰度改善哺乳引发的机体炎症。
SCFA主要由细菌发酵膳食纤维产生,随后被宿主血液吸收,对肠道功能、炎症和宿主健康起着至关重要的作用[20]。其中,乙酸可为宿主肠道菌群和肠上皮细胞提供能量;丁酸作为维持机体肠道健康及其完整性的重要物质,可为肠上皮细胞的增殖分化提供60%~70%的能量[21];戊酸可参与抑制机体结肠癌细胞的生长,缓解机体肠道炎症[22]。本研究中,饲粮添加甜菜碱盐酸盐有增加妊娠后期母猪粪便中乙酸、直链脂肪酸和总SCFA含量的趋势,提示甜菜碱盐酸盐可能通过调节营养物质代谢来维持其肠道健康;饲粮添加甜菜碱盐酸盐显著降低了哺乳后期母猪粪便中丁酸含量,且有降低戊酸含量的趋势,提示甜菜碱盐酸盐可通过为母猪提供能量满足哺乳仔猪的能量需要。
生物胺由机体结肠微生物发酵含氮化合物产生。其中,腐胺是精胺和亚精胺的前体,均可调节胎盘的生长;精胺和亚精胺可参与调节机体核酸和蛋白质等大分子物质的合成,促进其肠道健康;赖氨酸在机体脱羧酶作用下可产生尸胺。本研究发现,饲粮添加甜菜碱盐酸盐显著增加了妊娠第105天母猪粪便中尸胺含量,可能与肠道微生物促进了赖氨酸的分解代谢有关;显著增加了哺乳第21天母猪粪便中腐胺和亚精胺含量,提示甜菜碱盐酸盐可促进肠上皮细胞的增殖和维持其肠道健康[23]。
动物肠道菌群可发酵小肠内未被消化吸收的蛋白质产生色氨酸,进一步降解产生吲哚和粪臭素等物质[24]。粪臭素可通过血液循环,经肝脏代谢随尿液排出或者储存于肌肉和脂肪组织[25]。宿主对蛋白质的消化利用越少,未被消化吸收的蛋白质进入后肠就越多,进而会产生较多的粪臭素。本研究发现,饲粮添加甜菜碱盐酸盐可显著降低产后第21天粪臭素含量,这有利于提高小肠对蛋白质的利用率,减少肠道内粪臭素的形成。
腐胺和亚精胺可参与调节机体代谢及蛋白质合成,且腐胺对缓解肠道炎症具有重要作用。本研究通过肠道差异菌群与其代谢产物的关联分析发现,粪便寡养单胞菌、不动杆菌属、变形菌门和草螺旋体属相对丰度与亚精胺和腐胺粮含量呈正相关,厌氧原体属相对丰度与亚精胺、腐胺、异丁酸和异戊酸含量呈负相关。这提示甜菜碱盐酸盐参与了缓解机体炎症及调控/激活宿主相关蛋白质酶的合成[26],该作用可能是通过调节肠道菌群丰度和组成来实现的。有研究发现,甜菜碱盐酸盐可通过改善宿主肠道群落结构缓解机体炎症[14]。
现有研究表明,一些来源于植物的萜类化合物和姜黄素具有很强的抗炎活性[27]。本研究发现,饲粮添加甜菜碱盐酸盐可显著上调妊娠第105天母猪粪便微生物中与核苷酸代谢、聚糖生物合成与代谢和酶家族相关的代谢通路,以及哺乳第21天母猪粪便微生物中与异生素生物降解和代谢、萜类和多酮类代谢、脂代谢和其他氨基酸代谢相关的代谢通路,这可能有利于缓解母猪的机体炎症,改善母猪的脂蛋白代谢和能量消耗[28]。
4 结论妊娠-哺乳期饲粮添加甜菜碱盐酸盐改善了母猪的肠道菌群平衡及其代谢活性,上调了缓解机体炎症及改善脂代谢的相关代谢通路,促进了机体健康。
| [1] |
CRAIG S A S. Betaine in human nutrition[J]. The American Journal of Clinical Nutrition, 2004, 80(3): 539-549. DOI:10.1093/ajcn/80.3.539 |
| [2] |
RATRIYANTO A, MOSENTHIN R, BAUER E, et al. Metabolic, osmoregulatory and nutritional functions of betaine in monogastric animals[J]. Asian-Australasian Journal of Animal Science, 2009, 22(10): 1461-1476. DOI:10.5713/ajas.2009.80659 |
| [3] |
WANG H C, LI S S, FANG S L, et al. Betaine improves intestinal functions by enhancing digestive enzymes, ameliorating intestinal morphology, and enriching intestinal microbiota in high-salt stressed rats[J]. Nutrients, 2018, 10(7): 907. DOI:10.3390/nu10070907 |
| [4] |
DICKINSON H, ELLERY S, IRELAND Z, et al. Creatine supplementation during pregnancy: summary of experimental studies suggesting a treatment to improve fetal and neonatal morbidity and reduce mortality in high-risk human pregnancy[J]. BMC Pregnancy and Childbirth, 2014, 14: 150. DOI:10.1186/1471-2393-14-150 |
| [5] |
CORBETT H E, DUBÉ C D, SLOW S, et al. Uptake of betaine into mouse cumulus-oocyte complexes via the SLC7A6 isoform of y+L transporter[J]. Biology of Reproduction, 2014, 90(4): 81. |
| [6] |
GRESSE R, CHAUCHEYRAS-DURAND F, FLEURY M A, et al. Gut microbiota dysbiosis in postweaning piglets: understanding the keys to health[J]. Trends in Microbiology, 2017, 25(10): 851-873. DOI:10.1016/j.tim.2017.05.004 |
| [7] |
ZIAR H, GÉRARD P, RIAZI A. Effect of prebiotic carbohydrates on growth, bile survival and cholesterol uptake abilities of dairy-related bacteria[J]. Journal of the Science of Food and Agriculture, 2014, 94(6): 1184-1190. DOI:10.1002/jsfa.6395 |
| [8] |
DEBELIUS J, SONG S J, VAZQUEZ-BAEZA Y, et al. Tiny microbes, enormous impacts: what matters in gut microbiome studies?[J]. Genome Biology, 2016, 17(1): 217. DOI:10.1186/s13059-016-1086-x |
| [9] |
MA C, ZHANG W H, GAO Q K, et al. Dietary synbiotic alters plasma biochemical parameters and fecal microbiota and metabolites in sows[J]. Journal of Functional Foods, 2020, 75: 104221. DOI:10.1016/j.jff.2020.104221 |
| [10] |
高乾坤, 马翠, 孔祥峰, 等. 饲粮添加甜菜碱对巴马香猪繁殖性能、初乳成分及血浆代谢物和繁殖激素含量的影响[J]. 动物营养学报, 2020, 32(2): 646-653. GAO Q K, MA C, KONG X F, et al. Effects of dietary betaine supplementation on reproductive performance, colostrum composition and plasma metabolite and reproductive hormone contents of Bama mini-pigs[J]. Chinese Journal of Animal Nutrition, 2020, 32(2): 646-653 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.02.020 |
| [11] |
HU L, LIU Y, YAN C, et al. Postnatal nutritional restriction affects growth and immune function of piglets with intra-uterine growth restriction[J]. The British Journal of Nutrition, 2015, 114(1): 53-62. DOI:10.1017/S0007114515001579 |
| [12] |
DESANTIS T Z, HUGENHOLTZ P, LARSEN N, et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J]. Applied and Environmental Microbiology, 2006, 72(7): 5069-5072. DOI:10.1128/AEM.03006-05 |
| [13] |
LI H, QU J P, LI T T, et al. Diet simplification selects for high gut microbial diversity and strong fermenting ability in high-altitude pikas[J]. Applied Microbiology and Biotechnology, 2018, 102(15): 6739-6751. DOI:10.1007/s00253-018-9097-z |
| [14] |
CHEN Q, WANG Y, JIAO F Z, et al. Betaine inhibits Toll-like receptor 4 responses and restores intestinal microbiota in acute liver failure mice[J]. Scientific Reports, 2020, 10(1): 21850. DOI:10.1038/s41598-020-78935-6 |
| [15] |
ZHENG H, DIETRICH C, RADEK R, et al. Endomicrobium proavitum, the first isolate of Endomicrobia class. nov. (phylum Elusimicrobia)-an ultramicrobacterium with an unusual cell cycle that fixes nitrogen with a group Ⅳ nitrogenase[J]. Environmental Microbiology, 2016, 18(1): 191-204. DOI:10.1111/1462-2920.12960 |
| [16] |
WANG K, NAN X M, TONG J J, et al. Steam explosion pretreatment changes ruminal fermentation in vitro of corn stover by shifting archaeal and bacterial community structure[J]. Frontiers in Microbiology, 2020, 11: 2027. DOI:10.3389/fmicb.2020.02027 |
| [17] |
BRAHE L K, LE CHATELIER E, PRIFTI E, et al. Specific gut microbiota features and metabolic markers in postmenopausal women with obesity[J]. Nutrition & Diabetes, 2015, 5(6): e159. |
| [18] |
BELLER A, KRUGLOV A, DUREK P, et al. Specific microbiota enhances intestinal IgA levels by inducing TGF-β in T follicular helper cells of Peyer's patches in mice[J]. European Journal of Immunology, 2020, 50(6): 783-794. DOI:10.1002/eji.201948474 |
| [19] |
GUTZEIT C, MAGRI G, CERUTTI A. Intestinal IgA production and its role in host-microbe interaction[J]. Immunological Reviews, 2014, 260(1): 76-85. DOI:10.1111/imr.12189 |
| [20] |
BOETS E, GOMAND S V, DEROOVER L, et al. Systemic availability and metabolism of colonic-derived short-chain fatty acids in healthy subjects: a stable isotope study[J]. The Journal of Physiology, 2017, 595(2): 541-555. DOI:10.1113/JP272613 |
| [21] |
YAN H, AJUWON K M. Butyrate modifies intestinal barrier function in IPEC-J2 cells through a selective upregulation of tight junction proteins and activation of the Akt signaling pathway[J]. PLoS One, 2017, 12(6): e0179586. DOI:10.1371/journal.pone.0179586 |
| [22] |
YOSHIKAWA S, ARAOKA R, KAJIHARA Y, et al. Valerate production by Megasphaera elsdenii isolated from pig feces[J]. Journal of Bioscience and Bioengineering, 2018, 125(5): 519-524. DOI:10.1016/j.jbiosc.2017.12.016 |
| [23] |
FUSI E, BALDI A, CHELI F, et al. Effects of putrescine, cadaverine, spermine, spermidine and β-phenylethylamine on cultured bovine mammary epithelial cells[J]. Italian Journal of Animal Science, 2008, 7(2): 131-140. DOI:10.4081/ijas.2008.131 |
| [24] |
胡彩虹, 俞颂东, 许梓荣. 猪粪便细菌群作用下3-甲基吲哚(粪臭素)和吲哚形成的研究[J]. 中国畜牧杂志, 2002, 38(5): 10-11. HU C H, YU S D, XU Z R. Effect of mixed population of pig fecal bacteria on 3-methylindole (skatole) and indole production[J]. Chinese Journal of Animal Science, 2002, 38(5): 10-11 (in Chinese). DOI:10.3969/j.issn.0258-7033.2002.05.003 |
| [25] |
LIU H Y, HOU R, YANG G Q, et al. In vitro effects of inulin and soya bean oligosaccharide on skatole production and the intestinal microbiota in broilers[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(3): 706-716. DOI:10.1111/jpn.12830 |
| [26] |
YADAV P N, LIU Z, RAFI M M. A diarylheptanoid from lesser galangal (Alpinia officinarum) inhibits proinflammatory mediators via inhibition of mitogen-activated protein kinase, p44/42, and transcription factor nuclear factor-kappa B[J]. The Journal of Pharmacology and Experimental Therapeutics, 2003, 305(3): 925-931. DOI:10.1124/jpet.103.049171 |
| [27] |
MA C, GAO Q K, ZHANG W H, et al. Alterations in the blood parameters and fecal microbiota and metabolites during pregnant and lactating stages in Bama mini pigs as a model[J]. Mediators of Inflammation, 2020, 8829072. |
| [28] |
WALLACE R J. Ruminal microbial metabolism of peptides and amino acids[J]. The Journal of Nutrition, 1996, 126(4 Suppl): 1326S-1334S. |




