随着我国畜牧业的快速发展,人畜争粮现象日益严重,发展节粮型畜牧业是缓解这一矛盾的重要途径。据报道,我国农作物秸秆2010年产量就已达8.4亿t,但由于秸秆营养价值低且品质差的缺点,使秸秆在动物生产中的应用受到较大的限制[1],要想提高其营养价值必须经过合理的加工[2]。目前,秸秆的生物处理方法包括青贮和黄贮,黄贮是依靠枯草芽孢杆菌、乳酸菌、酵母菌和产纤维素菌等益生菌,通过厌氧发酵提高秸秆的营养价值和利用率,提高适口性,并且能够长期保存[3-5]。
反刍动物瘤胃液中的微生物能够分泌纤维素酶并降解纤维素[6-7]。Lee等[8]研究表明,稻草秸秆青贮时添加纯培养瘤胃真菌能够降低青贮饲料中酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)含量,提高青贮饲料粗纤维的降解率。Guo等[9]研究发现,体外发酵饲粮中添加纤维素分解菌提高了产气量及氨态氮(NH3-N)、总挥发性脂肪酸(TVFA)、乙酸和丙酸含量,提高了中性洗涤纤维降解率(NDFD),促进了饲料的消化降解。本实验室在西藏黄牛瘤胃中筛选出了1株高产纤维素酶菌株N30,与其他从西藏地区动物胃肠道中筛选得到的产纤维素酶菌株相比,高产纤维素酶菌株N30活性较高,且在更宽的温度范围内保持较高活性、温度稳定性和pH稳定性[10],但是该菌株是否能够促进黄贮的体外发酵进而提高黄贮品质还是未知。因此,本试验拟通过体外发酵法探究高产纤维素酶菌株N30处理对小麦、青稞和油菜黄贮发酵指标的综合影响效果,为其在反刍动物中的高效利用提供理论依据和实践指导。
1 材料与方法 1.1 试验材料 1.1.1 饲料和菌株来源小麦、青稞和油菜秸秆取自西藏自治区拉萨市达孜县塔杰乡。纤维素分解菌为高产纤维素酶菌株N30,由西藏黄牛瘤胃液中筛选而得,具体筛选步骤参照张元庆等[11]的方法。菌液与30%甘油以1 ∶ 1比例混合,-20 ℃保存。对小麦、青稞和油菜秸秆进行实验室小批量黄贮发酵,每种秸秆各发酵12袋,秸秆铡切为2.5 cm的小段,装入真空聚乙烯袋中,每袋500 g,将发酵用纤维素分解菌进行活化培养,配制成2种不同浓度的菌液,分别为1×1010和2×1010 CFU/kg,均匀撒于秸秆上,秸秆的水分含量控制在65%~70%,压实将空气排出,最后用封口膜封口,室温下发酵60 d。
1.1.2 瘤胃液供体动物选用4只健康、体重(25.0±0.5) kg、安装瘤胃瘘管的成年湘东黑山羊作为瘤胃液供体。饲粮按精粗比40 ∶ 60制成全混合日粮(TMR),其组成及营养水平参照NRC(2007)山羊营养需要量进行配制,每天08:00和18:00各饲喂1次,自由饮水。
1.1.3 体外发酵体外发酵液按照培养液与瘤胃液2 ∶ 1的比例配制而成[12]。体外发酵装置由HZS-H型恒温水浴摇床和容积为100 mL的玻璃注射器(最小刻度为1 mL)组成。注射器每次使用之前需洗净、烘干,然后用少量液体石蜡涂在活塞筒的四周,以防漏气,并可减少气体产生过程中活塞向上移动的阻力。
1.2 试验设计及测定指标体外发酵饲料为小麦、青稞和油菜黄贮,统一过1 mm筛。每种发酵饲料分为3个组,分别为对照组、添加1×1010 CFU/kg纤维素分解菌组(Ⅰ组)和添加2×1010 CFU/kg纤维素分解菌组(Ⅱ组)。
对发酵小麦、青稞和油菜黄贮进行感官评定,具体方法参照青贮饲料质量评定标准[13]。
27个发酵管随机分为9组,每组2个重复。在每个发酵管内装200 mg发酵饲料和1 mL菌液,用平板计数法确定菌量。Ⅰ和Ⅱ组分别添加1 mL的1×1010和2×1010 CFU/kg菌液,对照组中加入1 mL灭活的菌液,并迅速加入培养液至30 mL,进行体外发酵试验。
于发酵2、4、8、12、24、48 h测定厌氧发酵瓶内气压,并按公式[y=(x-0.816)/0.805]换算成室温标准气压下的气体体积,计算产气量,参照Wang等[14]提出的方法计算:
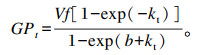
|
式中:GPt表示t时刻的累积产气量(mL/g);Vf表示潜在最大产气量(mL/g);k表产气速率(h-1);b表示形状参数。下式同。
起始底物降解速率[FRO0,mmol/(g·h)],即当t=0时的底物降解速率,计算公式参考Wang等[15-16]的模型,数学表达方程为:
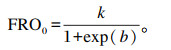
|
发酵结束后,将注射器内全部培养物取出,并立即用pH计测定pH,然后将一部分培养物以3 500×g离心15 min,上清液分别装入不同的离心管中,-20 ℃冷冻保存,待测NH3-N、微生物蛋白(MCP)和挥发性脂肪酸(VFA)含量;一部分发酵液过400目尼龙布后将残渣全部转移至石英坩埚中用热蒸馏水反复冲洗,随后置于105 ℃烘箱中烘干以测定干物质降解率(DMD)和NDFD。NH3-N含量采用苯酚-次氯酸钠比色法测定[17],VFA(乙酸、丙酸、丁酸、戊酸、异丁酸及异戊酸)含量使用气相色谱仪(安捷伦7890A,美国)测定[18],参照董晓玲等[19]的方法进行测定。MCP含量采用考马斯亮蓝法测定[20],甲烷(CH4)产量于体外瘤胃发酵48 h时,使用气相色谱仪测定。
1.3 统计分析采用Excel 2010软件对试验数据进行计算和整理,采用SAS 9.0软件进行单因素方差分析(one-way ANOVA),对差异显著项目进行多重比较,并采用Tukey法鉴定比较平均值之间的差异显著性,以P < 0.05作为差异显著判断标准,0.05 < P < 0.10表示有差异趋势。
2 结果 2.1 不同浓度纤维素酶菌剂处理对小麦、青稞和油菜黄贮化学成分的影响由表 1、表 2和表 3可知,Ⅰ组的小麦和青稞黄贮的感官评分显著高于对照组(P < 0.05)。Ⅰ和Ⅱ组的小麦、青稞和油菜黄贮的pH均显著高于对照组(P < 0.05)。Ⅰ和Ⅱ组的小麦和青稞黄贮的乳酸、乙酸和丙酸含量显著高于对照组(P < 0.05),各组之间油菜黄贮的乳酸、乙酸和丙酸含量差异不显著(P>0.05)。Ⅰ和Ⅱ组的小麦和青稞黄贮的NDF和ADF含量显著低于对照组(P < 0.05)。Ⅱ组的小麦、青稞和油菜黄贮的粗蛋白质含量显著高于对照组(P < 0.05)。Ⅰ和Ⅱ组的小麦黄贮的粗脂肪含量显著高于对照组(P < 0.05)。
|
|
表 1 不同浓度纤维素酶菌剂处理对小麦黄贮化学成分的影响 Table 1 Effects of different concentrations of cellulase agent treatment on chemical components of wheat yellow storage |
|
|
表 2 不同浓度纤维素酶菌剂处理对青稞黄贮化学成分的影响 Table 2 Effects of different concentrations of cellulase agent treatment on chemical components of highland barley yellow storage |
|
|
表 3 不同浓度纤维素酶菌剂处理对油菜黄贮化学成分的影响 Table 3 Effects of different concentrations of cellulase agent treatment on chemical components of rape yellow storage |
由表 4可知,Ⅰ和Ⅱ组的小麦和青稞黄贮的DMD显著高于对照组(P < 0.05),各组之间油菜黄贮的DMD差异不显著(P>0.05)。Ⅰ和Ⅱ组的小麦黄贮的NDFD显著高于对照组(P < 0.05),Ⅰ组的青稞黄贮的NDFD显著高于对照组和Ⅱ组(P < 0.05),各组之间油菜黄贮的NDFD差异不显著(P>0.05)。
|
|
表 4 不同浓度纤维素酶菌剂处理对小麦、青稞和油菜黄贮体外营养成分降解率的影响 Table 4 Effects of different concentrations of cellulase agent treatment on nutrient degradation rates in vitro of wheat, highland barley and rape yellow storages |
由表 5可知,Ⅰ和Ⅱ组的小麦黄贮的pH显著低于对照组(P < 0.05),Ⅰ和Ⅱ组的青稞黄贮的pH有降低的趋势(0.05<P < 0.10),各组之间油菜黄贮的pH差异不显著(P>0.05)。Ⅰ和Ⅱ组的油菜黄贮的NH3-N含量显著高于对照组(P < 0.05),各组之间小麦和青稞黄贮的NH3-N含量差异不显著(P>0.05)。各组之间小麦、青稞和油菜黄贮的MCP含量均无显著差异(P>0.05)。Ⅰ和Ⅱ组的小麦和青稞黄贮的TVFA含量显著高于对照组(P < 0.05)。Ⅱ组的小麦黄贮的丁酸含量显著低于对照组和Ⅰ组(P < 0.05),对照组的青稞黄贮的丁酸含量显著高于Ⅰ和Ⅱ组(P < 0.05);Ⅰ组的小麦黄贮的戊酸和异戊酸含量显著低于对照组和Ⅱ组(P < 0.05);Ⅰ和Ⅱ组的油菜黄贮的乙酸/丙酸有增加趋势(0.05<P < 0.10)。
|
|
表 5 不同浓度纤维素酶菌剂处理对小麦、青稞和油菜黄贮体外发酵参数的影响 Table 5 Effects of different concentrations of cellulase agent treatment on in vitro fermentation parameters of wheat, highland barley and rape yellow storages |
由表 6可知,Ⅰ和Ⅱ组的小麦和青稞黄贮的48 h总产气量显著高于对照组(P < 0.05),各组之间油菜秸秆的48 h总产气量差异不显著(P>0.05)。
|
|
表 6 不同浓度纤维素酶菌剂处理对小麦、青稞和油菜黄贮体外发酵产气特性的影响 Table 6 Effects of different concentrations of cellulase agent treatment on in vitro fermentation gas production characteristics of wheat, highland barley and rape yellow storages |
本研究结果表明,小麦、青稞和油菜黄贮添加纤维素分解菌提高了乳酸、乙酸含量及黄贮感官评分,降低了NDF和ADF含量,增加了粗蛋白质含量,提高了黄贮秸秆的营养价值和利用率。纤维素分解菌能快速水解细胞壁结构多糖,使之产生足量的葡萄糖,为乳酸菌的繁殖生长提供碳源,从而增加乳酸和VFA含量,降低纤维含量。小麦、青稞和油菜秸秆经黄贮及纤维素分解菌处理后,以小麦黄贮营养价值较高,其可能的原因是因为小麦秸秆中粗蛋白质含量高,粗纤维含量低,黄贮效果较好。孙娟娟等[21]和马广英等[22]研究发现,添加纤维素酶后,小麦和油菜黄贮的感官综合评定分值显著提高,NDF和ADF含量显著降低,粗蛋白质含量显著提高,这与本试验研究结果一致。
一般认为瘤胃内产气量的多少与饲粮的消化率呈正相关,产气越多,发酵效果越好。产气量是由于干物质的降解而产生的,一般生产中可以利用DMD来简单地评定瘤胃的发酵效果。DMD越高,饲料中的营养物质的利用就越多,说明瘤胃的内环境越有利于瘤胃微生物的发酵[23]。本试验发现,小麦和青稞黄贮添加纤维素分解菌提高了瘤胃产气量,增加了DMD和NDFD。杜江华等[24]和李昊[25]的研究同样发现,秸秆中添加纤维素分解菌,瘤胃产气量显著提高。
瘤胃pH是衡量瘤胃微生物发酵状况的重要指标,可综合反映微生物发酵活动及有机酸的代谢情况[26]。瘤胃pH的正常范围一般在5.5~7.5。有研究表明,当瘤胃pH低于6.2时,纤维分解菌的生长将会受到抑制[27]。本试验瘤胃pH维持在6.21~6.56,属于正常范围,说明添加纤维素分解菌没有对人工瘤胃酸碱内环境造成不良影响。小麦黄贮添加纤维素分解菌组瘤胃pH显著低于对照组,青稞黄贮添加纤维素分解菌组瘤胃pH也有降低的趋势。其原因可能是由于试验组添加了纤维素分解菌液,发酵较快,因此很快产出酸性物质,pH下降明显,这与杜江华等[24]的研究结果一致,说明添加活菌制剂可以加快瘤胃内微生物的发酵。NH3-N的形成主要是由于瘤胃微生物对饲粮中的含氮化合物的分解,而瘤胃中的NH3-N含量主要取决于2个因素,一个是饲粮中氮的降解速率,另一个是微生物对于氨的利用[28]。本试验中,油菜黄贮添加纤维素分解菌组的NH3-N含量较高,说明添加活菌制剂能够提高瘤胃NH3-N含量,这与孙满吉等[29]和杜江华[26]研究结果一致。这是由于添加活菌制剂后能够增加瘤胃中微生物的活性与数量,从而导致瘤胃中含氮化合物的降解增加,进而提高瘤胃NH3-N含量。
添加纤维素分解菌能够使瘤胃中的VFA含量增加[30]。本试验结果表明,与对照组相比,Ⅰ和Ⅱ组的小麦和青稞黄贮的TVFA含量显著提高;Ⅱ组的小麦黄贮的丁酸含量显著降低,青稞黄贮的丁酸含量显著降低;Ⅰ组的小麦黄贮的戊酸和异戊酸含量显著降低。黄立敏[31]在奶牛体外发酵饲粮中添加纤维素分解菌显著提高了乙酸、丙酸和TVFA含量。杜江华等[24]在体外发酵饲粮中添加纤维素分解菌和固氮菌混合液显著提高了乙酸、丙酸和TVFA含量。孙满吉等[29]研究发现,添加纤维素分解菌,瘤胃液中TVFA、乙酸含量显著提高,而对丙酸、丁酸含量和乙酸/丙酸无显著影响,这与本试验结果部分存在差异,原因可能是由于发酵底物的不同及菌液添加浓度的差别造成的,且本试验采用的是体外发酵的方法。当乙酸/丙酸小于3属于丙酸型发酵,而乙酸/丙酸大于3为乙酸型发酵。本试验中各组乙酸/丙酸都小于3,说明该发酵类型属于丙酸型发酵。
本试验中的各组甲烷产量均无显著差异。杜江华等[24]研究发现,4×1011 CFU/L菌液混合组甲烷产量明显高于对照组。乔国华等[32]直接将纤维素分解菌饲喂奶牛,发现微生物培养物可以提高甲烷产量。甲烷产量提高的原因在于饲粮中添加活菌制剂后,发酵加快,导致产生的甲烷不能被利用。本试验中,各组之间甲烷产量无显著差异的原因可能是由于菌液添加浓度较低造成的。
4 结论① 添加纤维素分解菌N30可增加小麦、青稞和油菜黄贮的DMD、NDFD和产气量,促进饲料的消化降解,增加TVFA含量,丁酸和戊酸含量有不同程度地下降。
② 添加纤维分解菌N30对小麦、青稞和油菜黄贮体外发酵有明显促进作用,且添加浓度以2×1010 CFU/kg为宜。
| [1] |
YUAN X F, LI P P, WANG H, et al. Enhancing the anaerobic digestion of corn stalks using composite microbial pretreatment[J]. Journal of Microbiology and Biotechnology, 2011, 21(7): 746-752. DOI:10.4014/jmb.1011.11026 |
| [2] |
OLADOSU Y, RAFⅡ M Y, ABDULLAH N, et al. Fermentation quality and additives: a case of rice straw silage[J]. BioMed Research International, 2016, 2016: 7985167. |
| [3] |
LARA E C, BASSO F C, DE ASSIS F B, et al. Changes in the nutritive value and aerobic stability of corn silages inoculated with Bacillus subtilis alone or combined with Lactobacillus plantarum[J]. Animal Production Science, 2016, 56(11): 1867-1874. DOI:10.1071/AN14686 |
| [4] |
WANG H L, HAO W, NING T T, et al. Characterization of culturable yeast species associating with whole crop corn and total mixed ration silage[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(2): 198-207. DOI:10.5713/ajas.17.0183 |
| [5] |
RANJIT N K, KUNG L, J r. The effect of Lactobacillus buchneri, Lactobacillus plantarum, or a chemical preservative on the fermentation and aerobic stability of corn silage[J]. Journal of Dairy Science, 2000, 83(3): 526-535. DOI:10.3168/jds.S0022-0302(00)74912-5 |
| [6] |
SEO J K, PARK T S, KWON I H, et al. Characterization of cellulolytic and xylanolytic enzymes of bacillus licheniformis JK7 isolated from the rumen of a native korean goat[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(1): 50-58. DOI:10.5713/ajas.2012.12506 |
| [7] |
WANG T Y, CHEN H L, LU M Y J, et al. Functional characterization of cellulases identified from the cow rumen fungus Neocallimastix patriciarum W5 by transcriptomic and secretomic analyses[J]. Biotechnology for Biofuels, 2011, 4(1): 24. DOI:10.1186/1754-6834-4-24 |
| [8] |
LEE S M, GUAN L L, EUN J S, et al. The effect of anaerobic fungal inoculation on the fermentation characteristics of rice straw silages[J]. Journal of Applied Microbiology, 2015, 118(3): 565-573. DOI:10.1111/jam.12724 |
| [9] |
GUO G, SHEN C, LIU Q, et al. The effect of lactic acid bacteria inoculums on in vitro rumen fermentation, methane production, ruminal cellulolytic bacteria populations and cellulase activities of corn stover silage[J]. Journal of Integrative Agriculture, 2020, 19(3): 838-847. DOI:10.1016/S2095-3119(19)62707-3 |
| [10] |
张庆芳, 王泽坤, 姜南, 等. 一株瘤胃源产纤维素酶菌株的筛选、鉴定及其酶学特性研究[J]. 中国酿造, 2019, 38(4): 46-50. ZHANG Q F, WANG Z K, JIANG N, et al. Screening, identification and enzymatic characteristics of a cellulose-producing strain from rumen[J]. China Brewing, 2019, 38(4): 46-50 (in Chinese). |
| [11] |
张元庆, 王栋, 孟庆翔. 瘤胃微生物纤维体研究进展[J]. 中国饲料, 2005(12): 2-4. ZHANG Y Q, WANG D, MENG Q X. Research progress of rumen microbial fibrous bodies[J]. China Feed, 2005(12): 2-4 (in Chinese). DOI:10.3969/j.issn.1004-3314.2005.12.002 |
| [12] |
MENKE K H, STEINGASS H. Estimation of the energetic feed value obtained by chemical analysis and in vitro gas production using rumen fluid[J]. Animal Research and Development, 1988, 28: 7-55. |
| [13] |
农业部畜牧兽医司. 青贮饲料质量评定标准[J]. 上海奶牛, 1997(2): 29-31. Department of Animal Husbandry and Veterinary Medicine Ministry of Agriculture. Silage quality evaluation standard[J]. Shanghai Dairy Cattle, 1997(2): 29-31 (in Chinese). |
| [14] |
WANG M, JANSSEN P H, SUN X Z, et al. A mathematical model to describe in vitro kinetics of H2 gas accumulation[J]. Animal Feed Science and Technology, 2013, 184(1/2/3/4): 1-16. |
| [15] |
WANG M, SUN X Z, TANG S X, et al. Deriving fractional rate of degradation of logistic-exponential (LE) model to evaluate early in vitro fermentation[J]. Animal, 2013, 7(6): 920-929. DOI:10.1017/S1751731112002443 |
| [16] |
WANG M, TANG S X, TAN Z L. Modeling in vitro gas production kinetics: derivation of logistic-exponential (LE) equations and comparison of models[J]. Animal Feed Science and Technology, 2011, 165(3/4): 137-150. |
| [17] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(6/7): 37. FENG Z C, GAO M. Improvement of colorimetric determination of ammonia nitrogen content in rumen liquid[J]. Inner Mongolia Animal Husbandry Science, 2010, 31(6/7): 37 (in Chinese). |
| [18] |
WANG M, SUN X Z, JANSSEN P H, et al. Responses of methane production and fermentation pathways to the increased dissolved hydrogen concentration generated by eight substrates in in vitro ruminal cultures[J]. Animal Feed Science and Technology, 2014, 194: 1-11. DOI:10.1016/j.anifeedsci.2014.04.012 |
| [19] |
董晓玲, 孟庆翔. 丙酸和丙酸菌添加对高油玉米秸秆青贮发酵品质以及瘤胃发酵参数影响的研究[J]. 中国畜牧杂志, 2007, 43(15): 35-38. DONG X L, MENG Q X. Effects of propionic acid and propionic acid bacteria on the fermentation and in vitro digestibility of high oil corn stover silage[J]. Chinese Journal of Animal Science, 2007, 43(15): 35-38 (in Chinese). DOI:10.3969/j.issn.0258-7033.2007.15.013 |
| [20] |
王金洛, 韩正康, 陈杰. 山羊瘤胃微生物蛋白(MCP)与十二指肠食糜MCP浓度的比较研究[J]. 动物营养学报, 1991, 3(2): 61. WANG J L, HAN Z K, CHEN J. Comparative study on the concentration of goat rumen microbial protein (MCP) and duodenal chyme MCP[J]. Chinese Journal of Animal Nutrition, 1991, 3(2): 61 (in Chinese). |
| [21] |
孙娟娟, 玉柱, 薛艳林, 等. 不同添加剂处理对小麦秸黄贮饲料发酵品质的影响[J]. 中国畜牧杂志, 2007, 43(23): 52-55. SUN J J, YU Z, XUE Y L, et al. Effects of different additive treatments on fermentation quality of wheat straw[J]. Chinese Journal of Animal Science, 2007, 43(23): 52-55 (in Chinese). DOI:10.3969/j.issn.0258-7033.2007.23.016 |
| [22] |
马广英. 作物秸秆黄贮效果研究[D]. 硕士学位论文. 石河子: 石河子大学, 2014. MA G Y. A research on the effect of ensiled crop straw[D]. Master's Thesis. Shihezi: Shihezi University, 2014. (in Chinese) |
| [23] |
JUÁREZ R A S, CERRILLO S M A, GUTIÉRREZ O E, et al. Assessment of the nutritional value of tropical grasses obtained from conventional analyses and in vitro gas production[J]. Técnica Pecuaria en México, 2009, 47(1): 55-67. |
| [24] |
杜江华, 黄国欣, 李彦芳, 等. 3种来源兼性纤维素分解菌与固氮菌混合对体外发酵的影响[J]. 中国畜牧杂志, 2017, 53(9): 109-113. DU J H, HUANG G X, LI Y F, et al. Effects of three sources of facultative bacteria cellulose mixed with nitrogen-ffixing bacteria on in vitro fermentation[J]. Chinese Journal of Animal Science, 2017, 53(9): 109-113 (in Chinese). |
| [25] |
李昊. 固氮菌和纤维素分解菌的分离及混合添加对瘤胃发酵的影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2013. LI H. The isolation of nitrogen-fixing bacteria and cellulose degrading bacteria and the effect of the two microbes on in vitro fermentation[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2013. (in Chinese) |
| [26] |
杜江华. 瘤胃固氮菌与三种来源兼性纤维菌混合对体外发酵影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2017. DU J H. Effects of three sources of facultative bacteria cellulose mixed with ruminal nitrogen-fixing bacteria on in vitro fermentation[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2017. (in Chinese) |
| [27] |
ZHOU M, CHUNG Y H, BEAUCHEMIN K A, et al. Relationship between rumen methanogens and methane production in dairy cows fed diets supplemented with a feed enzyme additive[J]. Journal of Applied Microbiology, 2011, 111(5): 1148-1158. DOI:10.1111/j.1365-2672.2011.05126.x |
| [28] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004. FENG Y L. Ruminant nutrition[M]. Beijing: Science Press, 2004 (in Chinese). |
| [29] |
孙满吉, 杨琼, 宫福臣, 等. 纤维素分解菌对奶牛瘤胃发酵的影响[J]. 中国饲料, 2013(19): 9-11, 17. SUN M J, YANG Q, GONG F C, et al. Effects of cellulose decomposing bacteria on rumen fermentation of dairy cows[J]. China Feed, 2013(19): 9-11, 17 (in Chinese). DOI:10.3969/j.issn.1004-3314.2013.19.004 |
| [30] |
SÁNCHEZ-SANTILLÁN P, COBOS-PERALTA M A. In vitro production of volatile fatty acids by reactivated cellulolytic bacteria and total ruminal bacteria in cellulosic substrate[J]. Agrociencia, 2016, 50(5): 565-574. |
| [31] |
黄立敏. 筛选纤维分解菌及其对体外瘤胃发酵、奶牛生产性能的影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2014. HUANG L M. Filter cellulose-degrading bacterial the effect on rumen fermentation and production performance in dairy cows[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2014. |
| [32] |
乔国华, 单安山. 直接饲喂微生物培养物对奶牛瘤胃发酵产甲烷及生产性能的影响[J]. 中国畜牧兽医, 2006, 33(5): 11-14. QIAO G H, SHAN A S. The effect of different direct-fed microbial culture on methane production in vitro and production performance in dairy cattle[J]. China Animal Husbandry & Veterinary Medicine, 2006, 33(5): 11-14. DOI:10.3969/j.issn.1671-7236.2006.05.003 |




