2. 农业农村部农产品质量安全风险评估实验室(呼和浩特), 内蒙古自治区农牧业科学院, 呼和浩特 010031
2. Laboratory of Quality & Safety Risk Assessment for Agricultural Products(Hohhot), Ministry of Agriculture and Rural Affairs, Inner Mongolia Academy of Agricultural and Animal Husbandry Sciences, Hohhot 010031, China
奶牛乳房炎发病率高,治疗成本昂贵,给全球奶牛养殖业造成了巨大的经济损失。乳房炎主要由细菌侵入奶牛乳腺所致。本课题组前期采集我国内蒙古、黑龙江、山东、上海、河北5个奶业主产省区的患乳房炎奶牛乳样,对引起乳房炎的大肠杆菌、金黄色葡萄球菌、克雷伯氏菌及无乳链球菌等病原微生物进行了分离鉴定和耐药性评估,发现大肠杆菌分离率最高[1]。脂多糖(lipopolysaccharide,LPS)是大肠杆菌细胞壁上的主要毒力因子,当乳腺内发生大肠杆菌感染时,进入乳腺的细菌释放出LPS,损伤奶牛乳腺细胞,导致奶牛乳脂率、乳蛋白率等显著降低,产奶量大幅度减少甚至停产。抗生素是目前治疗奶牛乳房炎最有效的手段,但其残留性和毒副作用对人体健康危害极大,在全球范围内被逐渐禁用[2-3]。近年来众多研究表明,蒿属植物在替代抗生素方面有显著效果,黑沙蒿、艾蒿、猪毛蒿、褐苞蒿等蒿属植物富含萜类、黄酮类、多糖类、精油、生物碱等生物活性物质,能通过增强机体免疫水平、修复组织氧化损伤、调控细胞炎症因子、抑制病原菌活性等途径发挥抗炎、抗氧化和杀菌等生物学作用[4-7]。黄花蒿不仅具有显著的抗炎抗氧化作用,同时,其有效成分青蒿素是目前最具疗效的抗疟药物成分之一。本课题组前期研究表明,黄花蒿乙醇提取物(ethanol extract of Artemisia annua,AAE)能改善奶牛乳成分。在奶牛饲粮中添加AAE能显著上调奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)中硬脂酰辅酶去饱和酶(SCD)、脂肪酸合成酶(FASN)等乳脂合成相关基因的表达量,从而调控乳中乳脂合成以及共轭亚油酸含量[8-9]。
牛乳蛋白主要成分为酪蛋白和乳清蛋白,酪蛋白是衡量牛奶品质的一项重要指标,对人体极具营养价值。哺乳动物雷帕霉素靶蛋白(mTOR)和Juns激酶(JAK)-信号转导转录激活因子(STAT)信号通路可通过介导BMECs增殖、分化、促乳因子分泌,从而调控乳蛋白合成[10-12]。前人研究发现,LPS不仅能显著降低BMECs增殖水平和乳蛋白分泌功能,还能明显抑制BMECs中mTOR、核糖体S6蛋白激酶1(S6K1)、真核起始因子4E(EIF4E)及真核细胞翻译启动因子4E结合蛋白1(EIF4EBP1)的基因表达量和磷酸化水平,这表明LPS可能通过抑制mTOR和JAK-STAT活化,从而降低乳蛋白率[13-14]。有研究发现,苜蓿素一定程度上能缓解LPS对乳腺细胞的氧化损伤以及乳蛋白合成的抑制作用[15]。但目前关于AAE对奶牛LPS诱导损伤乳腺细胞乳蛋白合成影响的研究未见报道。鉴于此,本文通过BMECs体外培养技术,研究AAE对LPS诱导损伤BMECs活力以及乳蛋白合成相关基因表达的影响,旨在对AAE调控大肠杆菌引起的奶牛乳房炎乳蛋白合成机制进行探讨,为生产上改善乳房炎奶牛乳品质提供理论依据和数据支持。
1 材料与方法 1.1 试验材料与试剂 1.1.1 试验材料试验当日采集体况健康的奶牛乳腺组织,尽快带回实验室。AAE活性成分参见王丽芳等[8]。
1.1.2 主要试剂脂多糖、胶原酶Ⅱ、胎牛血清、0.25%胰酶细胞消化液、DMEM/F-12(1 ∶ 1)培养基、青链霉素、胰岛素转铁蛋白硒钠购自美国Gibco公司;表皮生长因子(EGF)、氢化可得松、两性霉素B、二甲基亚砜(DMSO)购自美国Sigma公司;总RNA提取试剂购自天根生化科技(北京)有限公司;戊二醛、无水乙醇、异丙醇、三氯甲烷购自国药化学试剂有限公司。
1.2 试验设计试验分为5组,对照组:BMECs用基础培养基常规培养15 h;模型组:BMECs用基础培养基常规培养3 h+10 μg/mL LPS处理12 h;AAE+LPS组:BMECs分别用含3、6、12 μg/mL AAE的基础培养基培养3 h+10 μg/mL LPS处理12 h。
1.3 试验方法 1.3.1 BMECs体外正常模型的构建BMECs原代培养、纯化和传代等步骤参见丹妮[16]。选用3~4代细胞进行试验。通过免疫荧光技术,对BMECs进行角蛋白-18免疫荧光鉴定,并绘制BMECs生长曲线。
1.3.2 细胞活力检测细胞活力采用四甲基偶氮唑盐(MTT)比色法进行检测,BMECs培养方法同1.2.1。第3代细胞复苏后用胰酶细胞消化液消化下来,以9×104个/mL的细胞密度接入96孔板中,放入37 ℃二氧化碳恒温培养箱中培养48 h。对照组:BMECs用基础培养基常规培养15 h;模型组:BMECs用基础培养基常规培养3 h,3 h后取出96孔板,吸取并弃掉上清液,每孔加入10 μg/mL LPS置于37 ℃二氧化碳恒温培养箱中12 h;3个AAE+LPS组:BMECs分别用含有3、6、12 μg/mL AAE的基础培养基培养3 h,3 h后取出96孔板,吸取并弃掉上清液,每孔加入10 μg/mL LPS置于37 ℃二氧化碳恒温培养箱中12 h。
培养结束前4 h,取出所有96孔板,每孔加入20 μL MTT溶液,然后4 h后再次取出96孔板,弃去上清并每孔加入100 μL DMSO,振荡培养10 min后使用全自动酶标仪检测490 nm处吸光值。以此初步筛选适宜的AAE添加浓度。
1.3.3 乳蛋白合成相关指标检测将第3代BMECs接种到六孔板。试验分组同1.2.2。待细胞融合度达到80%以上,采用酶联免疫吸附测定(ELISA)试剂盒检测β-酪蛋白、αs1-酪蛋白和总蛋白含量的测定。检测方法参照ELISA试剂盒说明书,试剂盒购自泉州市睿信生物科技有限公司。
1.3.4 乳蛋白合成相关基因表达量的测定将第3代BMECs接种到六孔板。试验分组同1.2.2。待细胞融合度达到80%以上,去除上清后每孔分别加入1 mL的Trizol,具体方法参见石惠宇[17]的报道,进行总RNA的提取和质检,然后使用第一链合成试剂盒(FastQuant RT Kit FastQuant cDNA)进行RNA反转录。参照彩色荧光定量预混试剂盒说明进行基因荧光定量,使用LightCycler 480Ⅱ荧光定量PCR仪,反应程序为;95.0 ℃预变性30 s;进行40个循环反应,95.0 ℃变性30 s,60 ℃退火30 s,72.0 ℃延伸20 s。使用2-ΔΔCt法计算乳蛋白合成相关基因表达量。
|
|
表 1 引物序列及参数 Table 1 Primer sequences and parameters |
试验数据先使用Excel 2016进行初步整理,然后使用SPSS 22.0软件进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行多重比较,P<0.05表示差异显著,P>0.05表示差异不显著。
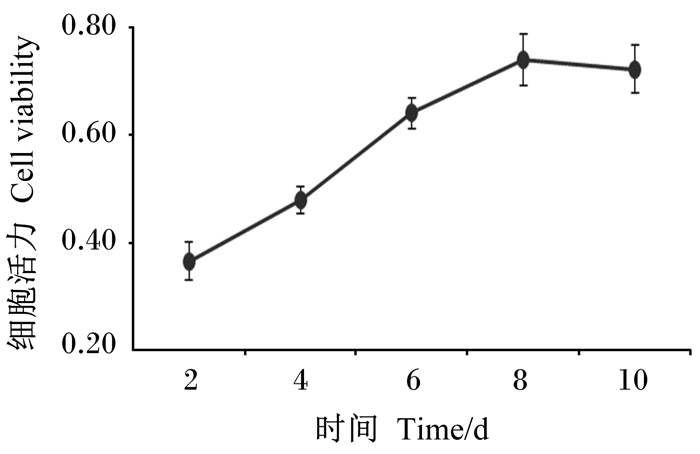
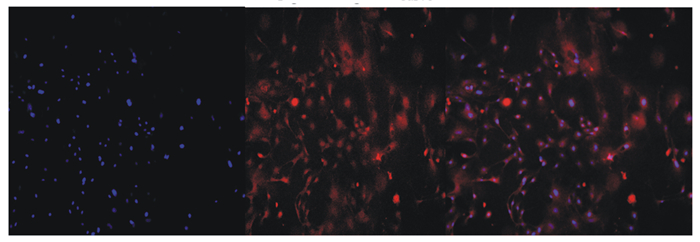
2 结果 2.1 BMECs生长情况和鉴定如图 1所示,纯化传代至第3代的BMECs在2~8 d细胞活力呈线性增长,8 d以后细胞活力缓慢降低,这表明了传代细胞具备正常增殖能力,但细胞培养应保持在8 d以内。如图 2所示,图中红色和蓝色荧光部分分别表示角蛋白-18和细胞核,其中,角蛋白-18激发的红色荧光清晰明亮,表明角蛋白-18在细胞核中表达量较大。证明已成功分离培养得到BMECs。
|
图 1 细胞生长曲线 Fig. 1 Cell growth curve |
|
图 2 鉴定BMECs骨架蛋白CK-18 Fig. 2 Identification of BMECs skeleton protein CK-18 (100×) |
由表 2可见,与对照组相比,模型组的BMECs活力显著降低(P < 0.05)。与模型组相比,3 μg/mL AAE提高了LPS诱导损伤BMECs活力,但差异不显著(P>0.05);6和12 μg/mL AAE显著提高了LPS诱导损伤BMECs活力(P<0.05)。
|
|
表 2 AAE对LPS诱导损伤BMECs活力的影响 Table 2 Effects of AAE on viability of injured BMECs induced by LPS |
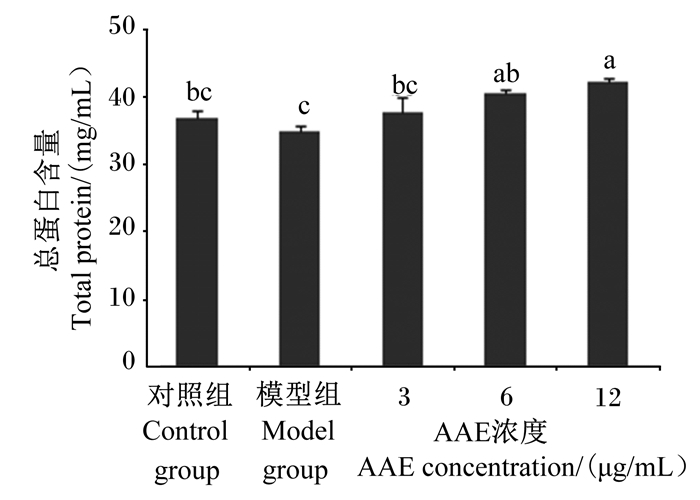
如图 3所示,与模型组相比,12 μg/mL AAE组总蛋白含量显著增高(P<0.05);3和6 μg/mL AAE组总蛋白含量有所增加,但差异不显著(P>0.05)。
|
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 3 AAE对LPS诱导损伤BMECs中总蛋白含量的影响 Fig. 3 Effects of AAE on total protein content of injured BMECs induced by LPS |
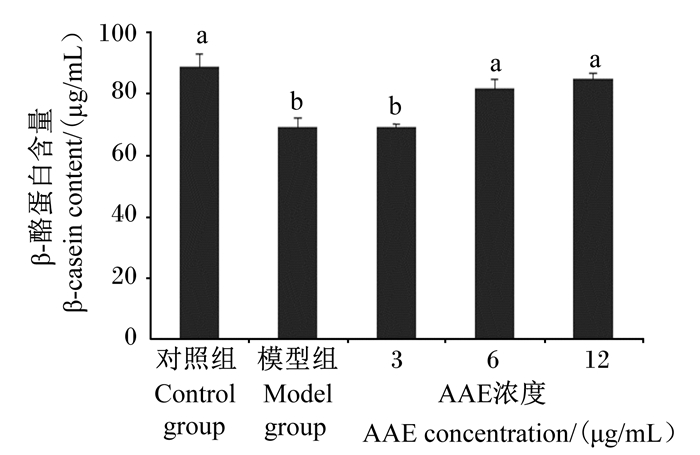
如图 4所示,6、12 μg/mL AAE组β-酪蛋白含量显著高于模型组(P<0.05),且与对照组无显著差异(P>0.05);3 μg/mL AAE组β-酪蛋白含量与模型组无显著差异(P>0.05),且显著低于对照组(P<0.05)。
|
图 4 AAE对LPS诱导损伤BMECs中β-酪蛋白含量的影响 Fig. 4 Effects of AAE on β-casein content of injured BMECs induced by LPS |
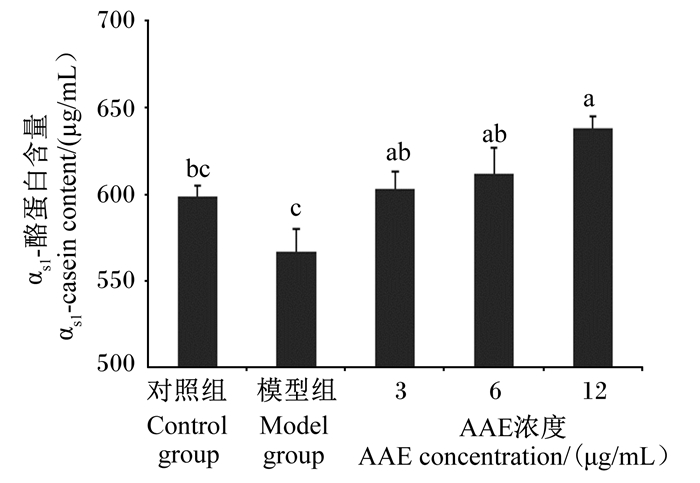
如图 5所示,3、6、12 μg/mL AAE组αs1-酪蛋白含量均显著高于模型组(P<0.05)。
|
图 5 AAE对LPS诱导损伤BMECs中αs1-酪蛋白含量的影响 Fig. 5 Effects of AAE on αs1-casein content of injured BMECs induced by LPS |
由表 2可见,与模型组相比,12 μg/mL AAE显著增加了α-酪蛋白(CSN1S1)基因表达量(P<0.05),3、6、12 μg/mL AAE显著增加了β-酪蛋白(CSN2)、mTOR、STAT5、EIF4EBP1、S6K1、JAK2基因表达量(P<0.05),6、12 μg/mL AAE显著增加了EIF4E基因表达量(P<0.05)。
3 讨论 3.1 AAE对LPS诱导损伤BMECs活力的影响奶牛乳房炎在全世界范围内均有极高的发病率,奶牛感染会出现不同程度泌乳机能损伤和生产性能下降。大肠杆菌是一种最常见的诱发乳房炎的环境病原菌之一,而LPS是大肠杆菌细胞壁外膜中的内毒素,是主要的致病因子,能诱导多种细胞类型凋亡和炎症,对BMECs的增殖有显著的抑制作用。研究表明,LPS可抑制BMECs增殖水平,导致细胞凋亡和肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)等多种炎症因子的产生[18]。另外,其他研究显示,随着LPS剂量的增大,毒性作用也随之增强,且炎症反应水平也与LPS呈剂量依赖性[13]。本试验研究结果表明,模型组细胞活力显著低于对照组,这与上述报道结果一致。植物提取物能增强LPS诱导损伤BMECs的抗氧化作用,降低细胞炎症水平,从而恢复炎症损伤细胞活力[19-20]。研究表明,AAE中的黄酮类和多糖类活性成分呈现出一定的抗炎活性,可下调细胞炎症因子的mRNA和蛋白表达水平[21-22]。在本试验中,AAE可提高LPS诱导损伤BMECs活力,这可能是AAE降低了LPS诱导的炎症反应,但具体机制尚不清楚,需进一步研究。
|
|
表 3 AAE对LPS诱导损伤BMECs中乳蛋白合成相关基因表达的影响 Table 3 Effects of AAE on expression of milk protein biosynthesis related genes of injured BMECs induced by LPS |
牛乳中酪蛋白有αs1(40%)、β(36%)、αs2和κ 4种亚型,而每种亚型又因为翻译后的磷酸化修饰和糖基化修饰而形成了多种基因变体[14]。研究表明,αs1-酪蛋白不仅可以促进动物体内钙的沉积和钙化以及其他矿物质元素的吸收,还可以改善动物机体免疫功能[23]。β-酪蛋白也能够一定程度促进机体对钙、锌等矿物质的吸收,且β-酪蛋白在水解后会产生许多具有特殊生物学活性的物质,如免疫调节和抗氧化作用的生物活性肽[24]。LPS对酪蛋白合成有显著的抑制作用,其可能通过下调氨基酸转运水平从而导致酪蛋白分泌水平显著降低[13]。植物提取物活性成分丰富,对乳腺炎奶牛及健康奶牛乳蛋白率有显著的改善作用。宋洁等[25]在乳腺炎奶牛饲粮中添加以黄酮类、脂质类等为主要成分的复合植物提取物,结果显示,该复合植物提取物能显著提高乳腺炎奶牛的乳蛋白率。斯琴毕力格等[8]在体况相近的荷斯坦奶牛饲粮中添加AAE,结果显示试验组乳蛋白含量与对照组相比有增加趋势[8]。本试验中,10 μg/mL LPS显著降低了BMECs中αs1-酪蛋白和β-酪蛋白含量,不同浓度的AAE能不同程度地提高LPS诱导损伤BMECs中总蛋白含量,6和12 μg/mL AAE显著提高了LPS诱导损伤BMECs中β-酪蛋白含量,且3、6和12 μg/mL AAE时均能显著提高LPS诱导损伤BMECs中αs1-酪蛋白含量。通过以上结果判断,AAE可能通过提高受损伤BMECs中αs1-酪蛋白和β-酪蛋白的含量来使细胞总蛋白含量恢复正常水平,且能一定程度上调节酪蛋白组成成分。
3.3 AAE对LPS诱导损伤BMECs中乳蛋白合成基因表达的影响CSN2和CSN1S1作为酪蛋白的主要组成部分,受催乳素和糖皮质激素(HP)等促乳激素的调控,其基因表达量是衡量乳蛋白合成的重要指标[26-27]。牛乳蛋白合成主要由JAK-STAT5和mTOR/S6K1/EIF4 2个信号通路进行调控,mTOR信号通路是一个将营养供应、蛋白质合成和细胞生长结合起来的重要通路[28]。mTOR是一种丝氨酸/苏氨酸激酶,在蛋白质合成过程中通过整合来自氨基酸、生长因子、能量状态等营养物质的上游信号和压力,在信号转导中起重要作用[29]。mTOR信号通路一旦激活,哺乳动物雷帕霉素靶蛋白复合靶点1(mammalian target of rapamycin complex 1,mTORC1)开始磷酸化,并刺激下游蛋白S6K1和EIF4EBP1的表达,从而调控乳蛋白mRNA翻译过程[12]。低磷酸化的4E结合蛋白(4E-bp1)与EIF4E结合,在mTORC1信号激活后,EIF4EBP1磷酸化与EIF4E分离[29-30]。催乳素和促生长因子可通过酪氨酸激酶Janus激酶(Janus kinase,Jak)使STAT5磷酸化。磷酸化的STAT5形成二聚体,进入细胞核与乳蛋白基因的启动子和增强子结合,诱导其表达,从而促进乳蛋白合成。有研究表明,真核起始因子5(EIF5)受到STAT5的调控,同时STAT5活性与EIF5表达量呈正相关[31]。
LPS可激活细胞因子信号转导抑制因子3(SOCS3),活化后的SOCS3可抑制催乳素诱导的STAT5以及其下游蛋白的基因表达量[32]。较低浓度的LPS就能显著下调JAK-STAT5和mTOR/S6K1/EIF4 2个信号通路相关基因的表达量[13]。研究表明,植物提取物可能通过促进乳蛋白合成相关信号通路基因转录及蛋白表达和磷酸化水平来改善LPS诱导损伤BMECs中乳蛋白合成水平降低现象。必需脂肪酸、维生素A、氨基酸等营养素都能不同程度地影响BMECs中乳蛋白CSN2和CSN1S1等相关基因的表达,其可能通过介导mTOR通路和JAK2-STAT5通路增加氨基酸的吸收利用和BMECs的增殖分化过程,从而调控乳蛋合成[33-35]。占今舜等[15]研究发现,苜蓿素能显著上调LPS诱导损伤BMECs中mTOR、S6K1、JAK2、STAT5等乳蛋白合成相关通路基因的表达水平。
目前,有关AAE对LPS诱导损伤BMECs中乳蛋白合成及相关作用机制未见报道。本试验研究结果表明,CSN1S1基因表达量随AAE浓度增加呈剂量依赖性提高,高浓度AAE能显著上调CSN1S1基因表达量。相对于模型组,3 μg/mL AAE即能显著增加CSN2基因表达量,且与LPS诱导损伤BMECs中αs1-酪蛋白和β-酪蛋白含量变化趋势相近。本试验中,LPS诱导下调了乳蛋白合成信号通路相关基因表达量,与前人研究结果一致。与LPS诱导损伤的模型组相比,AAE能上调mTOR、S6K1、EIF4E、EIF4EBP1、JAK2和STAT5基因表达量,表明AAE可能通过提高mTOR及JAK2-STAT5信号通路基因表达来促进BMECs中乳蛋白合成。
4 结论① 10 μg/mL LPS可抑制BMECs活力和酪蛋白分泌,且能下调乳蛋白合成相关基因表达量。
② AAE可提高LPS诱导损伤BMECs活力。
③ AAE可提高LPS诱导损伤BMECs中总蛋白、β-酪蛋白和αs1-酪蛋白含量,以及BMECs中乳蛋白合成相关基因mTOR、S6K1、JAK2、STAT5、CSN1S1、CSN2、EIF4EBP1、EIF4E的基因表达量。
④ 12 μg/mL AAE对LPS诱导损伤BMECs中乳蛋白合成有较好的预保护效果。
| [1] |
杜琳, 王丽芳, 冯小慧, 等. 我国部分地区奶牛乳房炎主要病原菌的分离鉴定及药敏试验[J]. 动物医学进展, 2018, 39(3): 124-128. DU L, WANG L F, FENG X H, et al. Isolation, identification and drug sensitivity test of main pathogenic bacteria of cow mastitis in some areas of China[J]. Advances in Veterinary Medicine, 2018, 39(3): 124-128 (in Chinese). DOI:10.3969/j.issn.1007-5038.2018.03.026 |
| [2] |
宋洁, 胡耀, 敖长金, 等. 植物提取物对奶牛乳房炎的影响及作用机制[J]. 动物营养学报, 2020, 32(1): 1-6. SONG J, HU Y, AO C J, et al. Effect and mechanism of extracts on mastitis in dairy cows[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 1-6 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.001 |
| [3] |
胡耀, 宋洁, 王丽芳, 等. 蒿属植物活性成分对哺乳动物乳房炎的影响及作用机制[J]. 动物营养学报, 2021, 33(4): 1936-1943. HU Y, SONG J, WANG L F, et al. Effects of Artemisia plant active components on mammalian mastitis and its mechanism[J]. Chinese Journal of Animal Nutrition, 2021, 33(4): 1936-1943 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.04.014 |
| [4] |
马国强. 黑沙蒿及其多糖对绒山羊瘤胃发酵参数、营养物质消化、血液抗氧化与免疫指标的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2019. MA G Q. Effects of Artemisia ordosica and its polysaccharides on ruminal fermentation, nutrient digestibility, serum antioxidant and immune parameters of cashmere goats[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2019. (in Chinese) |
| [5] |
周金沙, 朱良, 李乐, 等. 褐苞蒿挥发油成分及其抗菌活性研究[J]. 食品与机械, 2014, 30(2): 152-155, 254. ZHOU J S, ZHU L, LI L, et al. Study on the essential oil components and antibacterial activity of Artemisia nucarpa[J]. Food & Machinery, 2014, 30(2): 152-155, 254 (in Chinese). |
| [6] |
PIRBALOUTI A G, FIROZNEZHAD M, CRAKER L, et al. Essential oil compositions, antibacterial and antioxidant activities of various populations of Artemisia chamaemelifolia at two phenological stages[J]. Revista Brasileira De Farmacognosia, 2013, 23(6): 861-869. DOI:10.1590/S0102-695X2013000600002 |
| [7] |
STOJANOVICI G S, ICKOVSKI J D, DORDEVIĆ M, et al. The first report on chemical composition and antimicrobial activity of Artemisia scoparia Waldst. et Kit. extracts[J]. Natural Product Communications, 2020, 15(3). DOI:10.1177/1934578X20915034 |
| [8] |
斯琴毕力格, 王丽芳, 丁赫, 等. 饲粮中添加黄花蒿乙醇提取物对奶牛产奶性能及乳脂中共轭亚油酸含量的影响[J]. 动物营养学报, 2017, 29(11): 4137-4142. SIQINBI L G, WANG L F, DING H, et al. Effects of dietary Artemisia annua ethanol extract on milk performance and milk fat conjugated linoleic acid content of dairy cows[J]. Chinese Journal of Animal Nutrition, 2017, 29(11): 4137-4142 (in Chinese). DOI:10.3969/j.issn.1006-267x.2017.11.037 |
| [9] |
王丽芳, 张兴夫. 黄花蒿醇提物对奶牛乳腺细胞中共轭亚油酸合成相关酶基因表达的作用[J]. 中国农业科学, 2019, 52(18): 3271-3278. WANG L F, ZHANG X F. Effects of alcohol extract of Artemisia annua L.on expression of enzymes related to conjugated linoleic acid synthesis in bovine mammary gland cells[J]. Scientia Agricultura Sinica, 2019, 52(18): 3271-3278 (in Chinese). DOI:10.3864/j.issn.0578-1752.2019.18.018 |
| [10] |
庞学燕, 季昀, 田青, 等. 亮氨酸对κ-酪蛋白合成的影响及相关信号通路的研究[J]. 中国畜牧杂志, 2013, 49(9): 38-41. PANG X Y, JI Y, TIAN Q, et al. Effects of leucine on κ-casein synthesis and related signaling pathways[J]. Chinese Journal of Animal Science, 2013, 49(9): 38-41 (in Chinese). DOI:10.3969/j.issn.0258-7033.2013.09.010 |
| [11] |
王梦芝. 精氨酸水平对体外培养奶牛乳腺上皮细胞酪蛋白表达的影响[D]. 博士学位论文. 北京: 中国农业科学院, 2014. WANG M Z. Effect of arginine level on casein expression of BMECs cultured in vitro[D]. Ph. D. Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese) |
| [12] |
GAO H N, ZHAO S G, ZHENG N, et al. Combination of histidine, lysine, methionine, and leucine promotes β-casein synthesis via the mechanistic target of rapamycin signaling pathway in bovine mammary epithelial cells[J]. Journal of Dairy Science, 2017, 100(9): 7696-7709. DOI:10.3168/jds.2015-10729 |
| [13] |
刘立新, 林叶, 张莉, 等. 脂多糖对奶牛乳腺上皮细胞毒性作用及乳蛋白合成的影响[J]. 东北农业大学学报, 2015, 46(6): 61-66. LIU L X, LIN Y, ZHANG L, et al. Effect of lipopolysaccharide on cytotoxicity and milk protein synthesis of bovine mammary epithelial cells[J]. Journal of Northeast Agricultural University, 2015, 46(6): 61-66 (in Chinese). DOI:10.3969/j.issn.1005-9369.2015.06.010 |
| [14] |
周鹏, 张玉梅, 刘彪, 等. 乳类食物中β-酪蛋白的结构及营养功能[J]. 中国食物与营养, 2020, 26(4): 52-56. ZHOU P, ZHANG Y M, LIU B, et al. The structure and nutritional function of β-casein in dairy food[J]. Food and Nutrition in China, 2020, 26(4): 52-56 (in Chinese). DOI:10.3969/j.issn.1006-9577.2020.04.012 |
| [15] |
占今舜, 詹康, 陈小连, 等. 苜蓿素对脂多糖诱导下奶牛乳腺上皮细胞炎症和乳蛋白合成相关基因表达的影响[J]. 草业科学, 2018, 35(2): 441-448. ZHAN J S, ZHAN K, CHEN X L, et al. Effects of alfalfa on the expression of genes related to milk protein synthesis in milk cow mammary epithelial cells induced by lipopolysaccharide[J]. Pratacultural Science, 2018, 35(2): 441-448 (in Chinese). |
| [16] |
丹妮. 粗饲料品质对奶牛乳脂脂肪酸组成的影响及其机理研究[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2018. DAN N. Effects of roughage quality on fatty acid composition in milk fat of dairy cows and its mechanism[D]. Ph. D. Thesis. Hohhot: Inner Mongolia Agricultural University, 2018. (in Chinese) |
| [17] |
石惠宇. 维生素A通过Nrf2/谷胱甘肽过氧化物酶1/NF-κB信号通路缓解奶牛乳腺上皮细胞氧化应激的机理研究[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2018. SHI H Y. Vitamin A alleviates oxidative stress of BMECs through the Nrf2/glutathione peroxidase 1/NF-κB signaling pathway[D]. Ph. D. Thesis. Hohhot: Inner Mongolia Agricultural University, 2018. (in Chinese) |
| [18] |
丹丹. LPS诱导奶牛乳腺上皮细胞凋亡的分子机制研究[D]. 硕士学位论文. 呼和浩特: 内蒙古大学, 2019. DAN D. Study on the molecular mechanism of apoptosis induced by LPS in bovine mammary epithelial cells[D]. Ph. D. Thesis. Hohhot: Inner Mongolia University, 2019. (in Chinese) |
| [19] |
毛智斌. 葎草总黄酮对乳腺上皮细胞相关炎症和泌乳基因表达的影响[D]. 硕士学位论文. 郑州: 河南农业大学, 2016. MAO Z B. Effects of Humulus scandens flavonoids on mammary epithelial-associated inflammation and lactation gene expression[D]. Master's Thesis. Zhengzhou: Henan Agricultural University, 2016. (in Chinese) |
| [20] |
冯峰, 马维武, 管翠萍, 等. 几种药物对脂多糖诱导奶牛乳腺上皮细胞(BMECs)分泌炎性因子的影响[J]. 中国兽医学报, 2018, 38(12): 2387-2391. FENG F, MA W W, GUAN C P, et al. Effects of lipopolysaccharide on the secretion of inflammatory cytokines in bovine mammary epithelial cells (BMECs)[J]. Chinese Journal of Veterinary Medicine, 2018, 38(12): 2387-2391 (in Chinese). |
| [21] |
郭世伟. 黄花蒿水提物对肉仔鸡生长性能及免疫和抗氧化功能的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2020. GUO S W. Effects of water extract of Artemisia annua L. on growth performance, immune and antioxidant functions of broilers[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2020. (in Chinese) |
| [22] |
SONG Z H, CHENG K, ZHANG L L, et al. Dietary supplementation of enzymatically treated Artemisia annua could alleviate the intestinal inflammatory response in heat-stressed broilers[J]. Journal of Thermal Biology, 2017, 69: 184-190. DOI:10.1016/j.jtherbio.2017.07.015 |
| [23] |
田青. 牛αS1-酪蛋白基因研究新进展[J]. 中国牛业科学, 2011, 37(5): 43-45. TIAN Q. Research progress of αS1-casein gene in bovine[J]. Chinese Journal of Cattle Science, 2011, 37(5): 43-45 (in Chinese). DOI:10.3969/j.issn.1001-9111.2011.05.014 |
| [24] |
王麟艳. 牛乳β-酪蛋白消化产物的制备及其功能性评价[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2018. WANG L Y. Preparation and functional evaluation of dairy β-casein digestion products[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2018. (in Chinese) |
| [25] |
宋洁, 王丽芳, 张腾龙, 等. 复合植物提取物对乳腺炎奶牛生产性能、乳品质和免疫机能的影响[J]. 动物营养学报, 2020, 32(12): 5724-5732. SONG J, WANG L F, ZHANG T L, et al. Effects of compound plant extract on performance, milk quality and immune function of dairy cows with mastitis[J]. Chinese Journal of Animal Nutrition, 2020, 32(12): 5724-5732 (in Chinese). |
| [26] |
QIAN X, ZHAO F Q. Interactions of the ubiquitous octamer-binding transcription factor-1 with both the signal transducer and activator of transcription 5 and the glucocorticoid receptor mediate prolactin and glucocorticoid-induced β-casein gene expression in mammary epithelial cells[J]. The International Journal of Biochemistry & Cell Biology, 2013, 45(3): 724-735. |
| [27] |
BIONAZ M, LOOR J J. Gene networks driving bovine mammary protein synthesis during the lactation cycle[J]. Bioinformatics and Biology Insights, 2011, 5: 83-98. |
| [28] |
YUAN X H, ZHANG L, CUI Y J, et al. NCOA5 is a master regulator of amino acid-induced mTOR activation and β-casein synthesis in bovine mammary epithelial cells[J]. Biochemical and Biophysical Research Communications, 2020, 529(3): 569-574. DOI:10.1016/j.bbrc.2020.05.193 |
| [29] |
SHIMOBAYASHI M, HALL M N. Making new contacts: the mTOR network in metabolism and signalling crosstalk[J]. Nature Reviews Molecular Cell Biology, 2014, 15(3): 155-162. DOI:10.1038/nrm3757 |
| [30] |
陈坤琳, 钱勇, 蒋临正, 等. SIRT7对奶牛乳腺上皮细胞乳蛋白、乳脂和乳糖合成关键基因表达的调控[J]. 南京农业大学学报, 2019, 42(5): 917-923. CHEN K L, QIAN Y, JIANG L Z, et al. SIRT7 regulates the expression of key genes in BMECs milk protein, milk fat and lactose synthesis[J]. Journal of Nanjing Agricultural University, 2019, 42(5): 917-923 (in Chinese). |
| [31] |
耿子健. LTA-SA对奶牛乳腺上皮细胞中乳蛋白合成及相关信号通路的影响[D]. 硕士学位论文. 大庆: 黑龙江八一农垦大学, 2020. GENG Z J. Effects of LTA-SA on milk protein synthesis and related signaling pathways in bovine mammary epithelial cells[D]. Master's Thesis. Daqing: Heilongjiang Bayi Agricultural University, 2020. (in Chinese) |
| [32] |
李大彪, 李红磊, 邢媛媛, 等. 亚油酸对奶牛乳腺上皮细胞乳脂肪和乳蛋白合成相关基因表达的影响[J]. 中国细胞生物学学报, 2016, 38(3): 257-264. LI D B, LI H L, XING Y Y, et al. Effects of linoleic acid on the expression of genes related to milk fat and milk protein synthesis of BMECs[J]. Chinese Journal of Cell Biology, 2016, 38(3): 257-264 (in Chinese). |
| [33] |
苏芮, 刘阳, 闫素梅, 等. 维生素A对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响[J]. 动物营养学报, 2018, 30(8): 3151-3158. SU R, LIU Y, YAN S M, et al. Effects of vitamin A on the expression of BMECs in milk fat and milk protein synthesis[J]. Chinese Journal of Animal Nutrition, 2018, 30(8): 3151-3158 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.08.033 |
| [34] |
DAI W T, WHITE R R, LIU J X, et al. Seryl-tRNA synthetase-mediated essential amino acids regulate β-casein synthesis via cell proliferation and mammalian target of rapamycin (mTOR) signaling pathway in bovine mammary epithelial cells[J]. Journal of Dairy Science, 2018, 101(11): 10456-10468. DOI:10.3168/jds.2018-14568 |
| [35] |
钟婉琪. 油茶籽油对奶牛乳腺上皮细胞中乳脂和乳蛋白合成相关基因表达的影响研究[D]. 硕士学位论文. 长春: 吉林大学, 2019. ZHONG W Q. The effect of Camellia oleifera oil on the expression of genes related to milk fat and milk protein synthesis in bovine mammary epithelial cells[D]. Master's Thesis. Changchun: Jilin University, 2019. (in Chinese) |




