2. 河南省动物疫病与公共卫生重点实验室, 洛阳 471000;
3. 河南省肉羊繁育工程技术研究中心, 洛阳 471000
2. Key Laboratory of Animal Disease and Public Health of Henan Province, Luoyang 471000, China;
3. Research Center of Breeding Engineering Technology for Meat Sheep of Henan Province, Luoyang 471000, China
霉菌毒素种类繁多,已发现报道的有300多种,玉米赤霉烯酮(zearalenone,ZEN)作为其中污染范围最广、毒性作用最大的霉菌毒素之一,已成为当下研究和监管的重点[1]。ZEN广泛存在于各类谷物饲料中,并且能够在食物链中积累,对人和动物健康造成巨大危害。ZEN具有类雌激素作用,与机体内源性雌激素雌二醇具有相似的化学结构,可以与雌激素竞争性结合雌激素受体,表现出一定的生殖毒性,引发人和动物机体的生殖系统障碍,例如高雌激素综合征、假孕、流产以及子宫萎缩等[2-4]。此外ZEN的细胞毒性、免疫毒性以及致癌性也被广泛证实并报道[5-8]。近几年,我国的ZEN污染状况十分严重。Shao等[9]利用液相色谱-串联质谱(LC-MS/MS)技术对我国商用干犬食品中的霉菌毒素进行了检测,其中ZEN的污染率在87.5%以上。在黑龙江、广西与重庆等地各类原料和饲料样品中常见霉菌毒素含量的检测统计中发现,ZEN的超标率较往年呈明显上升趋势,其中在玉米副产品及宠物饲粮中ZEN的检出率均达到100%[10]。由ZEN污染造成的动物生长缓慢、产品品质不良等已经成为饲料和食品安全中一个重大的农业和医疗问题,解决ZEN污染迫在眉睫。
目前,清除ZEN的方法主要包括物理、化学和微生物降解法。物理降解法主要是利用吸附、辐射和高温等原理对ZEN进行处理,化学降解法主要是通过碱处理和氧化处理来降解ZEN毒素[11-12]。以上2种方法虽然都可以去除样品中一定水平的ZEN毒素,但往往存在耗费成本高、二次污染、改变饲料营养成分和感官质量等弊端。生物降解法因其反应条件温和、降解效率高以及降解产物安全无毒等优点,成为当下人们研究的热点。金博文等[13]以环戊酮作为唯一碳源,从动物粪便中筛选了具有高效ZEN降解能力的多食鞘氨醇杆菌(Sphingobacterium multivorum),该菌株能在48 h内降解培养基中83%的ZEN。此外,酵母菌属、链霉菌属以及红球菌属的一些菌株均被证实具有ZEN降解能力[14-16]。目前,人们研究的热点更多地集中于益生菌对ZEN的降解。大量研究表明,益生类芽孢杆菌种属微生物具有高效的ZEN解毒能力,当它们作为生物添加剂用于动物生产中时,能够提升动物的生长效率,改善动物产品品质[17]。Wang等[18]筛选了1株能在24 h内将培养基中的ZEN(10 μg/mL)完全降解的蜡样芽胞杆菌(Bacillus cereus),并且该菌株可以显著缓解ZEN中毒引起的小鼠生殖系统障碍和肝脏毒性,增加肠道中乳酸菌的丰富度,维护小鼠肠道菌群健康;Wang等[19]从土壤样品中分离出1株贝莱斯芽孢杆菌(Bacillus velezensis),37 ℃培养3 d后,能够将7.45 μg/mL的ZEN完全降解,此外该菌株对小鼠的肾脏损伤有一定的缓解作用;Wang等[20]从鸡大肠内容物中分离了1株赖氨酸芽孢杆菌(Bacillus lysine),该菌株可在短时间内将培养基中的ZEN(32 μg/mL)完全还原为无毒的次级代谢产物。
本试验从霉菌毒素污染严重的养殖场中采集了青贮饲料、发霉玉米、发酵玉米浆、土壤和动物粪便等样品,以ZEN为唯一碳源,以降解率为指标筛选样品中能有效降解ZEN的微生物,初步研究毒素降解机制,并优化菌株降解条件,评价菌株安全性,期望为生物降解ZEN提供良好的选择。
1 材料与方法 1.1 试验动物及材料试验动物为8周龄BALB/c小鼠,体重为27~30 g,购自河南科技大学试验牧场。样品包括青贮饲料、发酵玉米浆、发霉玉米、羊粪便和土壤,均采自洛阳市周边养殖场。
1.2 主要试剂ZEN标准品,甲醇(分析纯),TIANGEN细菌基因组提取试剂盒,TIANGEN超薄琼脂糖凝胶DNA胶回收试剂盒,ZEN酶联免疫吸附试验(ELISA)检测试剂盒(北京华安麦科生物技术有限公司)。
1.3 培养基初筛培养基:KH2PO4 1.52 g,Na2HPO4 2.44 g,(NH4)2SO4 0.5 g,MgSO4·7H2O 0.2 g,CaCl2 0.05 g,pH调至7.0,蒸馏水1 L,121 ℃灭菌30 min。
LB液体培养基:胰蛋白胨1 g,酵母提取物0.5 g,氯化钠1 g,蒸馏水100 mL,pH调至7.0,121 ℃灭菌30 min。
LB固体培养基:在上述LB液体培养基配方基础上加入琼脂粉2 g,pH调至7.0,121 ℃灭菌30 min。
1.4 仪器与设备LDZX-50KBS型立式压力蒸汽灭菌锅,Genesy 96T型PCR扩增仪,湘仪H1650-W高速离心机,DNP-9272BS型电热恒温培养箱,SULUN SKY-2102型恒温培养摇床,Thermo Muultiskan-FC型酶标仪,AOE UV1200型紫外可见分光光度计,BOXUN HHS-21-4型电热恒温水浴锅,Tanon凝胶成像系统。
1.5 菌株筛选 1.5.1 ZEN降解菌株的初筛对采集的样品进行编号,分别称取5 g处理后的样品加入到含有100 mL无菌生理盐水的锥形瓶中,于37 ℃、180 r/min恒温摇床中振荡富集4 h。取稀释液1 mL加入到含有ZEN(2 μg/mL)的4 mL液体初筛培养基中,于37 ℃、180 r/min恒温摇床中振荡培养3 d,每个处理做3个重复,以此方法连续转接5次。培养结束将上述处理各取1 mL培养液进行梯度稀释涂布于LB固体培养基中,于37 ℃恒温培养箱中培养16 h,挑取单菌落划线接种于LB固体培养基上,以此方法纯化3次,纯化后的菌株于4 ℃保存。
1.5.2 ZEN降解菌株的复筛将初筛得到的菌株在LB固体培养基中进行活化,挑取单菌落接种于4 mL LB液体培养基中,于37 ℃、180 r/min恒温摇床中振荡培养16 h。取40 μL培养液接种于含有ZEN(10 μg/mL)的4 mL LB液体培养基中,以不接菌的含有ZEN(10 μg/mL)的LB液体培养基为空白对照,于37 ℃、180 r/min恒温摇床中振荡培养48 h。根据玉米赤霉烯酮ELISA检测试剂盒说明书,对菌株培养液进行处理,用酶标仪检测培养液中ZEN的残留量,计算菌株降解效率。

|
将筛选的ZEN降解菌划线接种于LB固体培养基上,于37 ℃恒温培养箱中静置培养24 h,观察菌落形态,挑取单菌落,对菌体进行革兰氏染色,光学显微镜下观察细菌形态。
1.6.2 菌株16S rRNA鉴定按照细菌基因组提取试剂盒说明书,提取细菌基因组,利用细菌通用引物27F:(5′-AGAGTTTGATCMTGGCTCAG-3′)和1429R(5′-TACGGYTACCTTGTTACGACTT-3′),扩增菌株的16S rRNA片段。PCR反应体系(25 μL)为:dNTP mixture 2 μL,10×PCR buffer 2.5 μL,27F、1429R各1 μL,模板1 μL,Tks GflexTM DNA Polymerase 0.5 μL,加双蒸水至25 μL。PCR扩增程序为:95 ℃ 5 min→95 ℃ 30 s,56 ℃ 45 s,72 ℃ 90 s,35个循环→72 ℃ 10 min→4 ℃保存。1%琼脂糖凝胶电泳检测PCR扩增产物,用TIANGEN超薄琼脂糖凝胶DNA胶回收试剂盒回收纯化目的片段,送至生工生物工程(上海)股份有限公司测序。测序结果在NCBI中进行BLAST对比,用MEGA 7.0软件构建系统发育树,分析序列同源性。
1.7 菌株对ZEN吸附降解情况研究将活化后的ZEN降解菌接种于LB液体培养基中,37 ℃、180 r/min过夜培养,培养后的菌液等体积分成2份。其中一份置于4 ℃冰箱中保存待用,另一份在高压蒸汽灭菌锅中121 ℃灭菌处理20 min。将上述各组菌液于6 000 r/min条件下离心10 min,弃掉上清,用无菌磷酸盐缓冲液(PBS)清洗菌体沉淀2次,再用含有ZEN(10 μg/mL)的等量无菌PBS重新悬浮菌体,以含有ZEN(10 μg/mL)的等量无菌PBS为空白对照,于37 ℃、180 r/min恒温摇床中振荡培养48 h,每个样品设置3个重复。培养结束后,取5 mL培养液于12 000 r/min条件下离心10 min,保留上清待用,甲醇浸提菌体沉淀30 min,用ELISA检测试剂盒分别检测上清和沉淀中ZEN含量。
1.8 菌株降解ZEN的活性成分定位将ZEN降解菌接种于LB液体培养基中过夜培养,菌株培养液于4 ℃、6 000 r/min条件下离心20 min,上清液过0.22 μm水系滤膜,4 ℃保存备用。菌体沉淀用无菌PBS清洗2次,再用无菌PBS重悬沉淀,利用手持超声细胞破碎仪破碎菌体,4 ℃、12 000 r/min离心15 min,上清液过0.22 μm水系滤膜,获得细胞内容物。经上述处理后,向无细胞上清液和细胞内容物中加入一定量的ZEN(10 μg/mL),以含有相同浓度ZEN(10 μg/mL)的无菌PBS作为空白对照,于37 ℃、180 r/min恒温摇床中振荡培养48 h,用ELISA检测试剂盒检测各组中ZEN的残留量。
在上述试验基础上,将发挥主要降解作用的部分做如下处理:1)加蛋白酶K(65 ℃,水浴2 h);2)加蛋白酶K和1%十二烷基硫酸钠(SDS)(65 ℃,水浴2 h);3)热处理(100 ℃水浴2 h)。将上述各组与ZEN(10 μg/mL)共培养,每个样品做3个重复,于37 ℃、180 r/min恒温摇床中振荡培养48 h,ELISA试剂盒检测各组中ZEN残留量。
1.9 培养条件对菌株ZEN降解效率的影响研究不同培养条件对菌株ZEN降解效率的影响,分别设置如下培养条件:接种量(2%、4%、6%、8%、10%);温度(22、27、32、37、42 ℃);初始pH(4.0、5.0、6.0、7.0、8.0、9.0、10.0);培养时间(0、2、4、6、8、10、12、14、16 h)。每个样品设置3个重复,ELISA试剂盒检测ZEN含量变化。
1.10 动物试验将60只雌性BALB/c小鼠进行分笼饲养,保持室温22~25 ℃,相对湿度45%~60%条件下适应7 d,昼夜明暗交替。将小鼠随机分为6组,每组10只,对6组小鼠进行不同处理,试验分组见表 1。每天按表中分组处理方式定时灌胃,连续灌胃15 d。第15天灌胃结束后,小鼠禁食12 h。第16天对小鼠进行处理,通过眼球采血法收集小鼠血液,4 ℃、5 000 r/min条件下离心10 min,收集血清保存于-20 ℃。断颈处死所有小鼠,解剖收集小鼠脏器,包括肝脏、肾脏、胸腺、脾脏和子宫卵巢,称重。计算脏器指数:
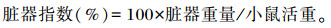
|
|
|
表 1 试验分组 Table 1 Groups of experiment |
保存的血清用于小鼠血液生化指标的检测,包括血清谷丙转氨酶(GPT)、谷草转氨酶(GOT)活性及总蛋白(TP)和尿酸(UA)含量等,检测方法参照各指标对应的试剂盒说明书。
1.11 数据处理试验数据用“平均值±标准误”形式表示,采用SPSS 17.0软件进行单因素方差分析,P < 0.05表示差异显著。部分数据使用Origin 2019软件进行处理与图形绘制。
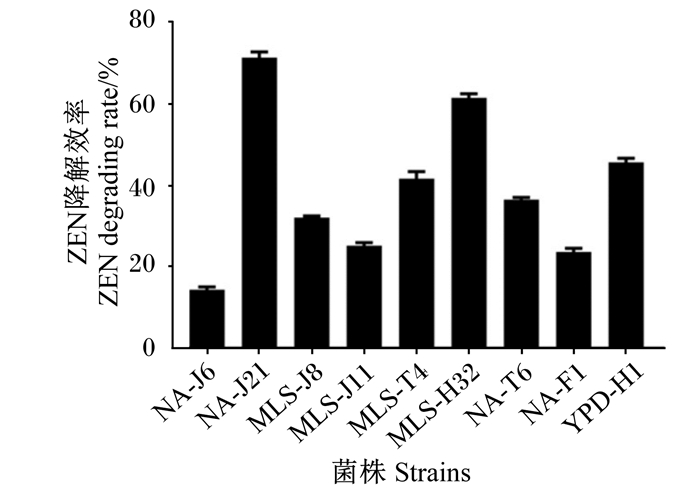
2 结果与分析 2.1 玉米赤霉烯酮降解菌株的筛选从采集的饲料、土壤和动物粪便等样品中分离得到了156株菌株用于ZEN降解菌的初筛。以含有ZEN(2 μg/mL)的初筛培养基对156株菌株进行分离培养,得到生长稳定、状况良好的菌株9株,其中1株来源于土壤样品编号为MRS-T6,2株来源于粪便样品编号分别为YPD-F1和YPD-F4,2株来源于青贮饲料编号分别为MLS-H1和MLS-H32,4株来源于发酵玉米浆样品编号分别为NA-J6、NA-J21、MLS-J8、MLS-J11。将初筛得到的9个菌株与含有ZEN(10 μg/mL)的培养基共培养48 h后,检测菌株ZEN降解效率,由图 1可知,菌株NA-J21和菌株MLS-H32的ZEN降解效率相对较高,分别为71.3%和61.5%,因此选取这2株菌进一步研究。
|
图 1 不同菌株ZEN降解效率 Fig. 1 ZEN degradation rate of different strains |
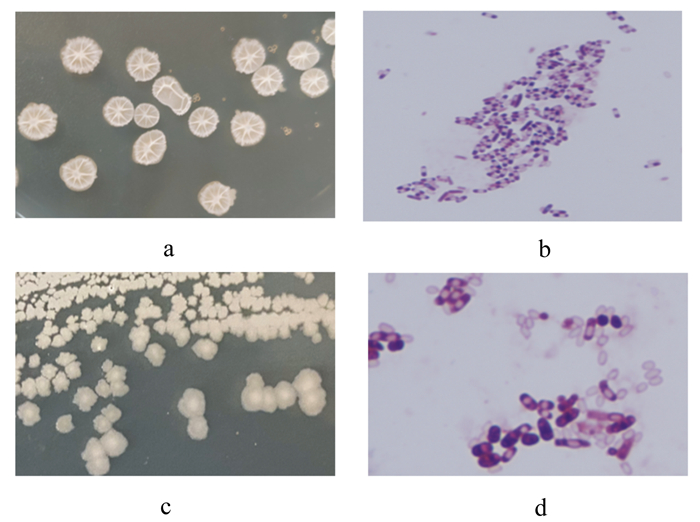
由图 2可知,菌株NA-J21菌落为圆形,边缘不规则,有隆起,呈乳白色,光学显微镜下革兰染色阳性,菌体呈短杆状,有芽孢;菌株MLS-H32菌落呈锯齿状,表面粗糙不透明,边缘不整齐,呈乳白色,干燥皱褶,光学显微镜下革兰氏染色阳性,菌体呈杆状,有芽孢。
|
图 2 菌株NA-J21和MLS-H32菌落形态(a、c)及革兰氏染色(b、d) Fig. 2 Colony morphology(a, c)and Gram stain(b, d)of NA-J21 and MLS-H32 strains(1 000×) |
PCR扩增菌株基因序列,琼脂糖凝胶电泳检测结果可见清晰目的条带,2株菌的基因序列长度均约为1 450 bp。将测序结果在NCBI中经BLAST对比,利用MEGA 7.0软件构建系统发育树,结果如图 3所示,菌株NA-J21与解淀粉芽孢杆菌的16S rRNA序列相似度达到99%以上,因此鉴定为解淀粉芽孢杆菌;菌株MLS-H32与枯草芽孢杆菌的16S rRNA序列的相似性最高,达到99%以上,因此鉴定为枯草芽孢杆菌。

|
Bacillus megaterium:巨大芽孢杆菌;Serratia marcescens:粘质沙雷氏菌;Bacillus safensis:安全芽孢杆菌;Bacillus subtilis:枯草芽孢杆菌;Bacillus amyloliquefaciens:解淀粉芽孢杆菌;strain:菌株。 图 3 基于16S rRNA序列的菌株NA-J21和MLS-H32系统发育树 Fig. 3 Phylogenetic tree of NA-J21 and MLS-H32 strains based on 16S rRNA |
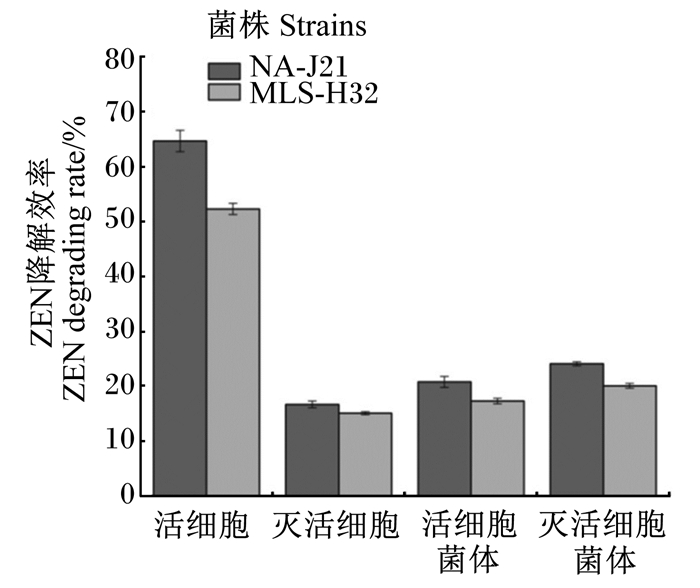
由图 4可知,菌株NA-J21和MLS-H32活细胞反应体系的ZEN降解效率均明显高于灭活细胞体系,说明菌株NA-J21与MLS-H32对ZEN的解毒能力主要是由于菌株的降解作用,同时细菌细胞壁对ZEN有一定吸附作用。此外,灭活细胞菌体对ZEN的清除率均高于活细胞菌体,分析原因可能是由于加热过程中,热处理使菌体细胞壁的肽聚糖和多聚糖的肽键或者糖苷键断裂,细胞壁的肽聚糖结构变薄、孔径增大,导致菌体的ZEN吸附效率增加。
|
活细胞:viable cell;灭活细胞:inactivated cell;活细胞菌体:viable cell bacteria;灭活细胞菌体:inactivated cell bacteria。 图 4 菌株发酵液不同组分对ZEN降解效率的影响 Fig. 4 Effects of different components of strains fermentation broth on ZEN degradation rate |
进一步研究菌株不同活性成分的ZEN降解情况,由图 5可知,菌株NA-J21和MLS-H32无细胞上清液对ZEN降解效率均明显高于细胞内容物,说明2种微生物发挥ZEN降解能力的活性物质主要存在于胞外。对菌株无细胞上清液进行不同处理,37 ℃培养48 h后,菌株NA-J21和MLS-H32无细胞上清液的ZEN降解效率分别为68.2%和60.3%;经蛋白酶K处理后,菌株ZEN降解效率有明显下降;加蛋白酶K和SDS共同处理后,菌株ZEN降解效率分别下降至5.5%和2.6%;100 ℃水浴2 h处理后,菌株降解效率有明显降低。以上结果说明,2株菌发挥主要ZEN降解作用的胞外活性物质是细胞分泌的胞外酶。此外,菌株NA-J21可能对高温具有一定的耐受性。
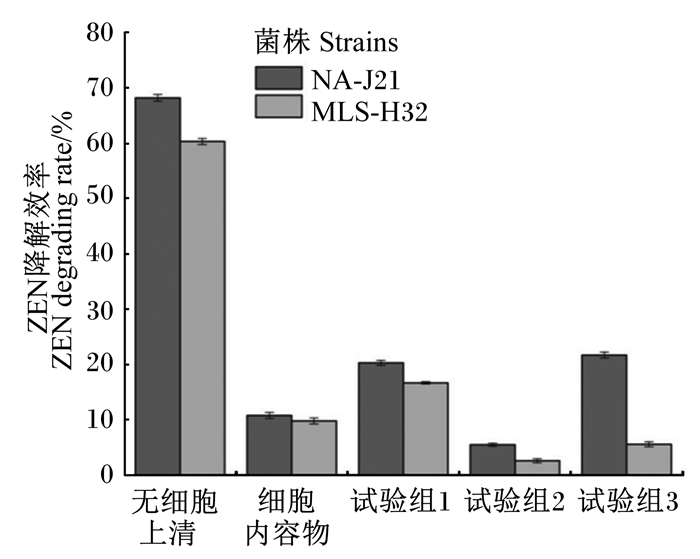
|
无细胞上清:acellular supernatant;细胞内容物:cellular contents。 试验组1:加蛋白酶K处理;试验组2:加蛋白酶K和SDS共同处理;试验组3:100 ℃水浴2 h。 Experimental group 1:treatment with proteinase K; Experimental group 2:treatment with proteinase K and SDS; Experimental group 3:100 ℃ water bath 2 h. 图 5 菌株无细胞上清液、细胞内容物和发酵液不同处理对ZEN降解效率的影响 Fig. 5 Effects of strain acellular supernatant, cellular contents and different treatments of fermentation broth on ZEN degradation rate |
由图 6可知,37 ℃培养48 h,接种量在1.0%~2.0%时,菌株NA-J21的ZEN降解效率随着接种量增加逐渐增大,最大达到71.7%,接种量大于2.0%时,ZEN降解效率有所降低。当菌株接种量在1.0%~2.5%时,菌株MLS-H32的ZEN降解效率与接种量呈正相关,降解效率最大达到62.1%,之后随着接种量增大,降解效率有所下降。当菌株达到最佳接种量后,随着接种量增大,细菌无法充分利用培养基中的能量来满足自身生长,导致菌株ZEN降解效率有所降低。因此,菌株NA-J21和MLS-H32最佳接种量分别为2.0%和2.5%。
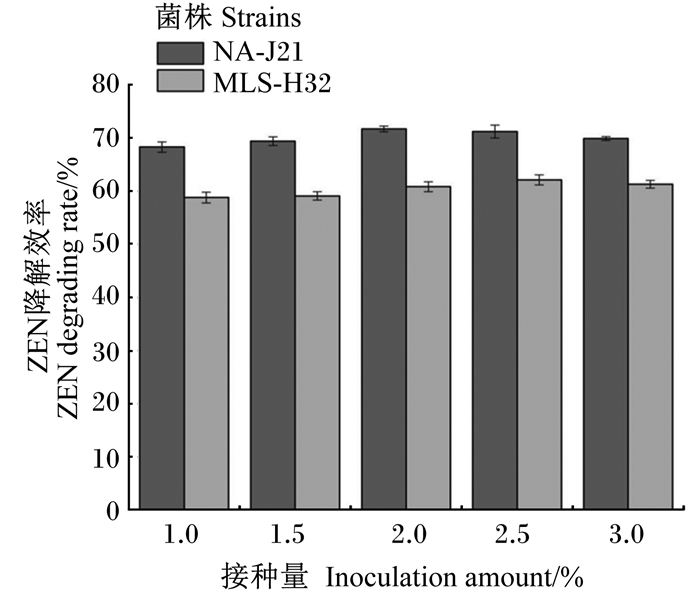
|
图 6 接种量对ZEN降解效率的影响 Fig. 6 Effects of inoculation amount on ZEN degradation rate |
由图 7可知,在最佳接种量下,37 ℃培养48 h,培养基不同初始pH对菌株的ZEN降解效率影响较大。在pH为4.0~7.0,随着pH的增大,菌株降解效率随之增大。当pH为7.0时,菌株NA-J21和MLS-H32对的ZEN降解效率达到最大,其中菌株NA-J21为69.1%,菌株MLS-H32为61.2%,pH大于7.0时,菌株降解效率也有所下降。因此,培养基初始pH为7.0时,菌株NA-J21和MLS-H32能够发挥最大ZEN降解效率。
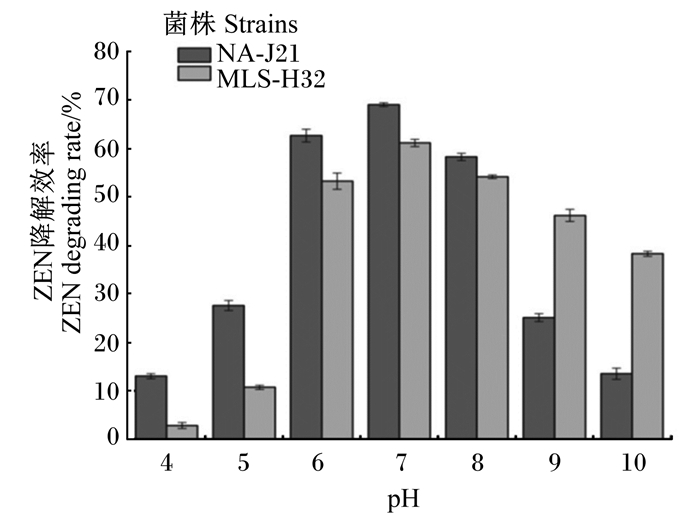
|
图 7 pH对ZEN降解效率的影响 Fig. 7 Effects of pH on ZEN degradation rate |
由图 8可知,在最佳接种量和初始pH 7.0条件下培养48 h,温度对于菌株ZEN降解效率的影响较大。菌株NA-J21在37 ℃培养条件,能够发挥最大ZEN降解效率,为71.6%;
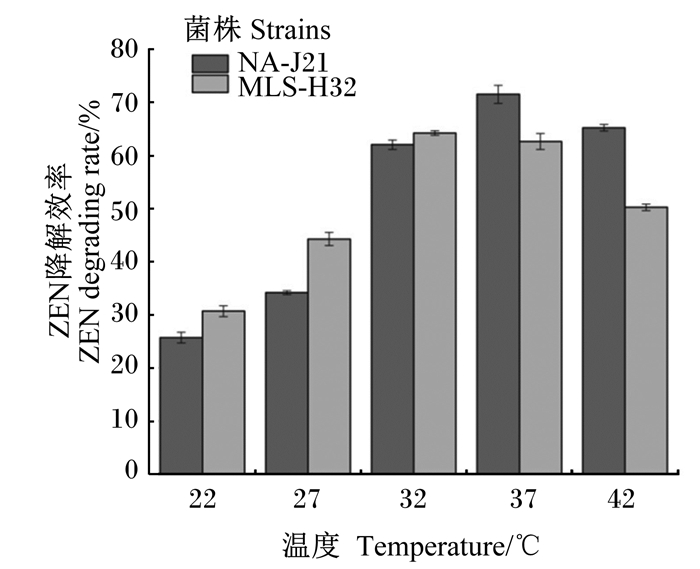
|
图 8 温度对ZEN降解效率的影响 Fig. 8 Effects of temperature on ZEN degradation rate |
菌株MLS-H32在32 ℃的培养条件下能够发挥最大降解效率,为62.7%;随着最适培养温度的改变,菌株的ZEN降解效率有所下降,分析原因可能是由于不同培养温度一定程度上抑制了细菌的生长,使得细菌产酶能力下降,降解ZEN的酶活性降低。
2.4.4 培养时间与菌株ZEN降解效率的关系设置培养基初始pH为7.0,由图 9可知,37 ℃条件下,随着培养时间增长,菌株NA-J21活菌数逐渐增大,ZEN降解效率随之升高,在12 h时达到71.5%,12 h之后趋于稳定,此时菌株NA-J21活菌数为7.6×109 CFU/mL;32 ℃条件下,随着培养时间增长,菌株MLS-H32活菌数逐渐增大,ZEN降解效率随之升高,在14 h时达到62.5%,14 h之后趋于稳定,此时菌株MLS-H32活菌数为9.2×109 CFU/mL。
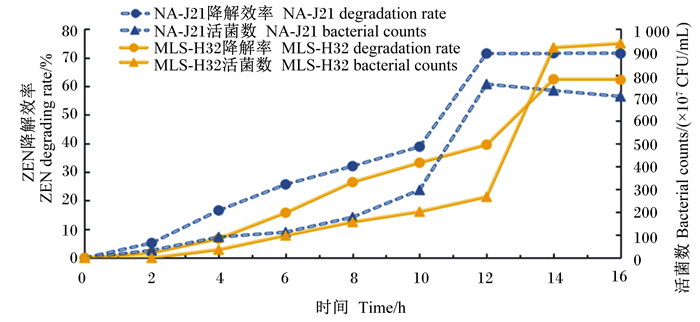
|
图 9 培养时间对ZEN降解效率的影响 Fig. 9 Effects of culture time on ZEN degradation rate |
由表 2可知,菌株NA-J21和MLS-H32培养液灌胃小鼠15 d后,对照组和试验组相比,各脏器指数无显著差异(P>0.05),表明菌株NA-J21和MLS-H32不会对小鼠脏器造成损伤。试验组与对照组相比,肝脏、肾脏和子宫卵巢指数显著增大(P < 0.05),脾脏和胸腺指数显著下降(P < 0.05),小鼠主要表现胸腺萎缩和子宫肿大,表明ZEN能够对小鼠脏器造成一定的损伤。对小鼠同时灌胃ZEN和ZEN降解菌,结果发现与ZEN灌胃组相比,小鼠的肝脏、肾脏和子宫卵巢指数均显著降低(P < 0.05),脾脏和胸腺指数均显著增大(P < 0.05)。结果表明菌株NA-J21和MLS-H32能够缓解ZEN引起的小鼠脏器损伤,具有一定安全性。
|
|
表 2 菌株NA-J21和MLS-H32对小鼠脏器指数的影响 Table 2 Effects of NA-J21 and MLS-H32 strains on organ indexes in mince |
由表 3可知,与对照组相比,试验组小鼠血清GPT、GOT活性及尿素(Urea)、UA含量显著增加(P < 0.05),TP和白蛋白(ALB)含量显著下降(P < 0.05),表明ZEN处理对小鼠的肝脏、肾脏等功能造成了一定损伤。与对照组相比,试验组1和3之间差异不显著(P>0.05)。此外,同时灌胃ZEN和ZEN降解菌的试验组2、4与试验组1、3之间显示出较小的差异。以上结果表明,菌株NA-J21和MLS-H32能够缓解ZEN引起的小鼠血清生化指标变化,对小鼠受到的ZEN损伤起到一定的保护作用。
|
|
表 3 菌株NA-J21和MLS-H32对小鼠血清生化指标的影响 Table 3 Effects of NA-J21 and MLS-H32 strains on serum biochemical indexes in mice |
ZEN广泛存在于各种饲料原料中,主要由镰刀菌属菌株产生,是动物饲用产品中毒性作用最大的霉菌毒素之一,能够引起动物机体的生殖机能障碍和免疫系统损伤等临床症状,使得动物生产效率低下、品质不良,对畜牧业造成了巨大经济损失。近年来,微生物降解ZEN受到广泛关注,其中多种益生类芽孢杆菌被证实具有高效的ZEN降解能力。Hsu等[21]研究了1株地衣芽孢杆菌(Bacillus licheniformis)CK1菌株的ZEN降解能力,发现该菌株在高温和酸性条件下对ZEN均能保持65%以上的降解效率,对常见致病菌有一定的抑制效果,并且具有良好的耐酸和耐胆盐等益生菌活性。本试验以ZEN为唯一碳源,从ZEN污染严重的发霉饲料以及发酵玉米浆中分离筛选了2株ZEN降解菌,分别为解淀粉芽孢杆菌和枯草芽孢杆菌,37 ℃培养48 h后,菌株对培养基中ZEN的清除率分别达到71.3%和61.5%。
利用解淀粉芽孢杆菌和枯草芽孢杆菌降解ZEN的研究已有报道,Lee等[22]研究的解淀粉芽孢杆菌LN菌株能在36 h内降解培养基中92%的ZEN,安全性评价结果证实该菌株不产肠毒素,同时具有耐酸、耐胆盐和抑制病原菌生长等益生菌活性,是作为饲料添加剂降解饲料中ZEN的良好选择;张晨曦等[23]从粮食样品中获得1株解淀粉芽孢杆菌NS2菌株,能在72 h内降解96.0%的ZEN(5 μg/mL),同时可以产生具有抗菌作用的次级代谢产物,抑制大肠杆菌、鼠伤寒沙门菌(Salmonella typhimurium)等常见致病菌的生长,具有良好的抑菌性;魏单平等[24]从兔粪便中筛选了1株解淀粉芽孢杆菌H6菌株,该菌株在72 h内能够降解95.6%的ZEN(1 μg/mL);Ju等[25]研究的枯草芽孢杆菌培养48 h后,对ZEN降解效率达到87%。本试验中筛选的菌株ZEN降解效率稍低于上述芽孢杆菌,可能是由于菌种间的差异造成的,另外培养条件不同也会影响菌株的产酶能力,从而使菌株的降解能力表现出一定差异。
本试验通过对菌株不同活性部位降解ZEN的研究,初步探明了菌株的ZEN降解机制包括酶降解和细胞壁吸附2种,其中酶降解发挥主要降解作用,为提取细胞胞外酶,制作添加剂用于实际生产中提供了一定理论基础。动物试验表明菌株NA-J21和MLS-H32不会对小鼠机体造成危害,对于ZEN中毒引起的小鼠脏器损伤具有一定治疗作用。益生菌作为饲料生物添加剂应用于畜牧生产中,在降解霉菌毒素的同时还能够达到改善动物生长水平,维护动物机体健康的目的[26-27]。芽孢杆菌因其来源广泛、易于生存和筛选、有ZEN降解能力的菌株种类繁多、益生效果好、降解效率普遍较高等优点,受到了越来越多的关注。Hanif等[28]从解淀粉芽孢杆菌FZB42中提取得到了一种脂肽化合物泛革素,该物质可以改变细胞膜结构和通透性,破坏真菌细胞壁,影响细胞器作用,抑制DNA的合成,从而有效限制ZEN毒素的产出。此外,枯草芽孢杆菌也常作为感受态细胞用于基因克隆中,对ZEN降解酶的重组质粒进行表达。Azam等[29]将2种ZEN降解酶构建成重组融合酶,该重组酶具有双重霉菌毒素降解能力,为微生物酶降解在实际生产中的应用提供了另一种选择。解淀粉芽孢杆菌和枯草芽孢杆菌都是经认定的安全益生菌[30],能够分泌多种蛋白质和抗生素,具有良好的霉菌毒素降解能力和抑菌效果。它们还可以通过改善动物肠道健康,提升机体对饲料中营养物质的吸收率,从而提高动物生长水平,在降解ZEN毒素酶制剂的开发和应用方面具有良好的前景。
4 结论通过以ZEN为唯一碳源的分离筛选,得到了2株能有效降解ZEN的菌株NA-J21和MLS-H32,经鉴定分别为解淀粉芽孢杆菌和枯草芽孢杆菌。菌株NA-J21和MLS-H32主要通过分泌胞外酶发挥降解作用,对ZEN的降解效率分别为71.3%和61.5%。菌株NA-J21降解ZEN的最适条件为:接种量2.0%,初始pH 7.0,温度37 ℃,培养时间为12 h;菌株MLS-H32的最佳ZEN降解条件为:接种量2.5%,初始pH 7.0,温度32 ℃,培养时间为14 h。菌株NA-J21和MLS-H32对于ZEN引起的小鼠脏器损伤具有一定的保护作用。
| [1] |
BENNETT J W, KLICH M. Mycotoxins[J]. Clinical Microbiology Reviews, 2003, 16(3): 497-516. DOI:10.1128/CMR.16.3.497-516.2003 |
| [2] |
LIU M, ZHU D D, GUO T, et al. Toxicity of zearalenone on the intestines of pregnant sows and their offspring and alleviation with modified halloysite nanotubes[J]. Journal of the Science of Food and Agriculture, 2018, 98(2): 698-706. DOI:10.1002/jsfa.8517 |
| [3] |
RAI A, DAS M, TRIPATHI A. Occurrence and toxicity of a fusarium mycotoxin, zearale none[J]. Critical Reviews in Food Science and Nutrition, 2020, 60(16): 2710-2729. DOI:10.1080/10408398.2019.1655388 |
| [4] |
YANG D C, JIANG X W, SUN J X, et al. Toxic effects of zearalenone on gametogenesis and embryonic development: a molecular point of review[J]. Food and Chemical Toxicology, 2018, 119: 24-30. DOI:10.1016/j.fct.2018.06.003 |
| [5] |
周建川, 史东辉, 计成. 玉米赤霉烯酮和脱氧雪腐镰刀菌烯醇对动物毒性的研究进展[J]. 动物营养学报, 2020, 32(6): 2460-2466. ZHOU J C, SHI D H, JI C. Research progress on toxicity of zearalenone and deoxynivalenol in animals[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2460-2466 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.06.003 |
| [6] |
CAI G D, SI M X, LI X, et al. Zearalenone induces apoptosis of rat Sertoli cells through Fas-Fas ligand and mitochondrial pathway[J]. Environmental Toxicology, 2019, 34(4): 424-433. DOI:10.1002/tox.22696 |
| [7] |
TAN S J, GE W, WANG J J, et al. Zearalenone-induced aberration in the composition of the gut microbiome and function impacts the ovary reserve[J]. Chemosphere, 2020, 244: 125493. DOI:10.1016/j.chemosphere.2019.125493 |
| [8] |
CAI G D, SUN K, WANG T, et al. Mechanism and effects of zearalenone on mouse T lymphocytes activation in vitro[J]. Ecotoxicology and Environmental Safety, 2018, 162: 208-217. DOI:10.1016/j.ecoenv.2018.06.055 |
| [9] |
SHAO M Y, LI L, GU Z L, et al. Mycotoxins in commercial dry pet food in China[J]. Food Additives & Contaminants, 2018, 11(4): 237-245. |
| [10] |
龚阿琼, 邓娟娟, 郑豆豆, 等. 2018年上半年原料及饲料毒素检测分析[J]. 中国饲料, 2018(17): 90-92. GONG A Q, DENG J J, ZHENG D D, et al. Detection and analysis of toxins in raw materials and feed in the first half of 2018[J]. China Feed, 2018(17): 90-92 (in Chinese). |
| [11] |
XU Y, WANG Y F, JI J, et al. Chemical and toxicological alterations of zearalenone under ozone treatment[J]. Food Additives & Contaminants, 2019, 36(1): 163-174. |
| [12] |
EL-NEKEETY A A, EL-KADY A A, ABDEL-WAHHAB K G, et al. Reduction of individual or combined toxicity of fumonisin B1 and zearalenone viadietary inclusion of org ano-modified nano-montmorillonite in rats[J]. Environmental Science and Pollution Resea rch International, 2017, 24(25): 20770-20783. DOI:10.1007/s11356-017-9721-y |
| [13] |
金博文, 徐长春, 李根, 等. 玉米赤霉烯酮降解菌的分离、鉴定及其适宜降解条件的研究[J]. 中国畜牧兽医, 2020, 47(9): 2808-2815. JIN B W, XU C C, LI G, et al. Isolation, identification and its suitable degradation conditions of a zearalenone degrading bacteria[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(9): 2808-2815 (in Chinese). |
| [14] |
RISA A, KRIFATON C, KUKOLYA J, et al. Aflatoxin B1 and zearalenone detoxifying profile of Rhodococcus type strains[J]. Current Microbiology, 2018, 75(7): 907-917. DOI:10.1007/s00284-018-1465-5 |
| [15] |
ZHANG H Y, DONG M, YANG Q Y, et al. Biodegradation of zearalenone by Sacchar omyces cerevisiae: possible involvement of ZEN responsive proteins of the yeast[J]. Journal of Proteomics, 2016, 143: 416-423. DOI:10.1016/j.jprot.2016.04.017 |
| [16] |
SUN X L, HE X X, XUE K S, et al. Biological detoxification of zearalenone by Aspergillus niger strain FS10[J]. Food and Chemical Toxicology, 2014, 72: 76-82. |
| [17] |
CHEN S W, WANG H T, SHIH W Y, et al. Application of zearalenone (ZEN)-detoxifying Bacillus in animal feed decontamination through fermentation[J]. Toxins, 2019, 11(6): 330. |
| [18] |
WANG Y, ZHANG J, WANG Y L, et al. Isolation and characterization of the Bacillus cereus BC7 strain, which is capable of zearalenone removal and intestinal flora modulation in mice[J]. Toxicon, 2018, 155: 9-20. DOI:10.1016/j.toxicon.2018.09.005 |
| [19] |
WANG N, LI P, WANG M Y, et al. The protective role of Bacillus velezensis A2 on the biochemical and hepatic toxicity of zearalenone in mice[J]. Toxins, 2018, 10(11): 449. DOI:10.3390/toxins10110449 |
| [20] |
WANG J Q, YANG F, YANG P L, et al. Microbial reduction of zearalenone by a new isolat ed Lysinibacillus.sp.ZJ-2016-1[J]. World Mycotoxin Journal, 2018, 11(4): 571-578. DOI:10.3920/WMJ2017.2264 |
| [21] |
HSU T C, YI P J, LEE T Y, et al. Probiotic characteristics and zearalenone removal ability of a Bacillus licheniformis strain[J]. PLoS One, 2018, 13(4): e0194866. DOI:10.1371/journal.pone.0194866 |
| [22] |
LEE A, CHENG K C, LIU J R. Isolation and characterization of a Bacillus amyloliquefacie ns strain with zearalenone removal ability and its probiotic pote ntial[J]. PLoS One, 2017, 12(8): e0182220. |
| [23] |
张晨曦, YAWA M E F, 赵月菊, 等. 解淀粉芽孢杆菌NS2降解玉米赤霉烯酮的研究[J]. 核农学报, 2020, 34(7): 1507-1517. ZHANG C X, YAWA M E F, ZHAO Y J, et al. Degradation effects of Bacillus amyloliquefaciens NS2 on zearalenone[J]. Journal of Nuclear Agricultural Sciences, 2020, 34(7): 1507-1517. |
| [24] |
魏单平, 刘玉洁, 孙向丽, 等. 玉米赤霉烯酮降解菌的筛选及其活性检测[J]. 畜牧兽医学报, 2017, 48(4): 761-768. WEI C P, LIU Y J, SUN X L, et al. Screening and activity detection of a bacterial strain degrading zearalenone[J]. Acta Veterinaria Et Zootechnica Sinica, 2017, 48(4): 761-768 (in Chinese). |
| [25] |
JU J, TINYIRO S E, YAO W R, et al. The ability of Bacillus subtilis and Bacillus natto to degrade zearalenone and its application in food[J]. Journal of Food Processing and Preservation, 2019, 43(10): 14122. |
| [26] |
LIU C Q, CHANG J, WANG P, et al. Zearalenone biodegradation by the combination of probiotics with cell-free extracts of Aspergillus oryzae and its mycotoxin-alleviating effect on pig production performance[J]. Toxins, 2019, 11(10): 552. |
| [27] |
CHANG J, WANG T, WANG P, et al. Compound probiotics alleviating aflatoxin B1 and zearalenone toxic effects on broiler production performance and gut microbiota[J]. Ecotoxicology and Environmental Safety, 2020, 194: 110420. |
| [28] |
HANIF A, ZHANG F, LI P P, et al. Fengycin produced by Bacillus amyloliquefaciens FZB42 inhibits Fusarium graminearum growth and mycotoxins biosynthesis[J]. Toxins, 2019, 11(5): 295. |
| [29] |
AZAM M S, YU D Z, LIU N, et al. Degrading ochratoxin a and zearalenone mycotoxins using a multifunctional recombinant enzyme[J]. Toxins, 2019, 11(5): 301. |
| [30] |
FEEDAP, BAMPIDIS V, AZIMONTI G, et al. Safety and efficacy of Bacillus subtilis DSM 28343 for pigs for fattening[J]. EFSA Journal, 2019, 17(6): e05725. |




