2. 乐山市市中区农业农村局, 乐山 614000;
3. 四川德康农牧食品集团股份有限公司, 成都 610200;
4. 西南大学动物医学院, 重庆 400700
2. Agricultural and Rural Bureau of Shizhong District, Leshan City, Leshan 614000, China;
3. Sichuan Dekang Agriculture and Animal Husbandry Food Group Co., Ltd., Chengdu 610200, China;
4. College of Veterinary Medicine, Southwest University, Chongqing 400700, China
新生仔猪由于免疫系统不成熟,很容易受到感染。饲喂新生仔猪益生菌可以对仔猪肠道菌群发育及其免疫系统产生短期或长期的影响,从而引起仔猪生长和免疫性能的改变。新生仔猪的肠道菌群最初是由母猪和周围环境建立。肠道菌群对动物的免疫性能非常重要,而益生菌作为饲料添加剂不仅可以促进宿主肠道微生物的平衡[1],还可以通过占据肠道微生物的结合位点或通过释放有机酸或产生抗生素样化合物来抵抗有害菌群的定植[2]。饲喂母猪益生菌可以提高母猪产仔数、体重以及降低腹泻率[3]。Hayakawa等[4]研究发现,饲喂母猪和仔猪益生菌可以提高母猪繁殖性能,降低断奶后仔猪腹泻发生率和改善肠道组织病理变化。动物饲粮中常常添加乳酸菌作为益生菌来提高动物生产水平。研究表明,植物乳杆菌(Lactobacillus plantarum)能显著抑制大肠杆菌和沙门氏菌生长,促进断奶仔猪小肠绒毛发育,改善肠道形态,提高断奶仔猪平均日增重和饲料转化率[5]。乳酸菌还能影响机体的免疫性能,机体抗氧化能力及免疫性能与功能性的德氏乳杆菌(Lactobacillus delbrueckii)、唾液乳杆菌(Lactobacillus salivarius)、Lactobacillus formicilis、罗伊氏乳杆菌(Lactobacillus reuteri)和黏膜乳杆菌(Lactobacillus mucosae)呈正相关,而与敏捷乳杆菌(Lactobacillus agilis)和庞氏乳杆菌(Lactobacillus pontis)呈负相关,添加乳酸菌复合物可以优化仔猪肠道菌群组成,减轻断奶应激,提高生长性能[6]。然而,关于鼠李糖乳杆菌(Lactobacillus rhamnosus)作为益生菌添加到早期断奶仔猪饲粮中的报道还非常少。因此,本研究旨在研究饲粮中添加鼠李糖乳杆菌对早期断奶成华黑仔猪生长性能、免疫性能和肠道菌群的影响。
1 材料与方法 1.1 试验菌株、动物和试验设计本研究使用的鼠李糖乳杆菌为商品化益生菌,活菌数为5×1011 CFU/g。仔猪(成华黑猪,本地品种)来自四川省成都市邛崃市嘉林生态农场。试验选用32头体重为(7.54±0.19) kg的28日龄断奶成华黑仔猪,随机分为2组,每组4个重复,每个重复4头仔猪。对照组饲喂基础饲粮,其组成及营养水平见表 1;鼠李糖乳杆菌组在基础饲粮中添加5.56 mg/kg鼠李糖乳杆菌,使每千克饲粮活菌数达到2.78×109 CFU。仔猪饲养在完全封闭的猪圈内,自由采食。根据猪场的日常操作,正常进行免疫、驱虫、消毒和管理等程序。试验预试期7 d,正试期28 d。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
在试验开始和结束时对仔猪进行称重,整个试验期间记录采食量,计算平均日增重、平均日采食量和肉料比。
1.2.2 免疫性能指标试验结束时,采用前腔静脉采血法用真空管收集对照组和鼠李糖乳杆菌组所有仔猪血液10 mL,3 000 r/min离心15 min,收集上清液并储存在-80 ℃冰箱中。血清生化指标:血清总蛋白(TP)、总胆固醇(TC)、甘油三酯(TG)和葡萄糖(GLU)含量采用购自南京建成生物工程研究所的试剂盒测定。血清抗氧化指标:血清超氧化物歧化酶(SOD)活性和总抗氧化能力(T-AOC)采用购自北京奇松生物科技有限公司的试剂盒测定,过氧化氢酶(CAT)活性采用购自南京建成生物工程研究所的试剂盒测定。血清免疫指标:血清肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)、补体3(C3)、干扰素-γ(IFN-γ)和免疫球蛋白G(IgG)含量采用购自北京奇松生物科技有限公司的试剂盒测定。测定方法严格按照试剂盒说明书进行。
1.2.3 盲肠内容物样品采集试验结束时,每个重复任意选取2头仔猪,注射戊巴比妥钠(40 mg/kg BW)麻醉后处死。用75%酒精擦拭所需肠道后结扎盲肠,将盲肠内容物挤入5 mL无菌EP管中,封口后立即放入液氮中。盲肠内容物样品小心转移至实验室在-80 ℃冰箱中保存,用于后续肠道菌群分析。
1.2.4 肠道菌群16S rDNA基因的高通量测序仔猪盲肠内容物样品送到上海融享生物科技有限公司进行微生物多样性分析。提取仔猪盲肠内容物总DNA后,用V3~V4引物扩增16S rDNA保守区域,并对产物进行纯化、定量和均一化形成测序文库。建好的文库先进行文库质检,质检合格的文库用Illumina HiSeq 2500进行测序,利用双末端测序法,构建小片段库。通过对reads拼接过滤,操作分类单元(operational taxonomic unit, OTU)聚类,并进行物种注释及丰度分析,揭示样品的物种构成。序列之间的相似性高于97%定义为1个OTU,每个OTU对应1种代表序列。将具有代表性的OTU序列与微生物参考数据库进行比较,得到每个OTU对应的物种分类信息以及从门到属水平各样品的群落组成情况[7]。
1.3 数据统计分析采用Student’s t检验进行组间数据差异显著性分析,结果用“平均值±标准差”表示,P>0.05为差异不显著,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析 2.1 鼠李糖乳杆菌对早期断奶成华黑仔猪生长性能的影响由表 2可知,与对照组相比,鼠李糖乳杆菌组早期断奶成华黑仔猪末重和平均日采食量无显著差异(P>0.05),平均日增重和肉料比显著提高(P<0.05)。结果表明,饲粮添加鼠李糖乳杆菌能够提高早期断奶成华黑仔猪的生长性能。
|
|
表 2 鼠李糖乳杆菌对早期断奶成华黑仔猪生长性能的影响 Table 2 Effects of Lactobacillus rhamnosus on growth performance of early weaned Chenghua black piglets |
由表 3可知,在血清生化指标中,与对照组相比,鼠李糖乳杆菌组早期断奶成华黑仔猪血清TP含量极显著提高(P<0.01),其他血清生化指标无显著差异(P>0.05);在血清抗氧化指标中,与对照组相比,鼠李糖乳杆菌组血清CAT和SOD活性极显著提高(P<0.01),血清T-AOC显著提高(P<0.05);在血清免疫指标中,与对照组相比,鼠李糖乳杆菌组血清TNF-α和IgG含量极显著提高(P<0.01),血清IL-2和C3含量显著提高(P<0.05),血清IFN-γ含量无显著差异(P>0.05)。
|
|
表 3 鼠李糖乳杆菌对早期断奶仔猪成华黑仔猪免疫性能的影响 Table 3 Effects of Lactobacillus rhamnosus on immune performance of early weaned Chenghua black piglets |
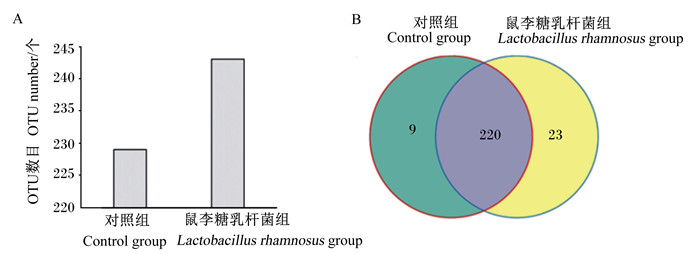
为了评估鼠李糖乳杆菌对早期断奶成华黑仔猪肠道菌群的影响,采集对照组和鼠李糖乳杆菌组63日龄仔猪盲肠内容物进行测序分析,共获得151 919对reads,经过滤后得到119 293 clean tags;每组样品至少产生26 663 clean tags,平均获得29 823 clean tags。对照组和鼠李糖乳杆菌组断奶仔猪盲肠内容物微生物16S rDNA保守片段平均片段长度分别为467.0和465.5 bp。早期断奶成华黑仔猪盲肠内容物菌群OTU数目分布情况见图 1。由图可知,对照组和鼠李糖乳杆菌组分别包含229和243个OTU,其中共同OTU数目为220个,对照组特有OTU数目为9个,鼠李糖乳杆菌组特有OTU数目为23个。
|
图 1 早期断奶成华黑仔猪盲肠内容物菌群OTU数目分布情况 Fig. 1 Distribution of OTU number in cecal contents of early weaned Chenghua black piglets |
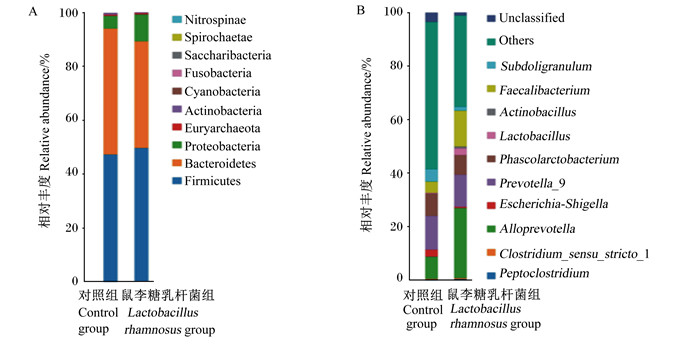
早期断奶成华黑仔猪盲肠内容物菌群物种分布见图 2。由图可知,从门水平上分析,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)3大类细菌为对照组和鼠李糖乳杆菌组断奶仔猪盲肠内容物菌群的优势菌门,且厚壁菌门和拟杆菌门占比最多,变形菌门次之。具体而言,对照组盲肠内容物厚壁菌门、拟杆菌门和变形菌门的相对丰度分别为45.43%、49.10%和4.47 %,鼠李糖乳杆菌组盲肠内容物厚壁菌门、拟杆菌门和变形菌门的相对丰度分别为45.16%、43.09%和10.47%。由表 4可知,从属水平上分析,对照组盲肠内容物乳杆菌属(Lactobacillus)、Alloprevotella、普雷沃氏菌属9(Prevotella_9)和埃希氏菌-志贺氏菌属(Escherichia-Shigella)的相对丰度分别为0.18%、6.25%、32.05%和2.11%,而鼠李糖乳杆菌组盲肠内容物相应菌属的相对丰度分别为3.96%、23.71%、14.57%和0.61%,其中鼠李糖乳杆菌组盲肠内容物乳杆菌属和Alloprevotella相对丰度较对照组分别增加了3.78和17.46个百分点,即细菌相对数量分别提高了21.00倍和2.79倍,而普雷沃氏菌属9和大肠杆菌-志贺氏菌属相对丰度较对照组分别降低了54.54%和70.62%。
|
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Proteobacteria:变形菌门:Euryarchaeota:广古菌门;Actinobacteria:放线菌门;Cyanobacteria:蓝藻菌门;Fusobacteria:梭杆菌门;Saccharibacteria:单糖菌门;Spirochaetae:螺旋菌门;Nitrospinae:硝棘菌门;Peptoclostridium:梭菌属;Clostridium_sensu_stricto_1:狭义梭菌属1:Escherichia-Shigella:埃希氏菌-志贺氏菌属;Prevotella_9:普雷沃氏菌属9;Phascolarctobacterium:考拉杆菌属;Lactobacillus:乳杆菌属;Actinobacillus:放线杆菌属;Faecalibacterium:粪杆菌属;Others:其他;Unclassified:未分类。 图 2 早期断奶成华黑仔猪盲肠内容物菌群物种分布柱状图 Fig. 2 Histogram of species distribution in cecal content flora of early weaned Chenghua black piglets |
|
|
表 4 早期断奶成华黑仔猪盲肠内容物菌群属水平差异细菌的相对丰度 Table 4 Relative abundance of differential bacteria at genus level in cecal contents of early weaned Chenghua black piglets |
鼠李糖乳杆菌是一种耐胃酸、耐胆汁并能有效定植在人体和动物肠道的乳酸菌属益生菌,因此被应用于人和动物生长发育、肠胃调理和腹泻病的预防等方面。在畜牧业中,鼠李糖乳杆菌能够改善鸡的生长性能和肉品质[8],还能影响健康猪只粪便微生物的组成和功能[9]。在本研究中,饲粮添加鼠李糖乳杆菌显著提高早期断奶成华黑仔猪平均日增重和肉料比,说明鼠李糖乳杆菌可以提高断奶仔猪生长性能,这与Bocourt等[10]研究发现鼠李糖乳杆菌能够提高仔猪平均日增重的结果一致。同时,本试验中,饲粮添加鼠李糖乳杆菌显著提高断奶仔猪血清TP、TNF-α、IL-2、C3和IgG含量、CAT和SOD活性以及T-AOC,说明鼠李糖乳杆菌可以提高断奶仔猪的免疫性能。血清TP含量反映了动物机体的营养状态和蛋白质利用率,TP含量的升高暗示了蛋白质吸收能力增加。血清CAT、SOD活性和T-AOC是血清抗氧化能力的重要指标,其在机体的内脏组织器官中发挥着重要的抗氧化功能,可以清除机体内多余的自由基。有研究报道,益生菌枯草芽孢杆菌(Bacillus subtilis)可以提高机体抗氧化酶的活性[11],提高动物免疫能力。动物的氧化应激易引发消化道疾病,导致动物生长发育缓慢、生产性能低下、饲料转化率降低以及抵抗疾病的能力下降等[12],而本研究中,上述抗氧化指标的增强说明饲喂了添加鼠李糖乳杆菌饲粮的仔猪具有更强的抗氧化能力,更能抵御机体内的有害物质。TNF-α是肿瘤坏死因子的一种类型,由活化的单核巨噬细胞产生,其作用是刺激T和B淋巴细胞协同作用,降低机体炎症反应,杀死机体的肿瘤细胞[13]。本研究中,鼠李糖乳杆菌组断奶仔猪血清TNF-α含量显著提高,这与Gastillo等[14]研究发现新生仔猪口服乳酸菌能够上调TNF-α分泌的结果一致,说明鼠李糖乳杆菌能够调控仔猪黏膜抗炎细胞因子基因的表达。IL-2由活化的T淋巴细胞产生,可以促进T淋巴细胞分泌细胞因子等,增强机体免疫能力[15]。IgG是血清中主要的抗体成分,补体是存在于人或动物体液中的一组与免疫有关且具有酶活性的球蛋白,C3是补体系统中含量最多、最重要的一个组分,是补体激活的经典途径、旁路途径以及甘露聚糖结合凝集素途径三者的交汇点,有着重要的生物学功能,如抗病毒、杀菌以及免疫调节作用[16],本研究发现,鼠李糖乳杆菌组断奶仔猪血清IgG和C3含量显著提高,说明鼠李糖乳杆菌能够有效提高仔猪机体免疫性能,对机体抵抗外来病菌的侵袭有很好的防御作用。这可能是由于鼠李糖乳杆菌作为抗原进入动物体内,刺激肠道,通过抗原递呈给T淋巴细胞,诱导IL-2释放,分泌大量IgG来介导体液免疫,使动物获得免疫保护力。
3.2 鼠李糖乳杆菌对早期断奶成华黑仔猪肠道菌群的影响在本研究中,厚壁菌门、拟杆菌门和变形菌门为对照组和鼠李糖乳杆菌组早期断奶成华黑仔猪盲肠内容物菌群的优势菌门。然而,在属水平上,2组的菌群构成发生了变化,特别是乳杆菌属、Alloprovotella、普雷沃氏菌属9和埃希氏菌-志贺氏菌属,其中,与对照组相比,鼠李糖乳杆菌组盲肠内容物乳杆菌属相对丰度明显提高。近几年,乳杆菌属被公认为是对人类和动物机体有益的常用益生菌。断奶仔猪盲肠内容乳杆菌属相对丰度提高可能是由于饲粮中添加鼠李糖乳杆菌后,增加了其在肠道菌群中的比例。普雷沃氏菌属9属于拟杆菌门中非常重要的菌属,研究发现,随着仔猪日龄增加,肠道中普雷沃氏菌属9的相对丰度会逐渐降低[17]。本研究中,鼠李糖乳杆菌组盲肠内容物普雷沃氏菌属9相对丰度较对照组有所降低,可能是由于鼠李糖乳杆菌促进了同龄仔猪的肠道发育。Alloprevotella亦属于拟杆菌门,可以产生短链脂肪酸,而短链脂肪酸在胃肠道中具有调控脂肪储备的作用[18],本研究中,鼠李糖乳杆菌组断奶仔猪生长性能的提高也可能受到了Alloprevotella相对丰度提高的间接调控。变形杆菌门包含了很多肠道致病菌,如埃希氏菌-志贺氏菌属能够引起腹泻。与对照组比较,鼠李糖乳杆菌组盲肠内容物埃希氏菌-志贺氏菌属相对丰度明显降低,可能是由于鼠李糖杆抑制了致病微生物的生长。另外,鼠李糖乳杆菌组盲肠内容乳杆菌属相对丰度的提高也可能会抢占肠道菌群的空间,降低pH,从而让乳杆菌属更易生长,而埃希氏菌-志贺氏菌属更难生存。有文献也证实了有些乳杆菌属益生菌具有抑制肠道致病菌的能力,如鼠李糖乳杆菌DR20和乳酸双歧杆菌(Bifidobacterium lactis)DR10对产毒素大肠杆菌(Escherichia coli)有拮抗作用[19];Lactobacillus frumenti能够提高肠道中有益微生物[Lactobacillus frumenti、格氏乳杆菌(Lactobacillus gasseri)和碲糖酵母(Kazachstania telluris)]的相对丰度,同时降低致病菌脱硫脱硫弧菌(Desulfovibrio desulfuricans)和腐殖假丝酵母(Candida humilis)的相对丰度[20]。这可能是由于鼠李糖乳杆菌能够稳定黏附在猪肠上皮细胞上[16],并抑制肠道内埃希氏菌-志贺氏菌属等病原菌的黏附;也可能是由于添加鼠李糖乳杆菌导致仔猪肠道内乳杆菌属和Alloprevotella相对丰度提高,埃希氏菌-志贺氏菌属相对丰度降低,从而间接影响到猪的生长和免疫性能。
4 结论综上所述,饲粮添加鼠李糖乳杆菌能够提高早期断奶成华黑仔猪平均日增重和肉料比,提高血清抗氧化能力和机体免疫性能,提高盲肠内容物乳杆菌属和Alloprevotella相对丰度,降低盲肠内容物埃希氏菌-志贺氏菌属相对丰度,改善肠道菌群结构,促进肠道健康,从而提高其生长性能和免疫性能。
| [1] |
FULLER R. Probiotics in man and animals[J]. Journal of Applied Bacteriology, 1989, 66(5): 365-378. DOI:10.1111/j.1365-2672.1989.tb05105.x |
| [2] |
VONDRUSKOVA H, SLAMOVA R, TRCKOVA M, et al. Alternatives to antibiotic growth promoters in prevention of diarrhoea in weaned piglets: a review[J]. Veterinární Medicína, 2010, 55(5): 199-224. |
| [3] |
TARAS D, VAHJEN W, MACHA M, et al. Response of performance characteristics and fecal consistency to long-lasting dietary supplementation with the probiotic strain Bacillus cereus var. Toyoi to sows and piglets[J]. Archives of Animal Nutrition, 2005, 59(6): 405-417. DOI:10.1080/17450390500353168 |
| [4] |
HAYAKAWA T, MASUDA T, KUROSAWA D, et al. Dietary administration of probiotics to sows and/or their neonates improves the reproductive performance, incidence of post-weaning diarrhea and histopathological parameters in the intestine of weaned piglets[J]. Animal Science Journal, 2016, 87(12): 1501-1510. DOI:10.1111/asj.12565 |
| [5] |
SUO C, YIN Y S, WANG X N, et al. Effects of Lactobacillus plantarum ZJ316 on pig growth and pork quality[J]. BMC Veterinary Research, 2012, 8: 89. DOI:10.1186/1746-6148-8-89 |
| [6] |
YANG J J, WANG C L, HUANG K H, et al. Compound Lactobacillus sp. administration ameliorates stress and body growth through gut microbiota optimization on weaning piglets[J]. Applied Microbiology and Biotechnology, 2020, 104(15): 6749-6765. DOI:10.1007/s00253-020-10727-4 |
| [7] |
CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [8] |
CHEN F, GAO S S, ZHU L Q, et al. Effects of dietary Lactobacillus rhamnosus CF supplementation on growth, meat quality, and microenvironment in specific pathogen-free chickens[J]. Poultry Science, 2018, 97(1): 118-123. DOI:10.3382/ps/pex261 |
| [9] |
SOLANO-AGUILAR G I, LAKSHMAN S, JANG S, et al. The effect of feeding cocoa powder and Lactobacillus rhamnosus on the composition and function of pig intestinal microbiome[J]. Current Developments in Nutrition, 2018, 2(5): nzy011. DOI:10.1093/cdn/nzy011 |
| [10] |
BOCOURT R, SAVON L, DÍAZ J, et al. Effect of the probiotic activity of Lactobacillus rhamnosus on productive and health indicators of piglets[J]. Cuban Journal of Agricultural Science, 2004, 38(1): 75-79. |
| [11] |
TANG Y, HAN L, CHEN X X, et al. Dietary supplementation of probiotic Bacillus subtilis affects antioxidant defenses and immune response in grass carp under Aeromonas hydrophila challenge[J]. Probiotics Antimicrob Proteins, 2019, 11(2): 545-558. DOI:10.1007/s12602-018-9409-8 |
| [12] |
LYKKESFELDT J, SVENDSEN O. Oxidants and antioxidants in disease: oxidative stress in farm animals[J]. The Veterinary Journal, 2007, 173(3): 502-511. DOI:10.1016/j.tvjl.2006.06.005 |
| [13] |
李涛, 陈正望. TNF-α在肿瘤中的作用[J]. 现代生物医学进展, 2011, 11(18): 3586-3588. LI T, CHEN Z W. The role of TNF-α in cancer[J]. Progress in Modern Biomedicine, 2011, 11(18): 3586-3588 (in Chinese). |
| [14] |
GASTILLO N A, PERDIGÓN G, DE MORENO DE LEBLANC A. Oral administration of a probiotic Lactobacillus modulates cytokine production and TLR expression improving the immune response against Salmonella enterica serovar Typhimurium infection in mice[J]. BMC Microbiology, 2011, 11: 177. DOI:10.1186/1471-2180-11-177 |
| [15] |
徐麒麟, 吴永胜, 朱佳文, 等. 蚯蚓提取物对成华猪生长性能、血清生化指标、抗氧化能力及免疫功能的影响[J]. 中国饲料, 2019(13): 42-46. XU Q L, WU Y S, ZHU J W, et al. Effects of earthworm extract on growth performance, serum biochemical index, antioxidant capacity and immune function of Chenghua pigs[J]. China Feed, 2019(13): 42-46 (in Chinese). |
| [16] |
崔志文. 鼠李糖乳杆菌影响仔猪肠道屏障功能的研究[D]. 博士学位论文. 杭州: 浙江大学, 2013. CUI Z W. Effects of Lactobacillus rhamnosus on intestinal barrier in piglets[D]. Ph. D. Thesis. Hangzhou: Zhejiang University, 2013. (in Chinese) |
| [17] |
BOREWICZ K A, KIM H B, SINGER R S, et al. Changes in the porcine intestinal microbiome in response to infection with Salmonella enterica and Lawsonia intracellularis[J]. PLoS One, 2015, 10(10): e0139106. DOI:10.1371/journal.pone.0139106 |
| [18] |
KONG C, GAO R Y, YAN X B, et al. Probiotics improve gut microbiota dysbiosis in obese mice fed a high-fat or high-sucrose diet[J]. Nutrition, 2019, 60: 175-184. DOI:10.1016/j.nut.2018.10.002 |
| [19] |
GOPAL P K, PRASAD J, SMART J, et al. In vitro adherence properties of Lactobacillus rhamnosus DR20 and Bifidobacterium lactis DR10 strains and their antagonistic activity against an enterotoxigenic Escherichia coli[J]. International Journal of Food Microbiology, 2001, 67(3): 207-216. DOI:10.1016/S0168-1605(01)00440-8 |
| [20] |
HU J, CHEN L L, ZHENG W Y, et al. Lactobacillus frumenti facilitates intestinal epithelial barrier function maintenance in early-weaned piglets[J]. Frontiers in Microbiology, 2018, 9: 897. DOI:10.3389/fmicb.2018.00897 |




