2. 浙江丰宇海洋生物制品有限公司, 舟山 316000;
3. 浙江一星实业股份有限公司, 海盐 314300
2. Zhejiang Fengyu Marine Organism Products Co., Ltd., Zhoushan 316000, China;
3. Zhejiang Star Industrial Limited by Share Ltd., Haiyan 314300, China
我国水产养殖体量庞大,在亚洲和太平洋地区生产的水产品占全世界总量的89%,其中我国就占67%。然而近年来,饲料产量逐年增加,而鱼粉产量则基本不变,导致鱼粉供给不足的矛盾日益突出。如何替代或减少饲料中鱼粉的使用量是现代水产动物营养与饲料研究的重要内容,而如何采用现代生物技术提高海洋生物原料在水产动物饲料中的生物学效价也是水产饲料技术发展的重要方向。
以鱼粉、虾粉生产过程中的压榨液(溶浆)为原料,通过酶解技术,得到干物质含量在50%左右的酶解鱼、虾溶浆等产品,经过酶解的鱼、虾溶浆液中含有更多的游离氨基酸[牛磺酸(Tau)]、小肽等生理营养因子,更利于鱼体肠道的吸收和利用,且谷氨酸(Glu)、丙氨酸(Ala)、亮氨酸(Leu)和牛磺酸等呈味氨基酸含量的增加也可以加强饲料的诱食效果[1]。此外有研究表明,8%~9%的酶解鱼溶浆产品(90%干物质计)与28%~30%的超级蒸汽鱼粉在黄颡鱼饲料中具有等效关系,可以完全替代饲料中的鱼粉,且黄颡鱼表现出更好的生长性能[2]。此外,酶解还可以降低高温对蛋白质和油脂的不利影响,减少挥发性盐基氮(TVBN)、生物胺、肌胃糜烂素和油脂氧化等不利因素对鱼体的毒害作用[3]。在饲料生产过程中,酶解的浆状产品在添加方式上有一定的局限性,而酶解的粉状产品则可以与其他粉状饲料原料一样使用。
本文以黄颡鱼为试验对象,在黄颡鱼饲料中添加酶解鱼溶浆粉(hydrolysate stickwater meal,SHM)、超微酶解鱼溶浆粉(total hydrolysate stickwater meal with superfine grinding,TSHM)和酶解虾溶浆粉(hydrolysate shrimp paste meal,SPM)完全替代30.0%的秘鲁超级蒸汽鱼粉,添加酶解鱿鱼内脏溶浆粉(hydrolysate squid viscera meal,HSVM)替代3.0%的秘鲁超级蒸汽鱼粉,经过池塘网箱养殖试验,研究了SHM、TSHM、SPM和HSVM替代鱼粉对黄颡鱼生长性能、鱼体生理健康的影响,探讨这些酶解溶浆粉替代鱼粉的可行性,并对作用机制进行探讨,为海洋生物蛋白质原料的深度开发及其在鱼类饲料中的应用提供研究基础和应用技术。
1 材料与方法 1.1 试验原料本试验所用的鱼粉为秘鲁超级蒸汽鱼粉,其原料鱼主要为秘鲁鳀鱼(Peruvian anchovy)。SHM、TSHM、SPM和HSVM均由浙江某生物制品有限公司提供,其生产工艺为:以日本鳀(Engraulis japonicus)、太平洋磷虾(Euphausia pacifica)全虾、鱿鱼(Loligo chinensis)内脏为原料,在蒸煮机中经90~100 ℃蒸煮40 min,双螺杆压榨机(孔径1 mm)压滤得到压榨饼(经过烘干得到鱼粉、虾粉、鱿鱼内脏粉)和压榨液;压榨液经三相卧式离心机(转速3 500 r/min)脱去油脂后得到液体(称为溶浆),液体经过减压浓缩得到干物质含量约30%的溶浆;溶浆转入酶解反应釜,在50~55 ℃下,用复合蛋白酶酶解2 h,转入终止反应釜加温至105 ℃进行酶灭活、灭菌1 h,得到酶解溶浆。酶解溶浆在120~140 ℃下经过喷雾干燥得到本试验所用的SHM、SPM和HSVM;其中,酶解溶浆经超微过滤(粒径要求小于48 μm)后喷雾干燥得到TSHM;TSHM与SHM采用相同原料,TSHM则除去了部分颗粒状物质(包括鱼肉纤维颗粒、砂石等颗粒),小肽和游离氨基酸含量会更高。鱼粉、SHM、TSHM、SPM和HSVM的营养水平如表 1所示。
|
|
表 1 鱼粉、SHM、TSHM、SPM和HSVM营养水平(干物质基础) Table 1 Nutrient levels of FM, SHM, TSHM, SPM and HSVM (DM basis) |
饲料营养水平按照等氮等脂设计,试验饲料组成及营养水平如表 2所示,试验原料和各组试验饲料的氨基酸组成如表 3所示。以含30.0%鱼粉饲料为对照组(FM组),按照鱼粉蛋白含量的35.0%、55.0%和75.0%分别添加酶解溶浆粉,得到含10.4%(SHM1组)、16.4%(SHM2组)和22.2% SHM(SHM3组),含9.9%(TSHM1组)、15.5%(TSHM2组)和21.2%TSHM(TSHM3组),含13.0%(SPM1组)、20.3%(SPM2组)和28.0% SPM(SPM3组),以及含27.0%鱼粉+3.0% HSVM(HSVM组)的共11种试验饲料。
|
|
表 2 试验饲料组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of experimental diets (DM basis) |
|
|
表 3 试验原料和各组试验饲料的氨基酸组成(干物质基础) Table 3 Amino acids composition of experimental raw materials and experimental diets in each group (DM basis) |
在试验饲料组成中,用美国鸡肉粉、棉籽蛋白和大豆浓缩蛋白(1:1:1)作为主要蛋白质源平衡试验饲料中的蛋白质含量,用豆油平衡试验饲料中的脂肪含量,用磷酸二氢钙平衡试验饲料中的总磷含量,用面粉来调节试验饲料颗粒的黏合度,用米糠粕调节试验饲料中原料的组成比例,玉米蛋白粉作为黄颡鱼色素和部分蛋白质来源在各组饲料中保持一致。
饲料所有原料经粉碎后过60目筛,将各种原料称量后逐级混匀,加入豆油和适量水在搅拌机(永强YQ-50型,济南慧峰机械设备有限公司)中搅拌混匀,用颗粒机(华翔HKj200型,章丘市华祥颗粒机械有限公司)加工制粒成直径1.5 mm、长度2~4 mm的颗粒饲料。饲料风干后放入密封袋中,置于-20 ℃冰箱中保存备用。
1.3 试验设计与饲养管理养殖试验在浙江一星实业股份有限公司提供的养殖基地池塘网箱中进行,在总面积为40 m×60 m的养殖池塘中设置试验网箱(规格为长1.5 m×宽1.5 m×深2.0 m,聚乙烯材质)33个,以浙江省海盐县长山河为水源,池塘中设置1台功率为1.5 kW的叶轮式增氧机,在每天11:30—14:30和22:00—01:00各运行3 h。
试验用黄颡鱼幼鱼购于浙江省湖州农业合作社,选取其中规格整齐、体色健康和体重为(17.64±0.14) g的黄颡鱼幼鱼1 320尾,随机分成11组,每组设置3个重复(网箱),每个重复40尾。各组分别投喂11种试验饲料。每天投喂2次(06:00—08:00和16:30—18.30),每天的投喂量为黄颡鱼体重的3%~5%,每2周随机挑选10个网箱称量黄颡鱼体重,调整投喂量,共投喂8周。
每天07:00、12:00和18:00记录水温,养殖期间水温一直保持在24~35 ℃。每5 d测定水下30 cm处的水质指标。养殖周期内水体溶解氧浓度>6 mg/L,pH在8.0~8.4,氨氮浓度 < 0.10 mg/L,亚硝酸盐浓度 < 0.005 mg/L,硫化物浓度 < 0.05 mg/L。
1.4 样品采集在养殖试验开始前,从剩余的黄颡鱼中随机抽取6尾黄颡鱼,作为初始鱼样本进行全鱼常规体成分分析。养殖试验结束后,禁食24 h采样。统计每个网箱中的黄颡鱼数量、体重和体长,用于计算黄颡鱼的存活率(survival rate,SR)、特定生长率(specific growth rate,SGR)、肥满度(condition factor,CF)和饲料系数(feed conversion rate,FCR)。从每个网箱中选取黄颡鱼雄鱼、雌鱼各2尾于-50 ℃冰柜中冷冻保存,用于常规体成分分析,分析试验前后鱼体粗蛋白质、粗脂肪含量,用于计算蛋白沉积率(protein retention rate,PRR)和脂肪沉积率(fat retention rate,FRR)。从每个网箱中随机抽取10尾鱼,用1 mL无菌注射器从尾柄处进行采血,置于2 mL Eppendorf管中,在室温条件下静置3 h,再用离心机以3 500 r/min离心10 min,取上层血清0.2 mL于0.5 mL Eppendorf管中,用液氮迅速冷却后于-50 ℃冰箱保存,用于血清生化指标分析。
1.5 指标测定将冷冻保存的全鱼样品解冻,按比例加水后用粉碎机低温粉碎均匀,采用低温真空冷冻干燥法测定样品水分含量(LGJ-18B型冷冻干燥机,北京四环科学仪器有限公司)。饲料和样品中粗蛋白质含量采用凯氏定氮法(GB 5009.5—2010;LNK-87型消化仪,江苏省宜兴市科教仪器研究所)测定,粗脂肪含量采用石油醚索氏抽提器法测定(GB/T 14772—2008;KN-520型石油醚索氏抽提器,济南阿尔瓦仪器有限公司),粗灰分含量采用马弗炉测定(GB 5009.4—2010;8-10TP型马弗炉,上海慧泰仪器制造有限公司),总磷含量采用分光光度法测定(ISO 6491—1998;L2-S型分光光度计,上海仪电有限公司),酸价根据AOCS Cd 3d-63测定,TVBN含量采用微量滴定法测定(SC/T 3032—2007),游离氨基酸和水解氨基酸含量均使用S-433D氨基酸分析仪(Sykam公司)测定。
血清谷草转氨酶(aspartate amino transferase,AST)、谷丙转氨酶(alanine amino transferase,ALT)活性及高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、胆固醇(cholesterol,CHOL)、甘油三酯(triglyceride,TG)、葡萄糖(glucose,GLU)、总胆汁酸(total bile acid,TBA)和总胆红素(total bilirubin,TBIL)含量采用雅培C800全自动生化分析仪测定。
1.6 计算公式SR、SGR、FCR、PRR、FRR、CF、肝体比(hepatopancreas somatic index,HSI)、脏体比(visceral somatic index,VSI)等常规生长性能指标按照下列公式进行计算:
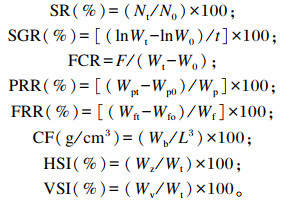
|
式中:Nt为试验末黄颡鱼数量;N0为试验初黄颡鱼数量;Wt为试验末平均体重;W0为试验初平均体重;t为试验天数;F为每尾鱼平均总摄食量;Wpt为试验末鱼体粗蛋白质含量;Wp0为试验初鱼体粗蛋白质含量;Wp为每尾鱼摄入的试验饲料粗蛋白质含量;Wft为试验末鱼体粗脂肪含量;Wf0为试验初鱼体粗脂肪含量;Wf为每尾鱼摄入的试验饲料粗脂肪含量;Wb为每尾鱼末体重;L为每尾鱼末体长;Wz为每尾鱼试验末肝胰脏平均重量;Wv为每尾鱼试验末内脏团平均重量。
1.7 数据分析试验数据用平均值±标准差(mean±SD,n=3)表示,采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),同时利用Duncan氏法比较分析各组间的数据。差异显著性水平为P < 0.05。
2 结果与分析 2.1 黄颡鱼生长性能和饲料效率由表 4可知,各组黄颡鱼的SR在80.8%~97.5%,与FM组相比,SHM3组的SR显著降低(P < 0.05),其余各组之间SR无显著差异(P>0.05),表明用SHM、TSHM、SPM和HSVM替代鱼粉对黄颡鱼的SR没有明显影响。
|
|
表 4 黄颡鱼生长性能和饲料利用效率 Table 4 Growth performance and feed efficiency of yellow catfish (n=3) |
与FM组相比,SHM2和SHM3组的SGR分别下降了22.28%、33.70%,TSHM2和TSHM3组分别下降了13.04%、40.22%,SPM1、SPM2和SPM3组分别下降了22.28%、43.48%和69.02%,均差异显著(P < 0.05);SHM1和TSHM1组分别下降了8.15%和5.98%,而HSVM组增加了12.52%,均无显著差异(P>0.05)。
与FM组相比,SHM1和TSHM1的FCR分别增加了14.93%和10.41%,HSVM组下降了12.67%,均无显著差异(P>0.05);SHM3、TSHM3、SPM2和SPM3组显著升高(P < 0.05)。
与FM组相比,HSVM组的PRR显著升高(P < 0.05),FRR差异不显著(P>0.05);其他各组的PRR和FRR均显著降低(P < 0.05)。
上述结果表明,在黄颡鱼饲料中用10.4% SHM和9.9% TSHM完全替代30.0%的鱼粉对黄颡鱼的生长性能和饲料效率无明显影响,表明10.4% SHM和9.9% TSHM与30.0%的鱼粉对黄颡鱼的生长性能和饲料效率具有一定的等效性;在饲料中添加3.0% HSVM替代等量的鱼粉后,黄颡鱼的生长性能提高,FCR降低。在同等添加水平下,SHM和TSHM对黄颡鱼的生长效果优于SPM;随着SHM、TSHM和SPM添加水平的增加,黄颡鱼的生长性能下降。
2.2 黄颡鱼体成分和形体指标由表 5可知,在体成分方面,与FM组相比,HSVM组的粗脂肪含量无显著差异(P>0.05),其他各组的粗脂肪含量显著降低(P < 0.05),并且随酶解溶浆粉添加水平的增加呈现下降趋势。FM组的粗灰分含量显著低于其他各组(P < 0.05),且其他各组的粗灰分含量随酶解溶浆粉添加水平的增加呈上升趋势。与FM组相比,其他各组的粗蛋白质含量显著升高(P < 0.05),SHM3、TSHM1、SPM2和HSVM组的总磷含量显著降低(P < 0.05)。
|
|
表 5 黄颡鱼体成分和形体指标 Table 5 Body composition and body parameters of yellow catfish (n=3) |
在形体指标方面,与FM组相比,HSM1、TSHM1和HSVM组的CF、VSI和HSI均无显著差异(P>0.05),而SHM3和SPM3组的CF、VSI和HSI均显著降低(P < 0.05),SPM1组的HSI、VIS和SPM2组的VIS均显著降低(P < 0.05)。
上述结果表明,在饲料中添加SHM、TSHM、SPM和HSVM可以增加黄颡鱼鱼体粗蛋白质含量,还能降低鱼体粗脂肪含量,而过高的酶解溶浆粉添加水平会使鱼体粗脂肪含量和CF下降。因此,在饲料中添加10.4% SHM、9.9% TSHM和3.0% HSVM未对黄颡鱼的体成分和形体指标造成不利影响。
2.3 黄颡鱼血清生化指标由表 6可知,与FM组相比,其他各组的血清TP和ALB含量差异不显著(P>0.05),SHM1和SPM2组的血清GLU含量下降,其他各组则上升,差异不显著(P>0.05)。
|
|
表 6 黄颡鱼血清生化指标 Table 6 Serum biochemical indices of yellow catfish (n=3) |
与肝脏健康相关的血清生化指标显示,与FM组相比,其他各组的血清CHOL含量差异不显著(P>0.05);SHM3、TSHM3、SPM1、SPM2和SPM3组的血清TG含量显著下降(P < 0.05),其他各组差异不显著(P>0.05),并且血清TG含量随酶解溶浆粉添加水平的增加呈现下降趋势;SHM3、SPM1、SPM2和SPM3组的血清HDL含量显著升高(P < 0.05),其他各组差异不显著(P>0.05);SHM3、SPM2和SPM3组的血清LDL含量显著升高(P < 0.05),其他各组差异不显著(P>0.05);SHM2、TSHM2、SPM3和HSVM组的血清ALT活性显著升高(P < 0.05),其他各组差异不显著(P>0.05);SHM1组的血清AST活性显著降低(P < 0.05),SHM3和SPM3组的血清AST活性显著升高(P < 0.05),且血清AST活性随酶解溶浆粉添加水平的增加呈现上升趋势;TSHM1、TSHM2、TSHM3、SPM1、HSVM组的血清TBA含量显著升高(P < 0.05),其他各组差异不显著(P>0.05);其他各组的血清TBIL含量差异不显著(P>0.05)。
上述结果表明,高添加水平的SHM、TSHM和SPM会使黄颡鱼的血清ALT和AST活性升高,表明高添加水平的酶解溶浆粉会对肝胰脏功能造成损伤。SHM3、TSHM3和SPM3组的血清TG含量降低,血清HDL和LDL含量升高,表明高添加水平的酶解溶浆粉会对鱼体脂肪代谢造成影响。因此,高添加水平的SHM、TSHM和SPM对黄颡鱼的健康会产生不利影响,而低添加水平的SHM、TSHM、SPM和HSVM对黄颡鱼的健康没有不利影响。
3 讨论 3.1 酶解溶浆粉替代黄颡鱼饲料中鱼粉的可行性本试验所使用的酶解溶浆粉是以东海海域捕捞的日本鳀和太平洋磷虾为原料生产鱼粉、虾粉过程中的副产物,即以压榨液经油水分离后的溶浆为原料经过酶解、喷雾干燥得到的酶解产品,含有丰富的游离氨基酸、小肽、牛磺酸、可溶性蛋白质以及其他未知营养因子等。这类产品是否可以作为鱼粉的替代原料是本文的研究目标。在黄颡鱼饲料中,常用植物蛋白质和动物蛋白质的合理搭配来满足鱼类生长发育所需要的蛋白质源,酶解溶浆粉作为海洋生物蛋白质和海洋生物特殊成分(未知营养因子)的来源,在饲料中合理搭配形成一种新的“鱼粉”饲料模式,这是本文使用酶解溶浆粉替代鱼粉的主要技术路线。
蛋白质水解物在水产养殖中已得到初步研究,在海鲈鱼[4](Dicentrarchus labrax)、大黄鱼[5](Pseudosciaena crocea R.)的饲料中添加鱼蛋白质水解物可以有效增强鱼体的生长性能和免疫能力,在真鲷(Pagrus major)[6]的饲料中添加虾蛋白质水解物可以提高其生长性能、饲料利用率、消化率和抗病能力。本试验结果显示,在黄颡鱼饲料中,在大豆浓缩蛋白、棉籽蛋白和美国鸡肉粉作为饲料蛋白质源的基础上,10.4% SHM、9.9% TSHM与30.0%鱼粉表现出了一定的等效关系。如果单纯从蛋白质含量比较,10.4% SHM、9.9% TSHM的蛋白质含量仅为30.0%鱼粉蛋白质含量的35%。
如何理解在黄颡鱼饲料中“10.4% SHM、9.9% TSHM与30.0%鱼粉具有等效关系”?第一,从氨基酸组成模式进行分析,本试验中,4种试验原料的18种水解氨基酸模式与鱼粉18种氨基酸模式的相关系数分别为0.708、0.833、0.829和0.954,显示HSVM的水解氨基酸模式更接近鱼粉的氨基酸模式;而4种原料游离氨基酸模式与鱼粉游离氨基酸模式相差较大,其相关系数分别为0.695、0.566、0.687和0.540;再从试验饲料的氨基酸组成模式看,4种试验原料的18种氨基酸模式与FM组饲料的18种氨基酸模式比较,其相关系数在0.783~0.845,有一定的差异。因此,从原料、饲料的18种氨基酸组成模式方面,4种原料、4种原料组成的饲料氨基酸模式与鱼粉、FM组饲料的18种氨基酸有一定的差异,而这种差异可以用来解释在黄颡鱼生长性能、饲料效率方面的差异,SHM1和TSHM1组的蛋白质含量仅仅为鱼粉蛋白质含量的35%,但生长性能和饲料系数没有显著差异。第二,从小肽、牛磺酸含量进行分析,由表 1和表 3可知,SHM、TSHM、SPM和HSVM的游离氨基酸和小肽含量均高于鱼粉,尤其是4种酶解溶浆粉小肽含量分别为鱼粉的8.80、9.38、6.99和5.51倍。此外,4种原料、4种原料组成的饲料中牛磺酸含量均高于鱼粉、鱼粉饲料,4种原料中牛磺酸含量分别为鱼粉的6.08、3.62、3.84和3.11倍,4种原料组成的饲料中牛磺酸含量是鱼粉饲料牛磺酸含量的2.26~6.19倍。因此,4种试验原料中小肽、牛磺酸含量是主要差异因素,并可能是影响酶解溶浆粉的生物学效价高于鱼粉的重要原因之一。第三,从未知营养因子方面进行分析,SHM较鱼粉具有更好的生物学效价,对黄颡鱼生长性能和饲料效率的影响结果不仅仅是其中蛋白质的营养作用,应该含有一些特殊的生物功能作用的物质,目前称之为“未知生长因子”。但具体是那些“未知生长因子”需要再深入的研究,除了小肽、牛磺酸之外,可能含包含氧化三甲胺、二甲基丙酸噻亭等成分。
在相同条件下,SPM对黄颡鱼的生长结果不如SHM。值得关注的是,用3.0%的HSVM作为诱食性物质和海洋生物特殊营养因子部分替代3.0%的鱼粉,黄颡鱼的生长性能得到显著增强,产生这种结果的原因可能与酶解溶浆粉中含有的丰富游离氨基酸、小肽、牛磺酸以及其他未知的营养因子有关。
依据本试验结果,在黄颡鱼饲料中用10.4% SHM、9.9% TSHM分别替代30.0%鱼粉具有一定的可行性,可以降低鱼粉的使用量;而用3.0% HSVM替代等量的鱼粉,可以取得更好的生长性能结果。这些结果对于水产饲料中降低鱼粉的使用量并维持良好的生长性能具有重要的指导意义,其技术路线具有可行性。
3.2 酶解溶浆粉对黄颡鱼生长性能的影响有研究指出,在饲料中添加适量的游离氨基酸可以有效促进鱼类的生长[7]。游离氨基酸、小肽、牛磺酸等营养因子在提高鱼类的生长性能和消化率[5, 8]、诱导非特异性免疫[4, 9]、增强消化酶活性[10],减少疾病发生[11]和增强抗氧化能力[12-13]等方面具有重要的生理作用。例如牛磺酸是广泛存在于机体内的一种含硫氨基酸,能促进鱼体的生长和摄食,改善肌肉品质,增加体蛋白质和脂肪沉积[14-15]。在Bui等[16]对真鲷的研究中,用蛋白质水解物替代10%的鱼粉,可以提高真鲷幼鱼的生长性能、饲料利用率、蛋白质消化率、特异性免疫力和抗病力。饲料摄食后消化的蛋白质和游离氨基酸会刺激小肠近端的内分泌细胞分泌胆囊收缩素(CCK)促进胰腺分泌,产生饱腹感[17],过量添加蛋白质水解物可能会降低鱼类的摄食率,进而影响生长。此外有研究表明,鱼体对氨基酸的吸收主要通过不同底物特异性的氨基酸转运蛋白或肠道肽转动蛋白(peptide-transporters 1,PepT1)以二肽和三肽的形式进入肠上皮细胞[18],根据肠段中不同位置蛋白质源含量的变化,氨基酸转运蛋白和PepT1的含量会相应发生变化,从而保持肠道对氨基酸的最大吸收率[19],所以鱼体肠道对游离氨基酸、寡肽等小分子物质的吸收速度很快,而蛋白质在肠道中消化吸收速度较慢,进而导致肠道氨基酸吸收不平衡,影响鱼体蛋白质的合成。因此,适量的游离氨基酸对鱼体的生长健康具有积极作用。
酶解鱼蛋白质的溶解度对鱼类的生长也会产生影响,本试验中,TSHM是在SHM的基础上,经过滤装置过滤后的酶解产品,拥有更多的可溶性活性物质以及减少了其他小颗粒不溶性杂质。Zheng等[13]对牙鲆(Paralichthys olivaceus)的研究结果表明,在饲料中添加从水解蛋白质中超膜过滤提取的小分子物质对牙鲆幼鱼的生长性能和饲料利用具有积极的影响,并且提高了牙鲆血浆中胰岛素样生长因子(insulin-like growth factor-Ⅰ,IGF-Ⅰ)含量和肝脏IGF-Ⅰ等相关生长因子的mRNA表达量。在Wei等[20]对大菱鲆(Scophthalmus maximus L.)的研究中,用超滤膜过滤酶解鱼蛋白质,分别将透过滤膜的酶解鱼蛋白质、未透过滤膜保留下来的酶解鱼蛋白质以及不经过滤的酶解鱼蛋白质添加到试验饲料中,饲料中添加透过滤膜的酶解鱼蛋白质的大菱鲆具有最高的SGR和末重。本试验中,TSHM1组的黄颡鱼相比SHM1组具有更好的SGR和饲料效率,虽然TSHM1组与SHM1组的差异不显著,但这与上述对牙鲆和大菱鲆研究结果一致,说明通过超微过滤得到的TSHM对黄颡鱼具有更好的生长效果。
不同海洋原料制成的蛋白质水解物对鱼类的生长发育具有不同的影响。本试验结果显示,相比相同鱼粉替代水平的HSM1和TSHM1组,在饲料中添加13.0% SPM降低了黄颡鱼的生长性能,而在饲料中添加3.0% HSVM提高了黄颡鱼的生长性能。有研究表明,在饲料中添加2.0%~3.5%的虾水解蛋白质有利于增强真鲷[6]和牙鲆[21]的生长性能和饲料利用率,增强非特异性免疫应答,由此得出一个推测:酶解虾蛋白质不能替代鱼粉作为饲料中的主要蛋白质源,但SPM和HSVM等不同原料蛋白质可以作为特殊的海洋生物营养因子低剂量添加到鱼类饲料中,改善鱼类饲料的营养水平,提高鱼类的生长性能。此外酶解溶浆粉中含有Glu、甘氨酸(Gly)、Ala、牛磺酸等丰富的味觉氨基酸[22-23],并且鱿鱼提取物常被认作为甲壳类动物诱食剂的良好来源[24-25],这可能对鱼类也具有相同的诱食效果。
3.3 过高添加水平的酶解溶浆粉导致黄颡鱼生长性能下降的可能原因从本试验结果来看,饲料中酶解溶浆粉的添加水平不是越高越好,过高的添加水平会阻碍鱼类生长,将酶解溶浆粉的添加水平控制在适宜的范围内,可以有效促进鱼类生长,那是什么原因会使过高添加水平的酶解溶浆粉对黄颡鱼的生长产生不利影响呢?Wu等[26]对黄颡鱼的研究表明,随着饲料中鱼溶浆、酶解鱼溶浆和SHM添加水平的增加,黄颡鱼的生长呈现出明显的下降趋势,推测饲料中过高水平的游离氨基酸可能会阻碍或降低鱼体的生长。Xu等[27]对大菱鲆的研究表明,在饲料中添加鱼蛋白质水解物替代10%的饲料蛋白质,大菱鲆的生长性能不受影响;而蛋白质水解物替代20%的饲料蛋白质时,大菱鲆的生长性能表现出下降趋势。尖吻鲈(Lates calcarifer Bloch)[28]饲料中蛋白质水解物含量从15%增加到30%,其生长性能出现显著下降。Hevrøy等[29]对大西洋鲑鱼(Salmo salar)的研究中,通过对血浆中氨基酸、尿素和氨态氮含量变化的研究,证明游离氨基酸在肠道内吸收速率快,且吸收不同步,因此饲料中高添加水平的酶解溶浆粉在鱼体肠道中很容易就被分解代谢,所以饲料中高添加水平的酶解溶浆粉并不一定能促进鱼类的生长,反而会因营养物质的分解代谢不同步对生长造成不利影响。Espe等[30]对大西洋鲑鱼的研究中,用碳-14(14C)标记鱼蛋白质浓缩物中的赖氨酸(Lys),但鱼体肌肉组织中14C-Lys含量不受鱼蛋白质浓缩物添加水平的影响,并且相比未添加或高添加水平的饲料,低添加水平的鱼蛋白质浓缩物可使大西洋鲑鱼获得更好的生长性能,表明氮和脂肪的消化率以及用于肌肉蛋白质合成的氨基酸掺入量并不是促进生长的原因。此外在鱼类行为方面,有研究表明过高的游离氨基酸含量会刺激肠道分泌胆囊收缩素[17],胆囊收缩素调控体内胰酶的代谢[31],促使鱼体产生饱腹感[32],降低采食量,长期摄入会导致生长受阻。
根据上述研究以及本试验得出的结果,推测饲料中低添加水平的酶解溶浆粉可能会在鱼体中产生一些合成代谢调节剂,促进对蛋白质的合成和利用,而饲料中高添加水平的酶解溶浆粉不仅导致过量的游离氨基酸在鱼体肠道内吸收利用不同步,而且酶解溶浆粉添加水平增高导致的其他营养物质减少会对鱼类的生长造成不利影响。
3.4 酶解溶浆粉对黄颡鱼体组成和血清生化指标的影响酶解溶浆粉的使用效果与其在饲料中的添加水平、原料来源以及水解程度密切相关[3, 33]。在一些研究报道中,用蛋白质水解物替代鱼粉对试验鱼体的粗蛋白质、粗脂肪和粗灰分含量均无显著影响[16, 34]。Refstie等[35]对大西洋鲑的研究中,蛋白质水解物添加水平从0增加到15%,鱼体的粗蛋白质含量增高。本试验结果显示,随着饲料中酶解溶浆粉添加水平的增加,黄颡鱼体的粗蛋白质和粗灰分含量呈现上升趋势,粗脂肪含量呈现下降趋势。结合CF、VSI和HSI等形体指标随饲料中酶解溶浆粉添加水平增高表现出的下降趋势,推测本试验中黄颡鱼由于饲料中酶解溶浆粉添加水平过高,对营养物质的吸收利用不平衡导致无法满足正常生长的营养需要,生长发育受阻,所以消耗脂肪提供活动能量所需,脂肪累积速率低于脂肪消耗速率,鱼体粗脂肪含量下降,鱼体粗蛋白质和粗灰分含量相对升高。
血清中AST和ALT是评价肝脏机能是否健康的重要指标[36]。健康状态下血清AST和ALT活性很低,当肝脏组织损伤时血清中AST和ALT活性就会上升。本试验中,随着饲料中酶解溶浆粉添加水平升高,血清AST和ALT活性增加,这与在大菱鲆[37-38]、黄颡鱼[11]中的研究结果一致。血清TP和ALB含量也是评价肝脏功能的重要指标之一,与机体的营养状况有着密切的关系[39]。本研究中,随着饲料中酶解溶浆粉添加水平升高,血清ALB含量呈现出上升趋势,表明高添加水平的酶解溶浆粉会给试验鱼肝脏造成损伤。
血脂的主要成分是TG和CHOL,两者含量的变化是反映机体脂肪代谢和肝脏病变的重要指标,LDL和HDL是将CHOL运出和运回肝脏的主要载体。曹林等[40]对鲈鱼幼鱼(Lateolabrax japonicus)的研究表明,饲料中添加水解蛋白质后血清TG和CHOL含量下降。Song等[41]对江鲽(Platichthys stellatus)的研究表明,饲料中添加大豆水解蛋白质后血清TG和CHOL含量下降。本试验结果与上述研究结果一致,血清CHOL和TG含量下降是肝脏病变的一种表现,而HDL和LDL含量升高可能与脂类代谢供能、肝脏细胞损伤而做出的保护机制有关。上述血清指标含量的变化表明饲料中高添加水平的酶解溶浆粉会对鱼体的肝脏功能造成不利影响,影响鱼体健康。
4 结论① 在黄颡鱼饲料中添加10.4% SHM和9.9% TSHM,以大豆浓缩蛋白、棉籽蛋白和美国鸡肉粉作为补充蛋白质源,完全替代30.0%鱼粉,对黄颡鱼的生长没有显著影响,表现出一定的等效关系。
② 在黄颡鱼饲料中添加3.0% HSVM作为诱食剂,以大豆浓缩蛋白、棉籽蛋白和美国鸡肉粉作为补充蛋白质源,部分替代鱼粉,对黄颡鱼的生长具有积极影响。
③ SHM、TSHM和SPM 3种酶解溶浆粉相比,在试验黄颡鱼生长表现中TSHM效果最好,SHM次之,SPM效果最差。此外,饲料中过高添加水平的SHM、TSHM和SPM都会导致黄颡鱼的生长性能下降和饲料利用率降低。
| [1] |
吴代武, 税典章, 蔡春芳, 等. 鳀鱼鱼浆的酶解过程与营养成分的变化[J]. 饲料工业, 2015, 36(24): 25-30. WU D W, SHUI D Z, CAI C F, et al. Nutrition changes associated with anchovy enzymolysis process[J]. Feed Industry, 2015, 36(24): 25-30 (in Chinese). |
| [2] |
周露阳, 吴代武, 高敏敏, 等. 鱼溶浆、酶解鱼溶浆和酶解鱼浆完全替代鱼粉对黄颡鱼生长的影响[J]. 水生生物学报, 2019, 43(3): 504-516. ZHOU L Y, T F, PU Q H, et al. The effects of fish meal replacement on growth performance of yellow catfish[J]. Acta Hydrobiologica Sinica, 2019, 43(3): 504-516 (in Chinese). |
| [3] |
叶元土. 顺应新形势, 提升水产饲料企业盈利能力[J]. 饲料工业, 2015, 36(2): 1-9. YE Y T. Enhancing profitability of Chinese aquaculture feed enterprises in the new situation[J]. Feed Industry, 2015, 36(2): 1-9 (in Chinese). |
| [4] |
KOTZAMANIS Y P, GISBERT E, GATESOUPE F J, et al. Effects of different dietary levels of fish protein hydrolysates on growth, digestive enzymes, gut microbiota, and resistance to Vibrio anguillarum in European sea bass (Dicentrarchus labrax) larvae[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2007, 147(1): 205-214. |
| [5] |
TANG H G, WU T X, ZHAO Z Y, et al. Effects of fish protein hydrolysate on growth performance and humoral immune response in large yellow croaker (Pseudosciaena crocea R.)[J]. Journal of Zhejiang University, 2008, 9(9): 684-690. DOI:10.1631/jzus.B0820088 |
| [6] |
KHOSRAVI S, RAHIMNEJAD S, HERAULT M, et al. Effects of protein hydrolysates supplementation in low fish meal diets on growth performance, innate immunity and disease resistance of red sea bream Pagrus major[J]. Fish & Shellfish Immunology, 2015, 45(2): 858-868. |
| [7] |
代伟伟, 麦康森, 徐玮, 等. 饲料中赖氨酸和精氨酸含量对大菱鲆幼鱼生长、体成分和肌肉氨基酸含量的影响[J]. 水产学报, 2015, 39(6): 876-887. DAI W W, MAI K S, XU W, et al. Effects of lysine-arginine interaction on growth performance, body composition, and muscle amino acid levels of juvenile turbot (Scophthalmus maximus L.)[J]. Journal of Fisheries of China, 2015, 39(6): 876-887 (in Chinese). |
| [8] |
KVÅLE A, HARBOE T, MANGOR-JENSEN A, et al. Effects of protein hydrolysate in weaning diets for Atlantic cod (Gadus morhua L.) and Atlantic halibut (Hippoglossus hippoglossus L.)[J]. Aquaculture Nutrition, 2008, 15(2): 218-227. |
| [9] |
LIANG M Q, WANG J L, CHANG Q, et al. Effects of different levels of fish protein hydrolysate in the diet on the nonspecific immunity of Japanese sea bass, Lateolabrax japonicus (Cuvieret Valenciennes, 1828)[J]. Aquaculture Research, 2006, 37(1): 102-106. DOI:10.1111/j.1365-2109.2005.01392.x |
| [10] |
SANTOS J F, CASTRO P F, LEAL A L G, et al. Digestive enzyme activity in juvenile Nile tilapia (Oreochromis niloticus, L.) submitted to different dietary levels of shrimp protein hydrolysate[J]. Aquaculture International, 2013, 21(3): 563-577. DOI:10.1007/s10499-012-9589-2 |
| [11] |
ZHOU Q C, JIN M, ELMADA Z C, et al. Growth, immune response and resistance to Aeromonas hydrophila of juvenile yellow catfish, Pelteobagrus fulvidraco, fed diets with different arginine levels[J]. Aquaculture, 2015, 437: 84-91. DOI:10.1016/j.aquaculture.2014.11.030 |
| [12] |
ZHENG K K, LIANG M Q, YAO H B, et al. Effect of size-fractionated fish protein hydrolysate on growth and feed utilization of turbot (Scophthalmus maximus L.)[J]. Aquaculture Research, 2013, 44(6): 895-902. DOI:10.1111/j.1365-2109.2012.03094.x |
| [13] |
ZHENG K, LIANG M, YAO H, et al. Effect of dietary fish protein hydrolysate on growth, feed utilization and IGF-Ⅰ levels of Japanese flounder (Paralichthys olivaceus)[J]. Aquaculture Nutrition, 2012, 18(3): 297-303. DOI:10.1111/j.1365-2095.2011.00896.x |
| [14] |
周铭文, 王和伟, 叶继丹. 饲料牛磺酸对尼罗罗非鱼生长、体成分及组织游离氨基酸含量的影响[J]. 水产学报, 2015, 39(2): 213-223. ZHOU M W, WANG H W, YE J D, et al. Effects of taurine supplementation on the growth, body composition and tissue free amino acid concentrations in Nile tilapia (Oreochromis niloticus)[J]. Journal of Fisheries of China, 2015, 39(2): 213-223 (in Chinese). |
| [15] |
王清滨, 王秋举, 杨翼羽, 等. 牛磺酸对投喂高脂饲料草鱼幼鱼生长、肌肉品质及抗氧化能力的影响[J]. 西北农林科技大学学报(自然科学版), 2015, 43(7): 49-56, 65. WANG Q B. Effect of taurine on growth, muscle quality and antioxidant capacity of juvenile grass carp (Ctenopharyngodon idella)[J]. Journal of Northwest A&F University (Natural Science), 2015, 43(7): 49-56, 65. (in Chinese) |
| [16] |
BUI H T D, KHOSRAVI S, FOURNIER V, et al. Growth performance, feed utilization, innate immunity, digestibility and disease resistance of juvenile red seabream (Pagrus major) fed diets supplemented with protein hydrolysates[J]. Aquaculture, 2014, 419: 11-16. |
| [17] |
WANG Y, CHANDRA R, SAMSA L A, et al. Amino acids stimulate cholecystokinin release through the Ca2+-sensing receptor[J]. American Journal of Physiology: Gastrointestinal and Liver Physiology, 2010, 300(4): G528-G537. |
| [18] |
GILBERT E R, WONG E A, WEBB K E, J r. Board-invited review: peptide absorption and utilization: implications for animal nutrition and health[J]. Journal of Animal Science, 2008, 86(9): 2135-2155. DOI:10.2527/jas.2007-0826 |
| [19] |
BAKKE S, JORDAL A E O, GÓMEZ-REQUENI P, et al. Dietary protein hydrolysates and free amino acids affect the spatial expression of peptide transporter PepT1 in the digestive tract of Atlantic cod (Gadus morhua)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2010, 156(1): 48-55. DOI:10.1016/j.cbpb.2010.02.002 |
| [20] |
WEI Y, LIANG M, MAI K, et al. 1H NMR-based metabolomics studies on the effect of size-fractionated fish protein hydrolysate, fish meal and plant protein in diet for juvenile turbot (Scophthalmus maximus L.)[J]. Aquaculture Nutrition, 2016, 23(3): 523-536. |
| [21] |
KHOSRAVI S, BUI H T D, RAHIMNEJAD S, et al. Dietary supplementation of marine protein hydrolysates in fish-meal based diets for red sea bream (Pagrus major) and olive flounder (Paralichthys olivaceus)[J]. Aquaculture, 2015, 435: 371-376. DOI:10.1016/j.aquaculture.2014.10.019 |
| [22] |
KIM S K, TAKEUCHI T, YOKOYAMA M, et al. Effect of dietary taurine levels on growth and feeding behavior of juvenile Japanese flounder Paralichthys olivaceus[J]. Aquaculture, 2005, 250(3/4): 765-774. |
| [23] |
SHAMUSHAKI V A J, KASUMYAN A O, ABEDIAN A, et al. Behavioural responses of the Persian sturgeon (Acipenser persicus) juveniles to free amino acid solutions[J]. Marine and Freshwater Behaviour and Physiology, 2007, 40(3): 219-224. DOI:10.1080/10236240701602184 |
| [24] |
MACKIE A M, SHELTON R G J. A whole-animal bioassay for the determination of the food attractants of the lobster Homarus gammarus[J]. Marine Biology, 1972, 14(3): 217-221. DOI:10.1007/BF00348282 |
| [25] |
MENDOZA R, MONTEMAYOR J, VERDE J. Biogenic amines and pheromones as feed attractants for the freshwater prawn Macrobrachium rosenbergii[J]. Aquaculture Nutrition, 2003, 3(3): 167-173. |
| [26] |
WU D W, ZHOU L Y, GAO M M, et al. Effects of stickwater hydrolysates on growth performance for yellow catfish (Pelteobagrus fulvidraco)[J]. Aquaculture, 2018, 488: 161-173. DOI:10.1016/j.aquaculture.2018.01.031 |
| [27] |
XU H G, MU Y C, ZHANG Y, et al. Graded levels of fish protein hydrolysate in high plant diets for turbot (Scophthalmus maximus): effects on growth performance and lipid accumulation[J]. Aquaculture, 2016, 454: 140-147. DOI:10.1016/j.aquaculture.2015.12.006 |
| [28] |
SRICHANUN M, TANTIKITTI C, KORTNER T M, et al. Effects of different protein hydrolysate products and levels on growth, survival rate and digestive capacity in Asian seabass (Lates calcarifer Bloch) larvae[J]. Aquaculture, 2014, 428-429: 195-202. DOI:10.1016/j.aquaculture.2014.03.004 |
| [29] |
HEVRØY E M, ESPE M, WAAGBØ R, et al. Nutrient utilization in Atlantic salmon (Salmo salar L.) fed increased levels of fish protein hydrolysate during a period of fast growth[J]. Aquaculture Nutrition, 2005, 11(4): 301-313. DOI:10.1111/j.1365-2095.2005.00357.x |
| [30] |
ESPE M, SVEIER H, HØGØY I, et al. Nutrient absorption and growth of Atlantic salmon (Salmo salar L.) fed fish protein concentrate[J]. Aquaculture, 1999, 174(1/2): 119-137. |
| [31] |
CAHU C, RØNNESTAD I, GRANGIER V, et al. Expression and activities of pancreatic enzymes in developing sea bass larvae (Dicentrarchus labrax) in relation to intact and hydrolyzed dietary protein; involvement of cholecystokinin[J]. Aquaculture, 2004, 238(1/2/3/4): 295-308. |
| [32] |
CUDENNEC B, FOUCHEREAU-PERON M, FERRY F, et al. In vitro and in vivo evidence for a satiating effect of fish protein hydrolysate obtained from blue whiting (Micromesistius poutassou) muscle[J]. Journal of Functional Foods, 2012, 4(1): 271-277. DOI:10.1016/j.jff.2011.12.003 |
| [33] |
吴代武, 何杰, 叶元土, 等. 日粮中鱼蛋白水解物对黄颡鱼生长、体成分和血清生理指标的影响[J]. 水产学报, 2017, 41(3): 415-427. WU D W, HE J, YE Y T, et al. Effects of fish protein hydrolysate on growth, body composition and serum biochemical parameters of yellow catfish (Pelteobagrus fulvidraco)[J]. Journal of Fisheries of China, 2017, 41(3): 415-427 (in Chinese). |
| [34] |
牟玉超, 柳茜, 卫育良, 等. 饲料中添加两种蛋白水解物对大菱鲆(Scophthalmus maximus L.)幼鱼生长性能及肠道组织学结构的影响[J]. 渔业科学进展, 2017, 38(2): 83-90. MOU Y C, LIU X, WEI Y L, et al. Effects of dietary inclusion of two protein hydrolysates on growth performance and intestinal histological structure of juvenile turbot (Scophthalmus maximus L.)[J]. Progress in Fishery Sciences, 2017, 38(2): 83-90 (in Chinese). |
| [35] |
REFSTIE S, OLLI J J, STANDAL H. Feed intake, growth, and protein utilisation by post-smolt Atlantic salmon (Salmo salar) in response to graded levels of fish protein hydrolysate in the diet[J]. Aquaculture, 2004, 239(1/2/3/4): 331-349. |
| [36] |
王香丽, 麦康森, 徐玮, 等. 蛋氨酸对瓦氏黄颡鱼幼鱼肝脏及血浆中谷草转氨酶和谷丙转氨酶活力的影响[J]. 中国海洋大学学报(自然科学版), 2015, 46(9): 49-53. WANG X L, MAI K S, XU W, et al. Influence of dietary methionine on the activity of liver and plasma glutamic-pyruvic and glutamic oxalacetic transaminases of juvenile drakbarbel catfish(Pelteobagrus vachelli)[J]. Journal of ocean university of China (Natural Science), 2015, 46(9): 49-53 (in Chinese). |
| [37] |
张莉莉, 梁萌青, 徐后国, 等. 饲料中添加磷虾水解物对大菱鲆幼鱼生长性能、体组成及相关酶活性的影响[J]. 水生生物学报, 2017, 41(3): 497-505. ZHANG L L, LIANG M Q, XU H G, et al. Effects of dietary krill hydrolysates on growth performance, body composition and related enzyme activities of juvenile turbot (Scophthalmus maximus L.)[J]. Acta Hydrobiologica Sinica, 2017, 41(3): 497-505 (in Chinese). |
| [38] |
姜立生, 陈玮, 李宝山, 等. 水解蛋白替代鱼粉对大菱鲆生长及生理代谢的影响[J]. 海洋渔业, 2019, 41(5): 596-605. JIANG L S, CHEN W, LI B S, et al. Effects of replacing fishmeal by protein hydrolysates on the growth performance and physiological metabolism of Scophthalmus maximus[J]. Marine Fisheries, 2019, 41(5): 596-605 (in Chinese). |
| [39] |
王卫卫, 吴谡琦, 孙修勤, 等. 硬骨鱼免疫系统的组成与免疫应答机制研究进展[J]. 海洋科学进展, 2010, 28(2): 257-265. WANG W W, WU S Q, SUN X Q, et al. Progress in research for components of the immune system and mechanism of the immune response in teleost[J]. Advances in Marine Science, 2010, 28(2): 257-265 (in Chinese). DOI:10.3969/j.issn.1671-6647.2010.02.018 |
| [40] |
曹林, 张婷婷, 徐后国, 等. 饲料中不同水解蛋白对鲈鱼(Lateolabrax japonicus)幼鱼鱼体及组织脂肪含量的影响[J]. 渔业科学进展, 2017, 38(3): 86-95. CAO L, ZHANG T T, XU H G, et al. Effects of different protein hydrolysates in high plant protein diets on the lipid accumulation of juvenile Japanese seabass (Lateolabrax japonicus)[J]. Progress in Fishery Sciences, 2017, 38(3): 89-98 (in Chinese). |
| [41] |
SONG Z D, LI H Y, WANG J Y, et al. Effects of fishmeal replacement with soy protein hydrolysates on growth performance, blood biochemistry, gastrointestinal digestion and muscle composition of juvenile starry flounder (Platichthys stellatus)[J]. Aquaculture, 2014, 427: 96-104. |




