2. 四川新希望六和科技创新有限公司, 成都 610000;
3. 重庆市水产技术推广总站, 重庆 400400
2. Sichuan New Hope Liuhe Technology Innovation Co., Ltd., Chengdu 610000, China;
3. Chongqing Fisheries Technology Extension Station, Chongqing 400400, China
紫苏(Perilla frutescens)又名赤苏、红苏,系唇形科1年生草本植物,广泛分布于我国浙江、四川、贵州、安徽及广东等多个省份,至今已有2 000多年的种植历史,是国家卫生部首批颁布的“药食同源”的60种物种之一,富含挥发油、酚酸及黄酮类等生物活性成分。紫苏饼是紫苏籽榨油后的副产物,其中残余了许多紫苏籽中的活性物质,如木屑草素、迷迭香酸和亚麻油等,具有抗氧化、抑菌、抗炎等功能,且硫苷和棉酚等抗营养因子极少,经微生物发酵后,大分子蛋白质降解为小分子多肽,易被机体消化吸收。且发酵过程中产生的益生菌、乳酸及未知生长因子等能有效维护机体健康。
大鲵(Andrias davidianus)是我国二级保护动物。目前,大鲵人工养殖过程中常以冰鲜为主要饵料,易引发大鲵胃肠、肝脏等消化道疾病和病毒性疾病等,造成很大的经济损失。本研究团队基于大鲵产业中面临的问题,经多年研究,创制大鲵饲料并示范成功[1-2]。
基于此,为进一步优化饲料配方,促进大鲵配合饲料的优质高效绿色化,提高抗病能力,同时推广药食性资源的利用,本试验以大鲵为研究对象,探讨紫苏饼和发酵紫苏饼对大鲵生长性能、消化道结构功能、免疫及脂质代谢部分指标的影响,为紫苏饼在大鲵配合饲料中的合理应用提供科学依据。
1 材料与方法 1.1 试验材料试验所需大鲵(陕西种,子2代)购买于陕西省汉中市绿源大鲵养殖场;紫苏饼由忠县湘楠农业开发有限公司提供,其余原料均由重庆新希望饲料有限公司提供。
1.2 试验饲料根据大鲵的营养需求,配合饲料以鱼粉、鸡肉粉和鱼油等为原料配制,对照组饲喂配合饲料,微调配方,分别添加5.0%的紫苏饼(紫苏饼组)和发酵紫苏饼(发酵紫苏饼组)(发酵紫苏饼利用乳酸菌、酵母菌和芽孢杆菌复合菌种发酵而来,试验开展前已筛选出适宜的发酵比例及条件,发酵前后营养成分变化见表 1),配制成3种等氮等脂的试验饲料。试验饲料组成及营养水平见表 2。
|
|
表 1 紫苏饼发酵前后营养成分变化(干物质基础) Table 1 Changes in nutritional components of perilla cake before and after fermentation (DM basis) |
|
|
表 2 试验饲料组成及营养水平(风干基础) Table 2 Composition and nutrient levels of experimental diets (air-dry basis) |
正式试验前,先将大鲵以对照组饲料驯食15 d。驯食完成后,选择96尾初始体质量为(54.14±0.17) g的健康大鲵,随机分为3组,每组4个重复,每个重复8尾,饲养于西南大学水产学院大鲵养殖系统中,单口蓝色箱子规格:70 cm×45 cm×17.5 cm,水深5 cm,水源为曝气自来水,每天早、晚各100%换水1次。因大鲵消化食物时间较长,故连续投喂2 d(17:30)后停食1 d。投喂3 h后捞取残饵,收集到残饵杯。正式饲喂试验时间105 d,期间无光照,利用空调维持水温22~25 ℃,溶解氧含量>6.0 mg/L,总氨氮含量<0.10 mg/L,亚硝酸盐含量<0.01 mg/L,pH 6.5~7.5。
1.4 样品采集大鲵养殖试验结束后饥饿72 h,每组每个重复随机选取6尾大鲵用适量MS-222麻醉,称重后用1 mL的1次性无菌注射器在尾静脉处取血,4 500 r/min离心10 min制备血浆放入液氮罐中速冻后,转入-80 ℃冰箱内保存,用于血浆生化指标测定。后将大鲵于冰上解剖,取出完整内脏团和肝脏,分离胃、肠道和背部肌肉样品,液氮速冻后,转入-80 ℃冰箱保存备用。
1.5 指标测定生长指标:养殖试验结束后,停食72 h(确保其空肠),准确称量各组大鲵体质量、饲料质量及残饵重,计算公式如下:

|
式中: W0为初始尾均重(g);Wt为终末尾均重(g);D为养殖试验天数;F为尾均干物质摄食量(g);N0为初始尾数;Nt为终末尾数。
试验饲料及肌肉常规营养成分测定:水分含量测定采用105 ℃烘箱干燥法(GB/T 6435—2006),粗蛋白质含量测定采用凯氏定氮法(GB/T 6432—1994),粗脂肪含量测定采用索氏抽提法(GB/T 6433—1994)。
血浆和组织生化指标的测定:胃中胃蛋白酶、氢钾ATP酶(H+-K+-ATP酶)活性;肠道胰蛋白酶、脂肪酶、淀粉酶、钠钾ATP酶(Na+-K+-ATP酶)活性; 肝脏和肠道总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)活性和丙二醛(MDA)含量;血浆二胺氧化酶(DAO)、谷丙转氨酶(ALT)、谷草转氨酶(AST)活性及内毒素(ET)、D-乳酸(D-LA)、免疫球蛋白M(IgM)、一氧化氮(NO)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量分别采用南京建成生物工程研究所试剂盒或上海优选生物科技有限公司酶联免疫吸附测定(ELISA)试剂盒进行测定。
肠道石蜡组织切片:由武汉塞维尔生物科技有限公司代制,切片为苏木精-伊红(HE)染色,用MIPlus07测量肠道绒毛高度、数量和空腔面积。
1.6 数据处理试验结果用SPSS 22.0对数据进行单因素方差分析(one-way ANOVA)。用Duncan氏多重比较法分析组间差异显著性程度,显著水平为P<0.05。数据用平均值±标准差(mean±SD)形式表示。
2 结果 2.1 紫苏饼与发酵紫苏饼对大鲵生长性能和饲料利用的影响大鲵FBW、WGR和SGR趋势均为发酵紫苏饼组显著高于对照组和紫苏饼组(P < 0.05),且紫苏饼组显著高于对照组(P < 0.05);FCR和存活率各组间差异不显著(P>0.05)(表 3)。
|
|
表 3 紫苏饼与发酵紫苏饼对大鲵生长性能及饲料利用的影响 Table 3 Effects of perilla cake and fermented perilla cake on growth performance and feed utilization of Andrias davidianus (n=4) |
发酵紫苏饼组胃中胃蛋白酶和H+-K+-ATP酶活性显著高于对照组(P < 0.05),较对照组分别提高了27.40%和29.96%;紫苏饼组胃H+-K+-ATP酶活性显著高于对照组(P < 0.05),较对照组提高了19.33%(表 4)。
|
|
表 4 紫苏饼与发酵紫苏饼对大鲵胃消化吸收能力的影响 Table 4 Effects of perilla cake and fermented perilla cake on stomach digestion and absorption capacity of Andrias davidianus (n=4) |
发酵紫苏饼组肠道脂肪酶和淀粉酶活性均显著高于紫苏饼组和对照组(P < 0.05),其中,脂肪酶活性较对照组提高了68.38%,淀粉酶活性比紫苏饼组和对照组分别提高了21.62%和150.00%;肠道胰蛋白酶和Na+-K+-ATP酶活性均在紫苏饼组出现最大值,其中胰蛋白酶活性显著高于其余2组(P < 0.05),且较对照组提高了102.37%,肠道Na+-K+-ATP酶活性显著高于对照组(P < 0.05),但与发酵紫苏饼组相比差异不显著(P>0.05);血浆DAO活性、ET和D-LA含量均在发酵紫苏饼组出现最小值,发酵紫苏饼组血浆DAO活性和D-LA含量与紫苏饼组相比差异不显著(P>0.05),但均显著低于对照组(P < 0.05)且较对照组分别降低了42.79%和113.52%,而血浆ET含量显著低于紫苏饼组和对照组(P < 0.05)(表 5)。
|
|
表 5 紫苏饼与发酵紫苏饼对大鲵肠道消化吸收能力和屏障功能的影响 Table 5 Effects of perilla cake and fermented perilla cake on digestion and absorption capacity and intestinal barrier function of Andrias davidianus (n=4) |
对照组和紫苏饼组、发酵紫苏饼组的绒毛数量和绒毛高度无显著差异(P>0.05);发酵紫苏饼组大鲵肠道空腔率显著低于其他2组,较对照组降低了40.38%(P<0.05)(表 6和图 1)。
|
|
表 6 紫苏饼与发酵紫苏饼对大鲵肠道形态结构的影响 Table 6 Effects of perilla cake and fermented perilla cake on intestinal structure of Andrias davidianus (n=4) |
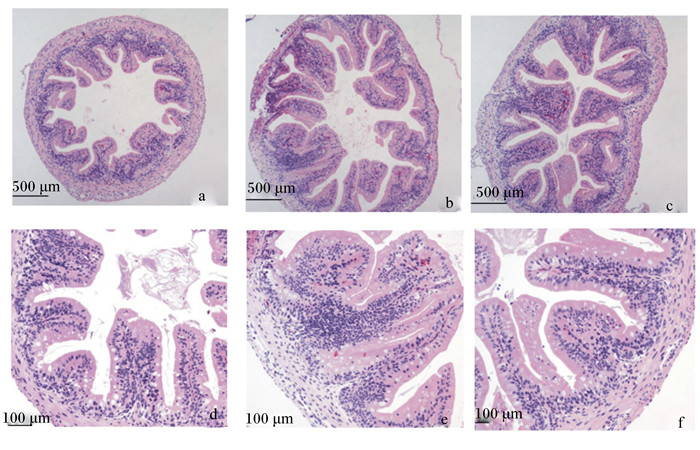
|
a:对照组小肠(40×):b:紫苏饼组小肠(40×):c:发酵紫苏饼组小肠(40×);d:对照组小肠(100×);e:紫苏饼组小肠(100×);f:发酵紫苏饼组小肠(100×)。 a: small intestine of control group (40×); b: small intestine of perilla cake group (40×); c: small intestine of fermented perilla cake group (40×); d: small intestine of control group (100×); e: small intestine of perilla cake group (100×); f: small intestine of fermented perilla cake group (100×). 图 1 紫苏饼与发酵紫苏饼对大鲵肠道形态结构的影响 Fig. 1 Effects of perilla cake and fermented perilla cake on intestinal structure of Andrias davidianus |
在肝脏中,发酵紫苏饼组T-AOC显著高于其余2组(P < 0.05),T-SOD活性显著高于对照组(P < 0.05),但与紫苏饼组差异不显著(P>0.05);在肠道中,紫苏饼组T-AOC显著高于发酵紫苏饼组和对照组(P < 0.05);发酵紫苏饼组T-SOD活性出现最大值,并显著高于其余2组(P < 0.05);MDA含量为发酵紫苏饼组 < 紫苏饼组 < 对照组,3组间差异显著(P < 0.05)(表 7)。
|
|
表 7 紫苏饼与发酵紫苏饼对大鲵肝脏和肠道抗氧化能力的影响 Table 7 Effects of perilla cake and fermented perilla cake on liver and gut intestinal antioxidant of Andrias davidianus (n=4) |
紫苏饼组血浆IgM含量与发酵紫苏饼组差异不显著(P>0.05),但均显著高于对照组(P < 0.05)且紫苏饼组较对照组提高了31.48%;血浆NO含量和AST活性各组间差异不显著(P>0.05);发酵紫苏饼组血浆ALT活性显著低于其余2组(P < 0.05)(表 8)。
|
|
表 8 紫苏饼与发酵紫苏饼对大鲵免疫和肝功能指标的影响 Table 8 Effects of perilla cake and fermented perilla cake on immunity and liver function indexes of Andrias davidianus (n=4) |
血浆TC和TG含量均在发酵紫苏饼组出现最小值,且均显著低于对照组(P < 0.05);各组血浆HDL-C含量差异不显著(P>0.05);紫苏饼组血浆LDL-C含量与发酵紫苏饼组差异不显著(P>0.05),但均显著低于对照组(P < 0.05)(表 9)。
|
|
表 9 紫苏饼与发酵紫苏饼对大鲵脂质代谢部分指标的影响 Table 9 Effects of perilla cake and fermented perilla cake on some lipid metabolism indexes of Andrias davidianus (n=4) |
紫苏类原料因富含黄酮类、酚酸类等活性成分,对促进动物生长发育、改善肉质有一定效果,这在小鼠[4]、肉鸡[5]等动物的试验中已得到证实。本试验所采用紫苏饼是紫苏籽榨油后的副产物,其中残余了许多紫苏籽中的活性物质,如木屑草素、迷迭香酸和亚麻油等,具有抗氧化、抑菌、抗炎等功能。发酵紫苏饼是利用复合菌种发酵而来的,富含有益菌、乳酸、小肽及多种促生长因子。本研究表明,紫苏饼和发酵紫苏饼均促进大鲵的生长性能,其中发酵紫苏饼促进效果更佳,与发酵工艺的产物相关,具体单一功能成分和复合功能成分组合有待进一步探讨。
3.2 紫苏饼和发酵紫苏饼改善了大鲵胃肠功能大量营养学研究表明,饲料成分会影响消化酶活性[6-7]。胃H+-K+-ATP酶是胃酸分泌的关键酶,Na+-K+-ATP酶则与肠道的吸收能力呈正相关,胰蛋白酶、脂肪酶和淀粉酶是消化三大营养物质的重要酶, DAO、ET和D-LA活性三者均能评价肠道屏障功能,本研究中,可能是因为紫苏饼中的多种天然活性物质及发酵加入的有益菌具有改善胃肠内环境,促进胃肠组织生长发育的作用,大鲵胃肠消化吸收功能及肠道屏障功能在发酵紫苏饼组及紫苏饼组有较大提升,其中发酵紫苏饼经过发酵后,硫苷等抗营养因子及有害物质减少,且富含有机酸、可溶性肽、氨基酸等小分子物质,添加后效果更佳。
3.3 紫苏饼和发酵紫苏饼提高了大鲵抗氧化能力紫苏属植物富含酚酸、黄酮类抗氧化活性物质,其抗氧化功效得到了中外学者的广泛关注[8]。SOD活性、T-AOC和MDA含量可以综合评价机体的抗氧化能力,本试验中采用的紫苏饼经发酵后,紫苏饼中多糖、脂肪和蛋白质等大分子物质会被降解,生成有机酸、可溶性肽、氨基酸等小分子物质,紫苏饼中富含的活性物质可以更好地在机体内释放,用以清除各种氧化自由基。所以本研究发现,大鲵的肠肝抗氧化能力总体趋势表现为“发酵紫苏饼组>紫苏饼组>对照组”。因此,可得出紫苏饼和发酵紫苏饼均具有提高大鲵对有氧代谢过程产生的超氧阴离子自由基的清除能力,这种自由基可侵犯细胞膜、血管壁、蛋白质、脂肪,甚至细胞核中的DNA。也有助于实现氧化与抗氧化系统达到平衡,促进细胞在受到各种有害刺激时的损伤后的修复,从而有益于肠肝的健康。
3.4 紫苏饼和发酵紫苏饼提高了大鲵肝脏和免疫功能紫苏籽中含有丰富的α-亚麻酸、紫苏醛、木犀草素和迷迭香酸等活性成分,这些活性成分在提高机体免疫力,降低脂质过氧化及保护肝脏方面效果显著[9-12]。宋代军等[13]研究发现,在肉仔鸡基础饲粮中添加紫苏籽提取物可以显著增强肉仔鸡的免疫能力,并推测与紫苏籽提取物中多种活性成分密切相关。而紫苏饼是紫苏籽榨油后的副产物,紫苏籽中多种活性成分残余至其中。本试验中,紫苏饼和发酵紫苏饼添加后大鲵血浆IgM含量有显著提升,转氨酶活性显著降低,NO(氮自由基)含量差异不显著。这说明紫苏饼对大鲵同样具有提高特异性免疫力,维护肝脏健康的作用。
3.5 紫苏饼和发酵紫苏饼优化了大鲵脂质代谢部分指标动物机体脂质代谢的紊乱对机体健康存在巨大威胁。中医药学方面的研究已证实,紫苏饼中富含的黄酮类化合物具有调节脂质代谢的能力[14]。本试验中,紫苏饼组和发酵紫苏饼组的大鲵血浆TC、TG和LDL-C含量显著降低,脂质代谢状况得到明显改善。这说明在大鲵饲料中添加适量紫苏饼,可减少胆固醇在血管中的积累,提高鲵体健康水平。
4 结论本试验条件下,饲料中添加5%的紫苏饼或发酵紫苏饼能促进大鲵生长性能,且发酵紫苏饼的综合效果优于紫苏饼。二者均具有增强胃肠消化吸收能力及肠道屏障功能,增强机体抗氧化、免疫能力和降低胆固醇的作用。
| [1] |
王双, 李战福, 李虹, 等. 大鲵幼体蛋白质的需求量[J]. 水产学报, 2020, 44(1): 99-110. WANG S, LI Z F, LI H, et al. Dietary protein requirement of juvenile giant salamander (Andrias davidianus)[J]. Journal of Fisheries of China, 2020, 44(1): 99-110 (in Chinese). |
| [2] |
LI Z F, CHEN X C, CHEN Y J, et al. Effects of dietary mulberry leaf extract on the growth, gastrointestinal, hepatic functions of Chinese giant salamander (Andrias davidianus)[J]. Aquaculture Research, 2020, 51(6): 2613-2623. DOI:10.1111/are.14639 |
| [3] |
岳崟, 郝靖, 杜天宇, 等. 紫苏叶促进大鼠肠胃消化吸收作用的研究[J]. 武汉轻工大学学报, 2014, 33(1): 21-25. YUE Y, HAO J, DU T Y, et al. Effect of perilla leaf on promoting rats gastrointestinal digestion and absorption[J]. Journal of Wuhan Polytechnic University, 2014, 33(1): 21-25 (in Chinese). DOI:10.3969/j.issn.2095-7386.2014.01.006 |
| [4] |
朴颖, 费宏扬, 权海燕. 紫苏叶提取物对肥胖小鼠的影响及作用机制[J]. 中华中医药杂志, 2017, 32(9): 3992-3996. PIAO Y, FEI H Y, QUAN H Y. Effects and mechanism research on Perillae folium extract in obese mice[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(9): 3992-3996 (in Chinese). |
| [5] |
潘存霞, 谢君. 紫苏籽提取物对肉鸡生长性能和鸡肉品质的影响[J]. 饲料工业, 2011, 32(21): 12-14. PAN C X, XIE J. Effect of Perilla frutescens extract on growth performance and meat quality of broilers[J]. Feed Industry, 2011, 32(21): 12-14 (in Chinese). DOI:10.3969/j.issn.1001-991X.2011.21.005 |
| [6] |
张皓迪, 王双, 李虹, 等. 配合饲料和鲢鱼肉对大鲵生长的比较试验[J]. 水生生物学报, 2021, 45(1): 146-152. ZHANG H D, WANG S, LI H, et al. Comparative experiment on formulated diet and silver carp meat for growth of the giant salamander (Andrias davidianus)[J]. Acta Hydrobiologica Sinica, 2021, 45(1): 146-152 (in Chinese). |
| [7] |
吴莉芳, 秦贵信, 刘春力, 等. 饲料大豆蛋白对鲤鱼消化酶活力和血液主要生化指标的影响[J]. 西北农林科技大学学报(自然科学版), 2009, 37(8): 63-69. WU L F, QIN G X, LIU C L, et al. Effects of dietary soybean protein on the activity of digestive enzyme and blood biochemical parameters of carp[J]. Journal of Northwest A & F University (Natural Science Edition), 2009, 37(8): 63-69 (in Chinese). |
| [8] |
田海娟, 高琼, 李一鸣, 等. 混菌发酵紫苏粕总黄酮提取优化及抗氧化性的研究[J]. 粮食与油脂, 2020, 33(12): 106-110. TIAN H J, GAO Q, LI Y M, et al. Study on extraction and antioxidant of total flavonoids from fermented Perilla meal by mixed bacteria[J]. Cereals & Oils, 2020, 33(12): 106-110 (in Chinese). DOI:10.3969/j.issn.1008-9578.2020.12.029 |
| [9] |
DIPASQUALE D, BASIRICÒ L, MORERA P, et al. Anti-inflammatory effects of conjugated linoleic acid isomers and essential fatty acids in bovine mammary epithelial cells[J]. Animal, 2018, 12(10): 2108-2114. DOI:10.1017/S1751731117003676 |
| [10] |
FUYUNO Y, UCHI H, YASUMATSU M, et al. Perillaldehyde inhibits AHR signaling and activates NRF2 antioxidant pathway in human keratinocytes[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 9524657. |
| [11] |
周亮, 乔印玲, 王莉, 等. 木犀草素通过抑制PTEN PI3K-AKT信号通路以及对免疫功能的调节作用介导对肺癌模型大鼠的干预研究[J]. 天然产物研究与开发, 2017, 29(12): 2128-2133, 2140. ZHOU L, QIAO Y L, WANG L, et al. Effects of luteolin on the expression of PTEN PI3K-AKT signaling pathway and immune function in lung cancer model rats[J]. Natural Product Research and Development, 2017, 29(12): 2128-2133, 2140 (in Chinese). |
| [12] |
ROCHA J, EDUARDO-FIGUEIRA M, BARATEIRO A, et al. Anti-inflammatory effect of rosmarinic acid and an extract of Rosmarinus officinalis in rat models of local and systemic inflammation[J]. Basic & Clinical Pharmacology & Toxicology, 2015, 116(5): 398-413. |
| [13] |
宋代军, 谢君, 杨游, 等. 紫苏籽提取物对肉鸡免疫机能的影响[J]. 中国兽医学报, 2014, 34(5): 793-797, 803. SONG D J, XIE J, YANG Y, et al. Effect of Perilla frutescens extract on immunity function of broilers[J]. Chinese Journal of Veterinary Science, 2014, 34(5): 793-797, 803 (in Chinese). |
| [14] |
何佳奇, 李效贤, 熊耀康. 紫苏总黄酮提取物对四氧嘧啶致糖尿病小鼠糖脂代谢及抗氧化水平的影响[J]. 中华中医药学刊, 2011(7): 1667-1669. HE J Q, LI X X, XIONG Y K. Effects of total flavonoids of Perilla frutescens leaves on blood glucose blood lipids and serum SOD, MDA leaves in alloxan induced diabetic mice[J]. Chinese Archives of Traditional Chinese Medicine, 2011(7): 1667-1669 (in Chinese). |




