我国是世界养鹅大国,2021年世界肉鹅出栏量约6.6亿只,我国商品鹅出栏5.7亿只[1]。除了养殖和消费数量大,我国鹅品种丰富、地方特色鲜明,本文所选用的皖西白鹅享有“世界珍禽”称号,1981年首批列入《中国家禽品种志》,其羽绒质量得到了世界公认[2],具有抗病力强、幼龄生长速度快、耐粗饲等特点。但是,随着鹅养殖的规模化,鹅肠道性疾病(鹅副黏病毒病、鹅大肠杆菌病、新型病毒性肠炎等)激增。大量研究表明,一些氨基酸除了参与合成动物体蛋白,还具有调控免疫功能和影响肠道健康作用。异亮氨酸可以减轻断奶仔猪模型中的轮状病毒感染和免疫反应,改善生长性能和免疫功能[3],提高鱼类肠道淀粉酶和胃蛋白酶活性[4]。苏氨酸参与机体蛋白质合成和免疫等生理功能[5]。同时,作为肠道黏蛋白的重要组成部分,苏氨酸可改善仔猪、鸡和鸭的小肠组织形态[6-7],维持空肠形态的完整性和修复大肠杆菌引起的绒毛损伤[8],调节蛋鸡肠道微生物种群[9]。上述研究为苏氨酸和异亮氨酸的功能提供了重要线索,但二者在皖西白鹅中的研究和应用较少。与鸡和鸭不同,鹅作为草食性动物,盲肠的结构和功能对其健康和生长具有重要作用。因此,本试验旨在研究苏氨酸和异亮氨酸对生长期皖西白鹅生长性能、盲肠组织结构、细胞因子和微生物区系的影响,为氨基酸在鹅饲粮中应用提供借鉴,也为鹅肠道性疾病的营养性预防提供一定的理论依据。
1 材料与方法 1.1 试验设计与饲养管理选取30日龄皖西白鹅(购自六安市皖西白鹅原种场)180只,随机分为3组,每组3个重复,每个重复20只,各重复之间体重接近。对照组饲喂基础饲粮;试验组分为苏氨酸组和异亮氨酸组,苏氨酸组在基础饲粮中添加2.0 g/kg的苏氨酸,异亮氨酸组在基础饲粮中添加2.5 g/kg的异亮氨酸。苏氨酸和异亮氨酸纯度均为98%,添加形式分别为L-苏氨酸和L-异亮氨酸。试验期60 d。饲养场地包含鹅舍、运动场和水池。皖西白鹅自由采食、充足饮水,按正常免疫程序进行免疫接种。饲粮营养水平参考《中国饲料成分及营养价值表(2019年第30版)》[10]计算,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验第30天和第60天,每个重复随机选取2只鹅,每组共6只鹅,颈静脉放血处死,取左、右2段盲肠中段组织,一段置于4%多聚甲醛中固定,一段置于-80 ℃冰箱中保存。取中段盲肠食糜,置于灭菌EP管里,置于液氮中保存,待测。
1.3 检测指标与方法 1.3.1 生长性能每天记录皖西白鹅采食量,每15 d称1次空腹体重,计算平均日采食量(average daily feed intake,ADFI)、平均日增重(average daily gain,ADG)和料重比(feed/gain,F/G)。
1.3.2 盲肠组织形态取固定24 h后的皖西白鹅盲肠组织,自来水冲洗24 h,经过乙醇梯度脱水、二甲苯透明、石蜡包埋等处理后,以5 μm的厚度切片,常规苏木精-伊红(HE)染色。使用正置荧光显微镜(BX63,日本Olympus公司)对切片进行拍照,每张切片选择5个视野,使用Image-Pro Plus 6.0软件(Media,美国Cybernetics公司)测量盲肠绒毛高度、隐窝深度,计算绒毛高度/隐窝深度(V/C)。
1.3.3 盲肠细胞因子含量取盲肠中段组织0.1 g,按1 ∶ 9质量体积比加匀浆介质,制备10%组织匀浆,3 000 r/min离心10 min,取上清,采用酶联免疫吸附测定(ELISA)法和酶标仪(Multiskan,美国Thermo Fisher Scientific公司)检测盲肠组织上清液中免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、分泌型免疫球蛋白A(SIgA)、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、白细胞介素-2(IL-2)、白细胞介素-4(IL-4)含量。
1.3.4 盲肠内容物16S rRNA高通量测序取中段盲肠食糜,将样品送至深圳微生太科技有限公司,使用DNA抽提试剂盒E.Z.N.A.® Soil DNA Kit(美国Omega Bio-Tek公司)提取DNA,以16S rRNA V3~V4区为目标片段,扩增引物为338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)。运用QIIME2 demux插件对不同样本的序列进行拆分[11]。将拆分后的序列,运用QIIME2 dada2插件进行质控、修剪、去噪、拼接以及去除嵌合体后,得到最终的特征序列[12]。
1.4 数据统计分析试验数据采用SPSS 25.0软件进行单因素方差分析(one-way ANOVA)和LSD多重比较,试验数据用平均值±标准误(mean±SE)表示,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 苏氨酸和异亮氨酸对皖西白鹅生长性能的影响由表 2可知,各组之间30、60、90日龄体重无显著差异(P>0.05)。各组之间30~60日龄ADG、F/G无显著差异(P>0.05),异亮氨酸组30~60日龄ADFI显著高于苏氨酸组(P<0.05)。各组之间61~90日龄ADG、ADFI无显著差异(P>0.05),苏氨酸组和异亮氨酸组61~90日龄F/G极显著低于对照组(P<0.01)。各组之间30~90日龄ADG、ADFI、F/G无显著差异(P>0.05)。
|
|
表 2 苏氨酸和异亮氨酸对皖西白鹅生长性能的影响 Table 2 Effects of threonine and isoleucine on growth performance of Wanxi white geese |
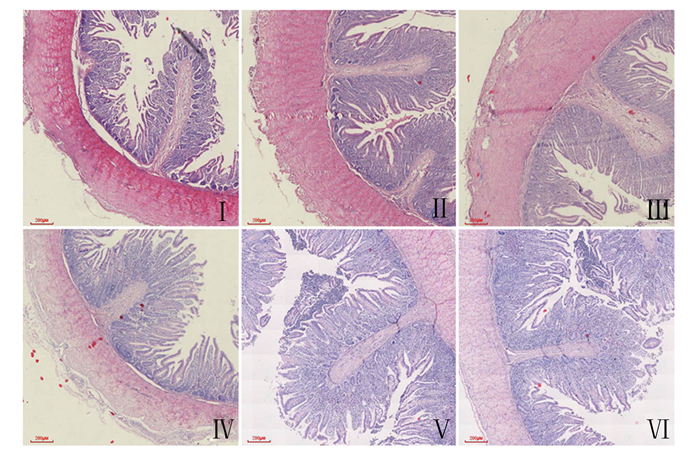
通过观察组织切片(图 1),盲肠管壁分为黏膜层、黏膜下层、肌层和浆膜。盲肠黏膜层绒毛较少,肠腺长而直,比较密集。
|
Ⅰ:60日龄对照组;Ⅱ:60日龄苏氨酸组;Ⅲ:60日龄异亮氨酸组;Ⅳ:90日龄对照组;Ⅴ:90日龄苏氨酸组;Ⅵ:90日龄异亮氨酸组。比例尺:200 μm。 Ⅰ: control group at 60 days of age; Ⅱ: threonine group at 60 days of age; Ⅲ: isoleucine group at 60 days of age; Ⅳ: control group at 90 days of age; Ⅴ: threonine group at 90 days of age; Ⅵ: isoleucine group at 90 days of age. Scale bar: 200 μm. 图 1 皖西白鹅盲肠组织结构 Fig. 1 Cecum morphology of Wanxi white geese |
由表 3可知,60日龄时,异亮氨酸组盲肠绒毛高度极显著高于对照组(P < 0.01),显著高于苏氨酸组(P < 0.05);异亮氨酸组盲肠隐窝深度显著高于对照组(P < 0.05);各组之间盲肠绒毛高度/隐窝深度无显著差异(P>0.05)。90日龄时,苏氨酸组盲肠绒毛高度显著高于异亮氨酸组(P < 0.05),苏氨酸组盲肠隐窝深度显著高于对照组和异亮氨酸组(P>0.05),苏氨酸组和异亮氨酸组盲肠绒毛高度/隐窝深度显著低于对照组(P<0.05)。
|
|
表 3 苏氨酸和异亮氨酸对皖西白鹅盲肠组织形态的影响 Table 3 Effects of threonine and isoleucine on cecum histomorphology of Wanxi white geese |
由表 4可知,90日龄时,各组之间盲肠IgG、IgA、IgM、SIgA、IL-2含量无显著差异(P>0.05),苏氨酸组和异亮氨酸组盲肠TNF-α含量显著低于对照组(P < 0.05),苏氨酸组盲肠IFN-γ显著高于对照组(P < 0.05),苏氨酸组盲肠IL-4含量显著高于对照组(P < 0.05)。
|
|
表 4 苏氨酸和异亮氨酸对90日龄皖西白鹅盲肠细胞因子含量的影响 Table 4 Effects of threonine and isoleucine on cecum cytokines contents of Wanxi white geese at 90 days of age |
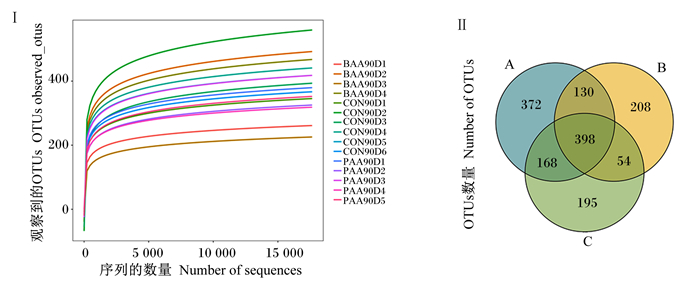
由图 2-Ⅰ可知,序列数量在5 000个以内各组OTUs数量增长较多,在序列数量超过5 000个以后,OTUs数量增加较平缓,序列数量已基本覆盖样品细菌物质,各个样品丰富度差异较大。
|
CON90D1~CON90D6代表对照组6个样品,BAA90D1~BAA90D4代表苏氨酸组4个样品,PAA90D1~PAA90D5代表异亮氨酸组5个样品。A、B、C分别代表对照组、苏氨酸组、异亮氨酸组。下图同。 CON90D1 to CON90D6 represent 6 samples of control group, BAA90D1 to BAA90D4 represent 4 samples of threonine group, and PAA90D1 to PAA90D5 represent 5 samples of isoleucine group. A, B and C represent control group, threonine group and isoleucine group, respectively. The same as below. 图 2 物种稀释曲线(Ⅰ)和OTUs韦恩图(Ⅱ) Fig. 2 Rarefaction curves of species (Ⅰ) and Venn diagram of OTUs (Ⅱ) |
由图 2-Ⅱ可知,在相似度97%的水平下,共鉴定5 580个OTUs,每个样本平均有(372±22)个。对照组和苏氨酸组共有528个相同的OTUs,苏氨酸组和异亮氨酸组共有452个相同的OTUs,对照组和异亮氨酸组有452个相同的OTUs,3组共有398个相同的OTUs。
2.4.2 各组盲肠样品alpha多样性分析由表 5可知,各组之间盲肠菌群Chao1指数、Shannon指数、Simpson指数无显著差异(P>0.05)。
|
|
表 5 90日龄皖西白鹅盲肠菌群alpha多样性分析 Table 5 Analysis of alpha diversity of cecum flora of Wanxi white geese at 90 days of age |
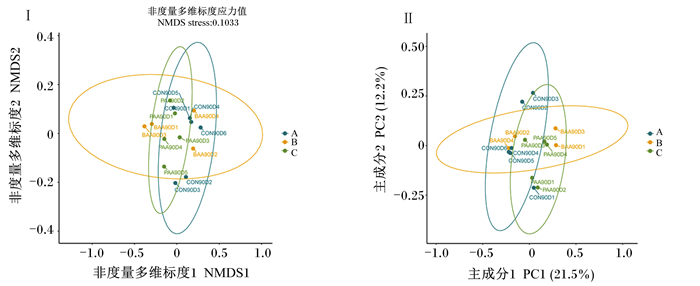
盲肠菌群beta多样性的主坐标分析(PCoA)和无度量多维标定法(NMDS)分析结果如图 3所示,图中每1个点代表 1个样本,相同颜色的点为同1个分组,2点之间得到距离越近表明二者的群落构成差异越小。当应力值(stress)<0.2时,说明数据可靠。通过NMDS分析和PCoA,显示样本相似性较好。主成分1贡献率约为21.5%,主成分2贡献率约为12.2%。
|
图 3 90日龄皖西白鹅盲肠菌群beta多样性 Fig. 3 Cecum flora beta diversity of Wanxi white geese at 90 days of age |
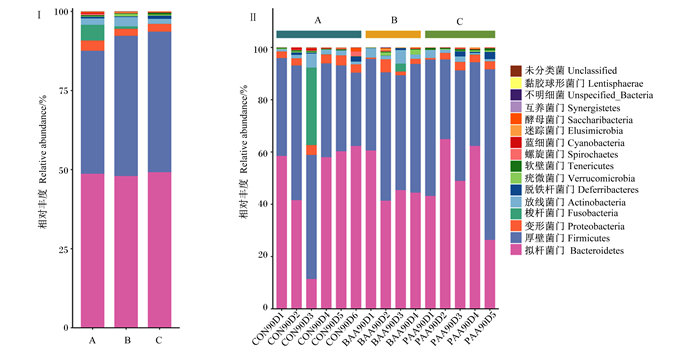
皖西白鹅盲肠微生物在门水平上组成如图 4所示,16个门中排名靠前的优势菌门有拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)、螺旋菌门(Spirochaetes)、脱铁杆菌门(Deferribacteres)、疣微菌门(Verrucomicrobia)。各组最优势地位的菌门均为拟杆菌门,次级优势地位的菌门为厚壁菌门,从整体上看,苏氨酸组和异亮氨酸组的厚壁菌门相对丰度大于对照组。
|
图 4 各组(Ⅰ)和各样品(Ⅱ)皖西白鹅盲肠菌群在门水平上的相对丰度 Fig. 4 Relative abundance of cecum flora at phylum level of Wanxi white geese in each group (Ⅰ) and each sample (Ⅱ) |
由表 6可知,90日龄时,异亮氨酸组盲肠软壁菌门(Tenericutes)相对丰度极显著高于对照组和苏氨酸组(P < 0.01)。各组之间盲肠其余菌门相对丰度无显著差异(P>0.05)。
|
|
表 6 90日龄皖西白鹅盲肠菌群门水平相对丰度 Table 6 Relative abundance of cecum flora at phylum level of Wanxi white geese at 90 days of age |
皖西白鹅盲肠微生物在属水平上组成如图 5所示,在属水平上物种注释共获得21个属,位于前10的优势菌属分别为:拟杆菌属(Bacteroides)、瘤胃球菌科未分类菌属(unspecified_Ruminococcaceae)、粪杆菌属(Faecalibacterium)、颤螺旋菌属(Oscillospira)、普雷沃菌属(Prevotella)、梭菌未分类属(unspecified_Clostridiales)、拟杆菌未分类属(unspecified_Bacteroidales)、瘤胃球菌属(Ruminococcus)、罕见小球菌属(Subdoligranulum)、消化球菌属(Peptococcus)。
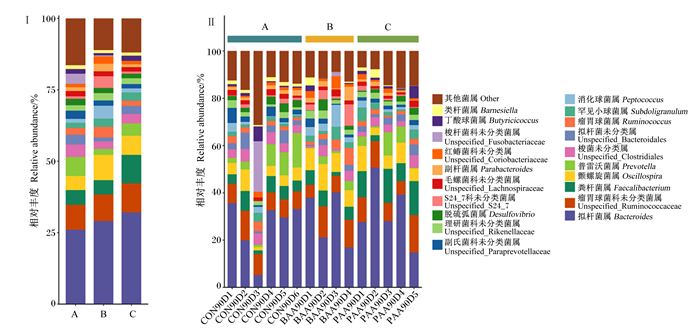
|
图 5 各组(Ⅰ)和各样品(Ⅱ)皖西白鹅盲肠菌群在属水平上的相对丰度 Fig. 5 Relative abundance of cecum flora at genus level of Wanxi white geese in each group (Ⅰ) and each sample (Ⅱ) |
由表 7可知,90日龄时,苏氨酸组盲肠颤螺旋菌属、消化球菌属和S24_7科未分类菌属(unspecified_S24_7)相对丰度显著高于对照组(P < 0.05)。苏氨酸组盲肠消化球菌属和S24_7科未分类菌属相对丰度显著异高于异亮氨酸组(P < 0.05)。各组之间盲肠其余菌属相对丰度无显著差异(P>0.05)。
|
|
表 7 90日龄皖西白鹅盲肠菌群属水平相对丰度 Table 7 Relative abundance of cecum flora at genus level of Wanxi white geese at 90 days of age |
作为功能性氨基酸,苏氨酸和异亮氨酸可改善畜禽生长性能。额外补充苏氨酸和异亮氨酸可提高仔猪和育肥猪的生长性能[13-14]。Lin等[15]研究发现,饲粮中添加5.5、5.7、6.9和8.1 g/kg的异亮氨酸可显著增加黄羽肉鸡体重。本试验发现,饲粮中添加异亮氨酸提高了30~60日龄皖西白鹅的ADFI,饲粮中添加异亮氨酸和苏氨酸均降低了61~90日龄皖西白鹅的F/G。苏氨酸是胃肠道黏蛋白的重要组成部分,在调节营养代谢、大分子生物合成和肠道平衡方面起着重要作用[16]。异亮氨酸在整个机体的生理功能中起着生长、免疫、蛋白质代谢、脂肪酸代谢和葡萄糖运输等功能,其还可以改善免疫功能[17]。异亮氨酸对葡萄糖和脂质代谢有显著影响,低水平的异亮氨酸会降低禽类的体重,相反,高水平的异亮氨酸可以改善畜禽的脂质和葡萄糖代谢,减少脂肪积累[18-20]。前人报道和本试验结果均表明,适宜水平的苏氨酸和异亮氨酸可提高畜禽的生长性能,异亮氨酸和苏氨酸提高皖西白鹅生长性能的可能机制是与盲肠微生物组成和组织结构变化有关,后文将进行深入讨论。另外,基于此2种氨基酸在鹅体内代谢特点研究较少,下一步可探究苏氨酸和异亮氨酸在鹅体内的消化代谢特点及其生物学功能。
3.2 苏氨酸和异亮氨酸对皖西白鹅盲肠组织形态和细胞因子含量的影响与哺乳动物不同,禽类盲肠结构具有皱襞和绒毛。鹅是草食性的家禽,盲肠是其消化纤维并吸收的主要部位。因此,盲肠的组织结构和盲肠内微生物对鹅的生长和健康有重要的作用。肠道的绒毛高度、隐窝深度和绒毛高度/隐窝深度是衡量肠道消化吸收的重要指标[18-21]。Tang等[16]发现额外补充苏氨酸会增加空肠绒毛高度与隐窝深度的比率。我们前期研究发现,饮水中添加2.5 mg/mL异亮氨酸显著提高了小肠的绒毛高度和绒毛高度/隐窝深度,显著降低了隐窝深度[22]。但是关于氨基酸对水禽尤其鹅的盲肠结构和功能影响的研究较为缺乏。本试验发现,饲粮中添加异亮氨酸提高了60日龄皖西白鹅盲肠绒毛高度,饲粮中添加苏氨酸对鹅盲肠绒毛高度和隐窝深度影响不显著。盲肠属于消化道后端,绒毛比前段的短,盲肠主要依靠微生物消化,所以盲肠菌群是其消化能力的体现。
Azzam等[23]发现补充苏氨酸显著增加了蛋鸡回肠IgM、IgG和SIgA含量。Dong等[24]发现饲粮中添加1.0、2.0、3.0和4.0 g/kg的异亮氨酸对血清IgM、IgG和SIgA含量无显著影响,对回肠SIgA、TNF-α、IL-2含量无显著影响。本试验发现,各组之间盲肠IgG、IgA、IgM、SIgA、IL-2含量无显著差异,与对照组相比,苏氨酸组和异亮氨酸组的盲肠TNF-α含量显著下降,苏氨酸组的盲肠IL-2、IFN-γ含量显著增加。TNF-α是肠道黏膜免疫中的促炎因子,过多会造成不必要的炎症反应,使血管通透性增加、细胞损伤,影响动物的健康;IL-2、IL-4在抗肿瘤调节起到了至关重要的作用。苏氨酸组盲肠IFN-γ含量显著增加,与Wils-Plotz等[25]研究结果相反,Wils-Plotz等[25]发现添加高苏氨酸组的感染球虫病肉鸡盲肠扁桃体IFN-γ基因的表达最低。IFN-γ是一种病毒抑制性细胞因子[26],IFN-γ含量高说明体内病毒含量也高。IFN-γ主要是由自然杀伤(NK)细胞和T淋巴细胞产生的[27],在NK和T淋巴细胞中白细胞介素-12(IL-12)和白细胞介素-18(IL-18)结合会进一步增加IFN-γ的产生[28],而IL-2有刺激NK和T淋巴细胞增殖的作用,本试验的苏氨酸组盲肠IFN-γ含量显著高于对照组,可能与苏氨酸组盲肠IL-2含量显著升高有关。这说明皖西白鹅额外添加苏氨酸和异亮氨酸对皖西白鹅免疫功能有一定影响。
3.3 苏氨酸和异亮氨酸对皖西白鹅盲肠微生物区系的影响鹅能消化利用纤维素主要依赖于肠道微生物[29]。多样性高的肠道微生物宿主可能更健康[30]。多种因素可以影响鹅盲肠微生物,在养殖水体中添加光合细菌可以显著改变扬州鹅肠道菌群结构[31]。在门水平上,厚壁菌门、变形菌门和拟杆菌门是鹅的主要肠道菌群,强制喂食加糖饲粮可以使天府肉鹅空肠厚壁菌门相对丰度增加,盲肠拟杆菌门相对丰度增加[32];在基础饲粮添加5%木薯叶处理对海南本地鹅盲肠中的微生物群落有显著影响[33]。
鹅利用纤维素是肠道中的微生物分泌消化酶,特别是纤维素酶,其盲肠的纤维素酶活性最高[34]。类杆菌属、瘤胃球菌属、梭状芽孢杆菌属和假单胞菌属是重要的纤维素分解细菌[35]。本研究发现,苏氨酸组和异亮氨酸组的盲肠瘤胃球菌科未分类菌属相对丰度较对照组都有提高,同时苏氨酸组的盲肠消化球菌属相对丰度显著高于对照组,说明饲喂苏氨酸和异亮氨酸可以提高纤维素的消化能力。饲粮中添加苏氨酸和异亮氨酸后皖西白鹅的生长性能提高可能与盲肠内菌群变化有关,苏氨酸和异亮氨酸都增加了盲肠内厚壁菌门、拟杆菌属和颤螺旋菌属相对丰度。首先,厚壁菌门与从饲料中获取能量和养分吸收(如不溶性纤维降解)的能力有关[36];其次,拟杆菌属能促进肠道食糜分解,提高其利用率,提高免疫能力,维持肠道维生态平衡[37];再次,颤螺旋菌能将糖、淀粉等发酵转化为短链脂肪酸,短链脂肪酸作为肠上皮细胞的首选能量,能抑制肠炎保护肠上皮细胞,对肠道健康具有重要作用[38]。盲肠微生物菌群的变化也影响盲肠组织结构的改变,包括绒毛生长和隐窝深度变化,另外,由于微生物组成改变造成细菌对盲肠上皮刺激改变,因此盲肠的免疫功能相关因子表达水平也受到影响。
4 结论① 饲粮中添加2.0 g/kg苏氨酸或2.5 g/kg异亮氨酸均可一定程度提高皖西白鹅生长性能,异亮氨酸对60日龄盲肠组织结构的影响较大,苏氨酸对90日龄盲肠组织结构的影响较大。
② 饲粮中添加2.5 g/kg异亮氨酸增加了皖西白鹅盲肠软壁菌门相对丰度,饲粮中添加2.0 g/kg苏氨酸增加了皖西白鹅盲肠颤螺旋菌属、消化球菌属和S24_7科未分类菌属相对丰度。
| [1] |
侯水生, 刘灵芝. 2021年水禽产业现状、未来发展趋势与建议[J]. 中国畜牧杂志, 2022, 58(3): 227-231, 238. HOU S S, LIU L Z. 2021 Waterfowl industry status, future development trends and proposals[J]. Chinese Journal of Animal Science, 2022, 58(3): 227-231, 238 (in Chinese). DOI:10.19556/j.0258-7033.20220215-07 |
| [2] |
江一鸣, 朱喜. 做实白鹅产业促进区域发展[N]. 消费日报, 2020-06-17(B01). JIANG Y M, ZHU X. Make the white goose industry realistic and promote regional development[N]. Consumption Daily, 2020-06-17(B01). |
| [3] |
MAO X B, GU C S, REN M, et al. L-isoleucine administration alleviates rotavirus infection and immune response in the weaned piglet model[J]. Frontiers in Immunology, 2018, 9: 1654. DOI:10.3389/fimmu.2018.01654 |
| [4] |
黄忠, 周传朋, 林黑着, 等. 饲料异亮氨酸水平对卵形鲳鲹消化酶活性和免疫指标的影响[J]. 南方水产科学, 2017, 13(1): 50-57. HUANG Z, ZHOU C P, LIN H Z, et al. Effects of dietary isoleucine levels on activities of digestive enzymes and immune index of Trachinotus ovatus[J]. South China Fisheries Science, 2017, 13(1): 50-57 (in Chinese). DOI:10.3969/j.issn.2095-0780.2017.01.007 |
| [5] |
SCHAART M W, SCHIERBEEK H, VAN DER SCHOOR S R D, et al. Threonine utilization is high in the intestine of piglets[J]. The Journal of Nutrition, 2005, 135(4): 765-770. DOI:10.1093/jn/135.4.765 |
| [6] |
刘升国, 曲正祥, 蒙国华, 等. 苏氨酸对肉鸡肠道形态、黏膜免疫及黏蛋白表达的影响[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集. 武汉: 中国畜牧兽医学会, 2016: 289. LIU S G, QU Z X, MENG G H, et al. Effect of threonine on intestinal morphology, mucosal immunity and mucin expression in broiler chickens[C]//Proceedings of the 12th Animal Nutrition Symposium of the Animal Nutrition Branch of the Chinese Society of Animal Husbandry and Veterinary Medicine. Wuhan: Chinese Association of Animal Science and Veterinary Medicine, 2016: 289. (in Chinese) |
| [7] |
任曼, 吕照勇, 史凯, 等. 异亮氨酸对大鼠空肠形态和抗菌肽表达的影响[J]. 安徽科技学院学报, 2016, 30(4): 6-10. REN M, LV Z Y, SHI K, et al. Modulation of isoleucine on intestinal morphology and antimicrobial peptide expression in rat jejunum[J]. Journal of Anhui Science and Technology University, 2016, 30(4): 6-10 (in Chinese). DOI:10.3969/j.issn.1673-8772.2016.04.002 |
| [8] |
REN M, LIU X T, WANG X, et al. Increased levels of standardized ileal digestible threonine attenuate intestinal damage and immune responses in Escherichia coli K88+ challenged weaned piglets[J]. Animal Feed Science and Technology, 2014, 195: 67-75. DOI:10.1016/j.anifeedsci.2014.05.013 |
| [9] |
DONG X Y, AZZAM M M M, ZOU X T. Effects of dietary threonine supplementation on intestinal barrier function and gut microbiota of laying hens[J]. Poultry Science, 2017, 96(10): 3654-3663. DOI:10.3382/ps/pex185 |
| [10] |
佚名. 中国饲料成分及营养价值表(2019年第30版)[J]. 中国饲料, 2019(22): 111-116. Anon. Tables of feed composition and nutritive in China (2019 thirty edition)[J]. China Feed, 2019(22): 111-116 (in Chinese). DOI:10.15906/j.cnki.cn11-2975/s.20192225 |
| [11] |
CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [12] |
CALLAHAN B J, MCMURDIE P J, ROSEN M J, et al. DADA2:high-resolution sample inference from Illumina amplicon data[J]. Nature Methods, 2016, 13(7): 581-583. DOI:10.1038/nmeth.3869 |
| [13] |
KERKAERT H R, CEMIN H S, WOODWORTH J C, et al. Improving performance of finishing pigs with added valine, isoleucine, and tryptophan: validating a meta-analysis model[J]. Journal of Animal Science, 2021, 99(1): skab006. DOI:10.1093/jas/skab006 |
| [14] |
ZHANG H, CHEN Y P, LI Y, et al. L-threonine improves intestinal mucin synthesis and immune function of intrauterine growth-retarded weanling piglets[J]. Nutrition, 2019, 59: 182-187. DOI:10.1016/j.nut.2018.07.114 |
| [15] |
LIN X J, LI L, GOU Z Y, et al. Reproductive performance, metabolism and oxidative stress profile in Chinese yellow-feathered broiler breeder hens fed multiple levels of isoleucine[J]. British Poultry Science, 2021, 62(4): 509-516. DOI:10.1080/00071668.2021.1894322 |
| [16] |
TANG Q, TAN P, MA N, et al. Physiological functions of threonine in animals: beyond nutrition metabolism[J]. Nutrients, 2021, 13(8): 2592. DOI:10.3390/nu13082592 |
| [17] |
GU C S, MAO X B, CHEN D W, et al. Isoleucine plays an important role for maintaining immune function[J]. Current Protein & Peptide Science, 2019, 20(7): 644-651. |
| [18] |
ZHANG Y Y, GUO K Y, LEBLANC R E, et al. Increasing dietary leucine intake reduces diet-induced obesity and improves glucose and cholesterol metabolism in mice via multimechanisms[J]. Diabetes, 2007, 56(6): 1647-1654. DOI:10.2337/db07-0123 |
| [19] |
LAYMAN D K, WALKER D A. Potential importance of leucine in treatment of obesity and the metabolic syndrome[J]. The Journal of Nutrition, 2006, 136(Suppl.1): 319S-323S. |
| [20] |
NISHIMURA J, MASAKI T, ARAKAWA M, et al. Isoleucine prevents the accumulation of tissue triglycerides and upregulates the expression of PPARalpha and uncoupling protein in diet-induced obese mice[J]. The Journal of Nutrition, 2010, 140(3): 496-500. DOI:10.3945/jn.109.108977 |
| [21] |
KLUESS J W, KAHLERT S, KRVGER J, et al. Postweaning development of porcine small intestinal morphology and epithelial cell proliferation[J]. Journal of Animal Science, 2016, 94(Suppl.3)): 416--422. |
| [22] |
任曼, 杨亚南, 赵春芳, 等. 异亮氨酸调控大鼠小肠黏膜形态和结构的作用机制[J]. 科学通报, 2022, 67(6): 520-527. REN M, YANG Y N, ZHAO C F, et al. The regulatory mechanism of isoleucine on the mucosal morphology and structure of rat intestine[J]. Chinese Science Bulletin, 2022, 67(6): 520-527 (in Chinese). |
| [23] |
AZZAM M M M, ZOU X T, DONG X Y, et al. Effect of supplemental L-threonine on mucin 2 gene expression and intestine mucosal immune and digestive enzymes activities of laying hens in environments with high temperature and humidity[J]. Poultry Science, 2011, 90(10): 2251-2256. DOI:10.3382/ps.2011-01574 |
| [24] |
DONG X Y, AZZAM M M M, ZOU X T. Effects of dietary L-isoleucine on laying performance and immunomodulation of laying hens[J]. Poultry Science, 2016, 95(10): 2297-2305. DOI:10.3382/ps/pew163 |
| [25] |
WILS-PLOTZ E L, JENKINS M C, DILGER R N. Modulation of the intestinal environment, innate immune response, and barrier function by dietary threonine and purified fiber during a coccidiosis challenge in broiler chicks[J]. Poultry Science, 2013, 92(3): 735-745. DOI:10.3382/ps.2012-02755 |
| [26] |
WHEELOCK E F, SIBLEY W A. Circulating virus, interferon and antibody after vaccination with the 17-D strain of yellow-fever virus[J]. The New England Journal of Medicine, 1965, 273: 194-198. DOI:10.1056/NEJM196507222730404 |
| [27] |
FARRAR M A, SCHREIBER R D. The molecular cell biology of interferon-gamma and its receptor[J]. Annual Review of Immunology, 1993, 11: 571-611. DOI:10.1146/annurev.iy.11.040193.003035 |
| [28] |
SCHRODER K, HERTZOG P J, RAVASI T, et al. Interferon-gamma: an overview of signals, mechanisms and functions[J]. Journal of Leukocyte Biology, 2004, 75(2): 163-189. DOI:10.1189/jlb.0603252 |
| [29] |
VOLK N, LACY B. Anatomy and physiology of the small bowel[J]. Gastrointestinal Endoscopy Clinics of North America, 2017, 27(1): 1-13. DOI:10.1016/j.giec.2016.08.001 |
| [30] |
KONSTANTINOV S R, FAVIER C F, ZHU W Y, et al. Microbial diversity studies of the porcine gastrointestinal ecosystem during weaning transition[J]. Animal Research, 2004, 53(4): 317-324. DOI:10.1051/animres:2004019 |
| [31] |
陈倬瑜,吴家,胡璇,等.养殖水体中添加光合细菌对扬州鹅孵化性能、水体净化效率、盲肠微生物多样性的影响[J/OL].中国畜牧杂志:1-13[2022-05-28].https://kns.cnki.net/kcms/detail/detail.aspx?FileName=ZGXM20220422002&DbName=CAPJ2022. DOI:10.19556/j.0258-7033.20211217-04. CHEN Z Y,WU J,HU X,et al.Effects of adding photosynthetic bacteria to breeding water on the hatching performance,water purification efficiency and appendix microbial diversity of Yangzhou geese[J/OL].Chinese Journal of Animal Science:1-13[2022-05-28].https://kns.cnki.net/kcms/detail/detail.aspx?FileName=ZGXM20220422002&DbName=CAPJ2022. DOI:10.19556/j.0258-7033.20211217-04.(in Chinese) |
| [32] |
LU C C, WEI R X, DENG D H, et al. Effect of different types of sugar on gut physiology and microbiota in overfed goose[J]. Poultry Science, 2021, 100(7): 101208. DOI:10.1016/j.psj.2021.101208 |
| [33] |
LI M, ZHOU H L, PAN X Y, et al. Cassava foliage affects the microbial diversity of Chinese indigenous geese caecum using 16S rRNA sequencing[J]. Scientific Reports, 2017, 7(1): 45697. DOI:10.1038/srep45697 |
| [34] |
黄萌, 曹立军, 李伟, 等. 鹅肠道内容物纤维素酶活性的分段比较[J]. 当代畜牧, 2010(1): 27-28. HUANG M, CAO L J, LI W, et al. Segmental comparison of cellulase activities in goose intestinal tract[J]. Contemporary Animal Husbandry, 2010(1): 27-28 (in Chinese). |
| [35] |
DESVAUX M, GUEDON E, PETITDEMANGE H. Cellulose catabolism by Clostridium cellulolyticum growing in batch culture on defined medium[J]. Applied and Environmental Microbiology, 2000, 66(6): 2461-2470. DOI:10.1128/AEM.66.6.2461-2470.2000 |
| [36] |
JIANG D L, LIU L, WANG C L, et al. Raising on water stocking density reduces geese reproductive performances via water bacteria and lipopolysaccharide contaminations in"geese-fish"production system[J]. Agricultural Sciences in China, 2011, 10(9): 1459-1466. DOI:10.1016/S1671-2927(11)60139-9 |
| [37] |
STAPPENBECK T S, HOOPER L V, GORDON J I. Developmental regulation of intestinal angiogenesis by indigenous microbes via Paneth cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(24): 15451-15455. DOI:10.1073/pnas.202604299 |
| [38] |
KAJANDER K, MYLLYLUOMA E, KYRÖNPALO S, et al. Elevated pro-inflammatory and lipotoxic mucosal lipids characterise irritable bowel syndrome[J]. World Journal of Gastroenterology, 2009, 15(48): 6068-6074. DOI:10.3748/wjg.15.6068 |




