2. 仲恺农业工程学院健康养殖创新研究院, 广州 510225;
3. 东北农业大学动物科学技术学院, 哈尔滨 150030;
4. 辽宁省农业发展服务中心, 沈阳 110032
2. Institute of Healthy Breeding and Innovation, Zhongkai College of Agricultural Engineering, Guangzhou 510225, China;
3. College of Animal Science and Technology, Northeast Agricultural University, Harbin 150030, China;
4. Agricultural Development Service Center of Liaoning Province, Shenyang 110032, China
肠道既是鹅进行养分消化吸收、物质新陈代谢的主要器官,又是保持机体内环境稳态的先天性屏障[1],保持肠道健康是实现鹅高效养殖的关键环节之一。然而,在鹅生产周期中高饲料转化率,养殖环境应激(如温度、水体、病原菌入侵)和频繁的免疫程序等,均可导致鹅在机体代谢过程中产生大量的自由基,造成鹅生长性能下降、肠道组织负荷过重等不良后果[2]。尤其是饲料禁抗以来,鹅肠道健康问题日益突出。肠道因其特有的血管解剖结构特点以及对流氧交换机制决定了其在应激状态下更容易发生氧化损伤,表现为肠道结构受损、消化吸收功能下降以及通透性增加等[3-4]。因此,寻找安全、高效的功能性饲料添加剂来提高鹅肠道抗氧化能力显得尤为重要。
茶多酚是茶叶中多酚类物质的总称,主要成分包括黄烷醇类(儿茶素)、黄酮醇类、酚酸类、黄酮类和花色苷类等物质,其中儿茶素占茶多酚总量的65%~80%[5]。茶多酚因结构中含有酚羟基,具有较强的抗氧化能力;除此之外还具有提高免疫力、调节脂质代谢和肠道健康等功效[6]。随着动物营养学的发展,茶多酚作为一种新型绿色饲料添加剂已应用于家禽生产。刘梅等[7]研究表明,茶多酚可以显著提高爱拔益加(AA)肉仔鸡血清抗氧化物酶谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)和过氧化氢酶(CAT)活性并显著降低丙二醛(MDA)含量,进而促进肉鸡机体的抗氧化能力。Wang等[8]研究表明,在1日龄AA肉鸡饲粮中添加儿茶素可通过提高肉鸡的胸腺指数、增加血清免疫球蛋白Y(IgY)和免疫球蛋白A(IgA)含量和上调肉鸡法氏囊中IgY和IgA基因相对表达量,提高肉鸡的抗氧化能力和免疫能力。钟雅静等[9]研究表明,种鸽饲粮添加茶多酚能够改善乳鸽肌肉嫩度和抗氧化能力。付晶等[10]研究表明,饲粮添加适宜剂量茶多酚可以提高乳鸽十二指肠抗氧化能力及物理屏障功能。目前,关于茶多酚在养鹅生产中的应用尤其是对鹅肠道健康的调控作用鲜有报道。本课题组前期研究结果表明,饲粮添加茶多酚对马岗鹅的生长性能无显著影响,此外1 000 mg/kg的茶多酚可以降低腹脂沉积并提高肌肉的抗氧化能力,进而改善马岗鹅的屠宰性能和肌肉品质[11]。鉴于此,本试验通过在马岗鹅基础饲粮中添加不同剂量的茶多酚,观察其对70日龄马岗鹅空肠形态发育、抗氧化能力以及紧密连接蛋白相关基因表达的影响,进一步探讨茶多酚对肠道健康的影响,以期为茶多酚在养鹅生产中的合理应用提供科学依据。
1 材料与方法 1.1 试验材料试验所用茶多酚购自成都某生物有限公司,其纯度为98.7%。
28日龄马岗鹅由广东省清远市金羽丰鹅业有限公司提供。
1.2 试验设计试验采用单因素完全随机分组设计,选取28日龄体况良好、体重基本一致的马岗鹅240只(公母各占1/2),随机分成4组,每组6个重复,每个重复10只鹅。对照组饲喂基础饲粮,低、中、高剂量茶多酚组分别在基础饲粮中添加100、500和1 000 mg/kg茶多酚。试验期共6周,其中预试期1周,正试期5周。
1.3 试验饲粮本试验采用玉米-豆粕-麸皮型基础饲粮,基础饲粮配方参考NRC(1994)鹅的营养需要量并结合广东省马岗鹅的生产经验配制。其营养水平为:代谢能12.16 MJ/kg、粗蛋白质15.00%、水分14.00%、粗灰分7.00%、粗纤维4.80%、钙1.20%、磷0.59%、总赖氨酸0.85%(以上均为计算值)。具体基础饲粮组成见本课题组已发表文献[11]。
1.4 饲养管理饲养试验在广东省清远市金羽丰鹅业有限公司开展。鹅舍包括地面运动场和水池,水池的水每4 d更换1次。试验前用生石灰对鹅舍进行消毒,试验期间按照常规防疫程序进行消毒和防疫。舍内设有水槽和料槽,试验鹅在试验期间均自由采食和饮水。每天观察鹅群健康状况和计算耗料量,每2周对鹅进行称重,每次称重前1晚断料12 h。
1.5 样品采集与处理70日龄时,每组随机选取6只公鹅,空腹12 h后进行剖杀,采集空肠组织。一部分直接固定于福尔马林溶液中,用于空肠黏膜形态结构观察;另一部分轻轻刮取空肠黏膜组织,保存于-80 ℃超低温冰箱,用于测定抗氧化能力以及与肠壁通透性相关基因的mRNA相对表达量。
1.6 测定指标与方法 1.6.1 空肠黏膜形态结构观察采集固定在福尔马林溶液中的空肠组织块经水洗,石蜡切片制作(脱水、透明、包埋、修块、切片)和苏木精-伊红(HE)染色等过程制成空肠黏膜组织切片。在光镜下进行观察、拍照记录,并利用软件Image-Pro Plus 6.0测量空肠的绒毛高度、隐窝深度,计算绒隐比。
1.6.2 空肠组织抗氧化能力称取0.1 g左右空肠组织置于冰上,按照1 ∶ 9的比例加入预冷的磷酸盐缓冲液(PBS),使用组织破碎仪将其充分破碎后,置于4 ℃离心机中,按3 000 r/min离心20 min,取上清液备用。
采用南京建成生物工程研究所相应试剂盒测定空肠GSH-Px、T-SOD、乳酸脱氢酶(LDH)活性及MDA含量;采用泉州科诺迪生物技术有限公司相应试剂盒测定空肠谷胱甘肽过氧化物酶2(GPX2)活性。
1.6.3 空肠黏膜抗氧化及肠道通透性相关基因表达参考文献[12],采用Trizol法提取空肠黏膜组织中总RNA,并进行浓度及纯度的测定。选择提取质量较高的RNA,按照TaKaRa反转录说明书所示步骤反转成cDNA,于-20 ℃冰箱保存备用。
根据GenBank中检索的相关基因序列,利用Oligo Primer Analysis软件(6.0)设计引物,并交付上海生工生物工程股份有限公司进行引物合成,引物序列如表 1所示。采用SYBR Green荧光染料法,按照PowerUpTM SYBR Green Master Mix试剂盒使用说明书进行实时荧光定量PCR(RT-PCR)试验,每个样品平行做3个重复,以β-肌动蛋白(β-actin)为内参,进行检测基因mRNA表达量的相对定量分析,并利用2-ΔΔCt法计算目的基因相对表达量。
|
|
表 1 引物序列 Table 1 Primer sequences |
试验数据采用SPSS 23.0统计软件进行单因素方差分析(one-way ANOVA),差异显著时用Tukey法进行多重比较,并对饲粮中不同添加量茶多酚的效应进行线性和二次回归分析,以期获得适宜的添加剂量。结果以“平均值±标准差”表示,P < 0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析 2.1 茶多酚对马岗鹅空肠黏膜形态的影响由图 1和表 2可知,与对照组相比,500 mg/kg组的绒毛高度显著提高(P < 0.05),且随着茶多酚添加量增加呈二次曲线变化(P < 0.05);100和500 mg/kg组的隐窝深度显著降低(P < 0.05),绒隐比显著提高(P < 0.05),并随着茶多酚添加量增加呈二次曲线变化(P < 0.05)。
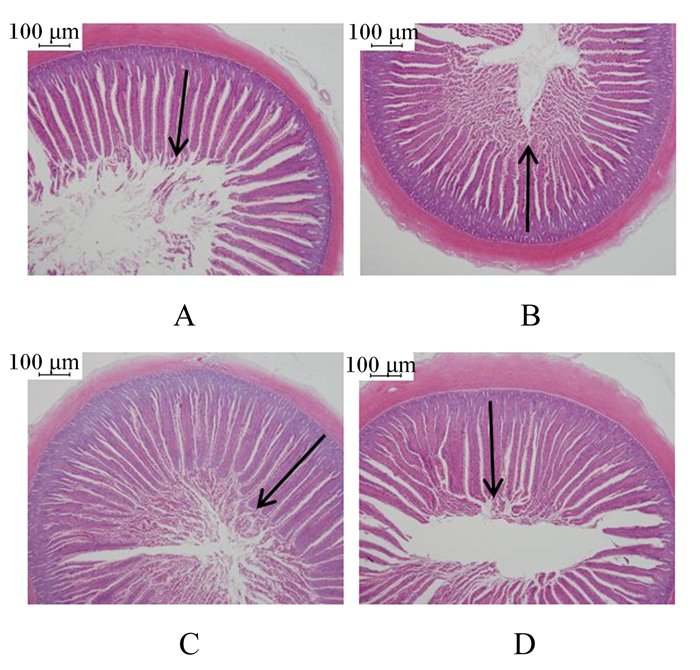
|
A: 70日龄对照组(40×); B:70日龄100 mg/kg组(40×); C:70日龄500 mg/kg组(40×); D:70日龄1 000 mg/kg组(40×); 图 1中箭头的长度代表空肠绒毛的高度。 A: 70-day-old control group (40×); B: 70-day-old 100 mg/kg group (40×); C: 70-day-old 500 mg/kg group (40×); D: 70-day-old 1 000 mg /kg group (40×); the length of the arrow in Fig. 1 represents the height of the jejunal villi. 图 1 饲粮添加茶多酚对马岗鹅空肠组织形态结构的影响 Fig. 1 Effects of dietary tea polyphenols on morphology of jejunum of Magang geese |
|
|
表 2 饲粮添加茶多酚对马岗鹅空肠黏膜形态发育的影响 Table 2 Effects of dietary tea polyphenols on jejunal mucosal morphology development of Magang geese |
通过对绒毛高度、隐窝深度、绒隐比(Y)分别与饲粮茶多酚的添加量(X)进行二次曲线拟合,建立回归方程:Y(绒毛高度)=250.775+759.303X-6 698.402X2(R2=0.448,PQ=0.002),Y(隐窝深度)=45.982-379.021X+3 435.522X2(R2=0.272,PQ=0.036), Y(绒隐比)=5.640+73.905X-681.574X2(R2=0.351,PQ=0.011)。根据曲线回归方程可以得出茶多酚添加量为567 mg/kg时绒毛高度最高,添加量为552 mg/kg时隐窝深度最低,添加量为542 mg/kg时绒隐比最高。以上结果表明,饲粮茶多酚添加量为542~567 mg/kg时,可以促进马岗鹅空肠绒毛增长,降低隐窝深度,并提高绒隐比,进而提高空肠消化吸收能力。
2.2 茶多酚对马岗鹅空肠组织抗氧化能力的影响由表 3可知,与对照组相比,500和1 000 mg/kg组空肠GSH-Px、T-SOD和GPX2活性均显著提高(P < 0.05),其中GSH-Px和GPX2活性呈线性变化且具有剂量依赖性(P < 0.05),T-SOD活性则呈线性和二次曲线变化(P < 0.05);100和500 mg/kg组空肠MDA含量显著降低(P < 0.05),呈二次曲线变化(P < 0.05);3个茶多酚组空肠LDH活性显著降低(P < 0.05),呈线性和二次曲线变化(P < 0.05)。
|
|
表 3 饲粮添加茶多酚对马岗鹅空肠组织抗氧化能力的影响 Table 3 Effects of dietary tea polyphenols on antioxidant capacity of jejunum of Magang geese |
通过对空肠T-SOD、MDA、LDH活性(Y)分别与饲粮茶多酚的添加量(X)进行二次曲线拟合,建立回归方程:Y(T-SOD)=133.174+1 078.959X-7 464.548X2(R2=0.489,PQ=0.001),Y(MDA)=0.489-7.019X+62.699X2(R2=0.344,PQ=0.012),Y(LDH)=4.555-48.363X+442.624X2(R2=0.530,PQ < 0.001)。根据曲线回归方程可以得出茶多酚添加量为722 mg/kg时空肠T-SOD活性最高,添加量为560 mg/kg时空肠MDA含量最低,添加量为546 mg/kg时空肠LDH活性最低。以上研究结果表明,饲粮添加546~722 mg/kg茶多酚时能够提高马岗鹅空肠抗氧化酶活性,抑制脂质过氧化物的生成,有效提高马岗鹅空肠组织抗氧化能力。
2.3 茶多酚对马岗鹅空肠组织与抗氧化相关基因mRNA相对表达量的影响由表 4可知,与对照组相比,500和1 000 mg/kg组马岗鹅空肠组织的超氧化物歧化酶1(SOD1)、谷胱甘肽过氧化物酶1(GPX1)、GPX2和血红素氧合酶-1(HO-1)mRNA相对表达量均显著升高(P < 0.05),且呈线性和二次曲线变化(P < 0.05)。
|
|
表 4 饲粮添加茶多酚对马岗鹅空肠组织与抗氧化相关基因mRNA相对表达量的影响 Table 4 Effects of dietary tea polyphenols on mRNA relative expression levels of antioxidant related genes in jejunum of Magang geese |
通过对空肠SOD1、GPX1、GPX2、HO-1 mRNA相对表达量(Y)分别与饲粮茶多酚的添加量(X)进行二次曲线拟合,建立回归方程:Y(SOD1)=0.934+33.8X-223.722X2(R2=0.946,PQ <0.001),Y(GPX1)=0.957+13.064X-97.867X2(R2=0.580,PQ <0.001),Y(GPX2)=0.984+8.716X-63.71X2(R2=0.597,PQ <0.001),Y(HO-1)=0.939+29.505X-213.775X2(R2=0.900,PQ <0.001)。根据曲线回归方程可以得出茶多酚添加量为755 mg/kg时空肠SOD1 mRNA相对表达量最高,添加量为667 mg/kg时空肠GPX1 mRNA相对表达量最高,添加量为684 mg/kg时空肠GPX2 mRNA相对表达量最高,添加量为690 mg/kg时空肠HO-1 mRNA相对表达量最高。以上研究结果表明,饲粮添加667~755 mg/kg茶多酚时能提高马岗鹅空肠组织中与抗氧化相关基因的mRNA相对表达量,该结果也进一步从分子水平证明茶多酚能够增强空肠组织的抗氧化能力。
2.4 茶多酚对马岗鹅空肠组织紧密连接蛋白相关基因mRNA相对表达量的影响由表 5可知,与对照组相比,500和1 000 mg/kg组马岗鹅空肠的紧密连接蛋白相关基因闭锁小带蛋白-1(ZO-1)、闭合蛋白-5(Claudin-5)和咬合蛋白(Occludin)的mRNA相对表达量均显著升高(P < 0.05),其中ZO-1 mRNA相对表达量呈线性和二次曲线变化(P < 0.05),而Claudin-5和Occludin mRNA相对表达量呈线性变化且具有剂量依赖性(P < 0.05);3个茶多酚组的空肠E钙黏连蛋白(E-cadherin) mRNA相对表达量均显著升高(P < 0.05),呈线性变化且具有剂量依赖性(P < 0.05)。
|
|
表 5 饲粮添加茶多酚对马岗鹅空肠组织紧密连接蛋白相关基因mRNA相对表达量的影响 Table 5 Effects of dietary tea polyphenols on mRNA relative expression levels of tight junction protein related genes in jejunum of Magang geese |
通过对ZO-1 mRNA相对表达量(Y)与饲粮茶多酚的添加量(X)进行二次曲线拟合,建立回归方程:Y(ZO-1)=0.974+13.619X-67.253X2(R2=0.808,PQ < 0.001)。以上研究结果表明,饲粮添加1 013 mg/kg茶多酚时可以提高马岗鹅空肠中ZO-1 mRNA相对表达量,提高肠道紧密连接的程度。
3 讨论 3.1 茶多酚对马岗鹅空肠组织抗氧化能力的影响GSH-Px、GPX2和T-SOD是机体重要的抗氧化酶,发挥着抗氧化的作用。GSH-Px对细胞的代谢具有一定的调节和保护作用[13]。GPX2主要在胃肠道表达,是动物抵抗过氧化物吸收的屏障[14]。T-SOD作为一类以金属阳离子为活性中心的抗氧化酶,能自主地清除超氧阴离子自由基(O2-·)[15]。付晶等[16]研究表明,茶多酚可以通过提高鹅小肠上皮细胞T-SOD和GSH-Px活性、抑制细胞脂质过氧化的发生,进而缓解过氧化氢(H2O2)诱导细胞发生的氧化应激损伤。Song等[17]研究报道,在AA肉仔鸡饲粮中添加300和600 mg/kg儿茶素,均可显著提高肉鸡空肠GSH-Px、T-SOD和CAT活性,降低MDA含量,并通过改善肉鸡肠道的形态发育,减轻因热应激所导致的肠道氧化损伤。肖红艳等[18]在奶山羊全混合日粮中添加5.71 g/kg的茶多酚,能显著提高血清中GSH-Px和T-SOD的活性,降低奶山羊机体的脂质过氧化水平,从而提高机体的抗氧化能力。
MDA作为脂质过氧化产物,其含量间接反映了机体氧化损伤的程度[19]。LDH是糖酵解过程中发挥重要作用的细胞质氧化还原酶,LDH正常情况下存在于机体组织细胞胞质内,当细胞发生氧化损伤时,细胞膜受损,LDH容易从胞质内泄漏,因此,LDH活性升高是机体发生氧化应激损伤的标志之一[20]。李忠浩等[21]发现,蛋鸡饲粮中添加100、150、200 mg/kg的茶多酚,可有效地降低MDA含量。曾亮[22]研究报道,添加儿茶素能降低鸭腿肉和鸭胸肉中MDA含量,从而增加鸭肉的保鲜时间。本研究与前人的研究结果基本一致,即茶多酚可以不同程度地提高马岗鹅空肠组织抗氧化酶活性、抑制脂质过氧化物的生成,进而提高其抗氧化能力。这可能与多酚类化合物本身特殊的化学结构酚羟基有关。羟基是氢的供体,可提供活泼氢、灭活自由基,进而抑制氧化应激的发生[23]。
鉴于此,本研究进一步从分子水平探究茶多酚对马岗鹅空肠黏膜组织抗氧化相关基因mRNA相对表达量的影响。HO-1是血红素降解的限速酶,周蓉等[24]建立体外醋酸铅诱导肾小管上皮细胞损伤模型,发现HO-1可通过上调自噬减轻醋酸铅诱导的细胞氧化应激损伤,从而发挥抗氧化作用。本研究发现,茶多酚可以通过促进空肠SOD1、GPX1、GPX2和HO-1等抗氧化酶相关基因的mRNA相对表达,增强马岗鹅空肠的抗氧化能力,这与本研究结果中,茶多酚可以显著提高马岗鹅空肠抗氧化酶活性、抑制过氧化反应结果相符。
3.2 茶多酚对马岗鹅空肠形态发育及紧密连接程度的影响空肠是鹅营养物质消化吸收的重要场所,肠绒毛高度、隐窝深度以及绒隐比是评价肠道健康的重要指标。绒毛高度增大,隐窝深度减小,绒隐比增大,给肠道提供了更大表面积,增强营养物质的吸收,其中上皮细胞充分成熟,功能也越活跃。相反,较短的绒毛和较深的隐窝,则降低肠道对营养物质的吸收能力,可能导致对疾病的抵抗力下降[25]。
郝洋洋[26]研究报道,400 g/t茶多酚能显著增加35日龄肉鸡的空肠绒毛高度,21日龄的绒毛高度以及绒隐比有增加的趋势,在一定程度上增加了空肠的表面积,促进了空肠的发育,提高营养物质的吸收效率。孙丹凤[27]研究表明,150 mg/kg茶多酚提高肉鸭回肠的绒毛高度,显著增加了绒隐比,增加回肠绒毛表面积。Ding等[28]通过在育肥猪饲粮中添加茶叶残渣增加了绒隐比,从而提高饲粮营养物质的表观消化率,同时保持猪肠道黏膜的完整性,提高机体的免疫力。本试验结果与上述研究结果相一致,即马岗鹅饲粮中添加适宜剂量的茶多酚,改善了空肠的形态发育,有助于提高肠道对营养物质的吸收能力。
肠道黏膜上皮细胞间通过紧密连接形成重要的物理屏障,其能够阻止病原体和大分子物质通过,紧密连接的表达可以调节上皮细胞渗透性和维持细胞极性,对先天免疫至关重要[29]。ZO-1是肠上皮细胞紧密连接的支架蛋白,位于细胞质内膜表面,作为枢纽,可以与胞质内的Claudins、Occludin等连接,其表达的大小影响细胞间紧密连接的形成,间接影响肠黏膜的防御屏障作用。Occludin主要位于紧密连接结构内,是一种分子质量为65 kD的跨膜蛋白,在细胞间发挥黏附分子的作用,对于紧密连接功能具有维持和调节作用[30]。Claudin-5是肠上皮细胞的重要因子,调节细胞的通透性,在维持肠黏膜屏障的稳定方面发挥作用。当Claudin-5表达下降时,肠道的紧密连接功能也随之下降,导致肠道的通透性增加[31]。E-cadherin是维持上皮细胞间连接的糖蛋白[32],其介导的细胞间黏附在维持细胞极性以及环境稳态中起到关键的作用[33]。付晶等[10]研究表明,茶多酚可通过提高乳鸽十二指肠Occludin、ZO-1和闭合蛋白-3(Claudin-3)mRNA相对表达量,维持乳鸽肠黏膜的完整性和降低肠道的通透性。张雨晨[34]研究发现,饲粮中添加绿茶粉能够上调小鼠小肠组织紧密连接蛋白闭合蛋白-1(Claudin-1)、ZO-1和Occludin mRNA相对表达量,增加小鼠肠道的机械屏障,缓解其因脂多糖诱导的免疫应激。朱晟易等[35]研究证实,普洱茶对非酒精性脂肪性肝病的大鼠肠道的紧密连接有一定程度的调控作用,可通过上调大鼠小肠黏膜Occludin和ZO-1基因表达水平,进一步加强小鼠小肠上皮细胞的紧密连接结构,起到预防和改善非酒精性脂肪性肝病的作用。以上研究结果与本研究相似,饲粮添加茶多酚可以通过促进肠道紧密连接蛋白相关基因的表达,增强肠道上皮细胞的紧密连接,对马岗鹅肠道的机械屏障功能具有一定的维持作用。
4 结论在本试验条件下,饲粮添加一定剂量的茶多酚,可以提高马岗鹅空肠的抗氧化能力、促进肠道发育并维持紧密连接的程度。综合考虑,在70日龄马岗鹅饲粮中添加500 mg/kg茶多酚的效果相对更好。
| [1] |
胡泽琼, 王浦卉, 朱婷, 等. 肠道健康标准和影响家禽肠道健康的因素分析及其防控方案[J]. 中国家禽, 2021, 43(3): 89-96. HU Z Q, WANG P H, ZHU T, et al. Intestinal health criteria and factors affecting poultry intestinal health and its prevention and control programs[J]. China Poultry, 2021, 43(3): 89-96 (in Chinese). DOI:10.16372/j.issn.1004-6364.2021.03.016 |
| [2] |
韩文宝. 我国鹅养殖业的现状及未来发展方向[J]. 家禽科学, 2017(8): 42-44. HAN W B. The status quo and future development direction of my country's goose breeding industry[J]. Poultry Science, 2017(8): 42-44 (in Chinese). DOI:10.3969/j.issn.1673-1085.2017.08.019 |
| [3] |
PEDERSEN B K, HOFFMAN-GOETZ L. Exercise and the immune system: regulation, integration, and adaptation[J]. Physiological Reviews, 2000, 80(3): 1055-1081. DOI:10.1152/physrev.2000.80.3.1055 |
| [4] |
BOROS M, TAKAICHI S, HATANAKA K. Ischemic time-dependent microvascular changes and reperfusion injury in the rat small intestine[J]. Journal of Surgical Research, 1995, 59(2): 311-320. DOI:10.1006/jsre.1995.1170 |
| [5] |
SHAO J H, WANG C, SHEN Y L, et al. Electrochemical sensors and biosensors for the analysis of tea components: a bibliometric review[J]. Frontiers in Chemistry, 2022, 9: 818461. DOI:10.3389/fchem.2021.818461 |
| [6] |
OZ H S, CHEN T, DE VILLIERS W J S D. Green tea polyphenols and sulfasalazine have parallel anti-inflammatory properties in colitis models[J]. Frontiers in Immunology, 2013, 4: 132. |
| [7] |
刘梅, 史挺, 王玉海, 等. 茶多酚对肉仔鸡生产性能及抗氧化能力的影响[J]. 中国饲料, 2018(19): 65-69. LIU M, SHI T, WANG Y H, et al. Effects of tea polyphenols on the production performance and antioxidant capacity of broilers[J]. China Feed, 2018(19): 65-69 (in Chinese). DOI:10.15906/j.cnki.cn11-2975/s.20181914 |
| [8] |
WANG Y J, YIN C N, WANG D X, et al. Supplemental summer-autumn tea leaf (Camellia sinensis) improve the immune status of broiler[J]. Journal of Applied Animal Research, 2018, 46(1): 1260-1267. DOI:10.1080/09712119.2018.1493386 |
| [9] |
钟雅静, 朱少平, 陈艾玲, 等. 亲鸽饲粮添加茶多酚对乳鸽生长性能、屠宰性能、肉品质及肌肉抗氧化能力的影响[J]. 中国家禽, 2021, 43(8): 41-47. ZHONG Y J, ZHU S P, CHEN A L, et al. Effects of dietary tea polyphenols for parental-pigeon on growth performance, slaughter performance, meat quality and muscle antioxidant capacity of squab[J]. China Poultry, 2021, 43(8): 41-47 (in Chinese). |
| [10] |
付晶, 邓珊, 陈艾玲, 等. 茶多酚对乳鸽十二指肠形态发育、抗氧化功能和紧密连接蛋白基因mRNA表达的影响[J]. 东北农业大学学报, 2021, 52(12): 31-39. FU J, DENG S, CHEN A L, et al. Effects of tea polyphenols (TP) on morphological development, antioxi-dant function and mRNA expression level of intestinal tight junction protein genes in duodenum of squabs[J]. Journal of Northeast Agricultural University, 2021, 52(12): 31-39 (in Chinese). DOI:10.3969/j.issn.1005-9369.2021.12.006 |
| [11] |
伍梓斌, 林桐, 王萱, 等. 茶多酚对马岗鹅生长性能、屠宰性能、肌肉品质及抗氧化能力的影响[J]. 中国畜牧杂志, 2022, 58(4): 231-235. WU Z B, LIN T, WANG X, et al. Effects of tea polyphenols on growth performance, slaughter performance, muscle quality and antioxidant capacity of Magang goose[J]. Chinese Journal of Animal Science, 2022, 58(4): 231-235 (in Chinese). |
| [12] |
付晶, 赵丹, 林桐, 等. 白术多糖对环磷酰胺致雏鸡肝脏细胞凋亡中线粒体通路的影响[J]. 东北农业大学学报, 2019, 50(4): 63-70. FU J, ZHAO D, LIN T, et al. Effects of Atractylodes rhizoma polysaccharide on the mitochondrial pathway in cyclophosphamide-induced apoptosis of chick liver cells[J]. Journal of Northeast Agricultural University, 2019, 50(4): 63-70 (in Chinese). |
| [13] |
SURAI P F, KOCHISH I I, FISININ V I. Glutathione peroxidases in poultry biology: part 1.Classification and mechanisms of action[J]. World's Poultry Science Journal, 2018, 74(2): 185-198. |
| [14] |
汤小朋, 陈磊, 熊康宁, 等. 硒蛋白-哺乳动物谷胱甘肽过氧化物酶家族研究进展[J]. 生命的化学, 2019, 39(6): 1076-1081. TANG X P, CHEN L, XIONG K N, et al. Research progress of selenoprotein-mammalian glutathione peroxidases family[J]. Chemistry of Life, 2019, 39(6): 1076-1081 (in Chinese). |
| [15] |
王思博, 崔红霞, 杨季, 等. 超氧化物歧化酶模拟物对氧化应激IPEC-J2细胞抗氧化性能的影响[J]. 中国畜牧兽医, 2021, 48(5): 1566-1573. WANG S B, CUI H X, YANG J, et al. Effect of superoxide dismutase mimetic on antioxidant capacity of oxidatively damaged IPEC-J2 cells[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(5): 1566-1573 (in Chinese). |
| [16] |
付晶, 林桐, 陈艾玲, 等. 茶多酚对过氧化氢诱导鹅小肠上皮细胞氧化损伤的保护作用[J]. 东北农业大学学报, 2020, 51(4): 61-69. FU J, LIN T, CHEN A L, et al. Protective effect of tea polyphenols on H2O2-induced oxidative stress in intestinal epithelial cells of goose embryo[J]. Journal of Northeast Agricultural University, 2020, 51(4): 61-69 (in Chinese). |
| [17] |
SONG J, LEI X, LUO J X, et al. The effect of epigallocatechin-3-gallate on small intestinal morphology, antioxidant capacity and anti-inflammatory effect in heat-stressed broilers[J]. Journal of Animal Physiology and Animal Nutrition, 2019, 103(4): 1030-1038. |
| [18] |
肖红艳, 屈金涛, 凌浩, 等. 茶多酚对奶山羊生产性能、血液指标和抗氧化功能的影响[J]. 动物营养学报, 2021, 33(8): 4533-4540. XIAO H Y, QU J T, LING H, et al. Effects of tea polyphenols on performance, blood indexes and antioxidant function of dairy goats[J]. Chinese Journal of Animal Nutrition, 2021, 33(8): 4533-4540 (in Chinese). |
| [19] |
李宁, 袁梅, 王之盛, 等. 活性干酵母对犊牛生长性能及血清生化、抗氧化和免疫指标的影响[J]. 动物营养学报, 2020, 32(11): 5448-5457. LI N, YUAN M, WANG Z S, et al. Effects of active dry yeast on growth performance and serum biochemical, antioxidant and immune indexes of calves[J]. Chinese Journal of Animal Nutrition, 2020, 32(11): 5448-5457 (in Chinese). |
| [20] |
DENG Q L, XU J, YU B, et al. Effect of dietary tea polyphenols on growth performance and cell-mediated immune response of post-weaning piglets under oxidative stress[J]. Archives of Animal Nutrition, 2010, 64(1): 12-21. |
| [21] |
李忠浩, 王丽. 日粮中添加茶多酚对产蛋鸡生产性能及抗氧化性能的影响[J]. 黑龙江畜牧兽医, 2014(9): 82-83. LI Z H, WANG L. Effects of adding tea polyphenols in the diet on the production performance and antioxidant performance of laying hens[J]. Heilongjiang Animal Science and Veterinary Medicine, 2014(9): 82-83 (in Chinese). |
| [22] |
曾亮. 儿茶素对鸭肉保鲜和对肉鸭生长的影响及其机理研究[D]. 博士学位论文. 长沙: 湖南农业大学, 2007. ZENG L. Effects of catechins on keeping fresh of duck meat and growth of duck and the action mechanisms[D]. Ph. D. Thesis. Changsha: Hunan Agricultural University, 2007. (in Chinese) |
| [23] |
ZHANG H, TSAO R. Dietary polyphenols, oxidative stress and antioxidant and anti-inflammatory effects[J]. Current Opinion in Food Science, 2016, 8: 33-42. |
| [24] |
周蓉, 徐雅虹, 陈闽东, 等. HO-1对醋酸铅诱导肾小管上皮细胞氧化应激的保护机制[J]. 中国中西医结合肾病杂志, 2020, 21(1): 12-16. ZHOU R, XU Y H, CHEN M D, et al. The mechanism of HO-1 protects renal tubular epithelial cells from lead acetate induced oxidative stress[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2020, 21(1): 12-16 (in Chinese). |
| [25] |
ZHAO Y, ZENG D, WANG H S, et al. Dietary probiotic Bacillus licheniformis H2 enhanced growth performance, morphology of small intestine and liver, and antioxidant capacity of broiler chickens against Clostridium perfringens-induced subclinical necrotic enteritis[J]. Probiotics and Antimicrobial Proteins, 2020, 12(3): 883-895. |
| [26] |
郝洋洋. 茶多酚和乳酸菌对肉鸡抗氧化能力和肠道发育的影响研究[D]. 硕士学位论文. 泰安: 山东农业大学, 2019. HAO Y Y. Effects of tea polyphenols and lactic acid bacteria on antioxidant capacity and intestinal development in broilers[D]. Master's Thesis. Tai'an: Shandong Agricultural University, 2019. (in Chinese) |
| [27] |
孙丹凤. 三种抗氧化剂的不同水平组合对肉鸭肠道组织结构和功能的影响[D]. 硕士学位论文. 武汉: 武汉工业学院, 2010. SUN D F. Effects of different levels of three antioxidants on the structure and function of meat duck intestine[D]. Master's Thesis. Wuhan: Wuhan University of Technology, 2010. (in Chinese) |
| [28] |
DING X Q, LI H Y, WEN Z W, et al. Effects of fermented tea residue on fattening performance, meat quality, digestive performance, serum antioxidant capacity, and intestinal morphology in fatteners[J]. Animals, 2020, 10(2): 185. |
| [29] |
ZIHNI C, MILLS C, MATTER K, et al. Tight junctions: from simple barriers to multifunctional molecular gates[J]. Nature Reviews Molecular Cell Biology, 2016, 17(9): 564-580. |
| [30] |
庾庆华. 肠上皮细胞紧密连接调节的研究[D]. 博士学位论文. 南京: 南京农业大学, 2009. YU Q H. Study on the regulation of tight junctions in intestinal epithelial cells[D]. Ph. D. Thesis. Nanjing: Nanjing Agricultural University, 2009. (in Chinese) |
| [31] |
洪流东, 黄会云, 陈玉, 等. 健脾清热活血类方药对溃疡性结肠炎肠黏膜功能障碍及claudin-2、claudin-5的影响[J]. 中国中西医结合消化杂志, 2015, 23(9): 599-603, 607. HONG L D, HUANG H Y, CHEN Y, et al. The mechanism of Jian Pi Qing Re Huo Xue decoction on improving colon mucosa dysfunction and regulating the expression of claudin-2 and claudin-5 in DSS-induced colitis[J]. Chinese Journal of Integrated Traditional and Western Medicine on Digestion, 2015, 23(9): 599-603, 607 (in Chinese). |
| [32] |
袁林, 徐又先, 沈世强, 等. 联合检测血清E-钙粘连蛋白和AFP在肝癌中的表达及术后复发的意义[J]. 中国癌症杂志, 2013, 23(6): 447-451. YUAN L, XU Y X, SHEN S Q, et al. To study expression and recurrence significance of uniting soluble E-cadherin and AFP pre-and postoperative in hepatocellular carcinoma[J]. China Oncology, 2013, 23(6): 447-451 (in Chinese). |
| [33] |
ZHANG K J, WANG D S, ZHANG S Y, et al. The E-cadherin repressor slug and progression of human extrahepatic hilar cholangiocarcinoma[J]. Journal of Experimental & Clinical Cancer Research CR, 2010, 29(1): 88. |
| [34] |
张雨晨. 绿茶粉调节免疫应激小鼠免疫功能和肠道机械屏障的作用机制[D]. 硕士学位论文. 合肥: 安徽农业大学, 2018. ZHANG Y C. Mechanism of green tea powder in regulating immune function and intestinal mechanical barrier in immune stress mice[D]. Master's Thesis. Hefei: Anhui Agricultural University, 2018. (in Chinese) |
| [35] |
朱晟易, 童钰铃, 赵奕, 等. 普洱茶对非酒精性脂肪肝大鼠肠道脂肪吸收及粘膜屏障的干预研究[J]. 茶叶科学, 2016, 36(3): 237-244. ZHU S Y, TONG Y L, ZHAO Y, et al. Effect of pu-erh tea on long chain fatty acid metabolism and expression of tight junction proteins in the rat model of non-alcoholic fatty liver disease[J]. Journal of Tea Science, 2016, 36(3): 237-244 (in Chinese). |




