犊牛出生后,瘤胃和瘤胃微生物区系逐步发育,消化机能还不完善。新生犊牛免疫力低下,发病率高,特别是腹泻率高,严重影响了犊牛的生长发育和成年后的生长性能。在禁抗背景下,如何促进哺乳期犊牛生长发育和健康状况,降低犊牛疾病发生率和死亡率,是多数养殖场最关注的问题之一。益生菌广泛存在于动物体消化道、呼吸道和生殖道内,被世界卫生组织联合专家组统一定义为:摄入合适数量后对宿主健康产生有益作用的活的微生物[1]。益生菌作为新型饲料添加剂越来越多地被应用于动物生产中,以提高动物生长发育,促进健康,降低环境污染,从而提高养殖业的经济效益和促进畜牧业健康发展。目前已有大量关于益生菌对犊牛生长性能和健康的研究,但是由于试验条件、品种选择、试验动物个体差异、饲粮组成以及添加益生菌的种类、添加量、品质、添加方式等的差异,所得的研究结果并不一致。例如,一些研究表明,益生菌对犊牛的生长发育具有显著提高作用[2],还可以提高犊牛血清免疫球蛋白G(IgG)含量[3],促进免疫应答[4],减少胃肠道病原体定植[5-6],抑制犊牛腹泻[7-8]。而在另一些研究中显示,添加益生菌对犊牛增重、饲料效率和干物质采食量影响不显著[9-12]。采用传统的定性文献分析方法很难准确地总结犊牛饲粮中添加益生菌的多个研究,难以明确益生菌对犊牛生长发育和健康的影响。因此,使用荟萃分析(Meta分析)进行系统循证性研究与评价显得至关重要。
Meta分析是对相同方向的多个单一原始研究进行数据合并,增加样本数量,同时根据研究异质性来源从不同角度解析效应值,从而提高了检验效果,获得更精确的研究结果,为决策提供更客观有力的依据[13]。近年来,Meta分析方法已在畜牧兽医研究领域中广泛应用。已有Meta分析系统评价了益生菌对犊牛的作用效果,但因其选择的牛品种过于庞杂(包括荷斯坦牛、夏洛莱牛、安格斯牛、杂交牛、秦川牛、韩牛等黄牛以及印度水牛、摩拉水牛等),饲养条件差异大,研究异质性高[14],或者纳入的文献较早(2012年以前)且数量偏少(15个研究)[15],致使不能全面准确地反映益生菌的应用效果。因此,本研究利用Meta分析方法,系统评价益生菌对哺乳期犊牛生长发育和健康指标的影响,同时根据差异来源进行亚组分析,比较不同益生菌组成、不同饲粮组成、不同菌属的作用效果,以期为益生菌在犊牛生产管理中的应用提供科学依据。
1 材料与方法本研究遵循系统评价和元分析(PRISMA)方法,使用系统回顾方法对已发表文献进行Meta分析[16]。
1.1 检索策略因为排除非英文发表文献中的数据和证据并不会改变Meta分析的结论[17],所以本研究检索了4个英文数据库:NCBI、Science Direct、Web of Science和Google Scholar。使用的关键词为:“probiotics”、“probiotic”、“calves”、“calf”,还使用了关键词“Lactobacillus”、“Bifidobacterium”、“Pediococcus”、“Bacillus”、“Lactococcus”、“Enterococcus”、“Streptococcus”、“Saccharomyces”、“Aspergillus”。检索时间段为文献建库至2021年3月10日。
1.2 文献筛选标准 1.2.1 文献纳入标准纳入标准:1)研究主题为饲喂益生菌对犊牛生长性能影响;2)试验犊牛健康无病;3)试验饲粮中无抗生素或其他添加剂;4)试验犊牛为未断奶的奶牛;5)研究结果中包含犊牛生长性状和血清指标数据,包括益生菌组和对照组的样本量、平均值、标准差或标准误;6)英文发表。
1.2.2 文献排除标准排除标准:1)排除综述、没有经过同行评议的会议和摘要论文等;2)排除重复发表文献;3)排除病牛试验研究;4)排除饲粮中含其他添加剂的研究;5)排除试验结果数据不完整的研究,比如缺失平均值或标准差,或通过换算无法得到相应数据的研究;6)排除非英文文献。
1.3 数据提取在数据库中按照关键词检索,根据以上标准严格进行筛选。筛选后提取数据:作者、发表年、发表国家、试验动物品种、样本量、试验动物初始日龄、试验持续时间、添加益生菌的种类、饲粮组成、测定指标及相应数据(平均值、标准误或标准差)。
1.4 统计学方法使用STATA/MP14.0软件(College Station,TX)进行数据分析。使用Q统计量和I2评估异质性(若I2 < 25则无异质性;若25≤I2 < 50则为轻度异质性;若50≤I2 < 75则为中度异质性;若75≤I2 < 100则为高度异质性)[18]。考虑犊牛饲养试验研究内部和研究之间的异质性,因此本研究选择随机效应模型进行分析[13]。而且随机效应模型的分析结果被认为比固定效应模型更保守[19]。通过使用随机效应模型来计算合并效应量,比较添加益生菌组和对照组之间的2组数的原始均数差(raw mean difference, RMD),RMD的P值小于0.05被认为差异显著,小于0.01被认为差异极显著。
为了探究异质性的来源,从益生菌组成(单一菌或复合菌)、饲粮组成(全乳或代乳料)、不同种属益生菌(芽孢杆菌属、酵母属和乳酸杆菌属)几个方面对影响益生菌作用效果的因素进行亚组分析。通过漏斗图评估发表偏倚,如果存在发表偏倚,则漏斗图不对称[20]。使用STATA中metainf命令进行敏感性分析,通过1次排除1项研究,计算剩余研究的效应值,评估分析该单一研究是否影响Meta分析结果[21]。
2 结果与分析 2.1 纳入文献的基本特征本研究从4个英文数据库(NCBI、Science Direct、Web of Science和Google Scholar)中共检索到5 058篇文献,其他来源文献2篇。去重后得到3 116篇文献,根据制定的筛选标准,最后共有34篇文献纳入后续的Meta分析中,文献筛选过程的流程图见图 1。
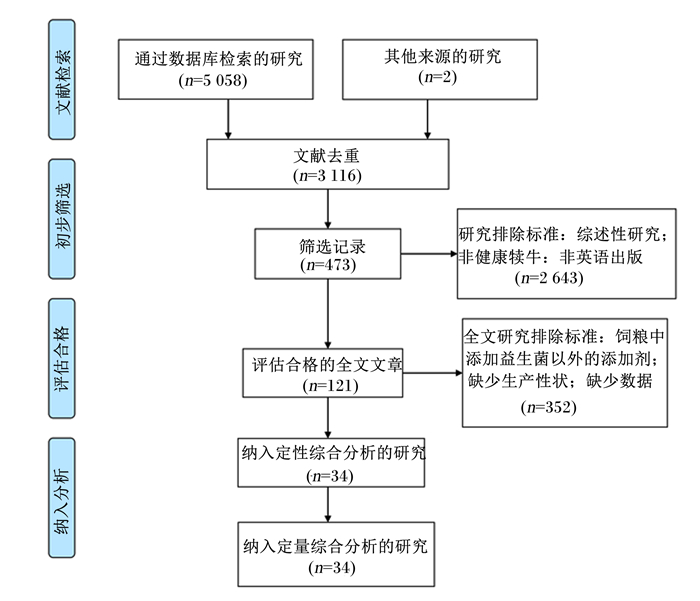
|
图 1 文献筛选过程的流程图 Fig. 1 Flowchart for reference selection process |
纳入文献均为英文发表,研究对象为哺乳期荷斯坦牛,试验组和对照组总共1 202头犊牛,试验组均在饲粮中添加益生菌,对照组为空白对照组。纳入Meta分析的文献特征如表 1。犊牛开始试验时间在1~28日龄,试验持续时间为26~90 d,饲粮组成包括全乳、代乳粉、开食料、脱脂乳和酸化乳等。饲粮中加入的益生菌有单一菌种,也有2个或多个组成的复合益生菌。共计使用了39种益生菌,其中嗜酸乳杆菌(L. acidophilus)使用11次,植物乳杆菌(L. plantarium)使用9次,粪肠球菌(E. faecium)和酿酒酵母(S. cerevisiae)各6次,枯草芽孢杆菌(B. subtilis)和干酪乳杆菌(L. casei)各5次,双歧杆菌(B. bifidum)和鼠李糖乳杆菌(L. rhamnosus)各3次,其余益生菌为1~2次。
|
|
表 1 纳入研究的特征 Table 1 Characteristics of included studies |
饲粮中添加益生菌对犊牛生长性能影响的Meta分析结果如表 2所示。整体来看饲粮中添加益生菌可极显著提高犊牛的平均日增重(ADG)和体重(BW)(P<0.001),极显著降低料重比(F/G)(P<0.001),但对总干物质采食量(TDMI)没有显著影响(P>0.05)。
|
|
表 2 饲粮中添加益生菌对犊牛生长性能影响的Meta分析 Table 2 Meta-analysis of effects of dietary supplementation with probiotics on growth performance of calves |
饲喂益生菌犊牛的ADG提高了52.602 g/d(P<0.001,I2=48.0%),轻度异质性,结果稳定可靠。对应亚组分析结果显示,饲粮中添加单一益生菌组犊牛ADG(RMD=58.657 g/d,P<0.001)比复合益生菌组的犊牛ADG(RMD=45.236 g/d,P<0.001)增加了29.67%。另外,全乳中添加益生菌犊牛ADG(RMD=59.255 g/d,P<0.001)比代乳粉中添加益生菌的犊牛ADG(RMD=29.879 g/d,P=0.001)提高了98.32%。
饲粮中添加益生菌试验结束时犊牛BW增加了2.390 kg(P<0.001,I2=8.0%),异质性低。亚组分析结果显示,添加单一益生菌犊牛BW(RMD=2.517 kg,P<0.001)比添加复合益生菌犊牛BW(RMD=2.303 kg,P<0.001)提高了9.29%。全乳中添加益生菌的犊牛BW(RMD=2.518 kg,P<0.001)比饲喂代乳粉犊牛(RMD=1.589 kg,P=0.004)提高了58.46%。
犊牛饲粮中添加益生菌可以使F/G下降0.107(P<0.001,I2=37.4%),轻度异质性。亚组分析结果显示,饲喂单一益生菌F/G极显著下降0.127(P<0.001,I2=56.2%),而饲喂复合益生菌F/G有下降的趋势(RMD=-0.093,P=0.066)。代乳粉中添加益生菌F/G显著下降0.098(P=0.026),而全乳中添加益生菌对F/G没有显著影响(P=0.108)。
2.2.2 益生菌对犊牛血清免疫球蛋白含量和粪便评分的影响益生菌对犊牛血清中免疫球蛋白含量和粪便评分影响Meta分析结果如表 3所示。饲粮中添加益生菌可显著提高犊牛血清中IgG含量(P < 0.05),极显著降低犊牛粪便评分(P<0.001),但对血清IgA和IgM含量没有显著影响(P>0.05)。
|
|
表 3 饲粮中添加益生菌对犊牛血清免疫球蛋白含量和粪便评分影响的Meta分析 Table 3 Meta-analysis of effects of dietary supplementation with probiotics on serum immunoglobulin contents and fecal score of calves |
虽然饲粮中添加益生菌对于犊牛血清中IgA含量没有显著影响(P>0.05),但是亚组分析结果显示,添加复合益生菌犊牛血清IgA含量极显著增加(RMD=0.892 g/L,P=0.003,I2=0.0%);全乳中添加益生菌IgA含量极显著增加(RMD=0.892 g/L,P=0.003,I2=0.0%)。
饲粮中添加益生菌可显著提高犊牛血清IgG含量(P=0.028,I2=21.50%),无异质性。亚组分析结果显示,添加单一益生菌犊牛血清IgG含量显著增加(RMD=0.331 g/L,P=0.013,I2=0.0%);代乳料中添加益生菌有提高血清IgG含量的趋势(RMD=0.222 g/L,P=0.098,I2=0.0%)。
虽然饲粮中添加益生菌对于犊牛血清中IgM含量没有显著影响(P>0.05),但是亚组分析结果显示,添加复合益生菌犊牛血清IgM含量显著增加(RMD=0.470 g/L,P=0.049,I2=0.0%)。
此外,饲粮中添加益生菌可以使犊牛粪便评分极显著降低0.080(P<0.001,I2=57.0%),中度异质性。亚组分析显示,饲喂单一益生菌可以极显著降低粪便评分(RMD=-0.073,P<0.010),而饲喂复合益生菌有降低粪便评分的趋势(P=0.050)。全乳中添加益生菌的犊牛粪便评分(RMD=-0.157,P=0.009)比代乳粉中添加益生菌的犊牛粪便评分(RMD=-0.068,P<0.001)降低了130.88%。
2.2.3 不同菌属对犊牛的影响由于研究之间采用的益生菌种类各异,而且前面各项分析结果显示添加单一益生菌对犊牛的生长性能和健康状况有显著影响。因此,我们将添加单一益生菌的研究按照益生菌的属进行分类统计,然后进行亚组分析。统计结果显示,芽孢杆菌属(Bacillus)、酵母属(Saccharomyces)和乳酸杆菌属(Lactobacillus)是单一添加使用频率最高的3个属(研究数量均为16项)。然后对单独添加这3个属益生菌研究进行Meta亚组分析,结果如表 4所示。犊牛饲粮中添加芽孢杆菌属可以极显著提高ADG(RMD=73.523 g/d,P<0.001),显著提高BW(RMD=3.097 kg,P=0.029),极显著降低F/G(RMD=-0.399,P < 0.001);但是对TDMI没有显著影响(P>0.05)。另外,添加乳酸杆菌属极显著降低F/G(RMD=-0.151,P<0.001),有降低粪便评分的趋势(RMD=-0.076,P=0.072),有增加血清中IgM含量的趋势(RMD=0.130 g/L,P=0.082)。此外,添加酵母属显著提高了ADG (RMD=50.274 g/d,P=0.010),有降低粪便评分的趋势(RMD=-0.076,P=0.094)。
|
|
表 4 饲粮中添加不同菌属的益生菌对犊牛生长性能影响的Meta分析亚组分析 Table 4 Subgroup analysis of Meta-analysis on effects of dietary supplementation with probiotics from different genera on growth performance of calves |
敏感性分析分别显示每一项研究对整体估计的影响,以此评估研究结果的稳健性或稳定性。Meta分析的敏感性分析结果表明,对于ADG、BW、TDMI、F/G、粪便评分及血清IgA、IgG和IgM含量这8个表型指标,没有一项研究影响每个指标的总体效应值,在不同的研究中,全局估计稳定,表明某个特定的试验不会改变整体结果,证实了本研究结果的统计稳定性。
2.4 发表偏倚评价图 2为对本研究进行发表偏倚评估的结果。从图中可以看出,随着纳入研究的规模和精度的增加,益生菌的干预效果的精确度也相应增加。对于数据量较小表型指标的Meta分析,效应值广泛地分布在图的底部,而对于数据量大的表型指标的研究,分布将更集中。本结果显示,TDMI和F/G的漏斗图存在一定程度的不对称性,提示这2项指标的Meta分析结果存在发表偏倚。其余表型指标的评价结果中代表研究结果的小图形较为集中,且无明显的不对称性,说明Meta分析纳入的研究同质性较好,不存在显著的发表偏倚,证实了本研究结果的统计稳定性。
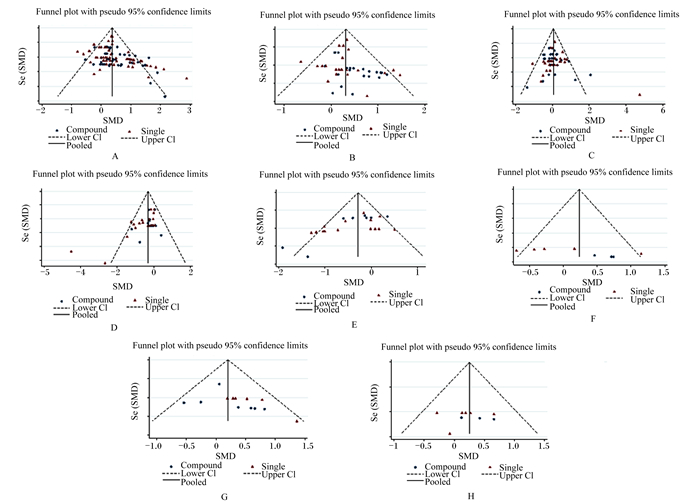
|
Se(SMD):标准化均数差的对数标准误Log standard error of SMD;SMD:标准化均数差standardized mean difference;Compound:复合;Single:单一;Lower CI:置信区间下限lower confidence interval;Upper CI:置信区间上限upper confidence interval;Pool:合并效应值;Funnel plot with pseudo 95% confidence limits:95%置信区间的漏斗图。 A:平均日增重ADG;B:体重body weight;C:总干物质采食量TDMI;D:料重比F/G;E:粪便评分fecal score;F:免疫球蛋白A含量IgA content;G:免疫球蛋白G含量IgG content;H:免疫球蛋白M含量IgM content。 图 2 漏斗图检验纳入Meta分析研究的发表偏倚 Fig. 2 Funnel plots to assess publication bias in Meta-analysis |
犊牛阶段的饲养管理对其生长发育、健康状况和成年后的生长性能非常关键,因此许多促进生长和健康的饲料添加剂被广泛研究并应用在犊牛生产中。其中,益生菌已被广泛应用并发现可以提高饲料转化率、促进犊牛生长性能和健康状况,但研究结果并不完全一致,甚至完全相反。因此,本研究以荷斯坦牛为研究对象,纳入最新研究文献进行Meta分析,全面系统评价益生菌对犊牛的应用效果。
3.1 益生菌对犊牛生长性能的影响本次Meta分析表明,饲粮中添加益生菌可以显著提高犊牛ADG和BW,降低F/G,但对TDMI没有显著影响。Frizzo等[30]的Meta分析结果也显示添加益生菌可有效提高犊牛的增重和饲料效率。本试验Meta分析中,饲喂益生菌犊牛的ADG提高了52.602 g/d。Alawneh等[14]对不同品种的牛进行亚组分析,结果显示使用益生菌荷斯坦牛犊牛的ADG增加了57.10 g/d。另外,本试验Meta分析中,饲粮中添加益生菌可以使F/G下降0.107,Alawneh等[14]的Meta分析结果中F/G下降0.13。机理研究表明,犊牛饲粮中添加益生菌,可以促进瘤胃发育,调节瘤胃pH,改变瘤胃发酵模式,改善胃肠道微生态平衡,特别是增加瘤胃中分解纤维素的微生物群体,从而提高瘤胃中纤维降解率,进而提高犊牛对营养物质的消化、吸收利用率,从而提高ADG和体重,降低F/G,显著提高犊牛生长性能[14, 54]。
3.2 益生菌对犊牛健康状况的影响本试验Meta分析结果表明,饲粮中添加益生菌可以显著提高犊牛血清中IgG含量,与Sun等[55]的研究结果一致。此外,Alawneh等[14]的Meta分析发现,添加益生菌犊牛血清中IgG含量提高了75.31 mg/dL,对血清IgA和IgM含量没有显著影响。多项研究表明,益生菌可以促进免疫器官的生长发育,还可以刺激免疫细胞,使其产生不同类型的细胞因子,从而诱导和调节免疫反应,提高机体的抗病力[28, 56-58]。
粪便评分是生产中用来判断犊牛腹泻发生率和健康状况的重要指标[59],有研究表明,添加益生菌可以降低犊牛粪便评分[48, 60],减少犊牛发病率[61]。Lee等[60]发现,枯草芽孢杆菌和植物乳杆菌联合饲喂可以缩短犊牛腹泻的持续时间,帮助平衡肠道菌群,预防犊牛腹泻。Mohamad等[61]也观察到在断奶前添加益生菌对犊牛健康有显著影响。Alawneh等[14]的Meta分析发现,饲粮中添加益生菌有降低犊牛粪便评分的趋势。本试验Meta结果表明,益生菌显著降低粪便评分,可能是由于益生菌调整了胃肠道微生物菌群结构,提升了有益菌的相对丰度。特别是当消化道双歧杆菌和乳酸菌等厌氧菌数量增多,明显抑制了大肠杆菌的生长,从而降低肠道及粪便中大肠杆菌的数量,降低腹泻率,提高动物的抗病力和健康状况[14, 62]。
3.3 不同菌属对犊牛的影响犊牛饲养中常用的芽孢杆菌属包括枯草芽孢杆菌和地衣芽孢杆菌等。芽孢杆菌能够调节肠道微生物菌群和pH,促进瘤胃纤维降解,该菌还具有产酶特性,能够将饲料中营养成分快速降解转化成营养物质供机体利用,从而提高饲料转化率[55]。本试验Meta分析结果也证实了犊牛饲粮中添加芽孢杆菌属可以显著提高ADG和BW,同时降低F/G。乳酸杆菌属常用的包括嗜酸性乳杆菌、屎肠球菌和双歧杆菌等。乳酸菌可以利用碳水化合物,产生乳酸和乙酸等,使肠道pH降低,有效抑制大肠杆菌和沙门氏菌,改善哺乳犊牛胃肠道健康[63]。酵母菌能够促进瘤胃中厌氧的有益菌生长,还可以与犊牛肠道内的有益菌协同作用,抑制大肠杆菌的定植[2]。另外,酵母菌水解产物具有促生长和免疫调节作用[54]。对以上3个属的益生菌作用效果亚组分析结果显示,芽孢杆菌属的促生长效果更好。
3.4 影响益生菌作用效果的因素分析亚组分析结果显示,添加单一益生菌犊牛ADG比复合益生菌增加了29.67%,BW提高了9.29%(从2.303 kg提高到2.517 kg)。饲喂单一益生菌F/G显著下降0.127,血清IgG含量增加了0.331 g/L,粪便评分降低了0.073。但是添加复合益生菌血清IgA含量增加了0.892 g/L,血清IgM含量增加了0.470 g/L。因此,综合考虑,添加单一菌促进犊牛生长发育和健康的作用效果更明显。有研究表明,饲喂单一植物乳杆菌可以提高犊牛饲料转化率,而饲喂复合植物乳杆菌和枯草芽孢杆菌则没有显著影响[43]。还有研究显示,给犊牛饲喂单一益生菌菌种对ADG和F/G的提高效果要大于复合益生菌[12, 22],饲喂单一嗜酸乳杆菌对犊牛血清IgG含量的提高幅度也大于嗜酸乳杆菌和植物乳杆菌复合益生菌的效果[24]。但Frizzo等[30]研究表明,益生菌的饲喂效果与补充单一菌或复合菌无关。不同研究的结论不同甚至矛盾,主要是因为各自研究中采用的菌种的来源、成分、有效含量、使用剂量、添加方法和使用频次(每天喂1或2次)不同,而且试验动物、试验条件和指标测定方法等存在差异[54]。因此,本研究结果也提示在犊牛饲养中,单一菌种混合作为复合益生菌使用时,各单一成分之间的组成、配合比例、使用数量、协调作用效果等需要进一步的研究。
全乳中添加益生菌犊牛血清中IgA含量增加了0.892 g/L。另外全乳中添加益生菌犊牛的ADG(RMD=59.255 g/d)比代乳粉中添加益生菌的犊牛(RMD=29.879 g/d)提高了98.32%,体重提高了58.46%(从1.589 kg提高到2.518 kg)。粪便评分降低了130.88%(从-0.068到-0.157)。因此,全乳中使用益生菌效果优于代乳料。这可能是因为不同研究采用的代乳料的营养成分(特别是蛋白质和粗纤维水平)、卫生指标以及饲喂方式、饲喂数量、温度等差异造成的[15, 54]。
3.5 本研究的局限性本研究也存在一定的局限性。首先,我们只选取了经过同行评审后发表的英文文献,纳入文献数量明显减少,但是不影响Meta分析的结论[17]。其次,针对饲粮中添加益生菌对犊牛影响的研究数量多,但各研究中添加的益生菌种类和添加水平各异,同时饲粮水平和饲养管理也存在差异,因而可能造成Mate分析结果有潜在异质性。另外,添加某一相同种属的益生菌研究较少,因此亚组分析纳入的研究数量偏少。
4 结论本试验对纳入的34项研究进行Meta分析,结果稳定可靠,表明饲粮中添加益生菌可以显著提高犊牛的生长性能,包括ADG和BW,降低F/G,还可以提高犊牛免疫性能,降低粪便评分。因此,益生菌在哺乳期犊牛饲养中具有较好的应用效果。亚组分析结果表明,饲喂单一益生菌的效果优于饲喂复合益生菌,添加在全乳中饲喂效果优于代乳粉,芽孢杆菌属、乳酸杆菌属和酵母属三者相比,芽孢杆菌属的效果较好,本研究结果可为犊牛生产中科学使用益生菌提供理论参考。
| [1] |
ATHANASIADOU S, KYRIAZAKIS I. Plant secondary metabolites: antiparasitic effects and their role in ruminant production systems[J]. The Proceedings of the Nutrition Society, 2004, 63(4): 631-639. DOI:10.1079/PNS2004396 |
| [2] |
CANGIANO L R, YOHE T T, STEELE M A, et al. Invited review: strategic use of microbial-based probiotics and prebiotics in dairy calf rearing[J]. Applied Animal Science, 2020, 36(5): 630-651. DOI:10.15232/aas.2020-02049 |
| [3] |
GENOVA K, SHINDARSKA Z, IGNATOVA M, et al. Effect of probiotic enterosan on some biochemical parameters and factors of immune resistance in calves of bulgarian simmental breed[C]//Tradition and Modernity in Veterinary Medicine. Sofia: University of Forestry, 2010: 139-145.
|
| [4] |
VILLOT C, GUAN L, SKIDMORE A, et al. 451 late-breaking: Saccharomyces cerevisiae boulardii stimulates immunoglobulin a production in the gut of neonate dairy calves[J]. Journal of Animal Science, 2019, 97(3): 143. |
| [5] |
PIEWNGAM P, ZHENG Y, NGUYEN T H, et al. Pathogen elimination by probiotic Bacillus via signalling interference[J]. Nature, 2018, 562(7728): 532-537. DOI:10.1038/s41586-018-0616-y |
| [6] |
WILLIAMS P. Bacillus subtilis: a shocking message from a probiotic[J]. Cell Host & Microbe, 2007, 1(4): 248-249. |
| [7] |
KAWAKAMI S-I, YAMADA T, NAKANISHI N, et al. Feeding of lactic acid bacteria and yeast on growth and diarrhea of Holstein calves[J]. Journal of Animal and Veterinary Advances, 2010, 9(7): 1112-1114. DOI:10.3923/javaa.2010.1112.1114 |
| [8] |
KAWAKAMI S I, YAMADA T, NAKANISHI N, et al. Feeding of lactic acid bacteria and yeast affects fecal flora of Holstein calves[J]. Journal of Animal and Veterinary Advances, 2011, 10(3): 269-271. DOI:10.3923/javaa.2011.269.271 |
| [9] |
GONCALVES G D, SANTOS G T D, RIGOLON L P, et al. The influence of probiotics addiction in the diet on the sanitary state and the performance of calves Holstein[J]. Brazilian Journal of Veterinary Research and Animal Science, 2000, 37(1): 74-78. |
| [10] |
KOCYIGIT R, AYDIN R, YANAR M, et al. Effect of doses of direct-fed microbials plus exogenous fibrolytic enzymes supplementation on growth, feed efficiency ratio and fecal consistency index of brown Swiss and Holstein Friesian Calves[J]. Indian Journal of Animal Research, 2015, 49(1): 63-69. DOI:10.5958/0976-0555.2015.00014.X |
| [11] |
RIDDELL J B, GALLEGOS A J, HARMON D L, et al. Addition of a bacillus based probiotic to the diet of preruminant calves: influence on growth, health, and blood parameters[J]. International Journal of Applied Research in Veterinary Medicine, 2008, 8(1): 78-85. |
| [12] |
JENNY B F, VANDIJK H J, COLLINS J A. Performance and fecal flora of calves fed a Bacillus subtilis concentrate[J]. Journal of Dairy Science, 1991, 74(6): 1968-1973. DOI:10.3168/jds.S0022-0302(91)78364-1 |
| [13] |
FLEISS J L. The statistical basis of Meta-analysis[J]. Statistical Methods in Medical Research, 1993, 2(2): 121-145. DOI:10.1177/096228029300200202 |
| [14] |
ALAWNEH J I, BARRETO M O, MOORE R J, et al. Systematic review of an intervention: the use of probiotics to improve health and productivity of calves[J]. Preventive Veterinary Medicine, 2020, 183: 105147. DOI:10.1016/j.prevetmed.2020.105147 |
| [15] |
SIGNORINI M L, SOTO L P, ZBRUN M V, et al. Impact of probiotic administration on the health and fecal microbiota of young calves: a Meta-analysis of randomized controlled trials of lactic acid bacteria[J]. Research in Veterinary Science, 2012, 93(1): 250-258. DOI:10.1016/j.rvsc.2011.05.001 |
| [16] |
LIBERATI A, ALTMAN D G, TETZLAFF J, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration[J]. Journal of Clinical Epidemiology, 2009, 62(10): e1-e34. DOI:10.1016/j.jclinepi.2009.06.006 |
| [17] |
NUSSBAUMER-STREIT B, KLERINGS I, DOBRESCU A I, et al. Excluding non-English publications from evidence-syntheses did not change conclusions: a Meta-epidemiological study[J]. Journal of Clinical Epidemiology, 2020, 118: 42-54. DOI:10.1016/j.jclinepi.2019.10.011 |
| [18] |
HIGGINS J P T, THOMPSON S G, DEEKS J J, et al. Measuring inconsistency in Meta-analyses[J]. BMJ (Clinical Research ed.), 2003, 327(7414): 557-560. DOI:10.1136/bmj.327.7414.557 |
| [19] |
RILEY R D, HIGGINS J P T, DEEKS J J. Interpretation of random effects Meta-analyses[J]. BMJ (Clinical Research ed.), 2011, 342: d549. DOI:10.1136/bmj.d549 |
| [20] |
TYSON M D, CHANG S S. Enhanced recovery pathways versus standard care after cystectomy: a Meta-analysis of the effect on perioperative outcomes[J]. European Urology, 2016, 70(6): 995-1003. DOI:10.1016/j.eururo.2016.05.031 |
| [21] |
LEAN I J, RABIEE A R, DUFFIELD T F, et al. Invited review: use of Meta-analysis in animal health and reproduction: methods and applications[J]. Journal of Dairy Science, 2009, 92(8): 3545-3565. DOI:10.3168/jds.2009-2140 |
| [22] |
ABU-TARBOUSH H M, AL-SAIADY M Y, KEIR EL-DIN A H. Evaluation of diet containing lactobacilli on performance, fecal coliform, and lactobacilli of young dairy calves[J]. Animal Feed Science and Technology, 1996, 57(1/2): 39-49. |
| [23] |
AGAZZI A, TIRLONI E, STELLA S, et al. Effects of species-specific probiotic addition to milk replacer on calf health and performance during the first month of life[J]. Annals of Animal Science, 2014, 14(1): 101-115. DOI:10.2478/aoas-2013-0089 |
| [24] |
AL-SAIADY M Y. Effect of probiotic bacteria on immunoglobulin G concentration and other blood components of newborn calves[J]. Journal of Animal and Veterinary Advances, 2010, 9(3): 604-609. DOI:10.3923/javaa.2010.604.609 |
| [25] |
WANG B, YANG C T, DIAO Q Y, et al. The influence of mulberry leaf flavonoids and Candida tropicalis on antioxidant function and gastrointestinal development of preweaning calves challenged with Escherichia coli O141:K99[J]. Journal of Dairy Science, 2018, 101(7): 6098-6108. DOI:10.3168/jds.2017-13957 |
| [26] |
BAYATKOUHSAR J, TAHMASEBI A M, NASERIAN A A, et al. Effects of supplementation of lactic acid bacteria on growth performance, blood metabolites and fecal coliform and lactobacilli of young dairy calves[J]. Animal Feed Science and Technology, 2013, 186(1/2): 1-11. |
| [27] |
CRUYWAGEN C W, JORDAAN IVENTER L. Effect of Lactobacillus acidophilus supplementation of milk replacer on preweaning performance of calves[J]. Journal of dairy science, 1996, 79(3): 483-6. DOI:10.3168/jds.S0022-0302(96)76389-0 |
| [28] |
KIM E T, LEE H G, KIM D H, et al. Hydrolyzed yeast supplementation in calf starter promotes innate immune responses in Holstein calves under weaning stress condition[J]. Animals, 2020, 10(9): 1468. DOI:10.3390/ani10091468 |
| [29] |
FODITSCH C, PEREIRA R V, GANDA E K, et al. Oral administration of Faecalibacterium prausnitzii decreased the incidence of severe diarrhea and related mortality rate and increased weight gain in preweaned dairy heifers[J]. PLoS One, 2015, 10(12): e0145485. DOI:10.1371/journal.pone.0145485 |
| [30] |
FRIZZO L S, ZBRUN M V, SOTO L P, et al. Effects of probiotics on growth performance in young calves: a Meta-analysis of randomized controlled trials[J]. Animal Feed Science and Technology, 2011, 169(3/4): 147-156. |
| [31] |
FRIZZO L S, BERTOZZI E, SOTO L P, et al. the effect of supplementation with three lactic acid bacteria from bovine origin on growth performance and health status of young calves[J]. Journal of Animal and Veterinary Advances, 2008, 7(4): 400-408. |
| [32] |
ABE F, ISHIBASHI NSHIMAMURA S. Effect of administration of bifidobacteria and lactic acid bacteria to newborn calves and piglets[J]. Journal of dairy science, 1995, 78(12): 2838-2846. DOI:10.3168/jds.S0022-0302(95)76914-4 |
| [33] |
GORGULU M, SIUTA A, ONGEL E, et al. Effect of probiotic on growing performance and health of calves[J]. Pakistan Journal of Biological Sciences, 2003, 6(7): 651-654. DOI:10.3923/pjbs.2003.651.654 |
| [34] |
HE Z X, FERLISI B, ECKERT E, et al. Supplementing a yeast probiotic to pre-weaning Holstein calves: feed intake, growth and fecal biomarkers of gut health[J]. Animal Feed Science and Technology, 2017, 226: 81-87. DOI:10.1016/j.anifeedsci.2017.02.010 |
| [35] |
HILL S R, HOPKINS B A, DAVIDSON S, et al. The addition of cottonseed hulls to the starter and supplementation of live yeast or mannanoligosaccharide in the milk for young calves[J]. Journal of dairy science, 2009, 92(2): 790-798. DOI:10.3168/jds.2008-1320 |
| [36] |
JATKAUSKAS J, VROTNIAKIENE V. Effects of probiotic dietary supplementation on diarrhoea patterns, faecal microbiota and performance of early weaned calves[J]. Veterinarni Medicina, 2010, 55(10): 494-503. DOI:10.17221/2939-VETMED |
| [37] |
JIANG X, XU H J, CUI Z Q, et al. Effects of supplementation with Lactobacillus plantarum 299v on the performance, blood metabolites, rumen fermentation and bacterial communities of preweaning calves[J]. Livestock Science, 2020, 239. |
| [38] |
KEKANA T W, NHERERA-CHOKUDA V F, BALOYI J J, et al. Immunoglobulin G response and performance in Holstein calves supplemented with garlic powder and probiotics[J]. South African Journal of Animal Science, 2020, 50(2): 264-271. |
| [39] |
KHAZIAKHMETOV F, KHABIROV A, TAGIROV K, et al. The influence of "Stimix Zoostim" and "Normosil" probiotics on fecal microflora, hematologic indicators, nutrient digestibility, and growth of mother-bonded calves[J]. Vet World, 2020, 13(6): 1091-1097. DOI:10.14202/vetworld.2020.1091-1097 |
| [40] |
KONG L, YANG C, DONG L, et al. Rumen fermentation characteristics in pre- and post-weaning calves upon feeding with mulberry leaf flavonoids and candida tropicalis individually or in combination as a supplement[J]. Animals, 2019, 9(11): 990. DOI:10.3390/ani9110990 |
| [41] |
MORRISON S J, DAWSON SCARSON A F. The effects of mannan oligosaccharide and Streptococcus faecium addition to milk replacer on calf health and performance[J]. Livestock Science, 2010, 131(2/3): 292-296. |
| [42] |
LE O T, DART P J, HARPER K, et al. Effect of probiotic Bacillus amyloliquefaciens strain H57 on productivity and the incidence of diarrhoea in dairy calves[J]. Animal Production Science, 2017, 57(5): 912-919. DOI:10.1071/AN15776 |
| [43] |
ZHANG R, ZHOU M, TU Y, et al. Effect of oral administration of probiotics on growth performance, apparent nutrient digestibility and stress-related indicators in Holstein calves[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(1): 33-38. DOI:10.1111/jpn.12338 |
| [44] |
ZHANG R, DONG X, ZHOU M, et al. Oral administration of Lactobacillus plantarum and Bacillus subtilis on rumen fermentation and the bacterial community in calves[J]. Animal Science Journal, 2017, 88(5): 755-762. DOI:10.1111/asj.12691 |
| [45] |
RYCHEN G, AQUILINA G, AZIMONTI G, et al. Safety and efficacy of Bacillus subtilis DSM 28343 as a feed additive for calves for rearing[J]. EFSA Journal, 2018, 16(3): e05220. |
| [46] |
SALAZAR L F L, NERO L A, CAMPOS-GALVAO M E M, et al. Effect of selected feed additives to improve growth and health of dairy calves[J]. PLoS One, 2019, 14(5): e0216066. DOI:10.1371/journal.pone.0216066 |
| [47] |
SAREMI B, NASERIAN A. Improvement of the growth and performance of Holstein neonatal calves receiving the microbial additive Saccharomyces cerevisiae (Iran Molasses Co., 2002)[J]. Journal of Dairy Science, 2002, 86(11): 3809-3809. |
| [48] |
SEIFZADEH S, AGHJEHGHESHLAGH F M, ABDIBENEMAR H, et al. The effects of a medical plant mix and probiotic on performance and health status of suckling Holstein calves[J]. Italian Journal of Animal Science, 2017, 16(1): 44-51. DOI:10.1080/1828051X.2016.1249421 |
| [49] |
STRZETELSKI J A, KOWALCZYK JKRAWCZYK K. Effect of various probiotics on calf performance[J]. Journal of Animal and Feed Sciences, 1998, 7: 241-244. DOI:10.22358/jafs/69983/1998 |
| [50] |
SUN P, WANG J, QZHANG H T. Effects of Bacillus subtilis natto on performance and immune function of preweaning calves[J]. Journal of dairy science, 2010, 93(12): 5851-5855. DOI:10.3168/jds.2010-3263 |
| [51] |
TAKEMURA K, SHINGU H, IKUTA K, et al. Effects of Saccharomyces cerevisiae supplementation on growth performance, plasma metabolites and hormones, and rumen fermentation in Holstein calves during pre- and post-weaning periods[J]. Journal of Animal Science, 2020, 91(1): e13402. |
| [52] |
TERRÉ M, MAYNOU G, BACH A, et al. Effect of Saccharomyces cerevisiae CNCM I-1077 supplementation on performance and rumen microbiota of dairy calves[J]. The Professional Animal Scientist, 2015, 31(2): 153-158. DOI:10.15232/pas.2014-01384 |
| [53] |
ZHANG L, JIANG X, LIU X, et al. Growth, health, rumen fermentation, and bacterial community of Holstein calves fed Lactobacillus rhamnosus GG during the preweaning stage[J]. Journal of Animal Science, 2019, 97(6): 2598-2608. DOI:10.1093/jas/skz126 |
| [54] |
RETTA K S. Role of probiotics in rumen fermentation and animal performance: a review[J]. International Journal of Livestock Production, 2016, 7(5): 24-32. DOI:10.5897/IJLP2016.0285 |
| [55] |
SUN Z, WANG T, DEMELASH N, et al. Effect of yeast culture (Saccharomyces cerevisiae) on broilers: a preliminary study on the effective components of yeast culture[J]. Animals: an Open Access Journal from MDPI, 2019, 10(1): 68. |
| [56] |
WANG H, YU Z, GAO Z, et al. Effects of compound probiotics on growth performance, rumen fermentation, blood parameters, and health status of neonatal Holstein calves[J]. Journal of Dairy Science, 2022, 105(3): 2190-2200. DOI:10.3168/jds.2021-20721 |
| [57] |
YAO J, WANG L L, ZHANG W J, et al. Effects of Bacillus megaterium on growth performance, serum biochemical parameters, antioxidant capacity, and immune function in suckling calves[J]. Open Life Sciences, 2020, 15(1): 1033-1041. DOI:10.1515/biol-2020-0106 |
| [58] |
SUN P, WANG J, QDENG L F. Effects of Bacillus subtilis natto on milk production, rumen fermentation and ruminal microbiome of dairy cows[J]. Animal, 2013, 7(2): 216-22. DOI:10.1017/S1751731112001188 |
| [59] |
LARSON L L, OWEN F G, ALBRIGHT J L, et al. Guidelines toward more uniformity in measuring and reporting calf experimental data1[J]. Journal of Dairy Science, 1977, 60(6): 989-991. DOI:10.3168/jds.S0022-0302(77)83975-1 |
| [60] |
LEE Y E, KANG I J, YU E A, et al. Effect of feeding the combination with Lactobacillus plantarum and Bacillus subtilis on fecal microflora and diarrhea incidence of Korean native calves[J]. Korean Journal of Veterinary Service, 2012, 35(4): 343-346. DOI:10.7853/kjvs.2012.35.4.343 |
| [61] |
MOHAMAD H, MEHDI D B, ABOLFAZL Z. The effect of feeding of bacterial probiotic in milk or starter on growth performance, health, blood and rumen parameters of suckling calves[J]. Research On Animal Production, 2013, 4(8): 57-69. |
| [62] |
ROODPOSHTI P M, DABIRI N. Effects of probiotic and prebiotic on average daily gain, fecal shedding of Escherichia coli, and immune system status in newborn female calves[J]. Asian-Australasian Journal of Animal Sciences, 2012, 25(9): 1255-1261. DOI:10.5713/ajas.2011.11312 |
| [63] |
FERNÁNDEZ S, FRAGA M, CASTELLS M, et al. Effect of the administration of Lactobacillus spp. strains on neonatal diarrhoea, immune parameters and pathogen abundance in pre-weaned calves[J]. Beneficial Microbes, 2020, 11(5): 477-488. DOI:10.3920/BM2019.0167 |




