2. 中国水产科学研究院长江水产研究所, 农业农村部淡水生物多样性保护重点实验室, 武汉 430223;
3. 上海海洋大学水产与生命学院, 上海 201306;
4. 武汉新华扬生物股份有限公司, 武汉 430074;
5. 浙江华太生物科技有限公司, 金华 322005
2. Key Laboratory of Freshwater Biodiversity Conservation, Ministry of Agriculture and Rural Affairs of China, Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China;
3. College of Aquatic Science and Technology, Shanghai Ocean University, Shanghai 201306, China;
4. SUNHY Biological Co., Ltd., Wuhan 430074, China;
5. Zhejiang Huatai Biotechnology Co., Ltd., Jinhua 322005, China
与畜禽相比,鱼类对糖利用率不高,尤其是肉食性鱼类[1-2]。随着水产养殖和饲料业的不断发展, 鱼粉的价格日益上涨,在鱼类饲料中常以植物蛋白质原料替代部分鱼粉[3-4], 但植物蛋白质原料含有较多的糖类[5];另外,为达到膨胀和黏合的目的,在水产膨化饲料加工过程中也需要加入一定水平糖类来增强物料的黏性,帮助膨化饲料形成一定硬度并增加其在水中的稳定性[6]。因此,这更容易造成肉食性鱼类饲料中的糖含量超过其耐受能力[7-9]。
大口黑鲈(Micropterus salmoides)是我国重要的淡水经济鱼类,作为典型的肉食性鱼类,大口黑鲈相较于大菱鲆(Scophthalmus maximus)[10]、军曹鱼(Rachycentron canadum)[11]等肉食性鱼类,对糖的利用能力更差[12]。长期摄食高糖饲料,会导致大口黑鲈生长受阻,肝糖原和脂肪含量增加[13],造成肝脏肥大、颜色苍白以及肝细胞空泡区增加[7, 14],引发肝脏功能性损伤[12, 15-16]。同时,摄食高糖水平饲料会改变大口黑鲈肠道形态,增加肠道炎症相关基因表达,降低肠道益生菌丰度和肠道对有害细菌的抵抗力[17]。因此,如何提高大口黑鲈对饲料中糖的适应性,改善肝脏和肠道健康,对发展其规模化健康养殖尤为重要。
植物甾醇是一种广泛存在于各种植物油、坚果和植物种子中的甾体化合物。近年来,因其具有良好的降血脂功效而较多应用于医学和食品生产中[18]。目前,在畜禽动物中,已有许多研究发现,饲料中添加适量植物甾醇,可以显著提高其生长性能[19-20]、增强抗氧化能力[21]、降低血脂水平[22]和改善肉质[23]。而进一步的研究发现,植物甾醇可以减少肝脏炎症发生[24]并可降低肝糖原沉积[25]。目前关于植物甾醇在水产动物方面的报道不多,但也发现饲料中添加适量的植物甾醇可显著提高如团头鲂(Megalobrama amblycephala)[26]、罗氏沼虾(Macrobrachium rosenbergii)[27]和大口黑鲈[28]等的生长性能和抗氧化能力,并具有降低血脂含量的作用。但现在仍不清楚植物甾醇是否可以降低鱼类肝糖原积累,以及对鱼类肝脏和肠道健康是否有改善作用。
因此,本研究在龚红等[28]的研究基础上,再次以大口黑鲈为研究对象,重新评估植物甾醇对其生长性能、饲料利用、体成分、肝脏和肠道健康以及肌肉质构的影响,以期为植物甾醇在鱼类饲料中的应用提供参考依据。
1 材料与方法 1.1 试验饲料本试验以鱼粉和鸡肉粉等为主要蛋白质源,鱼油和豆油为脂肪源,配制基础饲料。根据植物甾醇在团头鲂[26]、吉富罗非鱼[27]和大口黑鲈[28]等水产动物中的研究结果,本试验在基础饲料中分别添加0(对照)、22.5、45.0、67.5和90.0 mg/kg的植物甾醇,共配制出5种试验饲料,分别记作TZ0、TZ22、TZ45、TZ67和TZ90。
饲料配制之前,先将鱼粉和豆粕等饲料原料进行粉碎处理,过60目筛,然后按照配方逐级混匀。其中,先以面粉为稀释剂将植物甾醇预混料(含总甾醇15%,其中菜油甾醇6%,谷甾醇8%,豆油甾醇1%)逐级混匀后与其他原料再次混匀。将鱼油和豆油混合均匀后加入到配合好的原料中,再次混匀,加入适量的自来水后,使用饲料机(TSE65,北京现代洋工机械科技发展有限公司)将其加工制成直径2 mm的颗粒饲料,70~80 ℃干燥15 min(带式干燥机,DW型,常州苏式干燥设备有限公司),放至室温后储藏于-20 ℃冰箱中备用。试验饲料组成及营养水平见表 1。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验用鱼(优鲈3号)为购自荆州渔都特种水产养殖公司孵化的同一批鱼。在正式养殖试验前,为尽快驯化大口黑鲈使之对投喂及投喂人员产生条件反射,适应试验养殖环境,所有鱼用TZ0饲料暂养2周,每日投喂3次,分别为08:30、12:30和16:30,表观饱食投喂。但在驯化过程中,由于大口黑鲈在中午的摄食并不积极,摄食量较低,容易造成饲料浪费,故在正式试验中对试验鱼进行每日2次投喂。
试验开始前,试验鱼禁食24 h。挑选出600尾个体健壮、规格一致,初始平均体重为(5.01±0.06) g的大口黑鲈。养殖于15个流水养殖桶中(直径1.0 m,水深0.35 m,水体体积约270 L),每桶40尾,将15个桶随机分为5组,每组3个重复,分别投喂5种试验饲料。每日表观饱食投喂2次(08:00和16:30)。每日记录水温、大口黑鲈摄食行为和死亡数量等,养殖用水为地下水。饲养期间的水质条件为:水温20~23 ℃,溶解氧含量大于5.0 mg/L,pH 6.8~7.3,氨氮含量小于0.1 mg/L,亚硝酸盐含量小于0.01 mg/L。养殖试验持续8周。
1.3 样品采集和分析 1.3.1 样品采集养殖试验结束后,禁食24 h后,用MS-222麻醉(120 mg/L),对每桶试验鱼进行计数和称重,用于计算成活率、增重率和特定生长率,并根据饲料总投喂量计算饲料系数。禁食48 h后,用MS-222麻醉(120 mg/L),每桶随机取3尾鱼,测量体长和体重,用于计算肥满度,随后进行尾部静脉取血,4 ℃冰箱内静置2 h,3 000 r/min的转速离心15 min,取上清液,置于-80 ℃冰箱中,用于测定血清生化指标。解剖取相同部位的肝脏、肠道,置于4%多聚甲醛中,用于制作组织切片。每桶随机取3尾鱼,麻醉后解剖取内脏,称重并记录用于计算脏体比。将肝脏由内脏中分离,称重并记录用于计算肝体比,取肝脏样品,用于测定抗氧化指标和肝糖原含量,取去内脏全鱼鱼体背部侧线上方肌肉并保存肌肉样品,用于测定肌糖原含量和营养组成。每桶随机取3尾鱼,-20 ℃保存,用于测定全鱼常规营养组成。每桶随机取4尾鱼,取鱼体背部左侧侧线上方肌肉,立即用于肌肉质构的测定。
1.3.2 饲料和鱼体组成分析饲料、全鱼和肌肉营养组成的分析方法如下:水分含量测定采用105 ℃干燥法(GB/T 5009.3—2003),粗蛋白质含量测定采用凯氏定氮法(GB/T 5009.5—2003),粗脂肪含量测定采用索式抽提法(GB/T 5009.6—2003),粗灰分含量测定采用灼烧称重法(GB/T 5009.4—2003)。糖原含量测定采用南京建成生物工程研究所试剂盒(比色法),按照试剂盒使用说明进行操作。
1.3.3 血清生化指标测定血清葡萄糖(glucose, GLU)、甘油三酯(triglyceride, TG)、总蛋白(total protein, TP)、白蛋白(albumin, ALB)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)含量及谷草转氨酶(aspartate aminotransferase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)、碱性磷酸酶(alkaline phosphatase, ALP)、脂肪酶(lipase, LIP)和α-淀粉酶(α-amylase, α-AMY)活性由全自动生化分析仪(BS-460,深圳迈瑞生物医疗电子股份有限公司)测定,所用试剂均为购自深圳迈瑞生物医疗电子股份有限公司生产的同一批次试剂。
1.3.4 血清和肝脏抗氧化指标测定抗氧化指标采用南京建成生物工程研究所试剂盒测定,测定指标包括丙二醛(MDA, TBA法)含量及过氧化氢酶(CAT, 钼酸铵法)和超氧化物歧化酶(SOD, WST-1法)活性,按照试剂盒使用说明进行操作。
1.3.5 肌肉质构测定每桶随机取4尾鱼,取鱼体背部左侧侧线上方肌肉,立即用于肌肉质构测定。样本修整为1 cm×1 cm×1 cm块状。使用质构分析仪(TVT-300XP型,波通瑞华科学仪器北京有限公司)依据文献[29]中使用的质地剖面分析法(texture profile analysis, TPA)进行测定,参数设定如下:采用25 mm×25 mm的柱形探头,测定间隔时间为5 s,接触感应力为5 g,压缩比为60%,数据获得速率为200.00 pps,测试速度1 mm/s,每个样品重复测定3次, 取平均值。肌肉质构特性测定指标包括:硬度、弹性、凝聚性、胶黏性、咀嚼性、黏连性、回复性、黏附性。
1.3.6 肝脏、肠道形态结构分析肝脏、肠道经4%多聚甲醛固定24 h后,进行常规石蜡包埋切片,厚度为6 μm,苏木精-伊红(HE)染色,制作切片。
肝脏和肠道组织标本石蜡切片采用光学显微镜(CX33型,奥林巴斯工业)观察并用成像系统进行成像和图像采集。其中,肝脏细胞长度、细胞宽度、细胞核直径、肠道组织绒毛高度、绒毛宽度和肌层厚度由软件Image-pro plus 9.0测量。
肝脏组织颜色由测色色差计(WSC-1B型,上海仪电物理光学仪器有限公司)测定。将所取肝脏样品置于干净滤纸上,测色色差计探头对准肝脏样品,测定亮度(L*)值、红度(a*,+a*偏红,-a*偏绿)值和黄度(b*,+b*偏黄, -b*偏蓝)值。
1.4 计算公式成活率、增重率、摄食率、特定生长率、饲料系数、肥满度、肝体比和脏体比参照以下公式计算:

|
所有数据由Excel 2019整理后用SPSS 22.0软件进行统计分析。先进行ANOVA单因子方差分析,若组间差异显著,再用Duncan氏法进行多重比较,P<0.5为差异显著。结果均以“平均值±标准误”(n=3)表示。二次回归模型采用Origin 2021进行多项式拟合分析后制作。
2 结果 2.1 植物甾醇对大口黑鲈生长性能和饲料利用的影响各组试验鱼均无死亡情况发生,成活率为100%。由表 2可知,与TZ0组相比,饲料中添加植物甾醇对大口黑鲈生长性能和饲料利用无显著影响(P>0.05)。
|
|
表 2 饲料添加植物甾醇对大口黑鲈生长性能和饲料利用的影响 Table 2 Effects of dietary phytosterol on growth performance and feed utilization of Micropterus salmoides |
由表 3可知,在全鱼中,植物甾醇对试验鱼的粗蛋白质和粗灰分含量无显著影响(P>0.05),但是饲料中添加植物甾醇有提高水分含量、降低粗脂肪含量的趋势。与TZ0组相比,TZ22、TZ67和TZ90组全鱼肌肉水分含量显著提高(P<0.5),TZ45、TZ67和TZ90组粗脂肪含量显著降低(P<0.5)。在肌肉中,试验鱼肌肉的水分含量随植物甾醇添加量的提高呈上升趋势。其中,与TZ0组相比,TZ22、TZ67和TZ90组水分含量显著提高(P<0.5)。TZ45、TZ67和TZ90组肌糖原含量显著降低(P<0.5)。在肝脏中,饲料中添加植物甾醇显著降低了试验鱼肝糖原含量(P<0.5)。其中,肝糖原含量在TZ90组时达到最低,显著低于TZ0组(P<0.5)。随着饲料中植物甾醇添加量的提高,肝脏粗脂肪含量呈先下降后上升的趋势,在TZ45组达到最低,与TZ0组差异不显著(P>0.05)。
|
|
表 3 饲料中添加植物甾醇对大口黑鲈体成分的影响 Table 3 Effects of dietary phytosterol on fish body composition of Micropterus salmoides |
由表 4可知,饲料中添加植物甾醇对大口黑鲈血清中的LDL-C、HDL-C、TC、TP、ALB含量及ALP、LIP和α-AMY活性无显著影响(P>0.05)。与TZ0组相比,TZ22和TZ67组血清ALT活性显著降低(P<0.5);TZ22、TZ45和TZ67组血清AST活性显著降低(P<0.5);TZ45和TZ90组血清GLU含量显著升高(P<0.5);TZ22、TZ67和TZ90组血清TG含量显著升高(P<0.5)。
|
|
表 4 饲料中添加植物甾醇对大口黑鲈血清生化指标的影响 Table 4 Effects of dietary phytosterol on serum biochemical parameters of Micropterus salmoides |
由表 5可知,与TZ0组相比,饲料中添加植物甾醇对大口黑鲈血清SOD活性、肝脏SOD活性和肝脏MDA含量无显著影响(P>0.05)。在血清中,与TZ0组相比,TZ90组MDA含量显著降低(P<0.5),TZ67组CAT活性显著升高(P<0.5);在肝脏中,与TZ0组相比,TZ90组CAT活性显著降低(P<0.5)。
|
|
表 5 饲料添加植物甾醇对大口黑鲈血清和肝脏抗氧化指标的影响 Table 5 Effects of dietary phytosterol on antioxidant indexes in serum and liver of Micropterus salmoides |
由表 6可知,饲料中添加植物甾醇对大口黑鲈肌肉弹性、内聚性、胶黏性、咀嚼性和回复性无显著影响(P>0.05),但饲料中添加植物甾醇显著增加了试验鱼肌肉硬度、黏连性和黏附性(P<0.5)。其中,试验鱼的肌肉硬度随着植物甾醇添加量的增加,表现出先增加后降低的趋势,并在TZ67组达到最大;黏连性和黏附性随植物甾醇添加量的提高有上升的趋势,其中,黏连性在TZ45组达到最大,黏附性在TZ90组达到最大。
|
|
表 6 饲料中添加甾醇对大口黑鲈肌肉质构特性的影响 Table 6 Effects of dietary phytosterol on muscle texture properties of Micropterus salmoides |
由表 7可知,饲料中添加植物甾醇对大口黑鲈肝细胞的细胞核直径、细胞长度、L*和b*值无显著影响(P>0.05)。与TZ0组相比,除TZ90组外,各组间试验鱼肝细胞宽度无显著差异(P>0.05);TZ45组a*值显著高于TZ0组(P<0.5)。
|
|
表 7 饲料中添加植物甾醇对大口黑鲈肝细胞形态和肝脏颜色的影响 Table 7 Effects of dietary phytosterol on hepatocyte morphology and liver color of Micropterus salmoides |
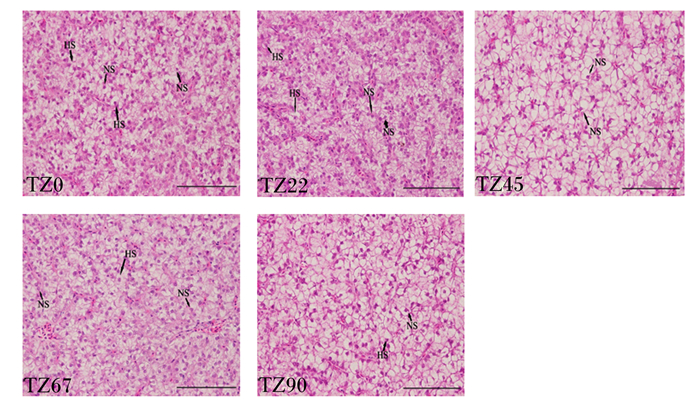
由图 1可知,与TZ0组相比,饲料中添加植物甾醇对大口黑鲈肝脏组织结构无明显影影响。各组试验鱼的肝脏组织较为完整,细胞与细胞之间界限清晰,未出现炎症细胞浸润及肝细胞损伤情况。但是,各组试验鱼肝细胞均有细胞肿胀、细胞核偏移和细胞空泡化的发生。
|
HS:肝细胞肿胀hepatocyte swelling;NS:细胞核偏移nuclear shift;图中比例尺为100 μm the scale in the figure is 100 μm。 图 1 饲料中添加植物甾醇对大口黑鲈肝脏组织学的影响 Fig. 1 Effects of dietary phytosterol on liver histology of Micropterus salmoides |
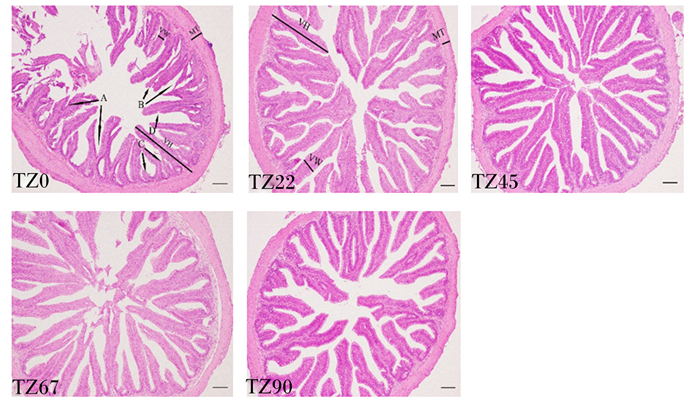
由图 2可知,TZ0组试验鱼的肠道存在明显的受损现象,表现为增生、坏死、萎缩情况,甚至出现纹状缘局部受损现象,且肠绒毛排列不规则。相比于TZ0组,TZ22、TZ45、TZ67和TZ90组肠绒毛结构完整,纹状缘排列整齐,肠绒毛异常现象不明显。
|
VH:绒毛高度villus height;VW: 绒毛宽度villus width;MT: 肌层厚度muscles thickness。 A:绒毛增生villous hyperplasia;B:绒毛坏死villous necrosis;C:绒毛萎缩villous atrophy;D:纹状缘局部受损striate margin damage。图中比例尺为100 μm the scale in the figure is 100 μm。 图 2 饲料添加植物甾醇对大口黑鲈肠道组织学的影响 Fig. 2 Effects of dietary phytosterol on intestinal histology of Micropterus salmoides |
由表 8可知,饲料中添加植物甾醇对大口黑鲈肠道绒毛特征无显著影响(P>0.05)。但相比于TZ0组,饲料中添加植物甾醇有提高试验鱼的肠绒毛高度的趋势,在TZ67组达到最高;而绒毛宽度则呈下降趋势,TZ90组时达到最低。
|
|
表 8 饲料中添加植物甾醇对大口黑鲈肠道绒毛特征的影响 Table 8 Effects of dietary phytosterol on intestinal villus characteristics of Micropterus salmoides |
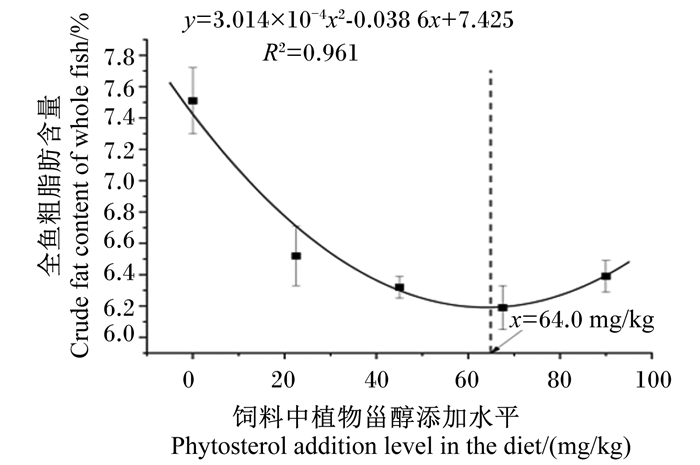
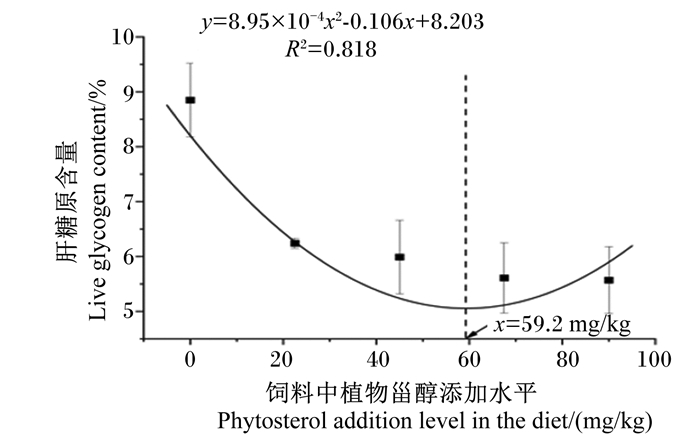
以饲料中植物甾醇添加量为自变量(x),以大口黑鲈全鱼粗脂肪含量为因变量(y)作回归分析,得到二次回归方程y=3.014×10-4x2-0.038 6x+7.425 (R2=0.961)。当x为64.0 mg/kg,大口黑鲈全鱼粗脂肪含量达到最低(图 3);以肝糖原含量(y)为评价指标,通过二次回归方程y=8.95×10-4x2-0.106x+8.203(R2=0.818)计算得到当饲料中植物甾醇添加量为59.2 mg/kg时,大口黑鲈肝糖原含量达到最低(图 4)。
|
图 3 饲料添加植物甾醇对大口黑鲈全鱼粗脂肪含量的影响 Fig. 3 Effects of dietary phytosterol on crude fat content of whole fish of Micropterus salmoides |
|
图 4 饲料添加植物甾醇对大口黑鲈肝糖原含量的影响 Fig. 4 Effects of dietary phytosterol on liver glycogen content of Micropterus salmoides |
在团头鲂的研究中发现,饲料中添加植物甾醇可以显著提高鱼体的增重率和特定生长率,对鱼体生长具有促进作用[26]。这与植物甾醇具有类激素作用,能够调节垂体与肝脏功能,促进生长激素和胰岛素样生长因子-Ⅰ(IGF-Ⅰ)的分泌有关[30]。但在本研究中并未发现大口黑鲈的生长性能随植物甾醇的添加出现显著提高。这可能与大口黑鲈的生物学特性有关。大口黑鲈属温水性鱼类,其生长最适水温为25~30 ℃[31],本试验期间的水温为20~23 ℃,而研究表明,当水温在25 ℃以上时,大口黑鲈特定生长率可达到最高[32]。因此,可能由于本试验期间水温未能达到大口黑鲈最适水温,影响了大口黑鲈的生长速度。
在团头鲂[26]、罗氏沼虾[27]和大口黑鲈[28]等报道中,根据生长表现得到的饲料中植物甾醇最适添加量分别为40、40和30 mg/kg,而在本研究中也发现以生长性能作为效应指标时,大口黑鲈饲料中植物甾醇最适添加量为45 mg/kg。但是,本研究以全鱼粗脂肪含量、肝糖原含量为效应指标时,大口黑鲈饲料中植物甾醇适宜添加量为59.2~64.0 mg/kg,稍高于以生长需要而确定的最适添加量。这可能和生长与生理需要(如抗氧化能力、消化酶活性和免疫力等)不同有关,这在鱼类维生素的相关研究中也有类似发现[33-35]。
3.2 饲料中添加植物甾醇对大口黑鲈肝脏健康的影响肝脏是鱼类糖代谢的主要场所,鱼类摄入含高水平糖类的饲料会造成肝糖原含量升高[36],当糖原积累过量时,会导致肝脏异常增大从而使肝细胞功能受损[37]。本研究中发现,饲料中添加适量植物甾醇可以有效减少肝糖原的积累。这与在田鼠[38]和大鼠[25]中的研究结果一致。这或许与植物甾醇能提高肝糖原磷酸化酶活性有关[38],糖原磷酸化酶可以催化糖原的磷酸解。在本研究中,饲料中添加植物甾醇提高了大口黑鲈的血清GLU含量,与Panda等[39]研究中大鼠的表现类似。这可能与植物甾醇对肝糖原分解的促进作用有关[25]。
在正常状态下, AST和ALT在血液中的活性较低。但当肝细胞发生病变和损伤时,会引起细胞膜通透性增加, 导致这2种酶由细胞内释放到血液中[40]。因此, AST和ALT活性也常作为反映肝脏功能受损的特异性指标。本研究中发现,与TZ0组相比,TZ22和TZ67组血清ALT活性显著降低,TZ22、TZ45和TZ67组血清AST活性显著降低,这表明饲料中添加植物甾醇可以改善大口黑鲈肝脏健康。
细胞在能量代谢过程中会产生活性氧(ROS),当ROS产生过多会导致细胞和组织损伤, 即氧化应激[41]。而SOD和CAT可以清除自由基,保护细胞免受ROS损伤[42]。MDA作为脂质过氧化的最终产物,其含量常被用于评估机体的脂质过氧化程度[43]。而植物甾醇可以通过调节抗氧化酶和自由基的产生来保护机体免受氧化应激的伤害[44-47]。在本试验中,肝脏MDA含量随着饲料中植物甾醇添加量的升高呈下降趋势,这与在罗非鱼[27]中的研究结果一致,说明植物甾醇可以提高肝脏抗氧化能力。此外,本研究也发现,TZ90组肝脏CAT活性显著降低。这可能是添加植物甾醇后肝脏的健康状况得到改善,肝脏中过氧化氢含量减少,而无需表达或激活CAT的活性[48]。
肝脏颜色通常也是判断肝脏健康的重要评价指标之一[15]。本试验中发现,代表肝脏红度的a*值随着植物甾醇添加量的增加呈上升趋势,表明随着植物甾醇添加量的提高,肝脏颜色更红,而这通常被认为是肝脏健康的表现。本研究中,组织学分析结果显示,各组肝脏组织较为完整,细胞与细胞之间界限清晰,未出现炎症细胞浸润及肝细胞损伤情况。但是,各组肝细胞均发现肝细胞空泡化以及细胞核受挤压偏移的现象发生。一般来讲,这种情况在养殖鱼类中较为常见[49]。空泡含有脂质和糖原,这与肝脏的正常代谢功能有关[50]。一些研究发现,肝脏中脂质和糖原沉积过高会导致肝脏病变,对鱼的健康造成不良影响[51]。从本试验中有关肝脏健康状况评价的血清生化指标,如血清ALT、AST活性的结果来看,饲料中添加适量植物甾醇确实可以改善肝脏健康,但是在组织学上这种改善并不明显。
3.3 饲料中添加植物甾醇对大口黑鲈肠道健康的影响研究表明,饮食因素可能会干扰鱼体肠内的稳态和结构特征[52-53]。在本研究中,TZ0组肠道存在明显增生、坏死、萎缩情况,甚至出现纹状缘局部受损现象,且肠绒毛排列不规则。而添加植物甾醇后,肠道结构得到明显改观,表明植物甾醇有利于大口黑鲈肠道健康。
肠道是食物消化、吸收和运输的主要器官,肠道功能对营养物质的吸收非常重要[54],可通过测量绒毛特征来评估肠道的健康和功能[55]。在本研究中,植物甾醇在一定程度上有提高大口黑鲈肠绒毛高度和降低绒毛宽度的趋势,这通常被认为是肠道结构形态得到改善的表现[56]。
3.4 饲料中添加植物甾醇对大口黑鲈肌肉质构的影响肌肉的质构特性是决定其可口性的重要因素,是肉质主要的感官和理化指标[57-58]。硬度是指使食品达到一定变形所需要的力,食品保持形状的内部结合力[59]。硬度越大,抵抗牙齿压力的能力越大,发生断裂所需的变形力越大,弹性也相应的越大。一般而言,鱼肉硬度的提高表明肉质得到了改善[60]。黏连性是指样品在与压力探头分离前减压过程中的延展距离,黏连性越大,表明样品延展性越好。黏附性是指探头脱离样品所需的能量,反映在咀嚼鱼肉时,鱼肉表面与舌、齿等之间的黏力[59]。在本研究中,TZ22、TZ45、TZ67组大口黑鲈肌肉硬度、黏连性和黏附性均显著高于TZ0组,表明大口黑鲈肌肉质构特性得到提升,植物甾醇显著改善了大口黑鲈的肌肉品质。
4 结论在本试验条件下,饲料中添加植物甾醇对大口黑鲈的生长性能无显著影响,但也发现适量的植物甾醇可以显著降低大口黑鲈肝脏和肌肉的糖原积累,提高其肌肉品质,并改善其肝脏和肠道健康情况。以全鱼粗脂肪含量、肝糖原含量为效应指标,经二次回归模型分析后,发现大口黑鲈饲料中植物甾醇适宜添加量为59.2~64.0 mg/kg。
| [1] |
STONE D A J. Dietary carbohydrate utilization by fish[J]. Reviews in Fisheries Science, 2003, 11(4): 337-369. DOI:10.1080/10641260390260884 |
| [2] |
WILSON R P. Utilization of dietary carbohydrate by fish[J]. Aquaculture, 1994, 124(1/2/3/4): 67-80. |
| [3] |
COCHRAN N J, COYLE S D, TIDWELL J H. Evaluation of reduced fish meal diets for second year growout of the largemouth bass, Micropterus salmoides[J]. Journal of the World Aquaculture Society, 2009, 40(6): 735-743. DOI:10.1111/j.1749-7345.2009.00293.x |
| [4] |
URÁN P A, GONÇALVES A A, TAVERNE-THIELE J J, et al. Soybean meal induces intestinal inflammation in common carp (Cyprinus carpio L.)[J]. Fish & Shellfish Immunology, 2008, 25(6): 751-760. |
| [5] |
JIANG Y, ZHAO P F, LIN S M, et al. Partial substitution of soybean meal with fermented soybean residue in diets for juvenile largemouth bass, Micropterus salmoides[J]. Aquaculture Nutrition, 2018, 24(4): 1213-1222. DOI:10.1111/anu.12659 |
| [6] |
杨洁, 李军国, 许传祥, 等. 不同淀粉源对水产膨化饲料加工及品质特性影响研究进展[J]. 水产学报, 2019, 43(10): 2102-2108. YANG J, LI J G, XU C X, et al. Research progress on the effects of different starch sources on processing and quality characteristics of extruded aquatic feed[J]. Journal of Fisheries of China, 2019, 43(10): 2102-2108 (in Chinese). DOI:10.11964/jfc.20190911975 |
| [7] |
刘康. 卵形鲳鲹(Trachinotus ovatus)幼鱼和大口黑鲈(Micropterus salmoides)幼鱼糖脂代谢比较研究[D]. 博士学位论文. 湛江: 广东海洋大学, 2017: 15-25. LIU K. Comparative study of carbohydrate and lipid metabolism of juvenile golden pompano (Trachinotus ovatus) and juvenile largemouth bass (Micropterus salmoides)[D]. Ph. D. Thesis. Zhenjiang: Guangdong Ocean University, 2017: 15-25. (in Chinese) |
| [8] |
HEMRE G I, MOMMSEN T P, KROGDAHL Å. Carbohydrates in fish nutrition: effects on growth, glucose metabolism and hepatic enzymes[J]. Aquaculture Nutrition, 2002, 8(3): 175-194. DOI:10.1046/j.1365-2095.2002.00200.x |
| [9] |
VIELMA J, KOSKELA J, RUOHONEN K, et al. Optimal diet composition for European whitefish (Coregonus lavaretus): carbohydrate stress and immune parameter responses[J]. Aquaculture, 2003, 225(1/2/3/4): 3-16. |
| [10] |
ZENG L, LEI J L, AI C X, et al. Protein-sparing effect of carbohydrate in diets for juvenile turbot Scophthalmus maximus reared at different salinities[J]. Chinese Journal of Oceanology and Limnology, 2015, 33(1): 57-69. DOI:10.1007/s00343-015-4070-5 |
| [11] |
REN M C, AI Q H, MAI K S, et al. Effect of dietary carbohydrate level on growth performance, body composition, apparent digestibility coefficient and digestive enzyme activities of juvenile cobia, Rachycentron canadum L[J]. Aquaculture Research, 2011, 42(10): 1467-1475. DOI:10.1111/j.1365-2109.2010.02739.x |
| [12] |
苟仕潘, 陈乃松, 徐祥泰, 等. 饲料中可消化淀粉对大口黑鲈生长、体组成和非特异性免疫指标的影响[J]. 水产学报, 2015, 39(10): 1499-1510. GOU S P, CHEN N S, XU X T, et al. Effects of dietary digestible starch levels on growth performance, body composition, and non-specific immunological index of largemouth bass (Micropterus salmoides)[J]. Journal of Fisheries of China, 2015, 39(10): 1499-1510 (in Chinese). |
| [13] |
AMOAH A, COYLE S D, WEBSTER C D, et al. Effects of graded levels of carbohydrate on growth and survival of largemouth bass, Micropterus salmoides[J]. Journal of the World Aquaculture Society, 2008, 39(3): 397-405. DOI:10.1111/j.1749-7345.2008.00168.x |
| [14] |
ZHANG W, LIU K, TAN B P, et al. Transcriptome, enzyme activity and histopathology analysis reveal the effects of dietary carbohydrate on glycometabolism in juvenile largemouth bass, Micropterus salmoides[J]. Aquaculture, 2019, 504: 39-51. DOI:10.1016/j.aquaculture.2019.01.030 |
| [15] |
GOODWIN A E, LOCHMANN R T, TIEMAN D M, et al. Massive hepatic necrosis and nodular regeneration in largemouth bass fed diets high in available carbohydrate[J]. Journal of the World Aquaculture Society, 2002, 33(4): 466-477. DOI:10.1111/j.1749-7345.2002.tb00026.x |
| [16] |
ZHAO L L, LIAO L, TANG X H, et al. High-carbohydrate diet altered conversion of metabolites, and deteriorated health in juvenile largemouth bass[J]. Aquaculture, 2022, 549: 737816. DOI:10.1016/j.aquaculture.2021.737816 |
| [17] |
ZHOU Y L, HE G L, JIN T, et al. High dietary starch impairs intestinal health and microbiota of largemouth bass, Micropterus salmoides[J]. Aquaculture, 2021, 534: 736261. DOI:10.1016/j.aquaculture.2020.736261 |
| [18] |
VALITOVA J N, SULKARNAYEVA A G, MINIBAYEVA F V. Plant sterols: diversity, biosynthesis, and physiological functions[J]. Biochemistry (Moscow), 2016, 81(8): 819-834. DOI:10.1134/S0006297916080046 |
| [19] |
NAJI T A A, AMADOU I, ZHAO R Y, et al. Effects of phytosterol in feed on growth and related gene expression in muscles of broiler chickens[J]. Tropical Journal of Pharmaceutical Research, 2014, 13(1): 9-16. DOI:10.4314/tjpr.v13i1.2 |
| [20] |
吴先华, 何若钢, 覃小荣, 等. 植物甾醇对生长育肥猪生长性能、抗氧化能力及免疫功能的影响[J]. 中国饲料, 2013(16): 30-32, 36. WU X H, HE R G, QIN X R, et al. Effects of phytosterol on growth performance blood biochemical index and antioxidant index[J]. China Feed, 2013(16): 30-32, 36 (in Chinese). DOI:10.3969/j.issn.1004-3314.2013.16.009 |
| [21] |
贾代汉, 周岩民, 王恬. 植物甾醇对肉鸡血清胆固醇、蛋白质水平和抗氧化酶活性的影响[J]. 中国粮油学报, 2007, 22(2): 88-93. JIA D H, ZHOU Y M, WANG T. Effects of phytosterol on cholesterol and protein level and antioxidation enzyme activity in serum of broilers[J]. Journal of the Chinese Cereals and Oils Association, 2007, 22(2): 88-93 (in Chinese). DOI:10.3321/j.issn:1003-0174.2007.02.022 |
| [22] |
GILMAN C I, LEUSCH F D L, BRECKENRIDGE W C, et al. Effects of a phytosterol mixture on male fish plasma lipoprotein fractions and testis P450scc activity[J]. General and Comparative Endocrinology, 2003, 130(2): 172-184. DOI:10.1016/S0016-6480(02)00590-7 |
| [23] |
顾莞婷, 周岩民, 王恬. 植物甾醇对肉鸭生产性能、血液胆固醇含量和胴体品质的影响[J]. 中国粮油学报, 2007, 22(3): 97-100, 106. GU G T, ZHOU Y M, WANG T. Effects of phytosterols on performance, plasma cholesterol content and carcass quality of meat duck[J]. Journal of the Chinese Cereals and Oils Association, 2007, 22(3): 97-100, 106 (in Chinese). DOI:10.3321/j.issn:1003-0174.2007.03.025 |
| [24] |
PLAT J, HENDRIKX T, BIEGHS V, et al. Protective role of plant sterol and stanol esters in liver inflammation: insights from mice and humans[J]. PLoS One, 2014, 9(10): e110758. DOI:10.1371/journal.pone.0110758 |
| [25] |
SHREE M K, VISHNUPRIYA V, PONNULAKSHMI R, et al. Effect of beta-sitosterol on glycogen metabolic enzyme in high-fat fed diabetic model[J]. Drug Invention Today, 2019, 12(5): 870-872. |
| [26] |
张严伟, 阮剑均, 温超, 等. 植物甾醇对团头鲂生长、血脂和肝胰脏抗氧化功能的影响[J]. 水产科学, 2012, 31(4): 192-196. ZHANG Y W, RUAN J J, WEN C, et al. Effects of phytosterol on growth performance, plasma biochemical parameters and antioxidant parameters in hepatopancreas of bluntnose black bream Megalobrama amblycephala[J]. Fisheries Science, 2012, 31(4): 192-196 (in Chinese). DOI:10.3969/j.issn.1003-1111.2012.04.002 |
| [27] |
潘忠超, 李志华, 孙凤刚, 等. 植物甾醇对罗氏沼虾生长性能, 消化酶, 肌肉品质及氨基酸组成的影响[J]. 江西水产科技, 2019(6): 3-7. LI Z C, PAN Z C, SUN F G, et al. Effects of phytosterol on growth performance, digestive enzymes, muscle quality and amino acid composition of Macrobrachium rosenbergii[J]. Jiangxi Fishery Science and Technology, 2019(6): 3-7 (in Chinese). DOI:10.3969/j.issn.1006-3188.2019.06.002 |
| [28] |
龚红, 孙凤刚, 黄志毅, 等. 植物甾醇对加州鲈生长性能, 形体指标, 肌肉成分及肝脏生化指标的影响[J]. 水产养殖, 2020, 41(8): 26-30. GONG H, SUN F G, HUANG Z Y, et al. Effects of phytosterol on growth performance, physical indicators, muscle composition and hepatic biochemical index of Micropterus salmoides[J]. Journal of Aquaculture, 2020, 41(8): 26-30 (in Chinese). DOI:10.3969/j.issn.1004-2091.2020.08.006 |
| [29] |
吴金平, 杜浩, 陈细华, 等. 烟酸对杂交鲟幼鱼生长性能、肌肉品质和抗氧化功能的影响[J]. 中国水产科学, 2020, 27(4): 406-413. WU J P, DU H, CHEN X H, et al. Effect of niacin on growth, flesh quality, and antioxidant function in hybrid sturgeon (Acipenser schrenckii×A. baeri♀)[J]. Journal of Fishery Sciences of China, 2020, 27(4): 406-413 (in Chinese). |
| [30] |
刘凡. 植物甾醇添加剂对日本鹌鹑IGF-1和肾上腺功能的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2011. LIU F. Effects of phytosterol additives on the IGF-1and adrenal functions in Japanese quail[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2011. (in Chinese) |
| [31] |
张韵桐. 一、大口黑鲈的生物学特征[J]. 中国水产, 1993(2): 28-29. ZHANG Y T. 1, Biological characteristics of Micropterus salmoides[J]. China Fisheries, 1993(2): 28-29 (in Chinese). |
| [32] |
韩晓磊, 王浩, 高俊杰, 等. 工厂化循环水养殖条件下大口黑鲈生长特点分析[J]. 水产科学, 2020, 39(4): 567-572. HAN X L, WANG H, GAO J J, et al. Analysis of growth characteristics of largemouth bass Micropterus salmoides in a recirculating aquaculture system (RAS)[J]. Fisheries Science, 2020, 39(4): 567-572 (in Chinese). DOI:10.16378/j.cnki.1003-1111.2020.04.014 |
| [33] |
周立斌, 张伟, 王安利, 等. 饲料维生素E添加量对花鲈生长、组织中维生素E积累量和免疫指标的影响[J]. 水产学报, 2009, 33(1): 95-102. ZHOU L B, ZHANG W, WANG A L, et al. Effects of dietary vitamin E supplement on growth, tissue vitam in E concentration and immune responses of Japanese seabass (Lateolabrax japonicus)[J]. Journal of Fisheries of China, 2009, 33(1): 95-102 (in Chinese). DOI:10.3321/j.issn:1000-0615.2009.01.013 |
| [34] |
胡重华, 张文平, 周秋白, 等. 饲料维生素A水平对黄鳝生长性能, 血清生化指标和组织消化酶活性的影响[J]. 动物营养学报, 2022, 34(5): 3208-3219. HU Z H, ZHANG W P, ZHOU Q B, et al. Effects of dietary vitamin A level on growth performance, serum biochemical indices and tissue digestive enzyme activities of Monopterus albus[J]. Chinese Journal of Animal Nutrition, 2022, 34(5): 3208-3219 (in Chinese). DOI:10.3969/j.issn.1006-267x.2022.05.047 |
| [35] |
吴凡, 文华, 蒋明, 等. 饲料维生素C水平对吉富罗非鱼生长性能、肌肉品质和抗氧化功能的影响[J]. 中国水产科学, 2015, 22(1): 79-87. WU F, WEN H, JIANG M, et al. Effect of dietary vitamin C on growth performance, flesh quality and antioxidant function in genetically improved farmed tilapia[J]. Journal of Fishery Sciences of China, 2015, 22(1): 79-87 (in Chinese). |
| [36] |
KUMAR S, SAHU N P, PAL A K, et al. Effect of dietary carbohydrate on haematology, respiratory burst activity and histological changes in L. rohita juveniles[J]. Fish & Shellfish Immunology, 2005, 19(4): 331-344. DOI:10.3969/j.issn.1000-9957.2005.04.015 |
| [37] |
KUMAR S, SAHU N P, PAL A K, et al. Metabolic fitness and growth performance in tropical freshwater fish Labeo rohita are modulated in response to dietary starch type (gelatinized versus non-gelatinized) and water temperature[J]. Aquaculture Nutrition, 2016, 22(5): 966-975. DOI:10.1111/anu.12327 |
| [38] |
NIEMINEN P, MUSTONEN A M, LINDSTRÖM-SEPPÄ P, et al. Phytosterols affect endocrinology and metabolism of the field vole (Microtus agrestis)[J]. Experimental Biology and Medicine, 2003, 228(2): 188-193. DOI:10.1177/153537020322800209 |
| [39] |
PANDA S, KAR A, PATIL S. Soy sterols in the regulation of thyroid functions, glucose homeostasis and hepatic lipid peroxidation in mice[J]. Food Research International, 2009, 42(8): 1087-1092. DOI:10.1016/j.foodres.2009.05.001 |
| [40] |
JUNG K, OHLRICH B, MILDNER D, et al. The apoenzyme of aspartate aminotransferase and alanine aminotransferase in the serum of healthy persons and patients suffering from liver diseases[J]. Clinica Chimica Acta, 1978, 90(2): 143-149. DOI:10.1016/0009-8981(78)90515-6 |
| [41] |
YANG S S, LIAN G J. ROS and diseases: role in metabolism and energy supply[J]. Molecular and Cellular Biochemistry, 2020, 467(1/2): 1-12. |
| [42] |
HOLDOM M D, LECHENNE B, HAY R J, et al. Production and characterization of recombinant Aspergillus fumigatus Cu, Zn superoxide dismutase and its recognition by immune human sera[J]. Journal of Clinical Microbiology, 2000, 38(2): 558-562. DOI:10.1128/JCM.38.2.558-562.2000 |
| [43] |
LI X, RAHIMNEJAD S, WANG L, et al. Substituting fish meal with housefly (Musca domestica) maggot meal in diets for bullfrog Rana (Lithobates) catesbeiana: effects on growth, digestive enzymes activity, antioxidant capacity and gut health[J]. Aquaculture, 2019, 499: 295-305. DOI:10.1016/j.aquaculture.2018.09.053 |
| [44] |
SINGH A. Sitosterol as an antioxidant in frying oils[J]. Food Chemistry, 2013, 137(1/2/3/4): 62-67. |
| [45] |
MANNARINO E, PIRRO M, CORTESE C, et al. Effects of a phytosterol-enriched dairy product on lipids, sterols and 8-isoprostane in hypercholesterolemic patients: a multicenter Italian study[J]. Nutrition Metabolism and Cardiovascular Diseases, 2009, 19(2): 84-90. DOI:10.1016/j.numecd.2008.03.012 |
| [46] |
VIVANCOS M, MORENO J J. β-Sitosterol modulates antioxidant enzyme response in RAW 264.7 macrophages[J]. Free Radical Biology and Medicine, 2005, 39(1): 91-97. DOI:10.1016/j.freeradbiomed.2005.02.025 |
| [47] |
MORENO J J. Effect of olive oil minor components on oxidative stress and arachidonic acid mobilization and metabolism by macrophages RAW 264.7[J]. Free Radical Biology & Medicine, 2003, 35(9): 1073-1081. |
| [48] |
DA SILVA MARINELI R, MARQUES A Y C, FURLAN C P B, et al. Antioxidant effects of the combination of conjugated linoleic acid and phytosterol supplementation in Sprague-Dawley rats[J]. Food Research International, 2012, 49(1): 487-493. DOI:10.1016/j.foodres.2012.07.022 |
| [49] |
LU K L, XU W N, LI J Y, et al. Alterations of liver histology and blood biochemistry in blunt snout bream Megalobrama amblycephala fed high-fat diets[J]. Fisheries Science, 2013, 79(4): 661-671. DOI:10.1007/s12562-013-0635-4 |
| [50] |
CAMARGO M M P, MARTINEZ C B R. Histopathology of gills, kidney and liver of a Neotropical fish caged in an urban stream[J]. Neotropical Ichthyology, 2007, 5: 327-336. DOI:10.1590/S1679-62252007000300013 |
| [51] |
刘伟, 文华, 蒋明, 等. 投喂率和投喂频率对吉富罗非鱼幼鱼生长和肝脏健康的影响[J]. 淡水渔业, 2019, 49(2): 89-98. LIU W, WEN H, JIANG M, et al. Effects of feeding rate and feeding frequency on growth performance and liver health for juvenile generically improved farmed tiplapid, Oreochromis niloticus[J]. Freshwater Fisheries, 2019, 49(2): 89-98 (in Chinese). |
| [52] |
OSTASZEWSKA T, DABROWSKI K, PALACIOS M E, et al. Growth and morphological changes in the digestive tract of rainbow trout (Oncorhynchus mykiss) and pacu (Piaractus mesopotamicus) due to casein replacement with soybean proteins[J]. Aquaculture, 2005, 245(1/2/3/4): 273-286. |
| [53] |
BAKKE-MCKELLEP A M, PENN M H, SALAS P M, et al. Effects of dietary soyabean meal, inulin and oxytetracycline on intestinal microbiota and epithelial cell stress, apoptosis and proliferation in the teleost Atlantic salmon (Salmo salar L.)[J]. British Journal of Nutrition, 2007, 97(4): 699-713. |
| [54] |
CABALLERO M J, IZQUIERDO M S, KJØRSVIK E, et al. Morphological aspects of intestinal cells from gilthead seabream (Sparus aurata) fed diets containing different lipid sources[J]. Aquaculture, 2003, 225(1/2/3/4): 325-340. |
| [55] |
SWATSON H K, GOUS R, IJI P A, et al. Effect of dietary protein level, amino acid balance and feeding level on growth, gastrointestinal tract, and mucosal structure of the small intestine in broiler chickens[J]. Animal Research, 2002, 51(6): 501-515. |
| [56] |
石朝明, 蒋余, 钟云飞, 等. 饲料纤维源对大口黑鲈生长、血浆生化指标、肠道抗氧化能力和组织学的影响[J]. 水产学报, 2019, 43(12): 2485-2493. SHI C M, JIANG Y, ZHONG Y F, et al. Effects of dietary fiber sources on growth, plasma biochemical indexes, intestinal antioxidant capacity and histology of largemouth bass (Micropterus salmoides)[J]. Journal of Fisheries of China, 2019, 43(12): 2485-2493 (in Chinese). |
| [57] |
CHENG J H, SUN D W, HAN Z, et al. Texture and structure measurements and analyses for evaluation of fish and fillet freshness quality: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2014, 13(1): 52-61. |
| [58] |
MORENO H M, MONTERO M P, GÓMEZ-GUILLÉN M C, et al. Collagen characteristics of farmed Atlantic salmon with firm and soft fillet texture[J]. Food Chemistry, 2012, 134(2): 678-685. |
| [59] |
戴志远, 崔雁娜, 王宏海. 不同冻藏条件下养殖大黄鱼鱼肉质构变化的研究[J]. 食品与发酵工业, 2008, 34(8): 188-190. DAI Z Y, CUI Y N, WANG H H. Changes of textural properties of cultured Pseudosciaena Crocea muscle under different frozen storage conditions[J]. Food and Fermmentation Idusries, 2008, 34(8): 188-190. |
| [60] |
JOHNSTON I A, LI X J, VIEIRA V L A, et al. Muscle and flesh quality traits in wild and farmed Atlantic salmon[J]. Aquaculture, 2006, 256(1/2/3/4): 323-336. |




