2. 天津农学院动物科学与动物医学学院, 天津市农业动物繁育与健康养殖重点实验室, 天津 300384
2. Tianjin Key Laboratory of Agricultural Animal Breeding and Healthy Husbandry, College of Animal Science and Veterinary Medicine, Tianjin Agricultural University, Tianjin 300384, China
致病性大肠杆菌是动物生产中常见病原菌之一,该菌定植在动物肠道,产生肠毒素,破坏肠上皮结构完整性,损坏肠道屏障功能,间接导致断奶仔猪腹泻引起氧化应激[1],肠道屏障受损,病原体扩散到其他器官,如增加肝脏酶类活性,诱导肝脏损伤[2-3]。大肠杆菌促使蛋氨酸和半胱氨酸代谢并产生具有毒性的同型半胱氨酸,诱导机体产生氧化应激[4]。氧化应激会对动物生长性能、免疫功能、肠道菌群组成、肠道形态和健康状况造成影响和损害[5-6]。所以,致病性大肠杆菌感染诱导氧化损伤,降低家畜生长性能,影响养殖业经济效益。在动物生产中,缓解大肠杆菌诱导氧化损伤的常用措施是使用抗氧化饲料添加剂,然而抗氧化饲料添加剂究竟有无作用以及效果如何我们尚不清楚。所以,利用动物氧化损伤模型来评价抗氧化饲料添加剂的作用效果是最为直观和可靠的方法。通过查阅相关文献,致病性大肠杆菌诱导小鼠氧化损伤模型少有报道,仅在Guo等[7]利用大肠杆菌诱导小鼠氧化应激的模型中,对小鼠心脏中的谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)和丙二醛(MDA)mRNA相对表达量进行了检测。利用致病性大肠杆菌建立一种氧化损伤模型,并对氧化损伤指标进行较为全面的评价就显得尤为重要。因此,本试验通过用不同浓度致病性大肠杆菌攻毒小鼠,以期建立一种稳定的小鼠氧化损伤模型。
研究表明,大肠杆菌感染小鼠后,其肝脏中的MDA含量及GSH-Px、SOD活性显著增加[8]。此外,大肠杆菌感染仔猪小肠上皮细胞后,促进促炎细胞因子的释放[9],降低紧密连接蛋白的表达[10]。通常来说,在酶类抗氧化系统中,组织内MDA含量及GSH-Px、SOD等活性的变化是衡量机体氧化系统是否平衡的重要标志[11-12]。Kelch样环氧氯丙烷相关蛋白1(Kelch-like epichlorohydrin-associated protein 1, Keap1)-核因子E2相关因子2(nuclear factor-E2-related factor 2, Nrf2)信号通路和巨自噬系统是2种宿主防御机制,参与了氧化应激反应[13]。Nrf2是一种氧化还原性转录因子,通过调节谷胱甘肽S-转移酶(glutathione S-transferase, GST)、GSH-Px、血红素加氧酶-1(heme oxygenase-1, HO-1)和SOD的转录活性来保护细胞免受炎症和氧化应激损伤[14]。p62是自噬基因的调节因子(编码基因为SQSTM1)[15],Keap1-Nrf2系统可以与自噬调节因子p62结合并且被磷酸化的p62激活,p62还与核转录因子-κB(NF-κB)信号传导相互作用,诱导NF-κB活化,促进释放抗炎因子[16]。有研究表明,p62/Nrf2信号通路是体内最重要的内源性抗氧化信号通路,可以调节抗氧化酶基因的表达[17],进而缓解氧化损伤。Huang等[18]在膳食中补充苹果多酚,增加益生菌和减少大肠杆菌数量来改善肠道生物屏障,激活猪模型中的Nrf2/Keap1信号通路,提高其肠道抗氧化能力。Zhang等[19]研究表明,益生菌激活断奶仔猪肝脏和空肠Nrf2/Keap1信号通路,改善仔猪的抗氧化能力。因此,根据前人研究结果,本试验通过检测血清中MDA含量、GSH-Px、SOD活性以及肝脏和空肠紧密连接蛋白、p62以及Nrf2 mRNA相对表达量等指标的变化作为评判小鼠氧化损伤模型成功建立的标准,并对致病性大肠杆菌诱导小鼠氧化损伤的作用机制进行了初步探讨。
1 材料与方法 1.1 主要试剂与仪器MDA、GSH-Px、SOD酶联免疫吸附检测试剂盒购自BD公司;核酸提取试剂RNAzol RT购自深圳研顺生物科技有限公司;引物由上海生工生物工程技术有限公司合成;反转录试剂盒和实时荧光定量PCR试剂盒均购自美国GeneCpoeia公司。
YXQ-LS-18SI型手提式压力蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂),SW-CJ-2FD型超净工作台(苏州安泰空气技术有限公司),JA2003型电子天平(上海舜宇恒平科学仪器有限公司),MLX-204型离心机(美国精骐有限公司),WH-2型漩涡混合仪(上海沪西分析仪器厂有限公司),Veriti V255249型PCR扩增仪(ABI公司),Light CyclerⓇ480型实时荧光定量PCR(Roche公司),ULTS1368型超低温冰箱(Thermo公司)。
1.2 菌液制备及培养试验所用致病性大肠杆菌为产肠毒素型大肠杆菌,为天津农学院动物科学与动物医学学院预防兽医学实验室保存。将10 g胰蛋白胨、5 g酵母浸粉和10 g氯化钠溶于1 L蒸馏水中,配制肉汤(LB)液体培养基,121 ℃高压蒸汽灭菌20 min,储存于4 ℃。固体培养基需在液体培养基的基础上加入2%琼脂粉。将活化的大肠杆菌接种到LB液体培养基中,37 ℃静置培养24 h,以菌液:甘油(1 ∶ 1)按比例配制后保存于-80 ℃冰箱中,用于后续试验。试验前,需用LB固体培养基对-80 ℃保存的大肠杆菌进行倍比稀释,计数。使用前,用生理盐水稀释至3.7×107和3.7×108 CFU/mL。
1.3 试验动物与分组选用6~8周龄SPF级雄性昆明小鼠18只,预饲3 d后,随机分为3组,每组6只。分别进行以下处理:空白对照组(CONT组),每只灌胃0.2 mL生理盐水;低剂量组(L-ETEC组),每只灌胃0.2 mL 3.7×107 CFU/mL大肠杆菌菌液;高剂量组(H-ETEC组),每只灌胃0.2 mL 3.7×108 CFU/mL大肠杆菌菌液。
1.4 样品采集灌胃大肠杆菌24 h后,收集小鼠眼球血样,血清分离后置于4 ℃保存,用于检测血清MDA含量以及GSH-Px和SOD活性。取血后,采用颈椎脱臼法处死小鼠。在无菌条件下,采集小鼠肝脏和空肠组织,一部分放于4%多聚甲醛中固定,待用于观察组织形态结构,另一部分用液氮速冻,然后转入-80 ℃保存,用于检测紧密连接蛋白、抗氧化酶、p62以及Nrf2 mRNA相对表达量。
1.5 测定指标 1.5.1 肝脏和空肠组织切片的制备与观察将小鼠肝脏、空肠进行脱水、石蜡包埋、切片,切片厚3~5 μm处理,再采用苏木精-伊红(HE)染色,使用正倒置一体荧光显微镜对切片进行观察与拍照。
1.5.2 血清MDA含量及抗氧化酶活性的检测严格按照酶联免疫吸附检测试剂盒说明书,采用硫代巴比妥酸(TBA)比色法测定血清中MDA含量,采用黄嘌呤氧化酶法测定血清中SOD活性,采用可见光比色法测定血清中GSH-Px活性。
1.5.3 肝脏和空肠中抗氧化酶、抗氧化酶信号通路、紧密连接蛋白以及p62和Nrf2相关基因mRNA表达测定按照All-in-OneTM qPCR Mix试剂盒说明书,向定量PCR管中加入10 μL(2×)All-in-One qPCR Mix、3 μL PCR水、3 μL cDNA、4 μL引物(2 μL上游和2 μL下游),总体积为20 μL。混匀离心后,用Light CyclerⓇ 480 Real-Time PCR检测目的基因mRNA的Ct值,并以甘油醛-3-磷酸脱氢酶(GAPDH)[20]作为内参基因,用2-ΔΔCt计算目的基因mRNA相对表达量。检测HO-1[21]、GSH-Px[22]、紧密连接蛋白1(Claudin 1)[20]、超氧化物歧化酶2(SOD2)[21]、超氧化物歧化酶1(SOD1)[23]、紧密连接蛋白8(Claudin 8)[24]、闭合蛋白(Occludin)[25]以及闭锁小带蛋白-1(ZO-1)[20] mRNA相对表达量。p62、Nrf2特异性引物是通过在NCBI获取其基因的全序列,使用Primer 5设计引物。引物由上海生工生物工程有限公司合成。上述引物序列见表 1。
|
|
表 1 引物序列信息 Table 1 Primer sequence information |
使用Excel 2016软件对肝脏和空肠目的基因mRNA相对表达量进行初步处理,采用SPSS 20.0统计软件进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行差异显著性检验,以P < 0.05作为差异显著性判断标准。使用Graphpad Prism 8.0制作柱形图。
2 结果与分析 2.1 大肠杆菌对小鼠肝脏和小肠组织病理学的影响由图 1可知,CONT组肝细胞排列整齐,窦间隙宽度适中,胞质染色清晰。L-ETEC组窦间隙变宽,大量炎性细胞浸润,肝组织中出现点状坏死。H-ETEC组在肝脏汇管区出现大量的炎性细胞聚集,组织中出现片状坏死,部分肝细胞水肿,胞核消失(图 1-A、图 1-C、图 1-E)。
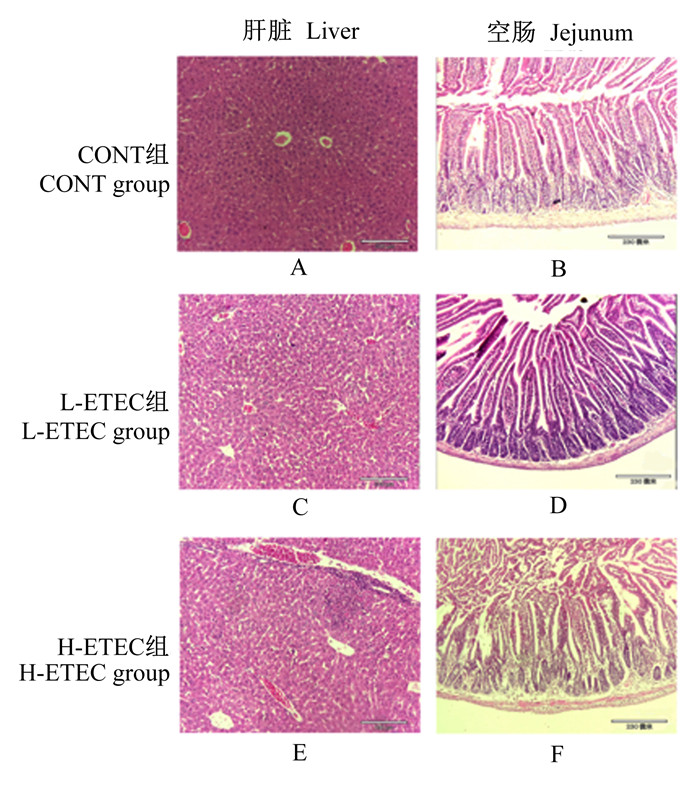
|
图 1 小鼠肝脏和空肠组织切片观察 Fig. 1 Observation of liver and jejunum tissue sections in mice (100×) |
CONT组空肠绒毛排列整齐。L-ETEC组绒毛固有层和上皮细胞出现不同程度的分离。H-ETEC组绒毛固有层和上皮细胞分离,绒毛顶端脱落,炎性细胞出现聚集,肠隐窝深度增加(图 1-B、图 1-D、图 1-F)。
2.2 大肠杆菌对小鼠肝脏和空肠紧密连接蛋白表达的影响由图 2可知,在肝脏中,与CONT组相比,L-ETEC组的Claudin 8 mRNA相对表达量显著降低(P<0.05),Occludin mRNA相对表达量显著提高(P<0.05),Claudin 1、ZO-1 mRNA相对表达量没有显著变化(P>0.05),但有增加趋势;H-ETEC组Claudin 8、Occludin mRNA相对表达量显著降低(P<0.05),Claudin 1、ZO-1 mRNA相对表达量没有显著变化(P>0.05),但有下降趋势。与L-ETEC组相比,H-ETEC组Claudin 1、Claudin 8、Occludin和ZO-1 mRNA相对表达量显著降低(P<0.05)(图 2-A~图 2-D)。
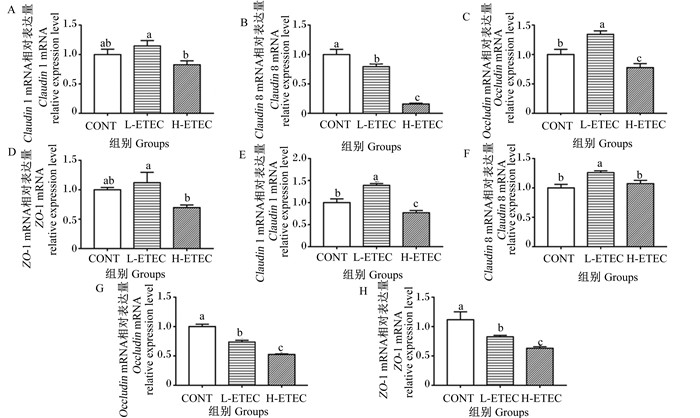
|
Claudin 1:紧密连接蛋白1;Claudin 8:紧密连接蛋白8;Occludin: 闭合蛋白;ZO-1:闭锁小带蛋白-1 zonula occludens-1。 图A~图D:肝脏;图E~图H:空肠。Figures A to D: liver; figures E to H: jejunum. 数据柱形标注不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with different small letters mean significant difference (P<0.05). The same as below. 图 2 大肠杆菌对小鼠肝脏和空肠紧密连接蛋白表达的影响 Fig. 2 Effects of Escherichia coli on expression of tight junction protein in liver and jejunum in mice |
在空肠中,与CONT组相比,L-ETEC组的Claudin 1、Claudin 8 mRNA相对表达量显著提高(P<0.05),Occludin、ZO-1 mRNA相对表达量显著降低(P<0.05);H-ETEC组的Claudin 1、Occludin和ZO-1 mRNA相对表达量显著降低(P<0.05),而Claudin 8 mRNA相对表达量没有显著变化(P>0.05)。与L-ETEC组相比,H-ETEC组Claudin 1、Claudin 8、Occludin和ZO-1 mRNA相对表达量均显著降低(P<0.05)(图 2-E~图 2-H),此结果说明高剂量的大肠杆菌降低了小鼠空肠的紧密连接蛋白的表达,破坏了肠道屏障功能。
2.3 大肠杆菌对小鼠血清MDA含量及抗氧化酶活性的影响由图 3可知,大肠杆菌感染后,试验组小鼠血清中MDA含量显著高于CONT组(P<0.05),且H-ETEC组差异尤为明显,诱导机体氧化损伤。H-ETEC组小鼠血清中SOD、GSH-Px活性显著低于CONT组、L-ETEC组(P<0.05),说明高剂量的大肠杆菌对小鼠有明显的氧化损伤作用。
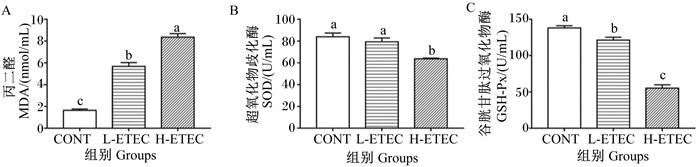
|
图 3 大肠杆菌对小鼠血清MDA含量及抗氧化酶活性的影响 Fig. 3 Effects of Escherichia coli on serum MDA content and antioxidant enzyme activity in mice |
由图 4可知,在肝脏中,与CONT组相比,L-ETEC组的Nrf2 mRNA相对表达量显著提高(P<0.05),H-ETEC组的Nrf2 mRNA相对表达量显著降低(P<0.05)(图 4-A~图 4-B)。在空肠中,L-ETEC组和H-ETEC组的p62和Nrf2 mRNA相对表达量均显著降低(P<0.05)(图 4-C~图 4-D)。以上结果说明,大肠杆菌感染有可能抑制肝脏和空肠p62/Nrf2信号通路,为验证是否抑制,进而检测下游相关蛋白因子的表达。
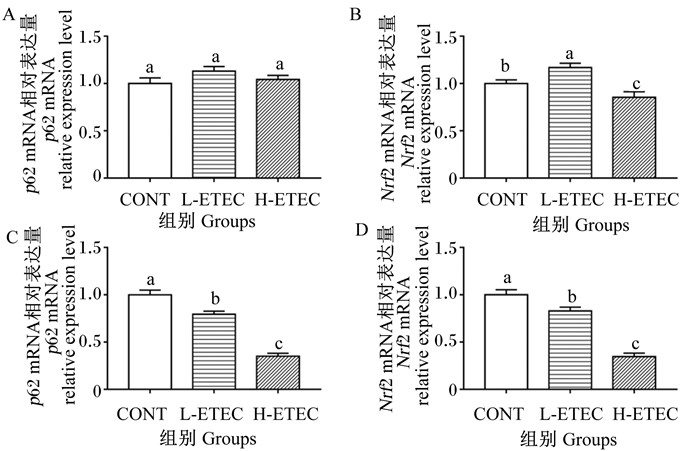
|
Nrf2:核因子E2相关因子nuclear factor-E2-related factor 2。 图A~图B:肝脏;图C~图D:空肠。Figures A to B: liver; figures C to D: jejunum. 图 4 大肠杆菌对小鼠p62/Nrf2通路关键蛋白表达的影响 Fig. 4 Effects of Escherichia coli on expression of key proteins of p62/Nrf2 pathway in mice |
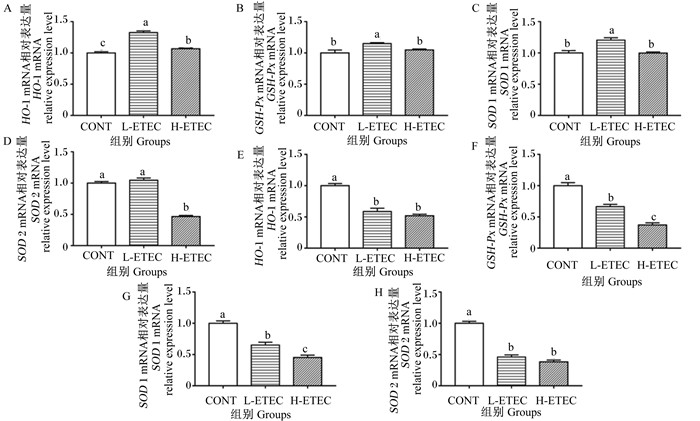
由图 5可知,在肝脏中,与CONT组相比,L-ETEC组的HO-1、GSH-Px、SOD1 mRNA相对表达量均显著提高(P<0.05),而SOD2 mRNA相对表达量没有显著变化(P>0.05);H-ETEC组的HO-1、GSH-Px、SOD2 mRNA相对表达量均显著提高(P<0.05),而SOD1 mRNA相对表达量没有显著变化(P>0.05)。与L-ETEC组相比,H-ETEC组的HO-1、GSH-Px、SOD1、SOD2 mRNA相对表达量均显著降低(P<0.05)。在空肠中,与CONT组相比,L-ETEC组的HO-1、GSH-Px、SOD1、SOD2 mRNA相对表达量均显著降低(P<0.05),与L-ETEC组相比,H-ETEC组的GSH-Px、SOD1 mRNA相对表达量均显著降低(P<0.05),而HO-1、SOD2 mRNA相对表达量没有显著变化(P>0.05)。以上结果说明,大肠杆菌感染能够降低抗氧化酶基因的表达,且高剂量效果更为明显。
|
HO-1:红素加氧酶-1 heme oxygenase-1;SOD1:超氧化物岐化酶1 superoxide dismutase 1;SOD2:锰超氧化物歧化酶2 manganese superoxide dismutase 2。 图A~图D肝脏;图E~图H:空肠。Figures A to D:liver; figures E to H: jejunum. 图 5 大肠杆菌对小鼠肝脏和空肠抗氧化酶表达的影响 Fig. 5 Effects of Escherichia coli on expression of antioxidant enzymes in liver and jejunum in mice |
肠道屏障一方面可以维持肠道菌群的耐受性和营养物质的吸收,另一方面能够抵御病原体的入侵[26]。肠道绒毛高度和隐窝深度是决定动物机体肠道吸收、消化营养物质的关键因素,其比值反映肠道功能情况[27]。当肠道绒毛高度变短时,肠道吸收面积减少,肠道通透性增加,引发炎症反应,影响机体正常摄食[28]。Lin等[29]研究发现,在小鼠感染大肠杆菌后,脾组织白髓区出现轻度局灶变性、坏死和脾结节扩张。在新生仔猪模型中,大肠杆菌处理后空肠绒毛高度与隐窝深度降低,杯状细胞数量减少[30]。与此相似,本试验中,高剂量大肠杆菌感染会使小鼠空肠绒毛固有层和上皮细胞分离,炎性细胞聚集,隐窝深度增加,由此说明大肠杆菌感染会对小鼠肠道功能造成损伤。
紧密连接是细胞间的主要连接类型,与营养吸收和抵抗致病微生物密切相关[31]。紧密连接蛋白,包括跨膜蛋白(Claudins和Occludin)和胞质蛋白(ZO-1、ZO-2、ZO-3),能够阻止微生物和毒素的入侵,维持屏障功能的健全性[32-33]。在抗氧化系统与氧化系统失衡的情况下,过量的活性氧(ROS)可通过减少紧密连接和细胞数量进而干扰上皮细胞的完整性和屏障功能的健全性[34]。据报道,大肠杆菌黏附在小肠微绒毛上,能够诱导小肠形态学病变,并产生肠毒素作用于肠细胞,破环紧密连接结构,打破物理屏障,允许肠道病原微生物入侵[35-36]。为了探究不同浓度致病性大肠杆菌感染对小鼠肝脏和空肠细胞完整性和屏障功能,本试验检测了Claudin 1、Claudin 8、Occludin和ZO-1 mRNA相对表达量。Wu等[37]用产肠毒素性大肠杆菌(ETEC K88)攻击猪小肠上皮细胞后,发现Claudin 1、Occludin和ZO-1 mRNA相对表达显著降低。Bao等[38]研究表明,海兰褐鸡腹腔注射大肠杆菌后,其肝脏中Claudin 1、Occludin和ZO-1 mRNA相对表达量显著降低。本试验中,大肠杆菌感染使空肠中Claudin 1、Occludin和ZO-1 mRNA相对表达量均显著降低,高剂量大肠杆菌感染使小鼠肝脏中Occludin和Claudin 8 mRNA相对表达量显著降低,这与前人研究结果相似。并且高剂量大肠杆菌攻毒小鼠使肝脏和空肠各紧密连接蛋白表达量均显著低于低剂量感染,由此说明,不同剂量的大肠杆菌均能够降低小鼠肝脏、空肠部分紧密连接蛋白表达,破坏其屏障功能,但以高剂量的大肠杆菌对小鼠的损伤更为明显。
MDA属于脂质代谢产物,能够直接反映动物机体内脂质过氧化强度及速率,间接反映组织受自由基损伤程度[39]。GSH-Px是一种抗氧化酶,可以催化过氧化氢和脂质过氧化物还原为水或脂质醇[40]。SOD是细胞内最有效的抗氧剂之一,它催化超氧阴离子转化为分子氧和过氧化氢[41]。正常情况下,MDA、SOD和GSH-Px通常负责去除氧离子,过氧化氢和过氧化物来平衡氧化系统[42],应对氧化应激。Nrf2是转录激活因子,在响应氧化应激等许多诱导细胞保护基因激活中起到关键作用[43],Nrf2的靶基因参与谷胱甘肽合成、ROS的消除、外源性代谢和药物转运[44]。当机体受到ROS或活性氮(RNS)积累诱导的氧化应激后,与Keap1结合的Nrf2会迅速从细胞质易位到细胞核,小Maf异构体(small Maf heterodimer, sMaf)蛋白二聚化,并通过抗氧化反应元件(ARE)激活靶基因进行细胞保护,这些基因维持氧化平衡,应对氧化应激[45-46]。此外,当细胞受到应激刺激时,细胞会通过自噬途径以减轻损伤来增加细胞存活机会。调节因子p62和Nrf2为正反馈调节[47],当机体发生自噬时,p62活性上调,与Keap1相互作用,激活Nrf2信号通路,中和过量的ROS,进而达到氧化平衡状态[48]。研究表明,当大肠杆菌K88刺激仔猪诱导肠道氧化损伤,肠道中MDA含量提高,SOD、GSH-Px、过氧化氢酶(catalase, CAT)活性和总抗氧化力(total antioxidant capacity, T-AOC)降低[49]。Dou等[50]发现,大肠杆菌K88攻毒猪肠上皮细胞24 h后Nrf2 mRNA相对表达量显著降低,且细胞中抗氧化基因的表达也降低。因此,本试验从抗氧化酶基因的表达和是否通过p62/Nrf2信号通路这2方面进行评定小鼠氧化损伤,寻找致病性大肠杆菌感染的适宜剂量,进而较完整地反映小鼠肝脏和空肠的损伤程度,为寻找合适的抗氧化饲料添加剂提供稳定的动物氧化损伤模型。
本试验中,在小鼠感染致病性大肠杆菌24 h后,小鼠血清MDA含量升高,血清中SOD、GSH-Px活性降低,这与前人研究结果[51]相似。Dou等[50]通过ETEC K88刺激猪小肠上皮细胞诱导氧化损伤,其SOD1和SOD2 mRNA相对表达量显著降低。本研究在小鼠上同样得到了证实,高剂量大肠杆菌感染后,小鼠空肠中的SOD1和SOD2 mRNA相对表达量显著降低。此外,Guo等[7]在大肠杆菌诱导小鼠氧化应激的模型中,小鼠心脏中的GSH、GSH-Px、SOD和MDA mRNA相对表达量在不同时间段均有不同程度的增加。本研究发现,低剂量大肠杆菌使小鼠肝脏中HO-1、GSH-Px和SOD mRNA相对表达量增加,而在空肠中,HO-1和GSH-Px mRNA相对表达量显著降低,说明与肝脏相比,空肠更容易受到氧化应激的影响。
Ying等[52]研究发现,大肠杆菌感染牛乳腺上皮细胞,可以激活Nrf2信号,并且上调p62 mRNA相对表达量。本试验研究同样表明,低剂量大肠杆菌攻毒小鼠后,肝脏中Nrf2 mRNA相对表达量显著提高,p62 mRNA相对表达量没有显著性变化,但有所提高,说明低剂量大肠杆菌感染可以诱导小鼠肝脏发生氧化反应。此外,本试验中,感染低剂量的大肠杆菌使空肠中p62和Nrf2 mRNA相对表达量均显著降低,肝脏中p62和Nrf2 mRNA相对表达量增加;但感染高剂量的大肠杆菌使小鼠肝脏和空肠中p62和Nrf2 mRNA相对表达量均显著降低,这与Ding等[53]在大肠杆菌攻毒家禽研究中的血清中MDA含量、GSH-Px活性以及肝脏中SOD活性、Nrf2含量变化一致,Nrf2 mRNA和抗氧化酶相对表达量显著降低。由此说明,低剂量大肠杆菌感染能够诱导小鼠发生氧化反应,而高剂量大肠杆菌感染能够降低小鼠肝脏和空肠中p62和Nrf2 mRNA相对表达量,抑制p62/Nrf2信号通路,进而降低抗氧化酶(HO-1、GSH-Px、SOD1、SOD2)基因的表达,诱导小鼠肠道氧化损伤,高剂量大肠杆菌感染可通过p62/Nrf2信号通路诱导小鼠氧化损伤并成功建立小鼠氧化损伤模型。
4 结论用0.2 mL 3.7×108 CFU/mL大肠杆菌菌液灌胃小鼠24 h,血清中MDA含量增加,SOD、GSH-Px活性均降低;肝脏和空肠中HO-1、GSH-Px、SOD1、SOD2、p62和Nrf2基因表达下降,成功建立了致病性大肠感染小鼠氧化损伤模型,其损伤的分子机制可能是通过抑制p62/Nrf2信号通路,进而降低小鼠肝脏、空肠部分紧密连接蛋白及抗氧化酶基因表达来实现。
| [1] |
NABUURS M J A, HOOGENDOORN A, VAN ZIJDERVELD F G. Effects of weaning and enterotoxigenic Escherichia coli on net absorption in the small intestine of pigs[J]. Research in Veterinary Science, 1994, 56(3): 379-385. DOI:10.1016/0034-5288(94)90156-2 |
| [2] |
MIRHOSEINI A, AMANI J, NAZARIAN S. Review on pathogenicity mechanism of enterotoxigenic Escherichia coli and vaccines against it[J]. Microbial Pathogenesis, 2018, 117: 162-169. DOI:10.1016/j.micpath.2018.02.032 |
| [3] |
GONG Y H, JIN X X, YUAN B Y, et al. G protein-coupled receptor 109a maintains the intestinal integrity and protects against ETEC mucosal infection by promoting IgA secretion[J]. Frontiers in Immunology, 2020, 11: 583652. |
| [4] |
DUCARMON Q R, ZWITTINK R D, HORNUNG B V H, et al. Gut microbiota and colonization resistance against bacterial enteric infection[J]. Microbiology and Molecular Biology Reviews: MMBR, 2019, 83(3): e00007-e00019. |
| [5] |
SCHRADER M, FAHIMI H D. Peroxisomes and oxidative stress[J]. Biochimica et Biophysica Acta, 2006, 1763(12): 1755-1766. DOI:10.1016/j.bbamcr.2006.09.006 |
| [6] |
DE LA FUENTE M. Effects of antioxidants on immune system ageing[J]. European Journal of Clinical Nutrition, 2002, 56(Suppl.3): S5-S8. |
| [7] |
GUO H R, ZUO Z C, WANG F Y, et al. Attenuated cardiac oxidative stress, inflammation and apoptosis in obese mice with nonfatal infection of Escherichia coli[J]. Ecotoxicology and Environmental Safety, 2021, 225: 112760. DOI:10.1016/j.ecoenv.2021.112760 |
| [8] |
SONG H T, ZUO Z C, YANG Z Z, et al. Hepatic histopathology and apoptosis in diet-induced-obese mice under Escherichia coli pneumonia[J]. Aging, 2019, 11(9): 2836-2851. DOI:10.18632/aging.101956 |
| [9] |
翟俊磊, 林颖, 王美艳, 等. 灵芝多糖对大肠杆菌感染IPEC-1细胞免疫功能的影响[J]. 动物营养学报, 2021, 33(12): 7118-7130. ZHAI J L, LIN Y, WANG M Y, et al. Effects of Ganoderma lucidum polysaccharides on immune function of IPEC-1 cells infected with Escherichia coli[J]. Chinese Journal of Animal Nutrition, 2021, 33(12): 7118-7130 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.12.051 |
| [10] |
李海花, 梁东梅, 乔家运. 植物乳杆菌抑制产肠毒素型大肠杆菌诱发猪肠上皮细胞炎症反应的分子机制[J]. 动物营养学报, 2021, 33(7): 4018-4029. LI H H, LIANG D M, QIAO J Y. Molecular mechanism of Lactobacillus plantarum inhibiting inflammatory response induced by enterotoxigenic Escherichia coli in porcine intestinal epithelial cells[J]. Chinese Journal of Animal Nutrition, 2021, 33(7): 4018-4029 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.07.043 |
| [11] |
VONA R, PALLOTTA L, CAPPELLETTI M, et al. The impact of oxidative stress in human pathology: focus on gastrointestinal disorders[J]. Antioxidants (Basel, Switzerland), 2021, 10(2): 201. |
| [12] |
LUBRANO V, BALZAN S. Enzymatic antioxidant system in vascular inflammation and coronary artery disease[J]. World Journal of Experimental Medicine, 2015, 5(4): 218-224. DOI:10.5493/wjem.v5.i4.218 |
| [13] |
KENSLER T W, WAKABAYASHI N, BISWAL S. Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway[J]. Annual Review of Pharmacology and Toxicology, 2007, 47: 89-116. DOI:10.1146/annurev.pharmtox.46.120604.141046 |
| [14] |
CHO H Y, REDDY S P M, YAMAMOTO M, et al. The transcription factor NRF2 protects against pulmonary fibrosis[J]. FASEB Journal, 2004, 18(11): 1258-1260. DOI:10.1096/fj.03-1127fje |
| [15] |
KOSZTELNIK M, KURUCZ A, PAPP D, et al. Suppression of AMPK/aak-2 by NRF2/SKN-1 down-regulates autophagy during prolonged oxidative stress[J]. FASEB Journal, 2019, 33(2): 2372-2387. DOI:10.1096/fj.201800565RR |
| [16] |
ICHIMURA Y, WAGURI S, SOU Y S, et al. Phosphorylation of p62 activates the Keap1-Nrf2 pathway during selective autophagy[J]. Molecular Cell, 2013, 51(5): 618-631. |
| [17] |
CHEN Q M, MALTAGLIATI A J. Nrf2 at the heart of oxidative stress and cardiac protection[J]. Physiological Genomics, 2018, 50(2): 77-97. DOI:10.1152/physiolgenomics.00041.2017 |
| [18] |
HUANG T T, CHE Q J, CHEN X L, et al. Apple polyphenols improve intestinal antioxidant capacity and barrier function by activating the Nrf2/Keap1 signaling pathway in a pig model[J]. Journal of Agricultural and Food Chemistry, 2022, 70(24): 7576-7585. DOI:10.1021/acs.jafc.2c02495 |
| [19] |
ZHANG J, LIU Y J, YANG Z B, et al. Illicium verum extracts and probiotics with added glucose oxidase promote antioxidant capacity through upregulating hepatic and jejunal Nrf2/Keap1 of weaned piglets[J]. Journal of Animal Science, 2020, 98(3): skaa07. |
| [20] |
RUAN Y C, WANG Y, DA SILVA N, et al. CFTR interacts with ZO-1 to regulate tight junction assembly and epithelial differentiation through the ZONAB pathway[J]. Journal of Cell Science, 2014, 127(Pt.20): 4396-4408. |
| [21] |
CHEN X, XI Z Y, LIANG H B, et al. Melatonin prevents mice cortical astrocytes from hemin-induced toxicity through activating PKCα/Nrf2/HO-1 signaling in vitro[J]. Frontiers in Neuroscience, 2019, 13: 760. DOI:10.3389/fnins.2019.00760 |
| [22] |
YANG S H, YU L H, LI L, et al. Protective mechanism of sulforaphane on cadmium-induced sertoli cell injury in mice testis via Nrf2/ARE signaling pathway[J]. Molecules, 2018, 23(7): 1774. DOI:10.3390/molecules23071774 |
| [23] |
LI C, TAN F, YANG J J, et al. Antioxidant effects of Apocynum venetum tea extracts on d-galactose-induced aging model in mice[J]. Antioxidants (Basel, Switzerland), 2019, 8(9): 381. |
| [24] |
SASSI A, WANG Y B, CHASSOT A, et al. Interaction between epithelial sodium channel γ-subunit and claudin-8 modulates paracellular sodium permeability in renal collecting duct[J]. Journal of the American Society of Nephrology, 2020, 31(5): 1009-1023. DOI:10.1681/ASN.2019080790 |
| [25] |
LI X F, ZHANG X J, ZHANG C, et al. Ulinastatin protects brain against cerebral ischemia/reperfusion injury through inhibiting MMP-9 and alleviating loss of ZO-1 and occludin proteins in mice[J]. Experimental Neurology, 2018, 302: 68-74. DOI:10.1016/j.expneurol.2017.12.016 |
| [26] |
STOEVA M K, GARCIA-SO J, JUSTICE N, et al. Butyrate-producing human gut symbiont, Clostridium butyricum, and its role in health and disease[J]. Gut Microbes, 2021, 13(1): 1-28. |
| [27] |
CHANG Y L, CAI H Y, LIU G H, et al. Effects of dietary leucine supplementation on the gene expression of mammalian target of rapamycin signaling pathway and intestinal development of broilers[J]. Animal Nutrition, 2015, 1(4): 313-319. DOI:10.1016/j.aninu.2015.11.005 |
| [28] |
TAYLOR S R, RAMSAMOOJ S, LIANG R J, et al. Dietary fructose improves intestinal cell survival and nutrient absorption[J]. Nature, 2021, 597(7875): 263-267. DOI:10.1038/s41586-021-03827-2 |
| [29] |
LIN Q, FU Q Q, LI X, et al. Human β-defensin 118 attenuates Escherichia coli K88-induced inflammation and intestinal injury in mice[J]. Probiotics and Antimicrobial Proteins, 2021, 13(2): 586-597. DOI:10.1007/s12602-020-09725-9 |
| [30] |
PENG X, WANG R, HU L, et al. Enterococcus faecium NCIMB 10415 administration improves the intestinal health and immunity in neonatal piglets infected by enterotoxigenic Escherichia coli K88[J]. Journal of Animal Science and Biotechnology, 2019, 10: 72. DOI:10.1186/s40104-019-0376-z |
| [31] |
PODOLSKY D K. Mucosal immunity and inflammation.Ⅴ.Innate mechanisms of mucosal defense and repair: the best offense is a good defense[J]. The American Journal of Physiology, 1999, 277(3): G495-G499. |
| [32] |
CHO Y E, SONG B J. Pomegranate prevents binge alcohol-induced gut leakiness and hepatic inflammation by suppressing oxidative and nitrative stress[J]. Redox Biology, 2018, 18: 266-278. DOI:10.1016/j.redox.2018.07.012 |
| [33] |
BERKES J, VISWANATHAN V K, SAVKOVIC S D, et al. Intestinal epithelial responses to enteric pathogens: effects on the tight junction barrier, ion transport, and inflammation[J]. Gut, 2003, 52(3): 439-451. DOI:10.1136/gut.52.3.439 |
| [34] |
WAN Y, FU Y Q, WANG F L, et al. Protective effects of a lipid extract from hard-shelled mussel (Mytilus coruscus) on intestinal integrity after lipopolysaccharide challenge in mice[J]. Nutrients, 2018, 10(7): 860. DOI:10.3390/nu10070860 |
| [35] |
WU X, SU D. Enterotoxigenic Escherichia coli infection induces tight junction proteins expression in mice[J]. Iranian Journal of Veterinary Research, 2018, 19(1): 35-40. |
| [36] |
GUTTMAN J A, SAMJI F N, LI Y L, et al. Aquaporins contribute to diarrhoea caused by attaching and effacing bacterial pathogens[J]. Cellular Microbiology, 2007, 9(1): 131-141. DOI:10.1111/j.1462-5822.2006.00773.x |
| [37] |
WU Y P, ZHU C, CHEN Z, et al. Protective effects of Lactobacillus plantarum on epithelial barrier disruption caused by enterotoxigenic Escherichia coli in intestinal porcine epithelial cells[J]. Veterinary Immunology and Immunopathology, 2016, 172: 55-63. DOI:10.1016/j.vetimm.2016.03.005 |
| [38] |
BAO J L, ZHANG Y, ZHANG L C, et al. Therapeutic effect of Schisandrin A on avian colibacillosis through gut-liver axis[J]. Poultry Science, 2021, 100(10): 101371. DOI:10.1016/j.psj.2021.101371 |
| [39] |
HO E, GALOUGAHI K K, LIU C C, et al. Biological markers of oxidative stress: applications to cardiovascular research and practice[J]. Redox Biology, 2013, 1(1): 483-491. DOI:10.1016/j.redox.2013.07.006 |
| [40] |
ARTHUR J R. The glutathione peroxidases[J]. Cellular and Molecular Life Sciences CMLS, 2001, 57(13/14): 1825-1835. |
| [41] |
POPRAC P, JOMOVA K, SIMUNKOVA M, et al. Targeting free radicals in oxidative stress-related human diseases[J]. Trends in Pharmacological Sciences, 2017, 38(7): 592-607. DOI:10.1016/j.tips.2017.04.005 |
| [42] |
FILOMENI G, DE ZIO D, CECCONI F. Oxidative stress and autophagy: the clash between damage and metabolic needs[J]. Cell Death and Differentiation, 2015, 22(3): 377-388. DOI:10.1038/cdd.2014.150 |
| [43] |
PAPP D, LENTI K, MÓDOS D, et al. The NRF2-related interactome and regulome contain multifunctional proteins and fine-tuned autoregulatory loops[J]. FEBS Letters, 2012, 586(13): 1795-1802. DOI:10.1016/j.febslet.2012.05.016 |
| [44] |
YATES M S, TRAN Q T, DOLAN P M, et al. Genetic versus chemoprotective activation of Nrf2 signaling: overlapping yet distinct gene expression profiles between Keap1 knockout and triterpenoid-treated mice[J]. Carcinogenesis, 2009, 30(6): 1024-1031. DOI:10.1093/carcin/bgp100 |
| [45] |
ITOH K, TONG K I, YAMAMOTO M. Molecular mechanism activating Nrf2-Keap1 pathway in regulation of adaptive response to electrophiles[J]. Free Radical Biology & Medicine, 2004, 36(10): 1208-1213. |
| [46] |
KWAK M K, WAKABAYASHI N, ITOH K, et al. Modulation of gene expression by cancer chemopreventive dithiolethiones through the Keap1-Nrf2 pathway.Identification of novel gene clusters for cell survival[J]. Journal of Biological Chemistry, 2003, 278(10): 8135-8145. |
| [47] |
SANTARINO I B, VIEGAS M S, DOMINGUES N S, et al. Involvement of the p62/NRF2 signal transduction pathway on erythrophagocytosis[J]. Scientific Reports, 2017, 7(1): 5812. |
| [48] |
MATHEW R, KARP C M, BEAUDOIN B, et al. Autophagy suppresses tumorigenesis through elimination of p62[J]. Cell, 2009, 137(6): 1062-1075. |
| [49] |
XIE W C, SONG L Y, WANG X Y, et al. A bovine lactoferricin-lactoferrampin-encoding Lactobacillus reuteri CO21 regulates the intestinal mucosal immunity and enhances the protection of piglets against enterotoxigenic Escherichia coli K88 challenge[J]. Gut Microbes, 2021, 13(1): 1956281. |
| [50] |
DOU C X, SHANG Z Y, QIAO J Y, et al. Clostridium butyricum protects IPEC-J2 cells from ETEC K88-induced oxidative damage by activating the Nrf2/ARE signaling pathway[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 4464002. |
| [51] |
LI H H, SHANG Z Y, LIU X J, et al. Clostridium butyricum alleviates enterotoxigenic Escherichia coli K88-induced oxidative damage through regulating the p62-Keap1-Nrf2 signaling pathway and remodeling the cecal microbial community[J]. Frontiers in Immunology, 2021, 12: 771826. |
| [52] |
YING Y T, YANG J, TAN X, et al. Escherichia coli and Staphylococcus aureus differentially regulate Nrf2 pathway in bovine mammary epithelial cells: relation to distinct innate immune response[J]. Cells, 2021, 10(12): 3426. |
| [53] |
DING X, YANG C W, YANG Z B, et al. Effects of star anise (Illicium verum Hook.f) oil on the nuclear factor E2-related factor 2 signaling pathway of chickens during subclinical Escherichia coli challenge[J]. Poultry Science, 2020, 99(6): 3092-3101. |




