生物体常常因暴露在寒冷、炎热和紫外线胁迫的环境下产生一系列的非特异性反应[1]。当机体因寒冷环境刺激时产生的反应称为冷应激。冷应激对神经内分泌系统[2]、生殖系统[3]和心血管系统[4]等许多器官有着广泛的影响,并且与去甲肾上腺素释放增加[5]、精子成熟受阻[6]、心功能不全[7]、机体能量消耗增加[8]、免疫功能障碍[9]以及抗氧化能力降低[10]都呈现显著相关性。
有研究表明,冷暴露会使畜禽生长发育减慢,降低生长性能和饲料利用率,从而影响畜牧业发展。冷暴露也会明显增加全身能量消耗,引起大量的代谢变化[11],包括摄入量、肝脏葡萄糖的生成以及外周组织葡萄糖利用都有所增加[12]。肝脏作为体内重要的能量代谢器官,在许多生理过程中发挥着解毒、血浆蛋白合成、葡萄糖平衡以及营养物质利用和循环作用[13]。有报道称,在急剧的低温暴露下大鼠肝糖原迅速减少,由此会导致能量消耗和细胞凋亡[14-15]。因此,本研究旨在探讨在冷暴露下,检测小鼠生长性能、血清生化指标、肝脏组织染色和Western Blot检测相关凋亡蛋白的表达,从不同角度探索慢性冷暴露对小鼠肝脏功能的影响。
1 材料与方法 1.1 试剂与仪器 1.1.1 主要试剂苏木精-伊红(HE)染色试剂盒及碘酸雪夫氏(PAS)染色试剂盒购自北京索莱宝生物科技有限公司。
RIPA裂解液、BCA试剂盒、苯甲基磺酰(PMSF)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳缓冲液(SDS-PAGE)、SDS-PAGE蛋白上样缓冲液、10×TBST均购自碧云天生物技术有限公司;增强型化学发光液(ECL)、聚偏二氟乙烯(PVDF)膜购自于美国默克密理公司;斯玛特生化检测试剂盘购自成都斯玛特科技有限公司。
抗体:Bcl-2相关X(Bax)抗体(60267-1g)、B细胞淋巴瘤-2(Bcl-2)抗体(60178-1g)、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)抗体(66470-2-lg)、β-肌动蛋白(β-actin)抗体(66009-1-lg)均购于武汉三鹰生物技术有限公司。
1.1.2 主要仪器全自动生化分析仪购自成都斯玛特科技有限公司;电泳槽、转模仪、ChemiDoc XRS+化学发光成像系统均购自美国Bio-Rad公司。
1.2 试验设计与饲养管理本研究选用8周龄雄性C57BL/6小鼠32只(购自中国人民解放军军事医学科学院试验动物中心),体重(22±1) g,随机分为2组:冷暴露组[(4±1) ℃]和对照组[(24.0±0.5) ℃],每组4个重复,每个重复4只小鼠。
于人工气候室适应性饲养1周后进行试验,在试验期间,小鼠采食SPF级辐照鼠粮(沈阳市前民动物实验饲料厂),记录体重。遵循昼夜交替规律,照明强度为100 lx,提供光照和黑夜均为12 h,并人工设定每天08:00和20:00为开灯和关灯时间。气候室温度为(24±0.5) ℃,相对湿度为(40±5)%。小鼠在(4±1) ℃温度下连续冷暴露3周,每天刺激3 h。冷暴露结束将小鼠安乐死,采集血液样品静置4 ℃冰箱中,肝脏样品置于-80 ℃冰箱中以便开展后续试验。
1.3 生长性能在冷暴露期间测定每天采食量,并计算平均日采食量,测定冷暴露之前和冷暴露结束之后的体重,计算平均日增重。
1.4 血清生化指标血液样本静置在4 ℃冰箱中,在24 h内,将血液样品1 2000 r/min离心20 min分离血清,取100 μL血清放入生化试剂盘中进行生化16项的检测:白蛋白(ALB)、总蛋白(TP)、球蛋白(GLB)、甘油三酯(TG)、葡萄糖(GLU)、钙(Ca)、无机磷(PHOS)、尿素氮(UN)、总胆红素(TB)、肌酐(Crea)含量及天门冬氨基氨酸转移酶(AST)、丙氨酸氨基转移酶(ALT)、淀粉酶(AMY)、肌酸激酶(CK)活性及尿酐比(B/C)、白球比(A/G)。
1.5 肝脏组织HE染色肝脏组织放入4%的甲醛溶液中进行固定24 h、脱水、透明并进行石蜡包埋,常规4 μm切片。二甲苯脱蜡、酒精水化、HE染色5 min,随后进行脱水二甲苯透明、封片,光学显微镜观察糖原分布变化。
1.6 肝脏组织PAS染色及肝糖原含量采样、固定、切片同HE染色。二甲苯脱蜡、酒精水化、高碘酸-雪夫染色8 min、苏木素染色2~3 min,随后进行脱水二甲苯透明、封片,光学显微镜观察。肝糖原含量是染色完用Image J 1.8.0软件检测光密度所得出的。
1.7 组织蛋白提取及Western Blot检测从-80 ℃冰箱中取出小鼠肝脏组织80 mg,进行研磨、裂解、离心,抽取上清液并做好标记。Western Blot检测相关凋亡蛋白表达。使用BCA蛋白浓度测定试剂盒测定蛋白浓度,使蛋白浓度相同,并充分混匀煮沸使蛋白质变性。按照SDS-PAGE凝胶配制试剂说明书,配制分离胶和浓缩胶。电泳结束后,转膜至PVDF膜上,配制5%脱脂乳室温封闭1 h,用1×TBST溶液洗PVDF膜3次,每次10 min。按照抗体说明书用TBST稀释抗体,孵育过夜。次日洗膜3次,每次10 min。二抗室温下孵育1 h,然后洗膜3次,每次10 min。将ECL按说明书比例配制,使用ChemiDoc XRS+化学发光成像系统,进行曝光显影观察。目的条带灰度值分析使用Image J 1.8.0软件系统。
1.8 数据统计分析采用GraphPad Prism 8.0.2软件对数据进行样本t检验,数据表示为平均值±标准差,P < 0.05表示差异显著,P < 0.01表示差异极显著,P>0.05表示差异不显著。
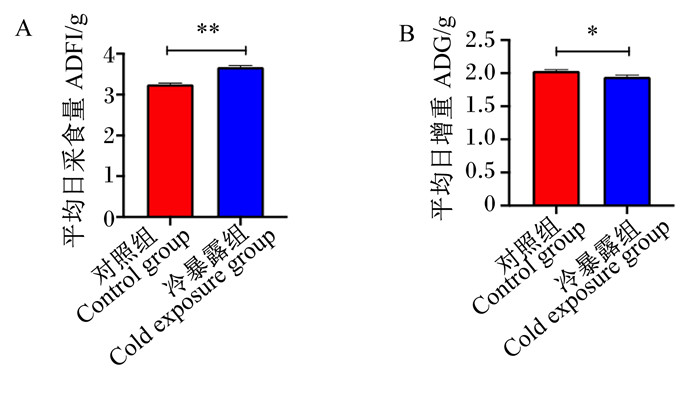
2 结果 2.1 冷暴露对小鼠生长性能的影响如图 1所示,与对照组相比,冷暴露组平均日采食量极显著升高(P < 0.01),平均日增重量显著降低(P < 0.05)。
|
*表示差异显著(P<0.05),* *表示差异极显著(P<0.01),NS表示差异不显著(P>0.05)。图 4同。 * indicates significant difference (P<0.05), * * indicates highly significant difference (P<0.01), NS indicates no significant difference(P>0.05). The same as Fig. 4. 图 1 冷暴露对小鼠生长性能的影响 Fig. 1 Effects of cold exposure on growth performance of mice |
如表 1所示,与对照组相比,冷暴露组血清ALB、TP、GLB、TB、TG、GLU、GA、UN、Crea含量,ALT、CK、AMY活性,A/G及B/C差异不显著(P>0.05);血清AST活性显著降低(P < 0.05),血清PHOS含量极显著降低(P < 0.01)。
|
|
表 1 冷暴露对小鼠血清生化指标的影响 Table 1 Effects of cold exposure on serum biochemical indices of mice |
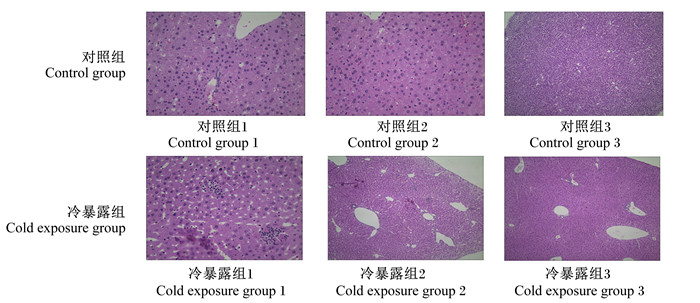
HE染色结果如图 2所示,与对照组相比,冷暴露组出现较多的空泡样变,肝细胞排列不均且形态异常,甚至消失,细胞间分界不明显,提示肝细胞受损。
|
图 2 冷暴露小鼠肝脏HE染色 Fig. 2 HE staining of liver of cold exposed mice (100×) |
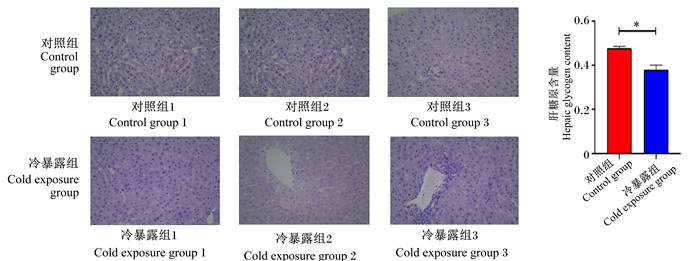
PAS染色结果如图 3所示,与对照组相比,冷暴露组出现较多的肝细胞变性,排列不均大小不等,提示肝细胞受损。与对照组相比,冷暴露组小鼠肝糖原含量减少,说明小鼠体内肝糖原在慢性冷暴露下发生改变。
|
图 3 冷暴露小鼠肝脏PAS染色及肝糖原含量 Fig. 3 PAS staining of liver of cold exposed mice (100×) and hepatic glycogen content |
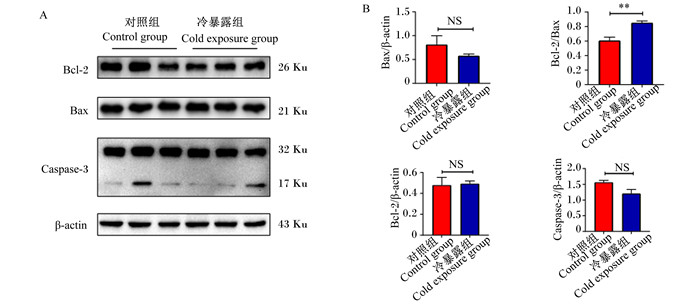
如图 4所示,与对照相比,冷暴露组Bcl-2/Bax的比值极显著升高(P < 0.01),Bax/β-actin、Bcl-2/β-actin、Caspase-3/β-actin的比值差异不显著(P>0.05)。
|
Bcl-2:B细胞淋巴瘤-2 B-cell lymphoma-2; Bax: Bcl-2相关X蛋白Bcl-2 associated X protein;Caspase-3:半胱氨酸天冬氨酸蛋白酶-3;β-actin:β-肌动蛋白。 图 4 冷暴露对小鼠肝脏中相关凋亡蛋白表达的影响 Fig. 4 Effects of cold exposure on expression of apoptosis related protein in liver of mice |
在畜禽养殖方面,冷暴露对动物生长性能、发育和免疫功能都有不利影响,这对养殖业造成一定的经济损失。有研究表明,较低的温度会导致摄食量的增加[16]。本试验结果显示,与对照组相比,冷暴露组平均日采食量极显著增加。与对照组相比,冷暴露组平均日增重显著降低,与Birkelo等[17]研究结果一致。在冷应激条件下,饲粮提供的大部分能量被用来维持动物身体的需要和保持内环境稳定,调节体温和脂肪沉积,从而导致平均日采食量的增加和平均日增重的降低。有研究表明,轻度冷应激时奶牛年平均产奶量会下降[18]。当雏鸡遭遇冷应激后会引起下痢肠道菌群紊乱,导致生长发育迟缓[19]。冷应激抑制了科尔沁牛免疫球蛋白的合成[20]。本研究中,小鼠在慢性冷暴露环境下,能量代谢增加,肝糖含量减少,Bcl-2/Bax比值极显著增加,以适应冷暴露来抵抗肝细胞免受细胞凋亡。但长期处在冷暴露的环境下会影响动物的神经内分泌系统、心血管系统和生殖系统。因此,在实际生产过程中除了改善动物的居住环境,还应加强饲养管理,适当在饲粮中添加维生素添加剂、氨基酸添加剂以及中草药添加剂来提高动物的抗应激能力,减少冷应激对机体的损伤。
肝脏中AST和ALT可作为评价肝脏功能状况的指标之一。有前人研究表明,当环境温度降低时,血清AST活性会明显降低,但随着温度的进一步下降,血清AST活性会略有上升。本试验结果显示,与对照组相比,冷暴露组血清AST活性显著降低,与Liang等[21]研究结果一致,说明在慢性冷暴露下,肝脏出现大量的代谢变化会使肝脏受到一定的损伤。在动物体内能够代谢氨基酸降解的酶主要是AST和ALT,而温度变化会影响酶活性,酶的作用会使体内蛋白质流失而减少,能量代谢增加,从而保障动物适应寒冷环境。而本试验中血清ALT活性没有显著的变化,可能是由于肝脏的代偿能力受冷暴露的影响较小,还需要进一步的探究。从组织染色结果来看,与对照组相比,冷暴露组肝脏出现较多的空泡样变和肝细胞变性,此现象说明冷暴露下,肝细胞会出现组织形态的变化和负荷范围内的损伤。肝脏在维持机体血清GLU和脂质平衡方面起着核心作用,正常情况下,机体主要靠GLU通过糖酵解途径获取能量,生成的中间代谢物又能为蛋白质和脂肪代谢提供原料,使糖、脂肪、蛋白质关系密切相关。肝脏功能障碍可以引起肝脏糖、脂代谢紊乱[22]。本试验结果发现,与对照组相比,冷暴露组小鼠血清GLU含量上升但差异不显著。研究发现,当雏鸡在寒冷的条件下,血浆中GLU含量会升高[23]。当在低温环境下,西门塔尔杂交犊牛血清GLU含量升高了84.5%[24]。荷斯坦奶牛在面对冷应激时,血清GLU含量也同样升高[25]。在研究育肥猪通过季节性冷刺激后,发现育肥猪的血清胰岛素、GLU含量与冷刺激时间长短有关。短期冷刺激使血清中胰岛素含量降低而GLU含量增加[26]。而Yao等[27]和Liu等[28]研究结果与本试验结果相反。TG主要功能是存储能量,本试验结果显示,与对照组相比,冷暴露组血清TG含量下降但不显著,这表明在冷暴露下,刺激肾上腺素导致GLU含量不稳定,糖原含量减少,需要摄入食物和加速能量代谢[29],被迫动用机体其他功能甚至脂肪沉积的能量,分解体内的营养,产生大量GLU使血糖含量增加。与对照组相比,冷暴露组血清Crea含量没有显著变化,与靳二辉等[30]和郝世秋等[31]的研究结果相反,这表明冷暴露时机体保护肾脏组织和功能免受损伤。磷在维持机体正常机能方面有着重要作用。本试验结果显示,与对照组相比,冷暴露组血清PHOS含量极显著降低,与张道敬[32]研究结果一致,由于机体适应了环境温度的变化,使得内分泌稳定,磷的含量极显著降低。也有研究表明,在急性冷应激状态下,血清磷的含量显著上升,因为在急性冷应激下内分泌发生改变,激素水平升高,磷的含量显著上升。以上血清生化指标变化结果表明,慢性冷暴露可引起小鼠血清中AST活性和PHOS含量显著改变,肝脏发生病理损伤,使机体在转氨酶水平和代谢水平发生变化。
细胞凋亡是细胞的一种程序性死亡的形式,它可以清除体内不需要和功能丧失的细胞,如胚胎发育期间或维持内环境的平衡[33]。Bcl-2、Bax和Caspase等是较为常见与细胞凋亡有关的蛋白,其中Bcl-2蛋白家族参与了线粒体膜通透性的调节,是凋亡系统的主要参与者之一。Bcl-2蛋白家族可分为促凋亡蛋白(Bax、Bak)和抗凋亡蛋白(Bcl-2)等,这2组间的比率可作为判定细胞凋亡标准,在一定程度上起着重要作用。Bax蛋白在接收到特定信号后发生构象变换并进入线粒体,在线粒体中促进细胞色素C释放到细胞中[33]。Caspase-3有重要的枢纽作用,是驱动者也是运行者[34]。2种凋亡途径最终都是通过激活Caspase家族中的成员因子,共同协作调控凋亡的产生[35],它直接参与调亡信号转导过程,并受到环境变化、DNA损伤等多种因素诱导。当冷应激时肝脏会处于高度的代谢状态,会引起肝脏发生应激反应,启动应激状态保护机制,刺激细胞凋亡程序[36]。有报道发现,在低温状态下会使内皮细胞中抗凋亡蛋白表达上调[37]。本试验结果表明,与对照组相比,冷暴露组Bcl-2/Bax比值极显著增加,与温宇婷等[38]研究结果一致,也有研究得出,应激引起Bcl-2/Bax比值降低[39],可能是由于冷暴露程度不够引起细胞发生反应。本试验结果显示,冷暴露能够使用Bcl-2/Bax比值增加,Bcl-2/Bax比值极显著增加,可对肝细胞起到保护作用,减少细胞凋亡,这表明在慢性冷暴露状态下对小鼠肝脏损伤作用与细胞凋亡的途径有关。
4 结论综上所述,慢性冷暴露会使小鼠的生长性能受阻,血清AST活性和PHOS含量下降,糖原含量减少,肝脏健康受到一定的损伤。肝脏Bcl-2/Bax比值极显著增加在一定程度上可对肝细胞起到保护作用,减少细胞凋亡,这些检测指标可以作为检测慢性冷暴露的一个参考指标,同时为畜牧业的生产提供一定的解决方案。
| [1] |
ORTOLANI D, GARCIA M C, MELO-THOMAS L, et al. Stress-induced endocrine response and anxiety: the effects of comfort food in rats[J]. Stress (Amsterdam, Netherlands), 2014, 17(3): 211-218. DOI:10.3109/10253890.2014.898059 |
| [2] |
SOLIANIK R, SKURVYDAS A, URBONIENE D, et al. Similar cold stress induces sex-specific neuroendocrine and working memory responses[J]. Cryo Letters, 2015, 36(2): 120-127. |
| [3] |
GARCÍA-DÍAZ E C, GÓMEZ-QUIROZ L E, ARENAS-RÍOS E, et al. Oxidative status in testis and epididymal sperm parameters after acute and chronic stress by cold-water immersion in the adult rat[J]. Systems Biology in Reproductive Medicine, 2015, 61(3): 150-160. DOI:10.3109/19396368.2015.1008071 |
| [4] |
CONG P F, LIU Y N, LIU N N, et al. Cold exposure induced oxidative stress and apoptosis in the myocardium by inhibiting the Nrf2-Keap1 signaling pathway[J]. BMC Cardiovascular Disorders, 2018, 18(1): 36. DOI:10.1186/s12872-018-0748-x |
| [5] |
JEDEMA H P, GOLD S J, GONZALEZ-BURGOS G, et al. Chronic cold exposure increases RGS7 expression and decreases α2-autoreceptor-mediated inhibition of noradrenergic locus coeruleus neurons[J]. European Journal of Neuroscience, 2008, 27(9): 2433-2443. DOI:10.1111/j.1460-9568.2008.06208.x |
| [6] |
MERIGGIOLA M C, BREMNER W J, PAULSEN C A, et al. A combined regimen of cyproterone acetate and testosterone enanthate as a potentially highly effective male contraceptive[J]. The Journal of Clinical Endocrinology & Metabolism, 1996, 81(8): 3018-3023. |
| [7] |
ZHANG Y M, LI L L, HUA Y N, et al. Cardiac-specific knockout of ET(A) receptor mitigates low ambient temperature-induced cardiac hypertrophy and contractile dysfunction[J]. Journal of Molecular Cell Biology, 2012, 4(2): 97-107. DOI:10.1093/jmcb/mjs002 |
| [8] |
MING X, YU X Y, LI J L, et al. Effects of acute and chronic cold stress on antioxidant function in intestinal tracts of chickens[J]. Journal of Northeast Agricultural University (English Edition), 2012, 19(2): 54-61. DOI:10.1016/S1006-8104(13)60038-0 |
| [9] |
LIAN S, GUO J R, WANG L P, et al. Impact of prenatal cold stress on placental physiology, inflammatory response, and apoptosis in rats[J]. Oncotarget, 2017, 8(70): 115304-115314. DOI:10.18632/oncotarget.23257 |
| [10] |
ZHANG W Y, NIU C J, JIA H, et al. Effects of acute cold exposure on oxidative balance and total antioxidant capacity in juvenile Chinese soft-shelled turtle, Pelodiscus sinensis[J]. Integrative Zoology, 2017, 12(5): 371-378. DOI:10.1111/1749-4877.12247 |
| [11] |
VENDITTI P, PAMPLONA R, AYALA V, et al. Differential effects of experimental and cold-induced hyperthyroidism on factors inducing rat liver oxidative damage[J]. Journal of Experimental Biology, 2006, 209(5): 817-825. DOI:10.1242/jeb.02045 |
| [12] |
SEPA-KISHI D M, SOTOUDEH-NIA Y, IQBAL A, et al. Cold acclimation causes fiber type-specific responses in glucose and fat metabolism in rat skeletal muscles[J]. Scientific Reports, 2017, 7(1): 15430. DOI:10.1038/s41598-017-15842-3 |
| [13] |
GHAFOORY S, BREITKOPF-HEINLEIN K, LI Q, et al. Zonation of nitrogen and glucose metabolism gene expression upon acute liver damage in mouse[J]. PLoS One, 2013, 8(10): e78262. DOI:10.1371/journal.pone.0078262 |
| [14] |
WANG J Y, CHEN Y M, ZHANG W B, et al. Akt activation protects liver cells from apoptosis in rats during acute cold exposure[J]. International Journal of Biological Sciences, 2013, 9(5): 509-517. DOI:10.7150/ijbs.5220 |
| [15] |
MENEGHINI A, FERREIRA C, DE ABREU L C, et al. Cold stress effects on cardiomyocytes nuclear size in rats: light microscopic evaluation[J]. Revista Brasileira de Cirurgia Cardiovascular, 2008, 23(4): 530-533. |
| [16] |
王密, 董顺义, 杨建成, 等. 牛磺酸在养禽业中的应用现状及其发展前景[J]. 中国家禽, 2007, 29(7): 51-53. WANG M, DONG S Y, YANG J C, et al. Application and perspective of taurine in poultry industry[J]. China Poultry, 2007, 29(7): 51-53 (in Chinese). DOI:10.3969/j.issn.1004-6364.2007.07.021 |
| [17] |
BIRKELO C P, JOHNSON D E, PHETTEPLACE H P. Maintenance requirements of beef cattle as affected by season on different planes of nutrition[J]. Journal of Animal Science, 1991, 69(3): 1214-1222. DOI:10.2527/1991.6931214x |
| [18] |
陈晓阳, 顾宪红, 孙福昱. 中国西南地区奶牛场奶牛冷热应激程度与防暑防寒情况调研报告[J]. 中国奶牛, 2021(10): 5-8. CHEN X Y, GU X H, SUN F Y. investigation report on stock, heat and cold stress and its regulation of dairy farms in Southwest China[J]. China Dairy Cattle, 2021(10): 5-8 (in Chinese). DOI:10.19305/j.cnki.11-3009/s.2021.10.002 |
| [19] |
王霞, 郭洁平. 冷应激对雏鸡肠道微生物的影响研究进展[J]. 中兽医医药杂志, 2022, 41(2): 46-50. WANG X, GUO J P. Effect of cold stress on intestinal microbe of chicks[J]. Journal of Traditional Chinese Veterinary Medicine, 2022, 41(2): 46-50 (in Chinese). |
| [20] |
包雨鑫, 吴佳琦, 王梓, 等. 冷应激对科尔沁牛与科尔沁牛杂交牛的生理指标及抗氧化功能的影响[J]. 黑龙江畜牧兽医, 2022(8): 51-54. BAO Y X, WU J Q, WANG Z, et al. Effect of cold stress on physiological indexes and antioxidant function of Kerqin cattle and crossbred Kerqin cattle[J]. Heilongjiang Animal Science and Veterinary Medicine, 2022(8): 51-54 (in Chinese). |
| [21] |
LIANG H Y, JIA Y Q, MIAO S J, et al. Efects of environ-mental temperature on serum indicators of cows fed in bricks cow house[J]. Journal of Heilongjiang Bayi Agri-cultural University, 2010, 12(6): 12-15. |
| [22] |
XU L N, LI Y, YIN L H, et al. miR-125a-5p ameliorates hepatic glycolipid metabolism disorder in type 2 diabetes mellitus through targeting of STAT3[J]. Theranostics, 2018, 8(20): 5593-5609. DOI:10.7150/thno.27425 |
| [23] |
王金涛, 李宁, 徐世文. 急、慢性冷应激对雏鸡腓肠肌及血清抗氧化功能的影响[J]. 中国农学通报, 2007, 23(3): 28-32. WANG J T, LI N, XU S W. Effects of acute and chronic cold stress on the antioxidative function of gastrocnemius and serum in chicken[J]. Chinese Agricultural Science Bulletin, 2007, 23(3): 28-32 (in Chinese). DOI:10.3969/j.issn.1000-6850.2007.03.007 |
| [24] |
孟祥坤, 曹兵海, 庄宏, 等. 慢性冷应激对西门塔尔杂交犊牛免疫相关指标的影响[J]. 中国农业大学学报, 2010, 15(6): 65-70. MENG X K, CAO B H, ZHUANG H, et al. Effects of chronic cold stress on immune of Simmental crossbred calves[J]. Journal of China Agricultural University, 2010, 15(6): 65-70 (in Chinese). |
| [25] |
梁鸿雁, 贾永全, 苗树君, 等. 慢性冷应激对奶牛乳清生化指标及酶活性的影响[J]. 中国畜牧兽医, 2011, 38(5): 45-47. LIANG H Y, JIA Y Q, MIAO S J, et al. Effect of chronic cold stress on biochemical indicators and enzyme in whey in holstein lactating cows[J]. China Animal Husbandry & Veterinary Medicine, 2011, 38(5): 45-47 (in Chinese). |
| [26] |
穆淑琴, 李驰, 闫峻, 等. 季节性短期冷刺激对育肥猪血液生化指标的影响[J]. 西北农业学报, 2017, 26(10): 1422-1428. MU S Q, LI C, YAN J, et al. Effect of seasonal cold short-term stimulation on blood biochemical indicators, levels of immune factors and oxidation index of finishing pigs[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2017, 26(10): 1422-1428 (in Chinese). DOI:10.7606/j.issn.1004-1389.2017.10.002 |
| [27] |
YAO R Z, YANG Y Y, LIAN S, et al. Effects of acute cold stress on liver O-GlcNAcylation and glycometabolism in mice[J]. International Journal of Molecular Sciences, 2018, 19(9): 2815. DOI:10.3390/ijms19092815 |
| [28] |
LIU P, YAO R Z, SHI H Z, et al. Effects of cold-inducible RNA-binding protein (CIRP) on liver glycolysis during acute cold exposure in C57BL/6 mice[J]. International Journal of Molecular Sciences, 2019, 20(6): 1470. DOI:10.3390/ijms20061470 |
| [29] |
张振玲, ESMAIL S H. 冷应激对肉鸡的影响[J]. 畜牧产业, 2021(10): 79-80. ZHANG Z L, ESMAIL S H. Cold stress: feed utilisation and performance in broilers[J]. Animal Agriculture, 2021(10): 79-80 (in Chinese). |
| [30] |
靳二辉, 李升和, 周金星, 等. 冷应激环境下补充维生素C对小鼠血清生化指标及部分内脏器的影响[J]. 安徽科技学院学报, 2012, 26(4): 8-13. JIN E H, LI S H, ZHOU J X, et al. The influence of supplement vitamin C on serum biochemical indicators and partial internal organ of male mice in cold stress environment[J]. Journal of Anhui Science and Technology University, 2012, 26(4): 8-13 (in Chinese). DOI:10.3969/j.issn.1673-8772.2012.04.004 |
| [31] |
郝世秋, 刘成荫, 黄淑成, 等. 热应激肉鸡血液内毒素及肾脏损伤指标测定[J]. 动物医学进展, 2014, 35(3): 83-86. HAO S Q, LIU C Y, HUANG S C, et al. Determination of renal impairment indexes in broilers induced by endotoxin during heat stress[J]. Progress in Veterinary Medicine, 2014, 35(3): 83-86 (in Chinese). DOI:10.3969/j.issn.1007-5038.2014.03.019 |
| [32] |
张道敬. 不同抗热应激添加剂对肉鸡生产性能和血液理化指标的影响[D]. 硕士学位论文. 南宁: 广西大学, 2002. ZHANG D J. The effect of different anti-heat stress additives on performance and blood biochemical indices of broiler[D]. Master's Thesis. Nanning: Guangxi University, 2002. (in Chinese) |
| [33] |
SINGH R, LETAI A, SAROSIEK K. Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins[J]. Nature Reviews. Molecular Cell Biology, 2019, 20(3): 175-193. DOI:10.1038/s41580-018-0089-8 |
| [34] |
金宝, 张育才. 促红细胞生成素对发育期小鼠脑损伤后神经细胞凋亡和caspase-3表达的影响[J]. 中华急诊医学杂志, 2013, 22(1): 35-39. JIN B, ZHANG Y C. Effects of erythropoietin on neuron apoptosis and expression of caspase-3 after excitotoxic brain injury in mice during different developmental stages[J]. Chinese Journal of Emergency Medicine, 2013, 22(1): 35-39 (in Chinese). DOI:10.3760/cma.j.issn.1671-0282.2013.01.008 |
| [35] |
LIU L, ZHANG Z Z, XING D. Cell death via mitochondrial apoptotic pathway due to activation of Bax by lysosomal photodamage[J]. Free Radical Biology and Medicine, 2011, 51(1): 53-68. DOI:10.1016/j.freeradbiomed.2011.03.042 |
| [36] |
VENDITTI P, DE ROSA R, DI MEO S. Effect of cold-induced hyperthyroidism on H2O2 production and susceptibility to stress conditions of rat liver mitochondria[J]. Free Radical Biology and Medicine, 2004, 36(3): 348-358. DOI:10.1016/j.freeradbiomed.2003.11.012 |
| [37] |
SAKURAI T, KUDO M, WATANABE T, et al. Hypothermia protects against fulminant hepatitis in mice by reducing reactive oxygen species production[J]. Digestive Diseases, 2013, 31(5/6): 440-446. |
| [38] |
温宇婷, 刘犇, 章志涛, 等. 运输应激对小鼠肠道的病理损伤及Bcl-2和Bax表达的影响[J]. 中国畜牧杂志, 2020, 56(5): 157-162. WEN Y T, LIU B, ZHANG Z T, et al. Effect of transport stress on pathological damage and expression of Bcl-2 and Bax in the mouse intestine[J]. Chinese Journal of Animal Science, 2020, 56(5): 157-162 (in Chinese). |
| [39] |
ZHAO L L, GU Q R, XIANG L T, et al. Curcumin inhibits apoptosis by modulating Bax/Bcl-2 expression and alleviates oxidative stress in testes of streptozotocin-induced diabetic rats[J]. Therapeutics and Clinical Risk Management, 2017, 13: 1099-1105. DOI:10.2147/TCRM.S141738 |




