玉米是我国主要的储备粮之一,其储存尤为重要。我国每年有大量存储期较长的玉米被轮换流入畜牧行业,最终用于饲料生产、食品加工以及工业乙醇的制备[1]。在长期储存的过程中,由于自身的呼吸作用,玉米的营养成分和理化性质发生改变。随着贮藏时间的延长,蛋白质游离的氨基与还原糖的羰基相互作用形成结构复杂的化合物,抑制了淀粉水解酶的活性,阻碍了淀粉被瘤胃微生物获得与利用;此外,玉米陈化的过程中直链淀粉含量有所增加,而支链淀粉含量降低,这加速了淀粉老化的进程,从而溶解度降低,导致淀粉的消化速度和消化程度降低[2]。
微生物固态发酵技术具有减少饲料中的抗营养因子和霉菌毒素、提高营养物质的消化率、改善发酵饲料品质等优点[3-4]。Hoffman等[5]的研究表明,青贮发酵能够促进高水分玉米中淀粉-蛋白质基质的降解,使瘤胃细菌更容易接触到淀粉颗粒,促进淀粉的降解。Kung等[6]和Saylor等[7]的研究表明,外源蛋白酶以及产酸能力强的布氏乳杆菌可降低高水分玉米发酵料的pH和醇溶蛋白含量,提高淀粉的体外降解率。
然而,影响固态发酵的因素较多,并且一些影响因素较难控制,为了获得优质的发酵饲料,不同的发酵底物应该具有不同的发酵工艺[8-9]。酸性蛋白酶和鼠李糖乳杆菌被大量的研究证明具有降解醇溶蛋白以及提高发酵品质的能力,可提高淀粉的消化率[6, 10]。因此,针对陈化玉米淀粉消化率低的特点,本试验分别以酸性蛋白酶和鼠李糖乳杆菌作为添加酶制剂和接种剂,利用固态发酵技术对陈化玉米进行发酵,使用响应面法对发酵因素进行优化,提高发酵料中瘤胃淀粉降解率。通过对比化学成分和抗氧化能力,分析发酵后陈化玉米品质的变化,以期为陈化玉米的合理应用提供科学依据。
1 材料与方法 1.1 试验材料陈化玉米购自哈尔滨周边粮库,储存时间为4年。酸性蛋白酶购自沧州某酶生物技术有限公司,活力≥60 000 U/g。鼠李糖乳杆菌(活菌数≥4×109 CFU/g)由东北农业大学反刍动物营养研究所提供。
1.2 试验方法 1.2.1 Plackett-Burman主效应因子的筛选基于前期单因素预试验的结果,将含水量、菌接种量、酶添加量、发酵温度以及发酵时间作为考察的因素,每个因素选取高(1)、低(-1)2个水平,设计Plackett-Burman试验,其中试验次数=12,试验因素及水平如表 1所示。
|
|
表 1 Plackett-Burman试验因素及水平 Table 1 Plackett-Burman experiment factors and levels |
根据Plackett-Burman试验所筛选出的重要影响因素,通过最陡爬坡试验确定这些影响因素的取值,使其逼近最大响应区域,以确定响应面试验的中心试验点。其爬坡方向与步长参考张昊月等[11]的方法。
1.2.3 Box-Behnken试验采用Box-Behnken设计响应面试验对陈化玉米发酵条件进行优化,将Plackett-Burman试验筛选出的显著影响因素设置为自变量,以瘤胃淀粉降解率为响应值,设计3因素3水平的分析试验,如表 2所示,中心试验点为最陡爬坡试验所确定。由陈化玉米发酵的拟合模型以及响应面图进行最优发酵条件的预测。在最优条件下发酵陈化玉米,测定其瘤胃淀粉降解率,并与预测值进行对比和验证。
|
|
表 2 Box-Behnken试验因素及水平 Table 2 Box-Behnken experiment factors and levels |
根据Saylor等[7]的方法,采用尼龙袋法测定瘤胃淀粉降解率。向孔径为50 μm、大小为10 cm×20 cm的尼龙袋中装入已准确称取的7 g样品,扎紧袋口后放置于3头装有永久性瘤胃瘘管的荷斯坦奶牛的瘤胃中。每个样品做3个重复,每头牛为1个重复。在发酵7 h时将尼龙袋取出,用冷水冲洗所有尼龙袋直到水澄清,将洗净后的尼龙袋于55 ℃的烘箱中烘48 h至恒重,回潮24 h后称重。取出尼龙袋中的残余物,粉碎过1 mm标准筛孔,装入自封袋中保存。
测定各组陈化玉米原样和7 h瘤胃降解残渣样中的淀粉含量,淀粉含量使用Megazyme总淀粉检测试剂盒(产品编号:K-TSTA;Megazyme国际有限公司,爱尔兰)进行测定。根据公式计算7 h瘤胃淀粉降解率:
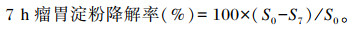
|
式中:S0为陈化玉米原样中的淀粉含量;S7为7 h瘤胃降解残渣淀粉含量。
1.4 发酵前和发酵后化学成分的测定按照AOAC(2000)[12]的方法测定干物质(DM)和粗蛋白质(CP)含量;根据Van Soest等[13]的方法测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量;采用硫酸-蒽酮法[14]测定可溶性碳水化合物(WSC)含量;根据张霞等[15]的方法测定醇溶蛋白含量;pH采用Sartorius PB-10型酸度计(赛多利斯科学仪器北京有限公司)测定。
1.5 发酵前和发酵后抗氧化能力的测定1, 1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力使用南京建成生物工程研究所试剂盒进行测定;羟基自由基清除能力按照Ajibola等[16]的方法测定;还原能力根据Chi等[17]的方法测定。
1.6 统计分析陈化玉米发酵条件优化部分的结果采用Design-Export 10.0.4进行分析,P < 0.05代表有显著性差异。发酵对陈化玉米的化学成分和抗氧化能力的影响采用SAS 9.2统计软件进行单因素方差分析(one way-ANOVA),P < 0.05表示差异显著。
2 结果与分析 2.1 Plackett-Burman试验Plackett-Burman试验设计及结果如表 3所示。经过12次不同发酵试验后,瘤胃淀粉降解率变化范围为44.27%~59.60%。其中,当含水量为40%,菌接种量为1×109 CFU/g,酶添加量为0.6%,发酵温度为34 ℃,发酵时间为15 d时淀粉降解率最高。对表 3的结果进行方差分析如表 4所示,模型P < 0.05表明模型显著;R2=0.973 1说明此回归模型拟合程度良好。此外,显著影响发酵陈化玉米中淀粉降解率的因子分别为含水量、菌接种量和酶添加量;而发酵温度和发酵时间对淀粉降解率影响不大,因此后续试验中,发酵温度和发酵时间设定为前期单因素试验中的最优水平(36 ℃和20 d)。
|
|
表 3 Plackett-Burman试验设计及结果 Table 3 Design and results of Plackett-Burman experiment |
|
|
表 4 Plackett-Burman试验结果方差分析 Table 4 Variance analysis of Plackett-Burman experiment results |
最陡爬坡试验设计及结果如表 5所示,当含水量(X1)=40%,菌接种量(X2)=7×108 CFU/g,酶添加量(X3)=0.5%时淀粉降解率最高,而继续升高含水量、菌接种量和酶添加量的水平反而会降低淀粉降解率。因此,响应面试验的中心试验点为:含水量40%,菌接种量7×108 CFU/g,酶添加量0.5%。
|
|
表 5 最陡爬坡试验设计及结果 Table 5 Design and results of steepest ascent experiment |
优化瘤胃淀粉降解率的Box-Behnken试验设计及结果如表 6所示,经过17次不同发酵试验后,发现淀粉降解率在中心试验点2、4、8、15和16时最大,依次为63.49%、61.18%、63.02%、62.48%和62.87%,此时的发酵条件为含水量40%,菌接种量7×108 CFU/g,酶添加量0.5%。对表 6的试验结果进行方差分析见表 7,模型P < 0.01达到极显著水平;R2=0.979 6说明表明97.96%的淀粉降解率可由该模型解释,与实际情况拟合良好;失拟项不显著(P=0.233 8),代表回归方程拟合度良好。此外,含水量、菌接种量和酶添加量的一次项和二次项、含水量和菌接种量的交互作用以及菌接种量和酶添加量的交互作用均显著影响瘤胃淀粉降解率(P < 0.05)。通过回归拟合,这3种试验因子对瘤胃淀粉降解率(Y)影响的回归方程为:
|
|
表 6 Box-Behnken试验设计及结果 Table 6 Design and results of Box-Behnken experiment |
|
|
表 7 Box-Behnken试验回归模型方差分析 Table 7 Variance analysis of Box-Behnken experiment regression model |

|
式中:A为含水量(%);B为菌接种量(CFU/g);C为酶添加量(%)。
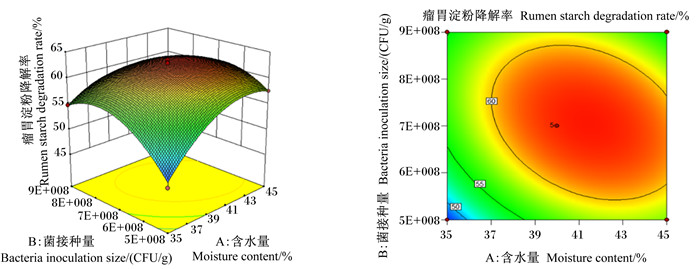
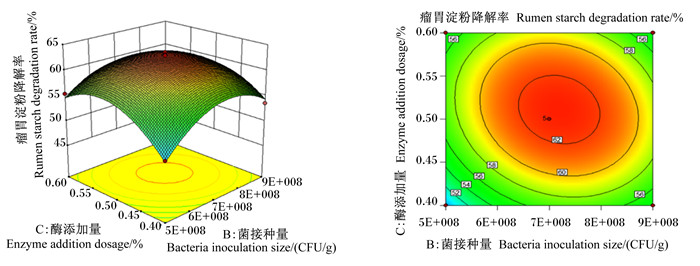
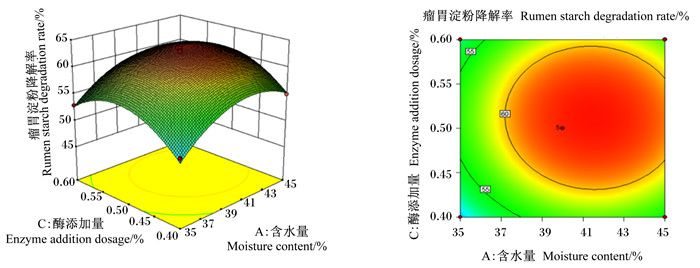
图 1至图 3为2个因素之间交互作用的响应面图和等高线图。响应面的斜率越大,对应的等高线越密集(接近于椭圆),说明2个因素的交互作用越显著。含水量与菌接种量的交互作用如图 1,随着含水量和菌接种量的增加,瘤胃淀粉降解率呈现先升高后下降的趋势,其交互图曲面坡度较陡,斜率较大,而等高线图接近于椭圆形,说明含水量与菌接种量的交互作用显著。由图 2可知,随着菌接种量和酶添加量的增加,瘤胃淀粉降解率呈现先升高后下降的趋势,其交互图曲面坡度与图 1相比较为平缓,说明其交互作用小于含水量与菌接种量的交互作用。同理,图 3中瘤胃淀粉降解率随着含水量和酶添加量的增加呈现先升高后下降的趋势,而交互图曲面坡度平缓,等高线不密集,说明含水量和酶添加量的交互作用不显著。以上结果与方差分析结果一致。
|
图 1 含水量和菌接种量对瘤胃淀粉降解率影响的响应面图和等高线图 Fig. 1 Response surface and contour graph of effects of moisture content and bacteria inoculation size on rumen starch degradation rate |
|
图 2 酶添加量和菌接种量对瘤胃淀粉降解率影响的响应面图和等高线图 Fig. 2 Response surface and contour graph of effects of enzyme addition dosage and bacteria inoculation size on rumen starch degradation rate |
|
图 3 酶添加量和含水量对瘤胃淀粉降解率影响的响应面图和等高线图 Fig. 3 Response surface and contour graph of effects of enzyme addition dosage and moisture content on rumen starch degradation rate |
运用Design-Export 10.0.4软件优化所得到的提高陈化玉米中瘤胃淀粉降解率的最优发酵条件为: 含水量41.44%,菌接种量7.04×108 CFU/g,酶添加量0.51%,发酵温度为36 ℃,发酵时间为20 d。在此条件下,所得瘤胃淀粉降解率预测值为63.04%。根据上述发酵条件重新发酵3次,所得瘤胃淀粉降解率分别为62.75%、63.15%和63.54%,与预测值相近。
2.4 发酵对陈化玉米化学成分和pH的影响发酵前后陈化玉米的化学成分如表 8所示,与陈化玉米相比,发酵陈化玉米显著降低了NDF、ADF和WSC、醇溶蛋白含量以及pH(P < 0.05),但显著提高了淀粉含量(P < 0.05)。
|
|
表 8 发酵前后陈化玉米的化学成分和pH Table 8 Chemical composition and pH of aging corn before and after fermentation |
发酵前后陈化玉米的DPPH自由基清除能力、羟基自由基清除能力以及还原能力如图 4所示。由图可知,发酵前后的陈化玉米的DPPH自由基清除能力和还原能力随着浓度的升高而增加。在不同的浓度下,发酵陈化玉米的DPPH自由基清除能力、羟基自由基清除能力以及还原能力均显著高于陈化玉米(P<0.05)。
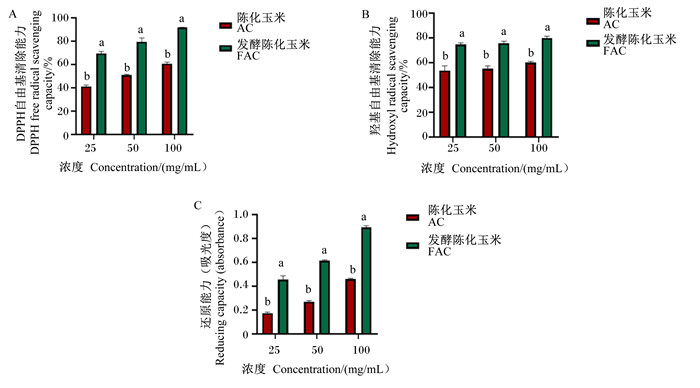
|
数据柱标注不同字母表示差异显著(P<0.05)。 Date bars with different letters mean significant difference (P<0.05). 图 4 发酵前后陈化玉米的抗氧化能力 Fig. 4 Antioxidant capacities of aging corn before and after fermentation |
玉米中的淀粉与醇溶蛋白结合形成的淀粉-蛋白质基质被认为是反刍动物利用和消化淀粉的障碍之一[5]。醇溶蛋白并不来源于淀粉的内部,而是位于淀粉颗粒的表面。醇溶蛋白可分为α、β、γ和δ 4种亚类,随着玉米醇溶蛋白的成熟,β以及γ玉米醇溶蛋白相互交联,与中间穿插的α和δ玉米醇溶蛋白共同形成紧密的网络结构,将淀粉牢牢包裹在具有强疏水性的淀粉-蛋白质基质中,导致淀粉不容易被瘤胃获得和利用[18-19]。Corona等[20]的研究也表明,玉米中醇溶蛋白含量与体外淀粉降解率以及瘤胃淀粉降解率均呈负相关。本研究中,含水量、菌接种量和酶添加量能够显著地影响陈化玉米的瘤胃淀粉降解率,这可能是通过改变醇溶蛋白含量来实现的。酸性蛋白酶的添加降低蛋白组分中醇溶蛋白的含量,但并不影响粗蛋白质的含量,这与Landry等[21]的研究结果一致。醇溶蛋白的降解使淀粉颗粒更容易与瘤胃微生物接触,促进了淀粉的消化吸收。Young等[22]和Kung等[6]也表明,蛋白酶可以提高全株玉米和高水分玉米的淀粉降解率。乳酸菌的接种能够增加发酵产物中的有机酸含量,降低pH,有利于醇溶蛋白的酸解,从而提高淀粉的利用效率[7]。因此,本研究中酸性蛋白酶和鼠李糖乳杆菌的添加通过破坏疏水性淀粉-蛋白质基质来提高瘤胃淀粉降解率。而含水量对于淀粉降解率的影响可能是由于其对乳酸菌活性和浓度的调控所致,含水量过低会导致乳酸菌的活性偏低,不利于发酵的进行;含水量过高则是对乳酸菌起到稀释的作用,降低了有机酸的浓度,导致醇溶蛋白的酸解受到抑制,这也间接解释了含水量与菌接种量的交互作用显著的原因。而由于蛋白酶与鼠李糖乳杆菌均能降低醇溶蛋白含量,菌酶协同发酵使陈化玉米中的淀粉降解率大大提升,因此菌接种量与酶添加量之间也具有显著的交互作用。
3.2 发酵对陈化玉米营养价值的影响根据Hoffman等[5]的报道,青贮发酵使淀粉-蛋白质基质中的所有α、β和δ Zein亚基减少了10%~40%,而γ醇溶蛋白亚基的降幅高达60%,醇溶蛋白含量的减少促进淀粉颗粒簇解离,增加了细菌在瘤胃中附着的表面积,从而促进淀粉的降解。然而,这需要较长的发酵时间。在实际生产中,一般采用添加酶制剂和菌接种剂而不是延长发酵时间的方式来提高饲料品质。本研究中,蛋白酶和乳酸菌的协同发酵降低了醇溶蛋白的含量,使淀粉更容易被瘤胃所利用。在饲料中,NDF和ADF难以消化和吸收,饲料的可接受性和采食量随着NDF含量的增加而下降,饲料的消化率随着ADF含量的增加而下降[23]。微生物发酵是一种高效的降解纤维,提高动物采食量和消化率的方法[24],在本研究中,发酵降低了陈化玉米的NDF和ADF含量,改善了发酵饲料的品质。在发酵的过程中,原料中的微生物利用可溶性糖作为底物,代谢产生乳酸,导致WSC含量的减少。有机酸的增加造成pH的下降,发酵后的陈化玉米发酵液pH低于4.20,抑制了有害细菌的生长繁殖,有利于粗蛋白质等营养成分的保留,这也是本研究中粗蛋白质含量变化不显著的主要原因。据报道,发酵可以改变淀粉的理化性质,并提高淀粉含量[25],与本研究的结果一致,这可能是由于发酵降低了其他组分的含量,使得淀粉含量升高。
3.3 发酵对陈化玉米抗氧化能力的影响在储藏过程中,由于多不饱和脂肪酸含量较高,玉米容易发生氧化酸败,游离脂肪酸氧化生成的过氧化氢会影响过氧化氢酶和过氧化物酶的活性,细胞膜脂质过氧化也会导致二者活性的进一步下降[26]。此外,过量的自由基含量会抑制动物的生产性能发挥,甚至危害动物的健康,这大大限制了陈化玉米的使用[27-29]。乳酸菌作为常用的益生菌和青贮接种剂,具有清除自由基、提高机体抗氧化能力[30]。然而,Ellis等[31]的研究表明,不同的乳酸菌抗氧化能力并不相同。Li等[32]和Zhang等[33]报道了具有抗氧化能力的植物乳杆菌和乳酸片球菌可提高紫花苜蓿青贮料的总抗氧化能力和谷胱甘肽过氧化物酶活性,进而提高了发酵料的抗氧化能力。本研究将鼠李糖乳杆菌作为发酵的接种剂应用于陈化玉米。据报道,鼠李糖乳杆菌在体外具有类似于抗氧化剂的活性,摄入机体内也能起到对机体细胞氧化应激的调节作用[34-35]。鼠李糖乳杆菌的接种提高了陈化玉米DPPH清除自由基能力、羟基自由基清除能力和还原能力,这与陈永芳等[36]将鼠李糖乳杆菌接种于胡萝卜汁,提高了其抗氧化能力的结果一致。这可能是由于鼠李糖乳杆菌细胞内存在的谷胱甘肽过氧化物酶、过氧化氢酶等抗氧化酶在发酵的过程中起到清除自由基的作用,或者是某种发酵产物具有抗氧化作用,而具体的抗氧化机制则需要进一步研究。
4 结论响应面法优化陈化玉米的最佳发酵条件为:含水量41.44%,鼠李糖乳杆菌的接种量7.04×108 CFU/g,酸性蛋白酶的添加量0.51%,发酵温度36 ℃,发酵时间20 d。发酵条件优化后提高了陈化玉米的营养价值和抗氧化能力。
| [1] |
LÓPEZ-MALVAR A, ORDÁS B, SOUTO C, et al. Chemical changes during maize tissue aging and its relationship with mediterranean corn borer resistance[J]. Journal of Agricultural and Food Chemistry, 2017, 65(42): 9180-9185. DOI:10.1021/acs.jafc.7b02911 |
| [2] |
REHMAN Z U. Storage effects on nutritional quality of commonly consumed csereals[J]. Food Chemistry, 2006, 95(1): 53-57. DOI:10.1016/j.foodchem.2004.12.017 |
| [3] |
谢建林, 高俊国, 王蒙, 等. 微生物发酵粗饲料在反刍动物生产中的应用研究进展[J]. 饲料研究, 2020, 43(3): 124-128. XIE J L, GAO J G, WANG M, et al. Advances in the application of microbial fermented rougues in the production of ruminants[J]. Feed Research, 2020, 43(3): 124-128 (in Chinese). DOI:10.13557/j.cnki.issn1002-2813.2020.03.031 |
| [4] |
钟晨, 姜世光, 王修启, 等. 微生物发酵饲料在畜禽生产中的研究进展[J]. 动物营养学报, 2020, 32(8): 3516-3525. ZHONG C, JIANG S G, WANG X Q, et al. Research progress of microbial fermentation feed in livestock and[J]. Chinese Journal of Animal Nutrition, 2020, 32(8): 3516-3525 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.08.009 |
| [5] |
HOFFMAN P C, ESSER N M, SHAVER R D, et al. Influence of ensiling time and inoculation on alteration of the starch-protein matrix in high-moisture corn[J]. Journal of Dairy Science, 2011, 94(5): 2465-2474. DOI:10.3168/jds.2010-3562 |
| [6] |
KUNG L, J r, WINDLE M C, WALKER N. The effect of an exogenous protease on the fermentation and nutritive value of high-moisture corn[J]. Journal of Dairy Science, 2014, 97(3): 1707-1712. DOI:10.3168/jds.2013-7469 |
| [7] |
SAYLOR B A, CASALE F, SULTANA H, et al. Effect of microbial inoculation and particle size on fermentation profile, aerobic stability, and ruminal in situ starch degradation of high-moisture corn ensiled for a short period[J]. Journal of Dairy Science, 2020, 103(1): 379-395. DOI:10.3168/jds.2019-16831 |
| [8] |
李硕, 陈宝江, 陈祥. 非常规植物性饲料资源固态发酵增值技术研究进展[J]. 饲料研究, 2021, 44(16): 145-147. LI S, CHEN B J, CHEN X. Research progress of solid state fermentation technology on unconventional plant-based feed resources[J]. Feed Research, 2021, 44(16): 145-147 (in Chinese). DOI:10.13557/j.cnki.issn1002-2813.2021.16.033 |
| [9] |
唐堂, 王琪, 周卫强, 等. 固态发酵技术研究分析及应用[J]. 工业微生物, 2020, 50(5): 55-59. TANG T, WANG Q, ZHOU W Q, et al. Research analysis and application of solid-state fermentation technology[J]. Industrial Microbiology, 2020, 50(5): 55-59 (in Chinese). DOI:10.3969/j.issn.1001-6678.2020.05.010 |
| [10] |
宗成, 吴金鑫, 朱九刚, 等. 添加剂对农副产物和小麦秸秆混合青贮发酵品质的影响[J]. 中国农业科学, 2022, 55(5): 1037-1046. ZONG C, WU J X, ZHU J G, et al. Effects of additives on the fermentation quality of agricultural by-products and wheat straw mixed silage[J]. Scientia Agricultura Sinica, 2022, 55(5): 1037-1046 (in Chinese). |
| [11] |
张昊月, 郭正彦, 吕志堂, 等. 应用响应面法优化发酵培养基提高达托霉素产量[J]. 微生物学通报, 2021, 48(1): 113-122. ZHANG H Y, GUO Z Y, LV Z T, et al. Medium optimization with the response surface methodology to improve daptomycin production[J]. Microbiology China, 2021, 48(1): 113-122 (in Chinese). DOI:10.13344/j.microbiol.china.200807 |
| [12] |
AO AC. Official methods of analysis[M]. Arlington: Association of Official Analytical Chemist, 2000.
|
| [13] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [14] |
MCDONALD P, HENDERSON A R. Determination of water-soluble carbohydrates in grass[J]. Journal of the Science of Food and Agriculture, 2010, 15(6): 395-398. |
| [15] |
张霞, 孙海洲, 李胜利, 等. 饲用玉米中醇溶蛋白含量的测定[J]. 中国奶牛, 2014(5): 11-14. ZHANG X, SUN H Z, LI S L, et al. A modified method to quantify prolamin proteins in different kinds of corn grains[J]. China Dairy Cattle, 2014(5): 11-14 (in Chinese). DOI:10.3969/j.issn.1004-4264.2014.05.003 |
| [16] |
AJIBOLA C F, FASHAKINJ B, FAGBEMI T N, et al. Effect of peptide size on antioxidant properties of African yam bean seed (Sphenostylis stenocarpa) protein hydrolysate fractions[J]. International Journal of Molecular Sciences, 2011, 12(10): 6685-6702. DOI:10.3390/ijms12106685 |
| [17] |
CHI H H, CHO S J. Improvement of bioactivity of soybean meal by solid-state fermentation with Bacillus amyloliquefaciens versus Lactobacillus spp. and Saccharomyces cerevisiae[J]. LWT-Food Science and Technology, 2016, 68(619)625. |
| [18] |
MU-FORSTER C, WASSERMAN B P. Surface localization of zein storage proteins in starch granules from maize endosperm proteolytic removal by thermolysin and in vitro cross-linking of granule-associated polypeptides[J]. Plant Physiology, 1998, 116(4): 1563-1571. DOI:10.1104/pp.116.4.1563 |
| [19] |
CORREA C E S, SHAVER R D, PEREIRA M N, et al. Relationship between corn vitreousness and ruminal in situ starch degradability[J]. Journal of Dairy Science, 2002, 85(11): 3008-3012. DOI:10.3168/jds.S0022-0302(02)74386-5 |
| [20] |
CORONA L, OWENS F N, ZINN R A. Impact of corn vitreousness and processing on site and extent of digestion by feedlot cattle[J]. Journal of Animal Science, 2006, 11: 3020. |
| [21] |
LANDRY J, DELHAYE S, DAMERVAL C. Improved method for isolating and quantitating α-amino nitrogen as nonprotein, true protein, salt-soluble proteins, zeins, and true glutelins in maize endosperm[J]. Cereal Chemistry, 2000, 77(5): 620-626. DOI:10.1094/CCHEM.2000.77.5.620 |
| [22] |
YOUNG K M, LIM J M, DER BEDROSIAN M C, et al. Effect of exogenous protease enzymes on the fermentation and nutritive value of corn silage[J]. Journal of Dairy Science, 2012, 95(11): 6687-6694. DOI:10.3168/jds.2012-5628 |
| [23] |
WANG X L, SONG J M, LIU Z H, et al. Fermentation quality and microbial community of corn stover or rice straw silage mixed with soybean curd residue[J]. Animals, 2022, 12(7): 919. DOI:10.3390/ani12070919 |
| [24] |
黄勤楼, 钟珍梅, 黄秀声, 等. 纤维素降解菌的筛选及在狼尾草青贮中使用效果评价[J]. 草业学报, 2016, 25(4): 197-203. HUANG Q L, ZHONG Z M, HUANG X S, et al. Screening of cellulose-degrading bacteria and evaluation of silage performance of pennisetum[J]. Acta Prataculturae Sinica, 2016, 25(4): 197-203 (in Chinese). |
| [25] |
王晓慧, 李玲伊, 韭泽悟, 等. 发酵对于淀粉理化性质及改性作用研究进展[J]. 中国食物与营养, 2013, 19(4): 33-36. WANG X H, LI L Y, JIU Z W, et al. Research progress on the effect of fermentation on physicochemical properties of starch[J]. Food and Nutrition in China, 2013, 19(4): 33-36 (in Chinese). |
| [26] |
YIN D F, YUAN J M, GUO Y M, et al. Effect of storage time on the characteristics of corn and efficiency of its utilization in broiler chickens[J]. Animal Nutrition, 2017, 3(3): 252-257. |
| [27] |
LIU J B, YAN H L, ZHANG Y, et al. Effects of stale maize on growth performance, immunity, intestinal morphology and antioxidant capacity in broilers[J]. Asian-Australasian Journal of Animal Sciences, 2020, 33(4): 605-614. |
| [28] |
李锦英, 陈代文, 郑萍, 等. 饲粮添加陈化玉米和复合抗氧化剂对仔猪生长性能、抗氧化功能及肝脏损伤的影响[J]. 四川农业大学学报, 2019, 37(1): 83-91. LI J Y, CHEN D W, ZHENG P, et al. Effects of aging corn and antioxidant blend supplementation on growth performance, antioxidant capacity and liver injure of weaning piglets[J]. Journal of Sichuan Agricultural University, 2019, 37(1): 83-91 (in Chinese). |
| [29] |
朱正鹏, 王瑜铭, 丁莹, 等. 陈化玉米对肉鸭生长性能、抗氧化功能及免疫器官指数的影响[J]. 中国畜牧杂志, 2018, 54(11): 71-74. ZHU Z P, WANG Y M, DING Y, et al. Effects of aged corn on growth performance, serum antioxidant activity and immune organ indexes of meat ducks[J]. Chinese Journal of Animal Science, 2018, 54(11): 71-74 (in Chinese). |
| [30] |
LIN M Y, YEN C L. Antioxidative ability of lactic acid bacteria[J]. Journal of Agricultural and Food Chemistry, 1999, 47(4): 1460-1466. |
| [31] |
ELLIS J L, BANNINK A, HINDRICHSEN I K, et al. The effect of lactic acid bacteria included as a probiotic or silage inoculant on in vitro rumen digestibility, total gas and methane production[J]. Animal Feed Science and Technology, 2016, 211: 61-74. |
| [32] |
LI F H, DING Z T, CHEN X Z, et al. The effects of Lactobacillus plantarum with feruloyl esterase-producing ability or high antioxidant activity on the fermentation, chemical composition, and antioxidant status of alfalfa silage[J]. Animal Feed Science and Technology, 2021, 273: 114835. |
| [33] |
ZHANG Y X, KE W C, BAI J, et al. The effect of Pediococcus acidilactici J17 with high-antioxidant activity on antioxidant, α-tocopherol, β-carotene, fatty acids, and fermentation profiles of alfalfa silage ensiled at two different dry matter contents[J]. Animal Feed Science and Technology, 2020, 268: 114614. |
| [34] |
许喜林, 周晓莉, 郑柳青, 等. 鼠李糖乳杆菌LR ZB1107-01的体外抗氧化活性[J]. 华南理工大学学报(自然科学版), 2021, 49(3): 88-94. XU X L, ZHOU X L, ZHENG L Q, et al. Antioxidant activity of Lactobacillus rhamnosus LR ZB1107-01 in vitro[J]. Journal of South China University of Technology (Natural Science Edition), 2021, 49(3): 88-94 (in Chinese). |
| [35] |
朱佳文, 徐麒麟, 苏志鹏, 等. 鼠李糖乳杆菌对早期断奶成华黑仔猪生长性能、免疫性能和肠道菌群的影响[J]. 动物营养学报, 2021, 33(9): 5324-5331. ZHU J W, XU Q L, SU Z P, et al. Effects of Lactobacillus rhamnosus on growth performance, immune performance and intestinal microflora of early weaned Chenghua black piglets[J]. Chinese Journal of Animal Nutrition, 2021, 33(9): 5324-5331 (in Chinese). |
| [36] |
陈永芳, 胡荣康, 吴林秀, 等. 益生菌发酵胡萝卜汁活性成分与抗氧化活性研究[J]. 中国酿造, 2018, 37(5): 76-80. CHEN Y F, HU R K, WU L X, et al. Active constituents and antioxidant activity of fermented carrot juice by probiotics[J]. China Brewing, 2018, 37(5): 76-80 (in Chinese). |




