2. 丰宁县农业农村局, 承德 067000;
3. 承德市兽药管理站, 承德 067000
2. Fengning County Agriculture and Rural Affairs Bureau, Chengde 067000, China;
3. Technology and Education Station of Chengde Municipal Bureau of Agriculture and Rural Affairs, Chengde 067000, China
随着我国“饲料全面禁抗”的实施,安全、无耐药性且益生效果好的益生菌成为饲用抗生素的重要替代品。乳酸菌作为肠道中的原籍菌群,参与宿主正常的代谢生理活动,被公认为是益生菌制剂的重要来源。理想的益生菌种往往来源于动物肠道[1-2],例如,来源于兔肠道[3]和牦牛肠道[4]的乳酸片球菌和植物乳植杆菌可有效提高饲料利用率,来源于番鸭肠道[5]的唾液乳杆菌对Caco-2细胞有较高的黏附力。对于羊胃肠道益生菌的分离及应用研究也有相关报道。汤凯等[6]、郝贺等[7]和何江波[8]已从健康成年的山羊胃肠道中分离出植物乳植杆菌、杜氏肠球菌、海氏肠球菌等益生菌。羊的消化道菌群往往随着日龄的增长而发生变化,哺乳期羔羊消化道微生物区系不健全,随着日龄的增长,微生物种类与数量逐渐增加,成年后微生物区系趋于稳定[9]。徐凤等[10]从不同日龄的山羊瘤胃和回肠中分离出不同种类的菌株,在2月龄瘤胃和回肠中分离的菌种分别为巴黎链球菌和屎肠球菌,而在8月龄瘤胃中分离的菌种增加了耐久肠球菌和弯曲乳杆菌,在回肠中分离出了肠膜明串珠菌;随着年龄的增长,2岁山羊瘤胃中分离出的菌种又增加了戊糖片球菌、海氏肠球菌和鹑鸡肠球菌,回肠中增加了粪肠球菌。
随着肉羊产业的快速发展,高强度育肥引起的肠道健康问题已逐渐暴露,饲料利用率降低也是肉羊育肥期普遍存在的问题,有针对性的筛选并开发饲用益生菌尤为重要。目前从育肥后期绵羊的瘤胃和肠道同时分离乳酸菌并进行比较分析的报道很少。本研究采用常规细菌分离筛选和鉴定技术,结合16S rRNA基因测序技术,拟从育肥期绵羊瘤胃和不同肠段内容物中分离、筛选并鉴定以获取安全、可抑制大肠杆菌和金黄色葡萄球菌、药敏性较广泛且耐受胃肠液的羊源乳酸菌菌株,以期为饲用益生菌的开发提供基础。
1 材料与方法 1.1 试验材料 1.1.1 样品采集选择10~14只8月龄的健康育肥羊[体重(60±5) kg],采集瘤胃和不同肠段(空肠、回肠、盲肠、结肠和直肠)的内容物放入灭菌管,密封,利用冰盒带回实验室进行后续操作。
1.1.2 培养基及主要试剂MRS肉汤培养基、MRS固体培养基、CaCO3-MRS固体培养基、营养琼脂培养基、营养肉汤培养基、革兰氏染色试剂盒,青岛海博生物有限公司;脱纤维羊血;北京索莱宝科技有限公司;药敏纸片,常德比克曼生物科技有限公司;羊胆盐、胃蛋白酶和胰蛋白酶,北京博奥拓达科技有限公司。
模拟人工胃液[11]:3.1 g/L NaCl,1.1 g/L KCl,0.15 g/L CaCl2·2H2O,0.6 g/L NaHCO3,调节pH为3.0,在超净台内加入胃蛋白酶10 g/L。
模拟人工肠液[11]:称取6.8 g KH2PO4溶解于500 mL水中,用NaOH调节混合液的pH至6.8,在超净台内加入胰蛋白酶10 g/L。
1.1.3 供试菌株用于抑菌试验的大肠杆菌(K88)和金黄色葡萄球菌(ATCC6538)购自中国农业微生物菌种保藏管理中心(ACCC)。
1.2 试验方法 1.2.1 乳酸菌分离纯化取消化道内容物1 g,稀释后恒温振荡1~2 h,静置。选择10-5、10-6、10-7 3个稀释度的菌液各吸取50 μL均匀涂布于CaCO3-MRS固体培养基平板,每个稀释度2个平行,37 ℃倒置培养24 h,观察并记录菌落形态特征,选取有透明圈的单菌落划线接种于MRS固体培养基中纯化,重复纯化,直至获取纯化菌落。
1.2.2 乳酸菌初筛乳酸菌初筛采用过氧化氢酶试验和产硫化氢试验。挑取分离纯化后的单菌落置于载玻片上,滴加1~2滴3%过氧化氢,静置0.5 min,筛选不产气泡的细菌(阴性),用接种针穿刺接种于硫酸亚铁培养基中,37 ℃培养24~48 h后,筛选接种针通过处未出现黑色的细菌(阴性)。
1.2.3 乳酸菌复筛将初筛后的菌落再次纯化划线,挑取单菌落接种于MRS液体培养基中,37 ℃培养24~48 h后进行溶血试验,使用移液枪点种于血琼脂培养基上,每种菌在同一个平板上点种3次,然后37 ℃恒温培养24~48 h后观察,筛选出无溶血现象的安全菌株。
1.2.4 乳酸菌形态学鉴定采用革兰氏染色法进行形态学鉴定。挑取生长良好的复筛菌落,进行革兰染色,然后镜检,观察菌体形态。
1.2.5 乳酸菌生化鉴定对分离菌株按细菌微量生化鉴定管使用说明书进行糖(醇)类发酵试验、甲基红试验、吲哚试验、明胶液化试验等各项生化鉴定,并记录试验结果。
1.2.6 16S rRNA基因序列的测定提取菌液DNA,以通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′TACGGYTACCTGTTACGACTT-3′)进行PCR扩增,扩增体系为25 μL,包括:上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,DNA模板(稀释20倍)1 μL,ddH2O 22 μL。PCR反应程序为:95 ℃预变性1 min;95 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35次循环,最后72 ℃延伸7 min。将PCR扩增产物进行电泳检测,回收的PCR产物送至北京志超伟业生物技术有限公司进行16S rRNA测序鉴定,测序结果通过NCBI中的BLAST进行同源性分析。
1.2.7 抑菌试验将鉴定的菌株接种于MRS液体培养基中,37 ℃恒温摇床培养24 h,测定发酵液的吸光度(OD)值。将2种典型致病菌(金黄色葡萄球菌和大肠杆菌)的浓度控制于106~107 CFU,采用稀释涂布平板法,将病原菌液均匀涂布于营养琼脂培养基中,并在平板上均匀打孔(φ 0.6 cm),每孔加入100 μL乳酸菌悬液,置于37 ℃恒温培养24~48 h,测量并记录抑菌圈直径。
1.2.8 药敏试验采用药敏纸片琼脂扩散法(K-B法),将乳酸菌液均匀涂布至MRS琼脂培养基中,按照梅花状放置药敏纸片,37 ℃倒置培养24 h,测量并记录抑菌圈直径。10种抗生素的种类及含量如表 1所示,试验菌株对10种抗生素的药敏性参照NCCLS[12]对肠球菌的耐药性判定标准和Charteris[13]对植物乳植杆菌的耐药性判定标准。
|
|
表 1 10种抗生素的种类、含量及判定标准 Table 1 Types, contents and judgment standard of 10 kinds of antibiotics |
在人工胃液耐受试验中,将乳酸菌菌液以2%的接种量接种到人工胃液和对照培养基(MRS液体)中,37 ℃培养3 h后进行倍比稀释,选择10-6和10-7 2个稀释度,吸取100 μL液体涂布平板,培养24~48 h后计数活菌数。
在人工肠液耐受试验中,将乳酸菌菌液以2%的接种量接种到人工肠液和对照培养基(MRS液体)中,其余步骤同人工胃液耐受试验。
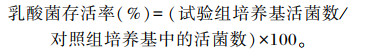
|
将乳酸菌菌液按2%的接种量接种于MRS液体培养基中,37 ℃、220 r/min条件下培养,每隔2 h测定菌液吸光度(OD)600 nm值,绘制生长曲线。
1.3 数据处理与统计分析用SPSS 20.0和GraphPad Prism软件对试验数据进行统计分析和图表绘制,以P < 0.05表示差异显著,P < 0.01表示差异极显著,P>0.05表示差异不显著。
2 结果与分析 2.1 乳酸菌的分离结果利用CaCO3-MRS固体培养基分离纯化的部分菌株菌落特征如图 1所示。菌落周围产生了明显的溶钙圈(图 1-A),说明该菌株具产酸能力,从不同胃肠道共分离获取产酸的菌株22株,平板观察菌株形态均为乳白色,边缘整齐,表面光滑,不透明。
|
图 1 产酸菌株的形态 Fig. 1 Morphology of acid-generating bacteria |
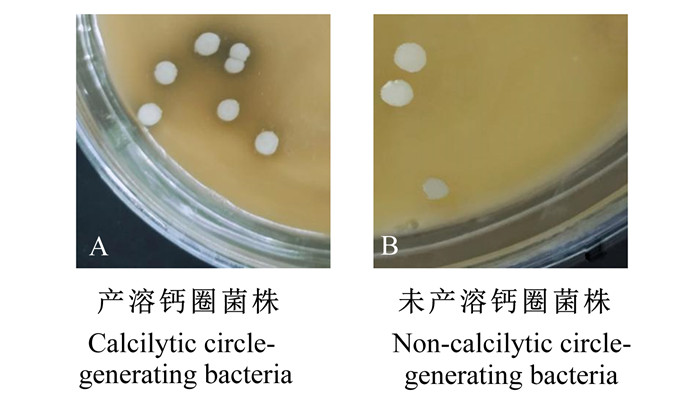
通过过氧化氢酶和产硫化氢试验结果获取18株阴性的菌株,再通过溶血试验复筛获取12株安全菌株,其中空肠4株(K1、K2、K3、K4)、回肠6株(H1、H2、H3、H4、H5、H6)、直肠1株(Z1)和瘤胃1株(L1),菌株溶血试验结果如图 2所示,其中,图 2-A中的菌株产生明显的透明圈,具溶血性,图 2-B中的菌株无溶血现象,为安全菌株。
|
图 2 菌株溶血试验结果 Fig. 2 Hemolysis test results of bacteria |
对12株安全菌株进行革兰氏染色观察,菌株镜检结果如图 3所示。12株安全菌株染色后镜检颜色均为蓝紫色,形态为球状,均为革兰氏阳性菌。

|
图 3 安全菌株的革兰氏染色结果 Fig. 3 Gram stain results of safe strains (1 000×) |
本试验分离出的12株安全菌株均可发酵葡萄糖、蔗糖、乳糖、麦芽糖等多种糖类,也可发酵甘露醇和山梨醇,且精氨酸双水解酶、胆汁七叶苷试验和甲基红试验均为阳性,而接触酶试验均为阴性。根据形态学观察以及生化试验试剂盒判定标准,初步判定本试验分离出的菌株均为肠球菌。
|
|
表 2 12株安全菌株的生化鉴定结果 Table 2 Biochemical identification results of 12 safe strains |
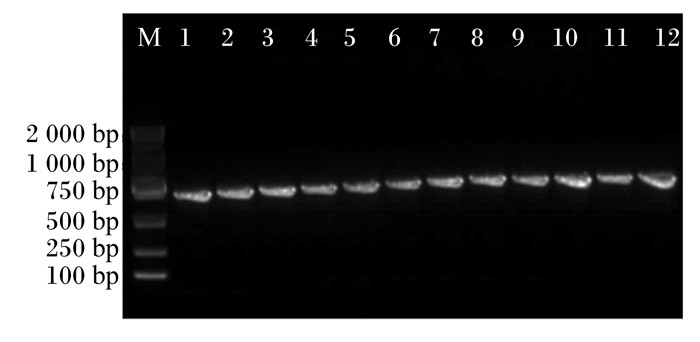
分别提取上述12株疑似肠球菌的DNA,16S rRNA扩增后获取的片段均在1 500 bp处出现无拖尾的单一条带(图 4),符合测序要求,将PCR产物测序结果进行BLAST序列比对(NCBI网站),确定上述的12株菌株为肠球菌属的海氏肠球菌(表 3)。
|
M:DL2000DNA标记物;1~12依次是菌株K1、K2、K3、K4、H1、H2、H3、H4、H5、H6、Z1、L1的PCR扩增产物。 M: DL2000DNA marker; 1 to 12 are the PCR amplification products of strains K1, K2, K3, K4, H1, H2, H3, H4, H5, H6, Z1 and L1 in sequence. 图 4 12株安全菌株的PCR扩增产物 Fig. 4 PCR amplification products of 12 safe strains |
|
|
表 3 12株安全菌株的16S rRNA序列相似性比对 Table 3 16S rRNA sequence similarity comparison of 12 safe strains |
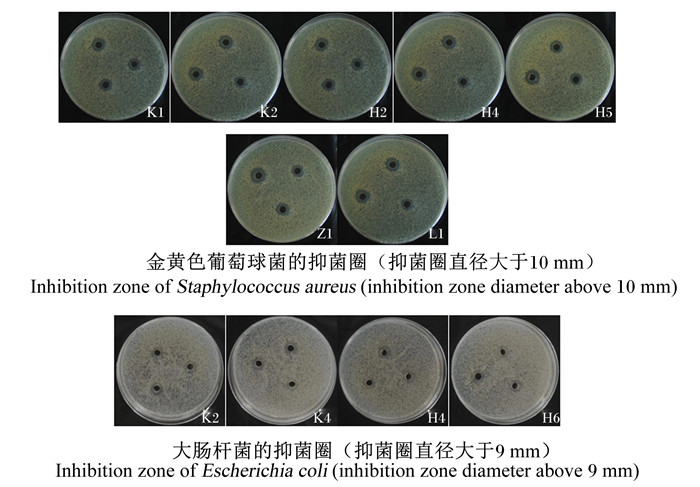
海氏肠球菌对金黄色葡萄球菌和大肠杆菌的抑制能力(抑菌圈直径)如表 4所示。上述12株海氏肠球菌对2种典型致病菌具不同程度的抑制性。12株海氏肠球菌对金黄色葡萄球菌的抑菌圈直径为7.30 ~12.30 mm(平均为9.90 mm),以从空肠分离出的K2菌株的抑菌圈直径最大,达(12.30±0.07) mm,显著或极显著高于K1、K3、K4、H1、H3、H4、H5和H6菌株(P < 0.05或P < 0.01)。12株海氏肠球菌对大肠杆菌的抑菌圈直径为6.90~9.47 mm(平均为8.43 mm),以来自空肠的K2和K4菌株的抑菌圈直径较大,分别为(9.43±0.04) mm和(9.47±0.10) mm,均显著高于K3、H2和Z1菌株(P < 0.05)。从表 4还可看出,12株海氏肠球菌对金黄色葡萄球菌的抑菌圈直径大于大肠杆菌,说明这些菌株对金黄色葡萄球菌的抑制效果好于大肠杆菌。部分菌株对2种致病菌的抑菌效果如图 5所示。
|
|
表 4 海氏肠球菌对致病菌的抑菌圈直径 Table 4 Inhibition zone diameter of Enterococcus hirae against pathogenic bacteria |
|
图 5 部分海氏肠球菌对金黄色葡萄球菌和大肠杆菌的抑制效果 Fig. 5 Inhibitory effect of some Enterococcus hirae on Staphylococcus aureus and Escherichia coli |
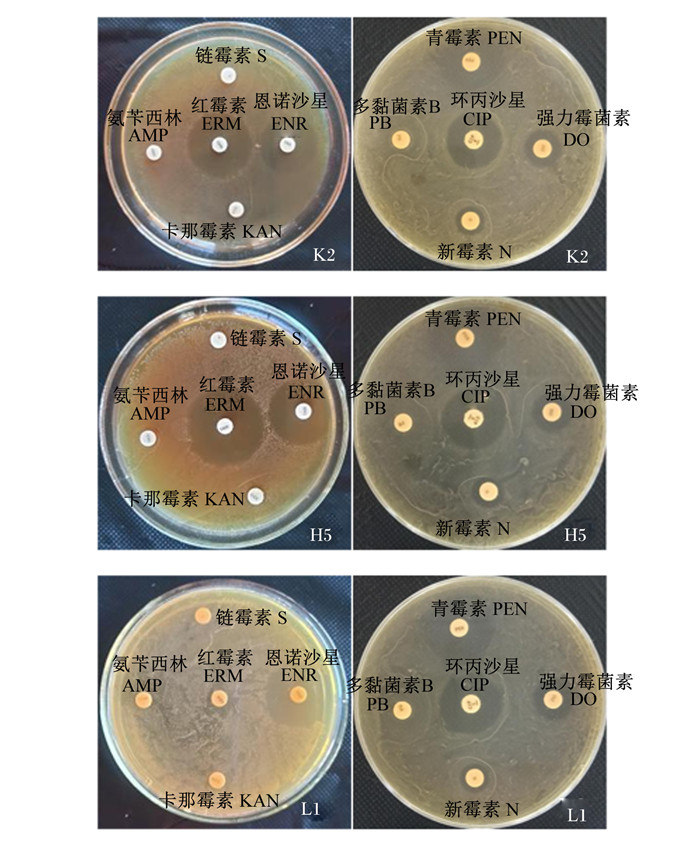
海氏肠球菌对抗生素敏感性结果如表 5所示。本试验分离出的12株海氏肠球菌中,除了从瘤胃中分离出的L1菌株,其余11株菌株对5种抗生素(红霉素、恩诺沙星、青霉素、强力霉菌素和环丙沙星)均具敏感性,其中对红霉素呈高度敏感性,对强力霉菌素呈中度敏感性。另外,K2和H5菌株对新霉素也具一定的敏感性,而L1菌株只对4种抗生素(恩诺沙星、青霉素、环丙沙星、强力霉菌素)具敏感性。部分菌株对抗生素的敏感性如图 6所示。
|
|
表 5 海氏肠球菌对抗生素的抑菌圈直径 Table 5 Inhibition zone diameter of antibiotics against Enterococcus haire |
|
图 6 部分海氏肠球菌对抗生素的敏感性 Fig. 6 Sensitivity of some Enterococcus hirae to antibiotics |
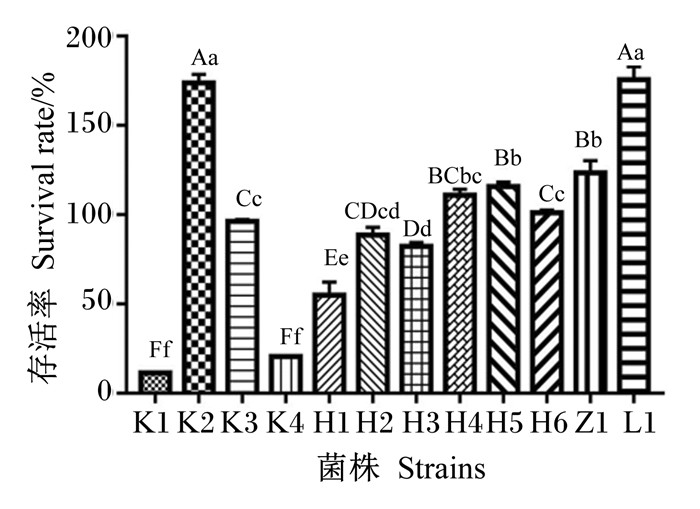
12株海氏肠球菌在人工胃液中的存活率如图 7所示,存活率排序为:L1>K2>Z1>H5>H4>H6> K3>H2>H3>H1>K4>K1。将其存活率分为高、中、低3个水平,从瘤胃中分离出的L1菌株和从空肠中分离出的K2菌株存活率较高,分别达175.6%和173.7%,极显著高于其他株菌(P < 0.01);中等存活率菌株为K3、H2、H3、H4、H5、H6和Z1菌株,存活率处于82.3%~123.5%,极显著高于3株低存活率菌株(K1、K4和H1)(P < 0.01),其中K1和K4存活率未超过50%。
|
数据柱标注不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同小写字母表示差异不显著(P>0.05)。下图同。 Date columns with different small letters mean significant difference (P < 0.05), and with different capital letters mean significant difference (P<0.01), while with the same small letters mean no significant difference (P > 0.05). The same as below. 图 7 12株海氏肠球菌在人工胃液中的存活率 Fig. 7 Survival rate of 12 strains of Enterococcus hirae in artificial gastric juice |
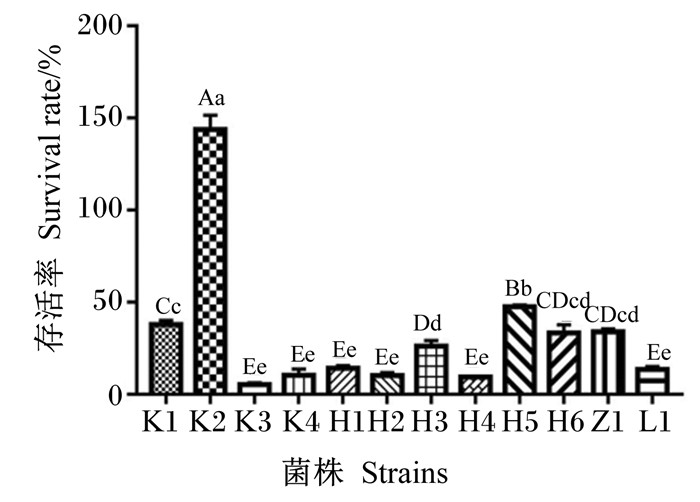
12株海氏肠球菌在人工肠液中的存活率如图 8所示,存活率排序为:K2>H5>K1>Z1>H6>H3>H1>L1>K4>H2>H4>K3。从空肠中分离出的K2菌株存活率最高,高达143.68%,极显著高于其他11株菌株(P < 0.01);K1、H3、H5、H6和Z1菌株存活率处于26.25%~47.62%,极显著高于6株低存活率菌株(H1、H2、H4、K3、K4和L1)(P < 0.01),6株低存活率菌株的存活率范围仅为5.26%~14.17%,其中以从空肠中分离出的K3菌株存活率最低,仅为5.26%。
|
图 8 12株海氏肠球菌在人工肠液中的存活率 Fig. 8 Survival rate of 12 strains of Enterococcus hirae in artificial intestinal fluid |
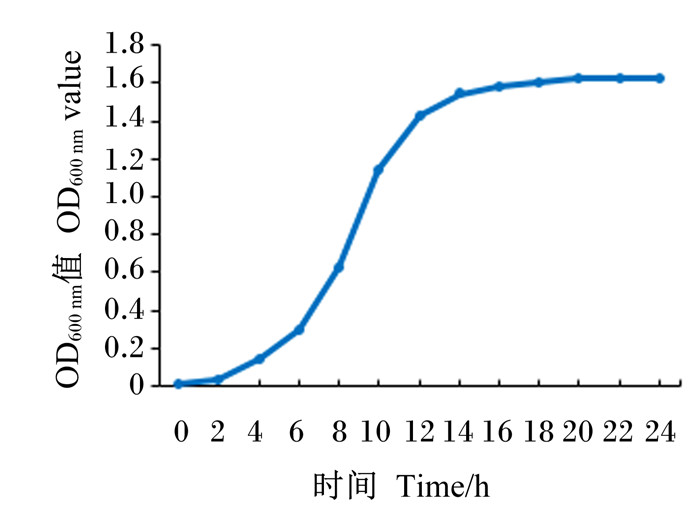
12株海氏肠球菌的生长对数期均为2~14 h,生长2 h后繁殖速度最快,14 h后进入生长平缓期。其中抑菌效果最强、抗生素敏感性相对另外11株菌株较广泛且在胃肠液中存活率较高的K2菌株的生长曲线如图 9所示。
|
图 9 K2菌株的生长曲线 Fig. 9 Growth curve of K2 strain |
优良的菌种是益生菌生产的先决条件,乳酸菌是重要的益生菌来源。据报道,有些乳酸菌来源于自然环境,如葡萄枝叶、高原燕麦和谷物,但由于体内外的环境差异,这些外环境来源的益生菌在内环境中并不能表现出令人满意的效果[14-15]。也有学者认为,理想的益生菌种常来源于动物肠道,寄主与肠道微生物长期相互适应和选择,使对某类动物适用的微生态制剂可能对另一类动物不产生效果[16-18]。本试验从育肥后期绵羊的不同肠段和瘤胃中分离获取益生效果好的乳酸菌,可为饲用益生菌的开发提供借鉴,但仍需后续的生产试验验证。
本试验通过16S rRNA同源性分析,从育肥绵羊消化道中分离鉴定出12株乳酸菌,该菌株与海氏肠球菌参考菌株MT473361.1、LC119115.1、MT457687.1等基因相似性达99%以上,说明分离菌株为海氏肠球菌,属于乳酸菌中的肠球菌属,是动物胃肠道的正常菌群[19]。近几年来,关于海氏肠球菌的报道国外多集中于细菌素的研究[19-21],细菌素可抑制有害菌繁殖,改善肠道环境,提高动物的消化机能。
国内研究多集中于该菌的发酵特性和抗衰老、降解吲哚等功能[22-25]。目前关于海氏肠球菌益生作用的研究已有文献报道。张旭等[26]从野鸟中筛选出1株对多种常用抗生素敏感且具耐受性的海氏肠球菌;王佳慧等[27]从牛粪中筛选出2株具抑菌特性的海氏肠球菌;石磊等[28]从牦牛粪便中分离出1株具抗腹泻功能的海氏肠球菌。也有研究认为,虽然多数肠球菌可能会引起尿路、腹腔和盆腔感染[29],但海氏肠球菌在肠球菌感染病例中仅占0.40%~3.03%[30],为感染率最低的一种肠球菌,现已被国家微生物资源平台收录并定义为潜在益生菌。张浩[31]曾从生长期羔羊消化道分离出2株乳酸菌,分别为植物乳植杆菌和乳酸乳球菌,而本试验从育肥后期绵羊消化道分离出的乳酸菌为海氏肠球菌,虽然不同试验筛出的细菌种类不同,但均来自绵羊消化道主要优势菌门的厚壁菌门。Zhang等[32]研究表明,绵羊肠道中乳酸菌的动态分布明显,空肠、回肠定植的菌群较为丰富。本试验也证明,分离的12株乳酸菌中4株来自空肠,6株来自回肠。由于益生菌的功能具有菌株特异性,且效果受多种因素的影响,本试验筛选的12株海氏肠球菌益生效果各不相同。贺曦等[33]研究认为,从成年藏羊肠道中分离出的海氏肠球菌对红霉素、恩诺沙星、青霉素等多种抗生素敏感,对新霉素不敏感,而本研究中源自空肠的K2菌株具有较广泛的抗生素敏感性,对红霉素、恩诺沙星、青霉素、强力霉菌素、环丙沙星和新霉素均具一定的敏感性,耐药性弱,可降低耐药基因传播风险。另外,海氏肠球菌能抑制多种致病菌。Arokiyaraj等[34]从水牛瘤胃分离出的海氏肠球菌能抑制铜绿假单胞菌、大肠杆菌、沙门氏杆菌等多种胃肠道常见致病菌。来源于面糊[20]和贻贝[35]的海氏肠球菌可通过产生细菌素对致病菌产生较高的抑制能力。本试验中,从育肥后期绵羊空肠内容物中分离出的K2菌株对金黄色葡萄球菌和大肠杆菌的抑菌圈直径分别达12.30和9.47 mm,且对金黄色葡萄球菌的抑制效果最佳,这与贺曦等[33]从成年羊肠道中筛选出乳酸菌的抑菌效果一致。而张浩[28]从羔羊肠道筛选的乳酸菌对大肠杆菌的抑菌效果较好,对金黄色葡萄球菌的抑菌效果不佳,这说明不同生理阶段绵羊消化道分离的益生菌益生效果不同。本试验中分离出的K2菌株在人工肠液和人工胃液中均具较高的存活率,这与Arokiyaraj等[34]和朱惠[36]的研究结果基本一致,说明该菌株具备在宿主肠道定植的基本条件。此外,从瘤胃中分离出的L1菌株耐受人工胃液的效果较好,存活率达到了175.61%,可能是因为L1菌株来源于瘤胃液,所以能在人工胃液中较好的存活。由此可见,本试验从育肥后期绵羊的消化道筛选出的海氏肠球菌相对哺乳期或生长前期可能具有一定的优势,作为饲用益生菌具有较大的潜力,但仍需进一步研究。在我们后续的研究中将明确其是否含有毒力因子,并通过小鼠试验开展该类菌株的体内安全性探究,为益生菌的开发提供借鉴。
4 结论本试验从育肥期绵羊胃肠道中筛选出12株安全、抑菌能力强、具有一定抗生素敏感性且能耐受胃肠液的海氏肠球菌,尤其是来源于空肠的K2菌株,对大肠杆菌和金黄色葡萄球菌的抑制效果最强,对70%的抗生素敏感以及在胃肠液中存活率最高,其益生效果最佳,可为饲用益生菌剂的开发提供参考菌种。
| [1] |
BARBOSA T M, SERRA C R, LA RAGIONE R M, et al. Screening for Bacillus isolates in the broiler gastrointestinal tract[J]. Applied and Environmental Microbiology, 2005, 71(2): 968-978. DOI:10.1128/AEM.71.2.968-978.2005 |
| [2] |
SALZMAN N H, DE JONG H, PATERSON Y, et al. Analysis of 16S libraries of mouse gastrointestinal microflora reveals a large new group of mouse intestinal bacteria[J]. Microbiology, 2002, 148(Pt 11): 3651-3660. |
| [3] |
夏雪茹. 兔源乳酸菌的筛选及其益生潜能评价[D]. 硕士学位论文. 保定: 河北农业大学, 2021. XIA X R. Screening of rabbit-derived lactic acid bacteria and evaluation of its probiotic potential[D]. Master's Thesis. Baoding: Hebei Agricultural University, 2021. (in Chinese) |
| [4] |
王银梦, 夏洪泽, 张晓涵, 等. 牦牛犊牛肠源益生性抑菌乳酸菌的筛选与鉴定[J]. 饲料研究, 2020, 43(12): 92-95. WANG Y M, XIA H Z, ZHANG X H, et al. Isolation and screening of probiotic lactic acid bacteria from the intestine of yak calves[J]. Feed Research, 2020, 43(12): 92-95 (in Chinese). DOI:10.13557/j.cnki.issn1002-2813.2020.12.024 |
| [5] |
谢璐娜. 番鸭肠道乳酸菌筛选鉴定、抑菌作用及对Caco-2细胞粘附的影响[D]. 硕士学位论文. 福州: 福建农林大学, 2015. XIE L N. Study on screening, identification, bacteriostatic efficiency and effects on Caco-2 cell adhesion of Lactobacillus from muscovy duck intestine[D]. Master's Thesis. Fuzhou: Fujian Agriculture and Forestry University, 2015. (in Chinese) |
| [6] |
汤凯, 杨劲松, 杨天澍, 等. 海南黑山羊肠道源乳酸菌的分离鉴定与生物学特性分析[J]. 中国酿造, 2021, 40(11): 149-153. TANG K, YANG J S, YANG T S, et al. Isolation, identification and biological characteristics of lactic acid bacteria from Hainan black goat intestinal tract[J]. China Brewing, 2021, 40(11): 149-153 (in Chinese). DOI:10.11882/j.issn.0254-5071.2021.11.027 |
| [7] |
郝贺, 朱原, 阿合玛尔列·海依拉提, 等. 羊瘤胃乳酸菌的分离鉴定及抗逆性筛选[J]. 中国草食动物科学, 2021, 41(2): 44-48, 54. HAO H, ZHU Y, HAIYILATI A, et al. Isolation, identification and stress resistance screening of rumen lactic acid bacteria in goat[J]. China Herbivore Science, 2021, 41(2): 44-48, 54 (in Chinese). DOI:10.3969/j.issn.2095-3887.2021.02.009 |
| [8] |
何江波. 羊瘤胃源乳酸菌的分离筛选及其菌剂制备方法研究[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2021. HE J B. Isolation and screening of lactic acid bacteria from rumen and study on the preparation method of bacteria agent[D]. Master's Thesis. Yangling: Northwest A & F University, 2021. (in Chinese) |
| [9] |
宗学阳, 张华文, 史怀平. 羔羊消化生理及消化道微生物研究进展[J]. 畜牧与兽医, 2022, 54(4): 124-129. ZONG X Y, ZHANG H W, SHI H P. Advance in research on digestive physiology and gastrointestinal microflora of lambs[J]. Animal Husbandry & Veterinary Medicine, 2022, 54(4): 124-129 (in Chinese). |
| [10] |
徐凤, 张焕容, 张兴民, 等. 不同年龄山羊胃肠道乳酸菌的分离鉴定[J]. 黑龙江畜牧兽医, 2017(5): 108-110. XU F, ZHANG H R, ZHANG X M, et al. Isolation and isolation of lactic acid bacteria in the gastrointestinal tracts of goats at different ages[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(5): 108-110 (in Chinese). |
| [11] |
韩佳临. 种猪肠道微生物分析、益生菌筛选及发酵豆粕的初步研究[D]. 硕士学位论文. 南宁: 广西大学, 2020. HAN J L. Preliminary study on the analysis of intestinal microbes in breeding pigs, screening of probiotics and fermented soybean meal[D]. Master's Thesis. Nanning: Guangxi University, 2020. |
| [12] |
NCCLS. Performance standards for antimicrobial susceptibility testing[J]. Twelfth Informational Supplement, 2002, 22(1): 48-49. |
| [13] |
CHARTERIS W P, KELLY P M, MORELLI L, et al. Antibiotic susceptibility of potentially probiotic Lactobacillus species[J]. Journal of food protection, 1998, 61(12): 1636-1643. DOI:10.4315/0362-028X-61.12.1636 |
| [14] |
蔺豆豆, 琚泽亮, 柴继宽, 等. 青藏高原燕麦附着耐低温乳酸菌的筛选与鉴定[J]. 草业学报, 2022, 31(5): 103-114. LIN D D, JU Z L, CHAI J K, et al. Screening and identification of low temperature tolerant lactic acid bacterial epiphytes from oats on the Qinghai-Tibetan Plateau[J]. Acta Prataculturae Sinica, 2022, 31(5): 103-114 (in Chinese). |
| [15] |
丁宁, 陆兆新, 别小妹, 等. 谷物中具有抑制霉菌活性乳酸菌的分离筛选及鉴定[J]. 南京农业大学学报, 2021, 44(6): 1187-1196. DING N, LU Z X, BIE X M, et al. Isolation and identification of antifungal lactic acid bacteria from different grains[J]. Journal of Nanjing Agricultural University, 2021, 44(6): 1187-1196 (in Chinese). |
| [16] |
GUO X H, KIM J M, NAM H M, et al. Screening lactic acid bacteria from swine origins for multistrain probiotics based on in vitro functional properties[J]. Anaerobe, 2010, 16(4): 321-326. |
| [17] |
GUO X H, LI D F, LU W Q, et al. Screening of Bacillus strains as potential probiotics and subsequent confirmation of the in vivo effectiveness of Bacillus subtilis MA139 in pigs[J]. Antonie Van Leeuwenhoek, 2006, 90(2): 139-146. |
| [18] |
MISHRA V, PRASAD D N. Application of in vitro methods for selection of Lactobacillus casei strains as potential probiotics[J]. International Journal of Food Microbiology, 2005, 103(1): 109-115. |
| [19] |
NESS I F, DIEP D B, IKE Y. Enterococcal bacteriocins and antimicrobial proteins that contribute to niche control[M]//GILMORE M S, CLEWELL D B, IKE Y, et al. Enterococci: from commensals to leading causes of drug resistant infection. Boston: Massachusetts Eye and Ear Infirmary, 2014.
|
| [20] |
GUPTA A, TIWARI S K. Probiotic potential of bacteriocin-producing Enterococcus hirae strain LD3 isolated from dosa batter[J]. Annals of Microbiology, 2015, 65(4): 2333-2342. |
| [21] |
BIRRI D J, BREDE D A, FORBERG T, et al. Molecular and genetic characterization of a novel bacteriocin locus in Enterococcus avium isolates from infants[J]. Applied and Environmental Microbiology, 2010, 76(2): 483-492. |
| [22] |
余琴, 马现永, 邓盾, 等. 海氏肠球菌IDO5对猪粪废水中吲哚降解条件优化及降解途径分析[J]. 生物技术通报, 2021, 37(12): 113-123. YU Q, MA X Y, DENG D, et al. Optimization of indole-degrading conditions in pig manure waste water by Enteroccus hirae IDO5 and analysis of its corresponding degradation pathway[J]. Biotechnology Bulletin, 2021, 37(12): 113-123 (in Chinese). |
| [23] |
董翎逸, 刘正奇, 裘梁, 等. 屎肠球菌WEFA23和海氏肠球菌WEHI01发酵荷叶上清的抑菌及抗氧化评价[J]. 南昌大学学报(理科版), 2018, 42(4): 375-381. DONG L Y, LIU Z Q, QIU L, et al. Antibacterial and antioxidant evaluation of supernatant of the fermented lotus leaf by Enterococcus faecium WEFA23 and Enterococcus hirae WHEHI01[J]. Journal of Nanchang University (Natural Science), 2018, 42(4): 375-381 (in Chinese). |
| [24] |
周文文, 高慧, 孙亚芳, 等. 海氏肠球菌的特殊功能——解酒和抗衰老[C]//2017中国食品科学技术学会第十四届年会暨第九届中美食品业高层论坛论文摘要集. 无锡: 中国食品科学技术学会, 2017: 346-347. ZHOU W W, GAO H, SUN Y F, et al. The special function of Enterococcus hirae-hangover and anti-aging[C]//2017 The 14th Annual Conference of China Food Science and Technology Society and the 9th China-Us Food Industry High-Level Forum Paper Abstract Collection. Wuxi: Chinese Institute of Food Science and Technology, 2017: 346-347. (in Chinese) |
| [25] |
胡颖, 杨琴, 甘盛力, 等. 海氏肠球菌(Enterococcus hirae)发酵特性及应用[J]. 乳业科学与技术, 2012, 35(1): 15-19. HU Y, YANG Q, GAN S L, et al. Fermentation characteristics of Enterococcus hirae and application in yogurt starter[J]. Journal of Dairy Science and Technology, 2012, 35(1): 15-19 (in Chinese). |
| [26] |
张旭, 李祥, 曾祥伟. 一株雀形目野鸟源海氏肠球菌的分离、鉴定[J]. 黑龙江畜牧兽医, 2015(18): 170-172. ZHANG X, LI X, ZENG X W. Isolation and identification of a strain of Enterococcus hirae from wild birds[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(18): 170-172 (in Chinese). |
| [27] |
王佳慧, 李禤, 贾丹, 等. 牛源性益生菌的分离鉴定及抑菌性研究[C]//第十三届(2018)中国牛业发展大会论文集. 晋中: 中国畜牧业协会, 2018: 225-232. WANG J H, LI X, JIA D, et al. Isolation, identification and antibacterial activity of bovine probiotics[C]//Proceedings of the 13th (2018) China Cattle Industry Development Conference. Jinzhong: China Animal Agriculture Association, 2018: 225-232. (in Chinese) |
| [28] |
石磊, 李禤, 李有全, 等. 牦牛粪便中乳酸菌的分离与鉴定[J]. 中国兽医杂志, 2019, 55(8): 21-23, 130. SHI L, LI X, LI Y Q, et al. Isolation and identification of Lactobacillus from yak dung in Gonghe county, Qinghai province[J]. Chinese Journal of Veterinary Medicine, 2019, 55(8): 21-23, 130 (in Chinese). |
| [29] |
CHIU C C, LIN T C, WU R X, et al. Etiologies of community-onset urinary tract infections requiring hospitalization and antimicrobial susceptibilities of causative microorganisms[J]. Journal of Microbiology, Immunology, and Infection, 2017, 50(6): 879-885. |
| [30] |
张芬. 婴儿源肠球菌的安全性评价及其体内外降胆固醇的益生功能和机制探究[D]. 硕士学位论文. 南昌: 南昌大学, 2017. ZHANG F. Safety evaluation of enterococci from healthy Chinese infants as well as their cholesterol-lowering effect in vitro and in vivo[D]. Master's Thesis. Nanchang: Nanchang University, 2017. (in Chinese) |
| [31] |
张浩. 年龄和腹泻因素对波尔山羊肠道菌群的影响及肠道益生菌的筛选[D]. 硕士学位论文. 泰安: 山东农业大学, 2018. ZHANG H. Effects of age and diarrhea on intestinal flora of Boer goats and screening of intestinal probiotics[D]. Master's Thesis. Tai'an: Shandong Agricultural University, 2018. (in Chinese) |
| [32] |
ZHANG H, SHAO M X, HUANG H, et al. The dynamic distribution of small-tail Han sheep microbiota across different intestinal segments[J]. Frontiers in Microbiology, 2018, 9: 32. |
| [33] |
贺曦, 徐淑琴, 马祥兆, 等. 藏羊源肠道海氏肠球菌的分离鉴定及益生特性研究[J]. 黑龙江畜牧兽医, 2021(22): 63-68, 150. HE X, XU S Q, MA X Z, et al. Isolation and identification of Enterococcus hirae from intestine of Tibetan sheep and its probiotic properties[J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(22): 63-68, 150 (in Chinese). |
| [34] |
AROKIYARAJ S, HAIRUL ISLAM V I, BHARANIDHARAN R, et al. Antibacterial, anti-inflammatory and probiotic potential of Enterococcus hirae isolated from the rumen of Bos primigenius[J]. World Journal of Microbiology and Biotechnology, 2014, 30(7): 2111-2118. |
| [35] |
VALLEJO M, PARADA R B, MARGUET E R. Aislamiento de cepas de Enterococcus hirae productoras de enterocinas a partir del contenido intestinal de mejillón patagónico (Mytilus edulis platensis)[J]. Revista Argentina de Microbiología, 2020, 52(2): 136-144. |
| [36] |
朱惠. 牦牛源海氏肠球菌Swun3株对小鼠生长性能和肠黏膜免疫的影响[D]. 硕士学位论文. 成都: 西南民族大学, 2016. ZHU H. Effect of Enterococcus hirae Swun3 isolated from yak on the growth performance and intestinal mucosal immunity in mice[D]. Master's Thesis. Chengdu: Southwest Minzu University, 2016. (in Chinese) |




