2. 江苏农林职业技术学院畜牧兽医学院, 句容 212400;
3. 山东沃奇乡村振兴产业发展有限公司, 潍坊 262100;
4. 青岛农业大学科技处, 青岛 266109
2. Institute of Animal Husbandry and Veterinary Medicine, Jiangsu Vocational College of Agriculture and Forestry, Jurong 212400, China;
3. Shandong Woqi Rural Revitalization Industry Development Co., Ltd., Weifang 262100, China;
4. Science and Technology Office, Qingdao Agricultural University, Qingdao 266109, China
苜蓿是家兔的理想饲料,但其资源有限,价格较高,只能满足50%的国内需求,且依赖进口苜蓿[1-2]。随着我国养兔业逐步向规模化方向发展,优质饲料资源短缺和价格过高已成为一个新的问题。我国木本植物饲料资源丰富,开发利用潜力很大。近年来,开发使用非传统饲料原料(如叶粉)来代替相对昂贵的传统饲料喂养动物,具有重要意义[2-3]。
文冠果树属无患子科,是我国珍贵的经济作物。文冠果既是健康的食材,又是传统的民间中药,能治疗多种疾病,如动脉硬化、高脂血症、多动症、慢性肝炎、风湿、小儿遗尿症等。文冠果的叶、壳和果柄富含三萜类、黄酮、类黄酮、香豆素、甾醇、木脂素、单萜、酚酸、生物碱、肌醇和皂苷等生物活性成分。文冠果提取物具有抗炎、抗应激、清除自由基、抗肿瘤活性和提高智力的功能[4-6]。最近的大鼠试验研究表明,文冠果壳提取物能调节肠道微生物群,改善肠道微环境[7]。但目前,有关文冠果叶对动物生长和健康方面的研究还处于空白。
发酵是处理植物性饲料的一种简单、廉价和有效的方法,用于延长储存期,去除抗营养因子,提高生物活性和消化率,进而改善营养质量[8-9]。近年来,发酵产物在动物生产中的应用越来越受到重视。发酵可以诱导植物细胞壁的结构破坏并释放酚类化合物,从而增强抗氧化活性[10-11]。因此,本研究旨在探讨以未发酵文冠果叶(UXSL)或发酵文冠果叶(FXSL)替代饲粮中苜蓿草粉对新西兰大白兔的生长性能、血液常规参数、肉品质、免疫器官指数、血清免疫功能及机体抗氧化功能的影响,以期为文冠果叶作为木本饲料资源应用于肉兔生产提供科学依据。
1 材料与方法 1.1 文冠果叶发酵物的制备文冠果叶片由山东沃奇乡村振兴产业发展有限公司(山东潍坊)提供。将叶片轻铺在阴凉处风干1周,然后将干燥的叶片在电动研磨机中研磨并通过40目筛,自封袋密封备用。
本试验中使用的产朊假丝酵母(Candida utilis,NFU-Y-186)和黑曲霉(Aspergillus niger NL-1)来源于南京林业大学化学工程学院微生物与基因工程实验室保存的菌株(购自中国普通微生物菌种保藏管理中心菌种库,ACCC2060、ACCC30005)。文冠果叶发酵物的制备工艺为:先接入产朊假丝酵母菌,24 h后再接入黑曲霉至文冠果叶、麸皮和豆粕(质量比=80 ∶ 10 ∶ 10)基质中,接种量均为10%,其中加入3.0%(NH4)2SO4、2.0%葡萄糖、2.0% KH2PO4、0.5% MgSO4·7H2O,在自然pH,60%含水量,30 ℃温度下,发酵72 h获得文冠果叶发酵物。自然晾干至含约914 g/kg干物质粉碎待用。文冠果叶发酵前后主要营养成分的变化如表 1所示。
|
|
表 1 文冠果叶发酵前后主要营养成分的变化 Table 1 Changes in main nutritional ingredients in X. sorbifolia leaves before and after fermentation |
试验采用单因素随机试验设计,选取40日龄已断奶、体重接近的健康新西兰大白兔144只,平均体重为(939±12) g,差异不显著(P>0.05),随机分为3组,每组6个重复,每个重复8只(公母各占1/2)。3个组分别为:对照组(基础饲粮)、UXSL组和FXSL组,试验组分别在基础饲粮中添加15%的UXSL和FXSL替代等量的苜蓿草。苜蓿草的主要营养成分为:粗蛋白质19.1%、粗纤维22.7%、中性洗涤纤维36.7%、酸性洗涤纤维25.0%。试验的预试期7 d,正试期42 d。基础饲粮参照NRC(1980)推荐的兔营养需要量配制,饲粮组成及营养水平见表 2。
|
|
表 2 饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of diets (air-dry basis) |
所有试验肉兔均在冬季饲养于同一兔舍,每个重复中的4只同性别的兔为1个笼位,兔笼长宽高为69 cm×44 cm×52 cm。由专职人员饲喂,每日饲喂3次,时间分别为07:00、12:00和18:00,自由饮水,按正常免疫程序进行免疫接种。
1.4 样品的采集与制备饲养试验结束后,每组抽取8只接近平均体重的试验兔禁食12 h进行屠宰采样。称重后用抗凝采血管心脏采血,其中一管血液样品在采血后2 h内,使用全自动血液细胞分析仪(Mindray,BC-5000 Vet,深圳迈瑞生物医疗电子股份有限公司)测定血液常规参数,包括红细胞参数、白细胞参数等;另一管于低温3 500 r/min离心15 min制备血清,分装后置-20 ℃用于测定血清免疫指标和抗氧化指标。随后对每组的8只肉兔进行屠宰,在每只肉兔的背腰最长肌的部位采集肌肉样品,各取3块,分别用于后续测定24和48 h的滴水损失(5 g)、肉色(30 g)、蒸煮损失和嫩度(剪切力)(30 g)。之后分离胸腺、脾脏和圆小囊,去除附着组织并擦净血液称重,按照公式计算免疫器官指数:
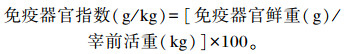
|
留取肝脏制备10%组织匀浆上清液,分装后置-20 ℃用于肝脏抗氧化指标测定。
1.5 检测指标与方法 1.5.1 生长性能测定在试验开始和结束时分别对兔子进行空腹称重。每周同一时间统计饲喂量,以重复为单位计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。试验期间每天认真观察,记录每个重复兔腹泻情况,根据腹泻兔耳标号进行持续天数统计,以便进行腹泻率的计算。同时以重复为单位记录死亡兔的只数。腹泻率和死亡率的计算公式如下:

|
使用Biotek Synergy 2多功能微孔板检测仪(美国)测定血清样品中的免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)含量,按照酶联免疫吸附试验(ELISA)试剂盒(上海酶联生物科技有限公司)说明书进行操作。
1.5.3 血清和肝脏抗氧化指标测定血清和肝脏组织匀浆中总抗氧化能力(T-AOC)测定采用Fe3+还原法,总超氧化物歧化酶(T-SOD)活性采用黄嘌呤氧化法测定,谷胱甘肽过氧化物酶(GSH-Px)活性采用5, 5’-二硫对硝基苯甲酸(DTNB)法测定,丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定。以上测定采用南京建成生物工程研究所试剂盒。
1.5.4 肉品质指标测定屠宰后剥离两侧全部背腰最长肌,迅速进行肉品质各项指标的测定。
pH测定:分别于屠宰后45 min和24 h时,将便携式数显pH计的电极头完全插入到左侧第4腰椎处肌肉中,取上、中、下3个点测量pH,取平均值。
滴水损失:分别取肌肉样品约10 g,记为W1,悬空挂于一次性塑料杯中(避免肉块贴壁),封口挂于4 ℃冰箱内,24 h后,拭去表面水分,称重记为W2,24 h滴水损失率(%)=100×(W1-W2)/W1。称量后的肉样重新悬空挂回4 ℃冰箱,24 h后再取出,揩干表层水分,肉样称重记为W3,48 h滴水损失率(%)=100×(W1-W3)/W1。
蒸煮损失:将约30 g新鲜肉样称重记为M1,置于自封袋中密封,袋口向上放入80 ℃恒温水浴锅内煮30 min,取出肉样,冷却30 min后用纸巾将表面水分擦干,肉样称重记为M2,蒸煮损失(%)=100×(M1-M2)/M1。
剪切力(嫩度):将每块测定完蒸煮损失的肉样沿肌肉纤维方向修成长宽厚1.5 cm×1.0 cm×0.5 cm的长条3~5块,用Salter剪切力仪(G2R Elec. Mf g. Co.)测定剪切力3~5次,取平均值。
肉色评定:在宰后的30 min内,从肉样的上、中、下3个部分各取1个点用色差仪(CHROMA METER CR-400, KONZCAminOLTA SENSING, INC, 日本)测定亮度(L*)、红度(a*)和黄度(b*)值,记录后取平均值。
1.6 统计分析试验数据用平均值和均值标准误表示,采用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),采用Duncan氏多重比较法进行显著性检验,差异显著性水平设为P<0.05。
2 结果与分析 2.1 FXSL对肉兔生长性能的影响由表 3可知,与对照组和UXSL组相比,FXSL组肉兔的末重(FBW)和ADG显著提高(P<0.05),而F/G显著降低(P<0.05)。FXSL组肉兔的腹泻率和死亡率与UXSL组相比虽无统计学差异(P>0.05),但有明显下降趋势。
|
|
表 3 FXSL对肉兔生长性能的影响 Table 3 Effects of FXSL on growth performance of rabbits |
由表 4可知,与对照组相比,FXSL组肉兔的白细胞计数(WBC)显著增加(P<0.05),其他各项血液常规参数在各组间均无显著差异(P>0.05)。
|
|
表 4 FXSL对肉兔血常规参数的影响 Table 4 Effects of FXSL on haematological parameters of rabbits |
由表 5可知,与对照组和UXSL组相比,FXSL组肉兔的胸腺指数和圆小囊指数有增加趋势,但无显著差异(P>0.05),FXSL组的脾脏指数显著增加(P<0.05)。
|
|
表 5 FXSL对肉兔免疫器官指数的影响 Table 5 Effects of FXSL on immune organ indexes of rabbits |
由表 6可知,肉兔血清IgG和IgA的含量在FXSL组最高,且显著高于对照组和UXSL组(P<0.05);血清IgM含量在各组间无显著差异(P>0.05)。
|
|
表 6 FXSL对肉兔血清免疫指标的影响 Table 6 Effects of FXSL on serum immune indexes of rabbits |
由表 7可知,与对照组和UXSL组相比,饲粮中添加FXSL显著增加了肉兔血清T-SOD和GSH-Px的活性及肝脏GSH-Px的活性(P<0.05);同时,与对照组相比,FXSL组肉兔的血清和肝脏中的MDA含量显著降低(P<0.05),与UXSL组相比,FXSL组的肝脏MDA含量也显著降低(P<0.05)。饲粮处理对血清T-AOC及血清和肝脏的T-AOC及T-SOD未产生显著影响(P>0.05)。
|
|
表 7 FXSL对肉兔血清和肝脏抗氧化指标的影响 Table 7 Effects of FXSL on serum and hepatic antioxidant indexes of rabbits |
由表 8可知,与对照组相比,饲粮中添加FXSL能够显著提高兔肉pH24 h(P<0.05),显著降低24和48 h滴水损失及剪切力(P<0.05),其中,48 h滴水损失在UXSL组和FXSL组间也有显著差异(P<0.05);FXSL组肉兔的蒸煮损失最低,但与各组间无统计学差异(P>0.05)。
|
|
表 8 FXSL对肉兔胸肌肉品质的影响 Table 8 Effects of FXSL on breast muscle quality of rabbits |
植物叶资源经过微生物发酵处理,产物中富含益生菌、各种酶、维生素、有机酸、氨基酸、肽、维生素和促生长因子[12-13],同时,发酵处理有助于宿主消化和吸收营养物质,从而改善动物生长性能[13-14]。本试验中,与对照组和UXSL组相比,FXSL组肉兔的FBW、ADG和F/G有显著改善,原因可能是:1)FXSL中的粗蛋白质含量从19.25%提高到了34.06%;2)肉兔肠道的健康状态和饲料利用率显著提高;3)黄酮类物质弱雌激素样的作用,可能起到生长激素的作用[15]。前人研究表明,酿酒酵母、黑曲霉和芽孢杆菌等益生菌可在固态发酵植物副产物中产生包括酚酸、单宁酸在内的多酚类化合物,从而显著提高发酵物料的功能价值[16]。例如,用热带假丝酵母或米曲霉发酵中草药,能产生多种水解酶(如α-淀粉酶、纤维素酶、麦芽糖酶、蛋白酶等),改善幼龄动物的消化系统和健康状况[17]。此外,银杏叶-杜仲叶[18]、辣木叶[19]等发酵植物作为添加剂可以有效提高动物的生长性能和饲料效率。
3.2 FXSL对肉兔血常规参数的影响血常规检验通常被用作衡量动物营养、生理和免疫系统的功能状态。其中,白细胞具有吞噬异物、抗体的产生、抵御病原体入侵等能力,是机体免疫功能的生物标志物[20]。本试验中,所有血液学参数的值都在Flecknell[21]报道的兔子的正常范围内,且白细胞计数值在FXSL组最高,显著高于对照组和XSL组,表明FXSL增强了吞噬细胞参与抵抗感染的功能[22]。这也支持了植物源性饲料添加剂能够刺激动物免疫活性的研究结果[23]。
3.3 FXSL对肉兔免疫功能的影响免疫器官的发育状况决定了机体的免疫状态,免疫器官指数能在一定程度上反映机体的免疫反应水平。在健康范围内,免疫器官指数增大是免疫功能和抗病能力增强的表现[24-25]。脾脏、胸腺、圆小囊是兔的重要免疫器官。本试验中,FXSL组的脾脏指数有显著提高,同时,胸腺指数和圆小囊指数也有提高趋势,说明FXSL能促进肉兔脾脏、胸腺和圆小囊发育。其原因可能是,FXSL中多糖含量较高,植物多糖能够直接激活巨噬细胞的免疫功能、T和B淋巴细胞、天然杀伤细胞和补体活性[26];此外,FXSL中的总多糖等活性成分可能与免疫细胞表面高亲和力的受体结合而促进免疫细胞的增殖分化,增加免疫器官内淋巴细胞与巨噬细胞等免疫活性细胞的数量,从而促进兔免疫器官发育,提高机体免疫能力[27]。
众所周知,黄酮类和萜烯类的活性化合物具有免疫增强活性,包括促进淋巴细胞合成、细胞因子释放、免疫球蛋白水平和吞噬活性[28]。血清抗体水平是体液免疫的标志性指标。实际上,IgG、IgA和IgM是所有哺乳动物体液免疫的关键组成部分,是保护机体免受病原微生物侵害的主要血清免疫球蛋白[29]。本研究发现,FXSL组肉兔血清IgA和IgG的含量显著高于对照组和UXSL组。前人相似研究表明,发酵银杏叶可提高猪血清IgG、IgA和IgM含量,这种有益作用可能是源于其对胃肠道中病原微生物生长的影响[17]。
3.4 FXSL对肉兔机体抗氧化功能的影响在正常生理条件下,动物细胞产生的活性氧(ROS)会对生物分子(包括蛋白质、DNA和脂质)造成损伤,导致脂质过氧化和蛋白质羰基化,最终导致细胞损伤和死亡[30]。同时,机体的酶性抗氧化防御体系(主要包括SOD、GSH-Px和CAT)在抵御脂质过氧化损伤过程中起着重要作用[11],可以保护细胞免受自由基的侵害,抗氧化酶的活性反映了机体清除活性氧的能力[17]。另外,MDA是脂质过氧化的主要终产物,具有高度的细胞毒性,会破坏细胞结构和功能,是反映组织过氧化损伤的重要指标[31]。本试验中,饲粮中添加FXSL显著增加了肉兔血清T-SOD和GSH-Px活性,及肝脏GSH-Px活性,同时,血清和肝脏中的MDA含量也有显著降低;与对照组相比,XSL组的T-SOD和GSH-Px的活性及MDA含量均有一定程度的改善。这些结果表明,兔饲粮中添加文冠果叶有利于保护组织免受脂质过氧化。原因可能是文冠果叶中含有丰富的类黄酮、多酚类和多糖,这些活性物质能够通过减少酶和非酶抗氧化系统的负担来减少细胞抗氧化剂的消耗[32]。由于发酵过程中产生的微生物酶分解植物细胞壁并释放具有抗氧化特性的酚类化合物和黄酮类化合物[33];加之黑曲霉发酵产生的β-葡萄糖苷酶将酚苷水解成苷元形式,因其亲脂性有助于通过细胞膜的磷脂双层,很容易被肠上皮细胞吸收[11, 33],导致FXSL的抗氧化活性的能力的增强。此外,发酵银杏叶-杜仲叶[17, 34]、松针叶[32]、构树叶[35]等作为添加剂饲喂畜禽可以有效提高其抗氧化功能。
3.5 FXSL对肉兔肉品质的影响宰后肌肉pH影响肉的嫩度、肉色、系水力等[36],也是影响肉加工工艺和食用品质的主要参数。屠宰后肉的pH快速下降可致蛋白质变性,从而导致颜色苍白和系水力差[12]。本试验结果表明,肉兔饲粮添加FXSL能有效地维持肉的较高pH。原因可能是FXSL的抗氧化作用,能够通过降低糖原的酵解,减少肌肉中乳酸的产生,从而使肌肉pH下降缓慢[27]。
肉中水分的流失会导致营养物质的损失,肉变得干、硬,风味和品质变差[34]。系水力在一定程度上反映肌肉的保水性能,一般用滴水损失率和蒸煮损失率来衡量,剪切力和系水力则体现肉的嫩度[37]。pH与系水力和嫩度密切相关[38]。本试验数据表明,系水力和嫩度的变化趋势与pH是一致的,而肌肉系水力与其细胞膜结构的完整性有关,完整性越好,系水力越高。这可能是由于FXSL的抗氧化作用,通过阻止肌细胞膜上磷脂的氧化,节约了内源的抗氧化剂,并维持细胞膜的完整性,减少了肌浆液的外渗[39],从而降低了肌肉的滴水损失[27, 34]。
4 结论① 肉兔饲粮中添加文冠果叶,并未对肉兔产生有害影响。
② 添加15% FXSL能够明显提高肉兔的生长性能,并改善肌肉品质,并能增强机体的免疫功能及抗氧化能力。
③ 在本试验条件下,肉兔饲粮中添加15% UXSL或FXSL替代等量苜蓿草,是完全可行的。
| [1] |
王熙遥. 中国苜蓿市场供给和需求关系研究[D]. 硕士学位论文. 呼和浩特: 内蒙古大学, 2017: 3-5. WANG X Y. Releationship between alfalfa supply and demand in China[D]. Master's Thesis. Hohhot: Inner Mongolia University, 2017: 3-5. (in Chinese) |
| [2] |
WU X Z, YANG P L, GAO X H, et al. Effects of replacement of alfalfa by big-leaf mulberry on growth performance, digestion and meat quality in growing rabbits[J]. World Rabbit Science, 2019, 27(4): 199-205. DOI:10.4995/wrs.2019.11529 |
| [3] |
DAL BOSCO A, MOURVAKI E, CARDINALI R, et al. Effect of dietary supplementation with olive pomaces on the performance and meat quality of growing rabbits[J]. Meat Science, 2012, 92(4): 783-788. DOI:10.1016/j.meatsci.2012.07.001 |
| [4] |
YANG C Y, HA W, LIN Y, et al. Polyphenols isolated from Xanthoceras sorbifolia husks and their anti-tumor and radical-scavenging activities[J]. Molecules, 2016, 21(12): 1694. DOI:10.3390/molecules21121694 |
| [5] |
LI N, WANG Y, LI X Z, et al. Bioactive phenols as potential neuroinflammation inhibitors from the leaves of Xanthoceras sorbifolia Bunge[J]. Bioorganic & Medicinal Chemistry Letters, 2016, 26(20): 5018-5023. |
| [6] |
LI Y J, XU J K, XU P, et al. Xanthoceras sorbifolia extracts ameliorate dendritic spine deficiency and cognitive decline via upregulation of BDNF expression in a rat model of Alzheimer's disease[J]. Neuroscience Letters, 2016, 629: 208-214. DOI:10.1016/j.neulet.2016.07.011 |
| [7] |
RONG W W, HAN K F, ZHAO Z H, et al. The protective effect of Xanthoceras sorbifolia Bunge husks on cognitive disorder based on metabolomics and gut microbiota analysis[J]. Journal of Ethnopharmacology, 2021, 279: 113094. DOI:10.1016/j.jep.2020.113094 |
| [8] |
CHAVAN J K, KADAM S S, BEUCHAT L R. Nutritional improvement of cereals by fermentation[J]. Critical Reviews in Food Science and Nutrition, 1989, 28(5): 349-400. DOI:10.1080/10408398909527507 |
| [9] |
FRIAS J, MIRANDA M L, DOBLADO R, et al. Effect of germination and fermentation on the antioxidant vitamin content and antioxidant capacity of Lupinus albus L. var. Multolupa[J]. Food Chemistry, 2005, 92(2): 211-220. DOI:10.1016/j.foodchem.2004.06.049 |
| [10] |
ĐORĐEVIĆ T M, ŠILER-MARINKOVIĆ S S, DIMITRIJEVIĆ-BRANKOVIĆ S I. Effect of fermentation on antioxidant properties of some cereals and pseudo cereals[J]. Food Chemistry, 2010, 119(3): 957-963. DOI:10.1016/j.foodchem.2009.07.049 |
| [11] |
NIU Y, WAN X L, ZHANG L L, et al. Effect of different doses of fermented Ginkgo biloba leaves on serum biochemistry, antioxidant capacity hepatic gene expression in broilers[J]. Animal Feed Science and Technology, 2019, 248: 132-140. DOI:10.1016/j.anifeedsci.2019.01.003 |
| [12] |
CAO F L, ZHANG X H, YU W W, et al. Effect of feeding fermented Ginkgo biloba leaves on growth performance, meat quality, and lipid metabolism in broilers[J]. Poultry Science, 2012, 91(5): 1210-1221. DOI:10.3382/ps.2011-01886 |
| [13] |
ZHU F H, ZHANG B B, LI J, et al. Effects of fermented feed on growth performance, immune response, and antioxidant capacity in laying hen chicks and the underlying molecular mechanism involving nuclear factor-κB[J]. Poultry Science, 2020, 99(5): 2573-2580. DOI:10.1016/j.psj.2019.12.044 |
| [14] |
PERALTA E M, HATATE H, KAWABE D, et al. Improving antioxidant activity and nutritional components of Philippine salt-fermented shrimp paste through prolonged fermentation[J]. Food Chemistry, 2008, 111(1): 72-77. DOI:10.1016/j.foodchem.2008.03.042 |
| [15] |
HAVSTEEN B H. The biochemistry and medical significance of the flavonoids[J]. Pharmacology & Therapeutics, 2002, 96(2/3): 67-202. |
| [16] |
MARTINS S, MUSSATTO S I, MARTÍNEZ-AVILA G, et al. Bioactive phenolic compounds: production and extraction by solid-state fermentation.A review[J]. Biotechnology Advances, 2011, 29(3): 365-373. DOI:10.1016/j.biotechadv.2011.01.008 |
| [17] |
ZHOU H, WANG C Z, YE J Z, et al. Effects of dietary supplementation of fermented Ginkgo biloba L. residues on growth performance, nutrient digestibility, serum biochemical parameters and immune function in weaned piglets[J]. Animal Science Journal, 2015, 86(8): 790-799. DOI:10.1111/asj.12361 |
| [18] |
曹银娣, 张旭晖, 孙智远, 等. 银杏-杜仲叶复合发酵工艺优化及发酵物对肉鸡肠道功能的影响[J]. 畜牧与兽医, 2020, 52(6): 27-34. CAO Y D, ZHANG X H, SUN Z Y, et al. Optimization of compound fermentation of Ginkgo biloba-Eucommia leaves and the effect of the fermented substances on intestinal function of broilers[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(6): 27-34 (in Chinese). |
| [19] |
ZHANG X H, SUN Z Y, CAI J F, et al. Dietary supplementation with fermented Moringa oleifera leaves inhibits the lipogenesis in the liver of meat ducks[J]. Animal Feed Science and Technology, 2020, 260: 114336. DOI:10.1016/j.anifeedsci.2019.114336 |
| [20] |
OLORUNTOLA O D, AYODELE S O, ADEYEYE S A, et al. Performance, haemato-biochemical indices and antioxidant status of growing rabbits fed on diets supplemented with Mucuna pruriens leaf meal[J]. World Rabbit Science, 2018, 26(4): 277-285. DOI:10.4995/wrs.2018.10182 |
| [21] |
FLECKNELL P. BSAVA manual of rabbit medicine and surgery[M]. Cheltenham: British Small Animal Veterinary Association, 2000.
|
| [22] |
SWENSON M J, REECE O W. Duke's physiology of domestic animals[M]. 11th ed. New York: Cornell University Press, 1993: 312-315.
|
| [23] |
DASHPUTRE N L, NAIKWADE N S. Preliminary immunomodulatory activity of aqueous and ethanolic leaves extracts of Ocimum basilicum Linn in mice[J]. International Journal of PharmTech Research, 2010, 2(2): 1342-1349. |
| [24] |
刘可园, 刘郝佳, 刘诚刚, 等. 大蒜茎秆对肉兔生产性能和免疫功能的影响[J]. 东北农业大学学报, 2012, 43(6): 41-45. LIU K Y, LIU H J, LIU C G, et al. Effect of garlic straw on performance and immune function of meat rabbit[J]. Journal of Northeast Agricultural University, 2012, 43(6): 41-45 (in Chinese). DOI:10.3969/j.issn.1005-9369.2012.06.009 |
| [25] |
曹卓洋, 吕清华, 诩嫒, 等. 基础日粮添加冬虫夏草菌丝体发酵液对獭兔免疫功能的影响[J]. 浙江大学学报(农业与生命科学版), 2018, 44(5): 638-642. CAO Z Y, LV Q H, XU Y, et al. Effects of zymotic fluid of Cordyceps sinensis mycelium on the immune function of Rex Rabl rabbit[J]. Journal of Zhejiang University(Agriculture & Life Sciences), 2018, 44(5): 638-642 (in Chinese). |
| [26] |
YU Y, SHEN M Y, SONG Q Q, et al. Biological activities and pharmaceutical applications of polysaccharide from natural resources: a review[J]. Carbohydrate Polymers, 2018, 183: 91-101. DOI:10.1016/j.carbpol.2017.12.009 |
| [27] |
XU M, CHEN X L, HUANG Z Q, et al. Effects of dietary grape seed proanthocyanidin extract supplementation on meat quality, muscle fiber characteristics and antioxidant capacity of finishing pigs[J]. Food chemistry, 2022, 367(1): 130781. |
| [28] |
ZHAO J D, SU Y, CHEN A T, et al. Effect of ginkgo leaf parenteral solution on blood and cochlea antioxidant and immunity indexes in OM rats[J]. Molecules, 2011, 16(12): 10433-10442. DOI:10.3390/molecules161210433 |
| [29] |
KONG X F, WU G Y, LIAO Y P, et al. Dietary supplementation with Chinese herbal ultra-fine powder enhances cellular and humoral immunity in early-weaned piglets[J]. Livestock Science, 2007, 108(1/3): 94-98. |
| [30] |
ZHENG X C, CHI C, XU C Y, et al. Effects of dietary supplementation with icariin on growth performance, antioxidant capacity and non-specific immunity of Chinese mitten crab (Eriocheir sinensis)[J]. Fish & Shellfish Immunology, 2019, 90: 264-273. |
| [31] |
WAN X L, SONG Z H, NIU Y, et al. Evaluation of enzymatically treated Artemisia annua L. on growth performance, meat quality, and oxidative stability of breast and thigh muscles in broilers[J]. Poultry Science, 2017, 96(4): 844-850. DOI:10.3382/ps/pew307 |
| [32] |
WU Q J, WANG Z B, WANG G Y, et al. Effects of feed supplemented with fermented pine needles (Pinus ponderosa) on growth performance and antioxidant status in broilers[J]. Poultry Science, 2015, 94(6): 1138-1144. DOI:10.3382/ps/pev013 |
| [33] |
HUR S J, LEE S Y, KIM Y C, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chemistry, 2014, 160: 346-356. DOI:10.1016/j.foodchem.2014.03.112 |
| [34] |
曹银娣, 张旭晖, 孙智远, 等. 银杏-杜仲叶复合发酵物对肉鸡抗氧化能力和胸肌肉品质的影响[J]. 动物营养学报, 2021, 33(3): 1386-1395. CAO Y D, ZHANG X H, SUN Z Y, et al. Effects of fermented Ginkgo biloba-Eucommia ulmoides leaves on antioxidant capacity and breast meat quality of broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(3): 1386-1395 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.03.021 |
| [35] |
邓铭, 池宙, 林东波, 等. 发酵构树饲料对断奶仔猪生长性能、养分表观消化率和血清生化指标的影响[J]. 动物营养学报, 2021, 33(1): 165-174. DENG M, CHI Z, LIN D B, et al. Effects of fermented Broussonetia papyrifera feed on growth performance, nutrient apparent digestibility, serum biochemical indexes of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 165-174 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.01.018 |
| [36] |
MIR N A, RAFIQ A, KUMAR F, et al. Determinants of broiler chicken meat quality and factors affecting them: a review[J]. Journal of Food Science and Technology, 2017, 54(10): 2997-3009. |
| [37] |
RODRÍGUEZ M, CARRO M D, VALIENTE V, et al. Effects of dietary fish oil supplementation on performance, meat quality, and cecal fermentation of growing rabbits[J]. Journal of Animal Science, 2017, 95(8): 3620-3630. |
| [38] |
WANG Z M, HE Z F, GAN X, et al. Interrelationship among ferrous myoglobin, lipid and protein oxidations in rabbit meat during refrigerated and superchilled storage[J]. Meat Science, 2018, 146: 131-139. DOI:10.1016/j.meatsci.2018.08.006 |
| [39] |
LI X L, HE L P, YANG Y, et al. Effects of extracellular polysaccharides of Ganoderma lucidum supplementation on the growth performance, blood profile, and meat quality in finisher pigs[J]. Livestock Science, 2015, 178: 187-194. DOI:10.1016/j.livsci.2015.04.001 |




