为了减少滥用抗生素造成的药物残留和细菌耐药性等危害,维护动物产品安全和公共卫生安全,我国自2020年起全面禁止饲料中添加抗生素。因此,开发安全、高效的饲用抗生素替代品已成为当前饲料行业和养殖行业的热点和共识,其中乳酸菌发酵饲料的研发与应用备受关注。乳酸菌是应用最早、最广泛的一类益生菌,具有维持肠道内菌群平衡、提高机体免疫力、促进营养物质吸收等多种功能。乳酸菌在发酵饲料过程中可利用饲料中的营养物质进行增殖,并代谢产生有机酸、酶类、胞外多糖等代谢产物,能够降低饲料pH,增加饲料的营养价值。大量研究证明,乳酸菌发酵饲料可以降解饲料中的抗营养因子[1],提高饲料的适口性和消化利用率[2],维持动物肠道的菌群平衡[3],增强机体免疫力[4],提高动物的生长性能[5-6]。目前关于乳酸菌发酵饲料在猪生产方面的研究和应用多采用单一菌株作为发酵菌种[7-10],而对以复合乳酸菌为菌种的固态发酵全价饲料的研究较少。为此,本试验以生长猪全价饲料为底物,以乳酸片球菌和副干酪乳杆菌为菌种进行固态发酵,制备成复合乳酸菌发酵饲料,研究其对生长猪生长性能、粪便菌群、血清免疫和抗氧化指标的影响,旨在为复合乳酸菌发酵饲料在生长猪养殖中的应用提供依据和指导。
1 材料与方法 1.1 试验设计选取90头初始体重为(40.69±1.16) kg的健康“长×大”二元生长猪,随机分为3组,每组3个重复,每个重复10头猪。对照组饲喂基础饲粮,试验Ⅰ组和试验Ⅱ组在基础饲粮中分别添加1%和3%复合乳酸菌发酵饲料(发酵饲料底物组成同基础饲粮)。基础饲粮为参照NRC(2012)20~50 kg生长猪营养需要配制的粉状配合饲料。基础饲粮组成及营养水平见表 1,饲粮中未添加任何抗生素。预试期5 d,正试期34 d。试验期间,所有猪只自由采食、饮水,饲养管理按常规进行。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
采用本研究室制备保存的乳酸片球菌ZPA017冻干菌粉和副干酪乳杆菌ZLP018冻干菌粉(活菌数均为2.0×1010 CFU/g)作为发酵菌种,与水和基础饲粮按照质量比0.2 ∶ 0.2 ∶ 800 ∶ 1 000进行混合,混合均匀后分装入发酵桶中密封,37 ℃发酵24 h后使用。复合乳酸菌发酵饲料每天配制,现配现用。
1.3 样品采集 1.3.1 粪样试验结束时,每个重复随机选择3头猪,采集新鲜粪便,共计27个粪样。每个粪样混合均匀后再分成2份,一份分装于50 mL无菌离心管中,放置于冰盒中,运回实验室后立即处理,用于测定粪便菌群数量;另一份分装于EP管中,经干冰速冻后-80 ℃保存,用于测定粪便菌群多样性。
1.3.2 血样试验结束的当天早晨,每个重复随机选择3头猪,前腔静脉采血5 mL,置于血清管中促凝,3 000 r/min离心10 min,分离血清后-20 ℃保存待测。
1.4 测定指标与方法 1.4.1 生长性能试验期间,准确记录每个重复猪只的饲料消耗情况。分别于试验的第1天和第34天早上对所有试验猪只进行空腹称重,由此计算生长猪的平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.4.2 饲料营养成分含量的测定干物质含量参照GB/T 6435—2006、粗蛋白质含量参照GB/T 6432—2018、粗灰分含量参照GB/T 6438—2007、粗纤维含量参照GB/T 6434—2006、钙含量参照GB/T 6436—2018、总磷参照GB/T 6437—2018、乳酸菌活菌数参照GB 4789.35—2016测定。pH的检测:称取25 g样品置于225 mL灭菌生理盐水中,混匀后在摇床上振荡30 min,静置,用pH计测定pH。乳酸含量采用南京建成生物工程研究所的乳酸测试盒进行检测。
1.4.3 粪便菌群数量采用平板菌落计数法测定粪样的菌群数量。其中,乳酸菌用改良MRS培养基、大肠杆菌用伊红美蓝培养基、沙门氏菌用胆硫乳培养基、金黄色葡萄球菌用Baird-Parker培养基进行培养,37 ℃培养48 h后进行菌落计数。菌群数量以每克粪便中所含菌落形成单位的对数[lg(CFU/g)]表示。
1.4.4 粪便菌群多样性采用Qiagen DNA提取试剂盒提取粪便总DNA,提取步骤参照试剂盒说明书。对提取的总DNA进行纯化及检测浓度和纯度。以粪便总DNA为模板,对细菌16S rRNA V3~V4区进行PCR扩增,所用上游引物为338F(5′-ACTCCTACGGGAGGCAGCA-3′),下游引物为806R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR扩增体系(20 μL):5×FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,5 μmol/L上、下游引物各0.8 μL,FastPfu Polymerase 0.4 μL,DNA模板10 ng,补ddH2O至20 μL。PCR反应条件:95 ℃预变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,27个循环;72 ℃ 10 min。PCR产物经2%琼脂糖凝胶电泳检测、切胶回收后,进行Illumina MiSeq PE300高通量测序。对测得的序列进行质控过滤后,在97%的相似水平下进行操作分类单元(OTU)聚类和生物信息统计分析。基于OTU聚类分析结果,进行α多样性指数分析,包括丰富度指数(ACE指数、Chao1指数)、多样性指数(Shannon指数、Simpson指数)和覆盖率(Coverage);基于分类学信息,在各个分类水平上进行群落结构的统计分析。
1.4.5 血清生化、免疫和抗氧化指标血清总蛋白(TP)、球蛋白(GLB)、白蛋白(ALB)、胆固醇(TC)、甘油三酯(TG)、葡萄糖(GLU)、尿素氮(UN)、钙(Ca)和磷(P)含量采用日立7020自动生化分析仪测定;血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性以及总抗氧化能力(T-AOC)、丙二醛(MDA)含量按试剂盒说明书进行测定,以上试剂盒均购自南京建成生物工程研究所;采用酶联免疫吸附测定(ELISA)法测定血清免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)含量,所用试剂盒购自美国Bethyl公司。
1.5 数据处理与分析采用Excel 2016对试验数据进行初步整理后,再采用SPSS 25.0软件进行单因素方差分析(one-way ANOVA),当方差分析具显著性差异时进行Duncan氏法多重比较,以P < 0.05作为差异显著判断标准。结果用平均值±标准误表示。
2 结果与分析 2.1 全价饲料发酵前后营养成分变化由表 2可知,生长猪全价饲料经过复合乳酸菌发酵后,干物质、粗蛋白质、粗纤维、粗灰分、钙、总磷含量未见显著变化(P>0.05),pH显著降低(P < 0.05),乳酸含量为55.37 g/kg。复合乳酸菌发酵饲料中乳酸片球菌和副干酪乳杆菌的活菌数分别为1.50×109和1.48×109 CFU/g。
|
|
表 2 全价饲料发酵前后营养成分变化(风干基础) Table 2 Nutrient variation of complete feed before and after fermentation (air-dry basis) |
由表 3可知,与对照组相比,试验Ⅰ组生长猪的ADG提高了9.42%(P < 0.05),F/G降低了7.75%(P < 0.05);试验Ⅱ组生长猪的F/G降低了7.36%(P < 0.05)。生长猪的始重、末重、ADFI各组间差异不显著(P>0.05)。
|
|
表 3 复合乳酸菌发酵饲料对生长猪生长性能的影响 Table 3 Effects of compound lactic acid bacteria fermented feed on growth performance of growing pigs |
由表 4可知,与对照组相比,试验Ⅰ组和试验Ⅱ组生长猪粪便中乳酸菌数量显著增加(P < 0.05),大肠杆菌和金黄色葡萄球菌数量显著减少(P < 0.05)。生长猪粪便中沙门氏菌数量各组间差异不显著(P>0.05)。
|
|
表 4 复合乳酸菌发酵饲料对生长猪粪便菌群数量的影响 Table 4 Effects of compound lactic acid bacteria fermented feed on fecal microflora number of growing pigs |
由表 5可知,各组OTU序列的Coverage均在0.99以上,说明测序质量高,得到的OTU序列对于试验结果具有代表性。与对照组相比,试验Ⅰ组生长猪粪便菌群的Shannon指数显著增加(P < 0.05);试验Ⅰ组和试验Ⅱ组生长猪粪便菌群的ACE指数和Chao1指数显著增加(P < 0.05),Simpson指数显著降低(P < 0.05)。
|
|
表 5 生长猪粪便菌群α多样性指数分析 Table 5 Analysis of α diversity indexes in fecal microbiota of growing pigs |
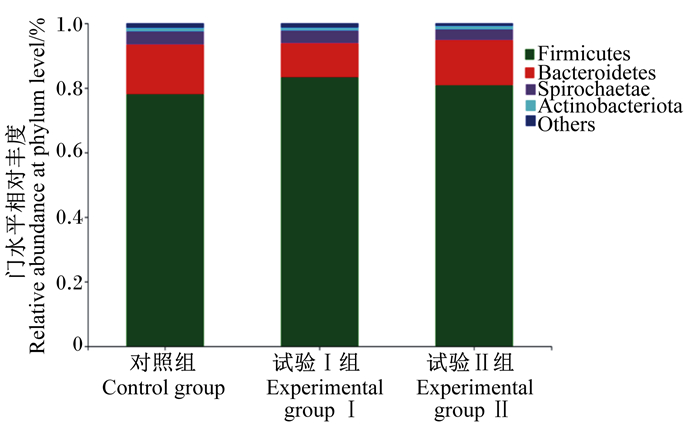
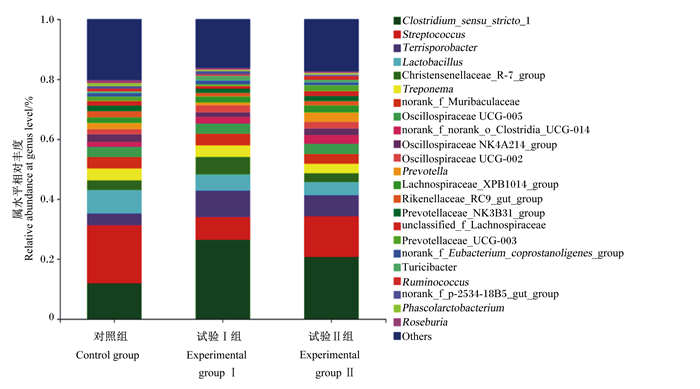
根据物种注释结果,3组生长猪粪便菌群在门水平上的相对丰度见图 1,在属水平上的相对丰度见图 2。由图 1可知,除门水平上未命名的菌群外,3组粪样中相对丰度大于0.1%的门共有4个,分别为厚壁菌门(Firmicutes,80.74%)、拟杆菌门(Bacteroidetes,13.32%)、螺旋体门(Spirochaetae,3.29%)和放线菌门(Actinobacteriota,1.07%)。方差分析结果显示,与对照组相比,试验Ⅰ组和试验Ⅱ组粪便中Firmicutes的相对丰度增加(83.29%、80.88% vs. 78.05%,P>0.05),Bacteroidetes的相对丰度显著降低(10.59%、13.95% vs. 15.41%,P < 0.05)。由图 2可知,除属水平上未命名的菌群外,3组粪样中相对丰度大于1%的菌属共有14个,分别为狭义梭菌属1(Clostridium_sensu_stricto_1,19.67%)、链球菌属(Streptococcus,13.49%)、土孢杆菌属(Terrisporobacter,6.62%)、乳酸杆菌属(Lactobacillus,5.87%)、克里斯滕森菌科R-7群属(Christensenellaceae_R-7_group,3.99%)、密螺旋体属(Treponema,3.69%)、颤螺旋菌科UCG-005属(Oscillospiraceae_UCG-005,3.31%)、颤螺旋菌科NK4A214群属(Oscillospiraceae_NK4A214_group,2.15%)、普雷沃氏菌属(Prevotella,2.07%)、颤螺旋菌科UCG-002属(Oscillospiraceae_UCG-002,2.06%)、毛螺菌科XPB1014群属(Lachnospiraceae_XPB1014_group,2.01%)、理研菌科RC9肠道群属(Rikenellaceae_RC9_gut_group,1.63%)、普雷沃氏菌科NK3B31群属(Prevotellaceae_NK3B31_group,1.62%)和普雷沃氏菌科UCG-003属(Prevotellaceae_UCG-003,1.29%)。方差分析结果显示,与对照组相比,试验Ⅰ组和试验Ⅱ组Clostridium_sensu_stricto_1的相对丰度显著升高(P < 0.05),试验Ⅰ组Streptococcus的相对丰度显著降低(P < 0.05)。
|
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Spirochaetae:螺旋体门;Actinobacteriota:放线菌门;Others:其他。 图 1 生长猪粪便菌群门水平上的相对丰度 Fig. 1 Relative abundances of fecal microbiota at phylum level of growing pigs |
|
Clostridium_sensu_stricto_1:狭义梭菌属1;Streptococcus:链球菌属;Terrisporobacter:土孢杆菌属;Lactobacillus:乳酸杆菌属;Christensenellaceae_R-7_group:克里斯滕森菌科R-7群属;Treponema:密螺旋体属;Oscillospiraceae_UCG-005:颤螺旋菌科UCG-005属;Oscillospiraceae_NK4A214_group:颤螺旋菌科NK4A214群属;Prevotella:普雷沃氏菌属;Oscillospiraceae_UCG-002:颤螺旋菌科UCG-002属;Lachnospiraceae_XPB1014_group:毛螺菌科XPB1014群属;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群属;Prevotellaceae_NK3B31_group:普雷沃氏菌科NK3B31群属;Prevotellaceae_UCG-003:普雷沃氏菌科UCG-003属;Others:其他。 图 2 生长猪粪便菌群属水平上的相对丰度 Fig. 2 Relative abundances of fecal microbiota at genus level of growing pigs |
由表 6可知,与对照组相比,试验Ⅰ组和试验Ⅱ组生长猪的血清TP含量分别提高了9.50%(P < 0.05)和13.33%(P < 0.05),GLB含量分别提高了16.25%(P < 0.05)和12.92%(P < 0.05),ALT活性分别降低了27.68%(P < 0.05)和22.74%(P < 0.05),UN含量分别降低了21.50%(P < 0.05)和18.53%(P < 0.05),TC含量分别降低了24.55%(P < 0.05)和14.29%(P < 0.05);试验Ⅰ组生长猪的血清AST活性降低了32.29%(P < 0.05);生长猪的血清ALB、TG、GLU、Ca、P含量各组间无显著差异(P>0.05)。
|
|
表 6 复合乳酸菌发酵饲料对生长猪血清生化指标的影响 Table 6 Effects of compound lactic acid bacteria fermented feed on serum biochemical indexes of growing pigs |
由表 7可知,与对照组相比,试验Ⅰ组和试验Ⅱ组生长猪的血清IgG含量分别提高了37.79%(P < 0.05)和15.14%(P < 0.05),IgM含量分别提高了36.91%(P < 0.05)和26.51%(P < 0.05),SOD活性分别提高了34.47%(P < 0.05)和29.99%(P < 0.05),GSH-Px活性分别提高了37.07%(P < 0.05)和31.99%(P < 0.05),MDA含量分别降低了25.39%(P < 0.05)和20.74%(P < 0.05);生长猪的血清IgA含量和T-AOC各组间差异不显著(P>0.05)。
|
|
表 7 复合乳酸菌发酵饲料对生长猪血清免疫和抗氧化指标的影响 Table 7 Effects of compound lactic acid bacteria fermented feed on serum immune and antioxidant indexes of growing pigs |
有研究指出,乳酸菌发酵饲料中含有大量的乳酸菌和有机酸、酶、胞外多糖等代谢产物,可以增加饲料的适口性和营养价值,促进肠道的健康和营养物质的消化吸收,有利于动物生长性能的提高[11-12]。与单一菌种发酵相比,多菌种复合发酵饲料可以充分发挥乳酸菌菌种之间的协同作用,不仅能快速增菌和产酸,加快发酵进程,而且可以丰富饲料中的代谢产物,提高发酵品质,有望成为未来发酵饲料的发展趋势[13-15]。王磊等[16]报道,以鼠李糖乳杆菌、乳酸片球菌和干酪乳杆菌为复合菌种制备的发酵饲料,可以极显著降低八眉三元猪的ADFI,显著降低其F/G。本试验中,乳酸片球菌和副干酪乳杆菌复合发酵饲料饲喂生长猪,添加量为1%和3%时均能够显著降低生长猪的F/G。有研究认为,发酵饲料的促生长效果与发酵饲料的菌种、发酵工艺、添加剂量、饲喂时间长短、饲料的营养成分、猪的生长阶段等密切相关[15, 17-18]。由本试验结果可以看出,复合乳酸菌发酵饲料能够降低生长猪的F/G,其原因可能是复合乳酸菌发酵能够增加饲料中的有益代谢产物,提高饲料的营养价值,从而提高饲料转化率。此外,本试验结果还显示,当复合乳酸菌发酵饲料添加量为1%时可显著提高生长猪的ADG,而3%的添加量对猪的ADG没有显著影响。此结果表明,本试验条件下制备的乳酸菌发酵饲料以添加1%较为适宜,过多添加未能取得更好的促增重效果,其原因可能是乳酸菌发酵饲料中含有较多的乳酸菌活菌,过多添加可能会影响肠道菌群结构,或是额外增加微生物对肠道中部分营养物质的消耗,从而影响宿主对营养物质的消化吸收和生长发育[19]。本研究结果提示,后续研究中还需进一步对复合乳酸菌发酵饲料的营养成分、代谢产物和添加剂量等进行更深入地分析和明确,以期能够更好地促进乳酸菌发酵饲料在猪生产中的应用。
3.2 复合乳酸菌发酵饲料对生长猪粪便菌群数量的影响乳酸菌可以利用饲料中的营养物质进行繁殖、代谢。乳酸菌进入动物肠道后,能够与大肠杆菌等有害菌竞争肠道上皮的黏附位点,争夺营养物质,而乳酸等有机酸能够降低肠道内pH,增加有益菌数量,抑制有害菌的生长[20-22],有益于肠道内微生物区系的平衡和肠道健康的改善。张铮等[10]研究结果显示,给断奶仔猪饲喂唾液乳杆菌发酵饲料可显著提高粪便中乳酸菌数量和降低大肠杆菌数量。Van Winsen等[23]的研究结果也表明,植物乳杆菌液体发酵饲料显著增加了生长育肥猪粪便中乳酸菌数量,显著减少了沙门氏菌和大肠杆菌数量。本试验中,生长猪饲喂复合乳酸菌发酵饲料能够显著提高粪便中乳酸菌数量,显著降低大肠杆菌和金黄色葡萄球菌数量,同时也有降低沙门氏菌数量的趋势,与上述研究结果基本一致。由此可见,生长猪饲喂复合乳酸菌发酵饲料后,可增加肠道有益菌数量,减少有害菌数量,有效调节肠道菌群平衡,促进肠道健康。
3.3 复合乳酸菌发酵饲料对生长猪粪便菌群结构的影响动物肠道是机体的消化器官和免疫器官,肠道菌群在维持宿主肠道的结构功能、促进营养物质的消化吸收和代谢以及调节机体的免疫功能等方面具有重要的作用[24]。研究认为,添加乳酸菌可以改变猪肠道的菌群结构,进而改善肠道的消化吸收和机体健康[25-26]。
α多样性指数可反映样本中微生物群落的丰富度和多样性,分析其变化有助于从宏观上评估复合乳酸菌发酵饲料对猪肠道菌群的影响。Ace指数和Chao1指数可反映物种的种类和丰富度,Shannon指数和Simpson指数可反映物种的多样性和均匀度,受样本丰富度和均匀度的影响,Simpson指数越小,说明群落的物种多样性越高。Zhang等[26]研究发现,罗伊氏乳杆菌能够显著增加断奶仔猪肠道菌群的ACE指数和Chao1指数。Tajima等[27]研究发现,乳酸菌液体发酵饲料可以显著提高断奶仔猪粪便菌群的Shannon指数和Chao1指数。本试验中,生长猪饲喂复合乳酸菌发酵饲料后,粪便菌群的ACE指数和Chao1指数显著增加,Simpson指数显著降低。从该结果可以看出,复合乳酸菌发酵饲料进入生长猪肠道后可以影响肠道菌群,能够提高肠道菌群的物种丰富度和多样性,有利于肠道健康和机体健康。
本试验中,生长猪粪便菌群在门水平上主要为Firmicutes和Bacteroidetes,相对丰度占比在90%以上,并且乳酸菌发酵饲料可显著降低粪便菌群中Bacteroidetes的相对丰度,这与诸多研究结果[28-29]相似。Bacteroidetes是肠道中数量最大的革兰氏阴性菌,主要参与饲粮中多糖的降解,其相对丰度降低的原因可能是,复合乳酸菌发酵饲料可以降低肠道内pH,从而抑制了Bacteroidetes等革兰氏阴性菌的定植和繁殖。进一步在属水平上分析发现,复合乳酸菌发酵饲料显著增加了生长猪粪便中Clostridium_sensu_stricto_1的相对丰度,显著降低了Streptococcus的相对丰度,这与Wang等[30]的研究结果类似。Clostridium_sensu_stricto_1是猪肠道内的优势菌属之一,与蛋白质代谢有关[31],其相对丰度升高的原因可能是,复合乳酸菌发酵可以增加饲料中的粗蛋白质含量或氨基酸浓度,由此提高了肠道内细菌发酵底物的氮源浓度。Streptococcus是动物肠道内的条件致病菌,具有诱导发病的潜在风险,其相对丰度降低的原因可能与复合乳酸菌发酵饲料能够降低肠道内pH或是乳酸菌的拮抗作用有关。
3.4 复合乳酸菌发酵饲料对生长猪血清生化指标的影响血清生化指标可以间接反映机体的营养代谢和组织器官的功能。血清TP由肝脏合成,可反映机体对蛋白质的吸收情况以及与体液免疫的关系,而GLB由浆细胞分泌,可反映机体的免疫状况和抵抗力。本试验结果显示,饲喂复合乳酸菌发酵饲料后,生长猪血清中TP和GLB含量显著升高,说明该发酵饲料可以增强生长猪的蛋白质合成能力和免疫力。血清TC是血脂的重要组成部分,可反映肝脏脂肪代谢情况。Lye等[32]研究发现,乳酸菌可通过调控体内胆盐水解酶的活性和同化胆固醇的途径来降解血液中胆固醇含量。本试验中,试验组血清TC含量显著低于对照组,揭示乳酸菌发酵饲料对生长猪的脂代谢具有促进作用。血清UN是蛋白质代谢的终产物,当动物体内氨基酸平衡良好时,其含量会下降[33]。本试验中,试验组血清UN含量显著低于对照组,说明复合乳酸菌发酵饲料有利于机体蛋白质的合成和代谢,可增加机体氮沉积量,促进生长,其原因可能与乳酸菌发酵改善了饲料的氨基酸组成有关。血清ALT和AST常被用作肝功能检测的敏感指标,其活性过高时提示肝脏细胞可能受到损伤[34]。本试验结果显示,试验组血清中ALT和AST活性较对照组降低,说明复合乳酸菌发酵饲料对生长猪的肝脏具有一定的保护作用,可促进蛋白质的合成和吸收,有利于生长猪的生长发育。
3.5 复合乳酸菌发酵饲料对生长猪血清免疫和抗氧化指标的影响乳酸菌发酵饲料中的乳酸菌和代谢产物,可以作为独立抗原刺激肠道黏膜、上皮细胞和相关淋巴组织,促进淋巴细胞增殖,从而增强机体的免疫力[35-36]。血清中的免疫球蛋白是体液免疫的主要抗体,主要包括IgG、IgM和IgA,其含量可在一定程度上反映机体的免疫水平。Mizumachi等[37]研究发现,植物乳杆菌液体发酵饲料可以提高断奶仔猪的血清IgM和IgG含量。张秀江等[6]研究显示,植物乳杆菌液体发酵饲料可显著升高育肥猪血液中IgA和IgG含量。本研究显示,复合乳酸菌发酵饲料显著提高了生长猪的血清IgG、IgM含量,表明复合乳酸菌发酵饲料能够促进蛋白质的合成和免疫力的提高,对猪群的健康状况有利。
氧化应激是动物机体内氧自由基产生的一种负面影响,过量的氧自由基会损伤细胞中的蛋白质、脂类和核酸等,引起机体衰老与疾病[38]。机体的抗氧化酶系统(如T-AOC、SOD、GSH-Px等)具有清除活性氧自由基的功能,是维持动物健康的重要防线。T-AOC是衡量机体抗氧化功能的综合指标,SOD和GSH-Px是动物体内重要的抗氧化酶,而MDA含量可反映机体受损的程度。Gilbert等[36]和刘志云等[39]的研究均发现,饲料经过微生物发酵后含有丰富的有益代谢产物(维生素、小肽、消化酶等),能够提高饲料的抗氧化功能。李涛等[40]的试验发现,乳酸杆菌发酵饲料可以显著提高生长猪血清中SOD和GSH-Px活性,显著降低MDA含量。本试验也得到了相同的结果,表明复合乳酸菌发酵饲料能够增强生长猪对体内活性氧自由基的清除能力,提高机体的抗氧化应激能力,从而有益于生长猪的健康。
4 结论本试验条件下,饲粮中添加1%的复合乳酸菌固态发酵饲料能够提高生长猪的生长性能,改善肠道菌群组成和肠道健康,并能增强机体的免疫功能和抗氧化功能。
| [1] |
LI S L, JIN Z Y, HU D J, et al. Effect of solid-state fermentation with Lactobacillus casei on the nutritional value, isoflavones, phenolic acids and antioxidant activity of whole soybean flour[J]. LWT, 2020, 125: 109264. DOI:10.1016/j.lwt.2020.109264 |
| [2] |
KOO B, KIM J W, NYACHOTI C M. Nutrient and energy digestibility, and microbial metabolites in weaned pigs fed diets containing Lactobacillus-fermented wheat[J]. Animal Feed Science and Technology, 2018, 241: 27-37. DOI:10.1016/j.anifeedsci.2018.04.007 |
| [3] |
HUMER E, WETSCHEREK W, SCHWARZ C, et al. Effects of maize conservation techniques on the apparent total tract nutrient and mineral digestibility and microbial metabolites in the faeces of growing pigs[J]. Animal Feed Science and Technology, 2014, 197: 176-184. DOI:10.1016/j.anifeedsci.2014.08.006 |
| [4] |
刘辉, 季海峰, 王四新, 等. 副干酪乳杆菌发酵饲料对生长猪生长性能、粪便菌群数量与挥发性脂肪酸含量以及血清生化和免疫指标的影响[J]. 动物营养学报, 2019, 31(8): 3747-3754. LIU H, JI H F, WANG S X, et al. Effects of Lactobacillus paracasei-fermented feed on growth performance, fecal bacteria populations and volatile fatty acid contents, and serum biochemical and immune indexes of growing pigs[J]. Chinese Journal of Animal Nutrition, 2019, 31(8): 3747-3754 (in Chinese). |
| [5] |
SKREDE G, HERSTAD O, SAHLSTRØM S, et al. Effects of lactic acid fermentation on wheat and barley carbohydrate composition and production performance in the chicken[J]. Animal Feed Science and Technology, 2003, 105(1/2/3/4): 135-148. |
| [6] |
张秀江, 胡虹, 王秋菊, 等. 乳酸菌液体发酵饲料对育肥猪养分表观消化率、粪样菌群、血液生化指标和生产性能的影响[J]. 饲料工业, 2019, 40(20): 28-33. ZHANG X J, HU H, WANG Q J, et al. Effects of Lactobacillus liquid fermented feed on apparent nutrient digestibility, fecal microflora, blood biochemical indexes and production performance of fattening pigs[J]. Feed Industry, 2019, 40(20): 28-33 (in Chinese). |
| [7] |
沈雪娇, 宋艳, 朱宇, 等. 产γ-氨基丁酸乳酸杆菌发酵饲料对育肥猪生产性能和肉品质的影响[J]. 中国饲料, 2018(21): 41-45. SHEN X J, SONG Y, ZHU Y, et al. Effects of fermented feed with γ-aminobutyric acid-producing Lactobacillus on growth performance and meat quality in finishing pigs[J]. China Feed, 2018(21): 41-45 (in Chinese). |
| [8] |
LOH T C, THU T V, FOO H L, et al. Effects of different levels of metabolite combination produced by Lactobacillus plantarum on growth performance, diarrhoea, gut environment and digestibility of postweaning piglets[J]. Journal of Applied Animal Research, 2013, 41(2): 200-207. DOI:10.1080/09712119.2012.741046 |
| [9] |
赵臣. 嗜酸乳杆菌发酵饲料及其对母猪健康和繁殖性能的影响[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2017. ZHAO C. Lactobacillus acidophilus fermented feed and its effects on health and reproductive performance in sows[D]. Master's Thesis. Lanzhou: Gansu Agricultural University, 2017. (in Chinese) |
| [10] |
张铮, 石青松, 朱伟云, 等. 乳酸菌发酵饲料对断奶仔猪生长性能和肠道健康的影响[J]. 江苏农业科学, 2018, 46(19): 170-173. ZHANG Z, SHI Q S, ZHU W Y, et al. Effects of fermented feed with lactic acid bacteria on growth performance and intestine health of weaned piglets[J]. Jiangsu Agricultural Sciences, 2018, 46(19): 170-173 (in Chinese). |
| [11] |
刘金萍. 植物乳杆菌A6(Lactobacillus plantarum A6)生物学特性及在发酵饲料中应用的研究[D]. 硕士学位论文. 南宁: 广西大学, 2004. LIU J P. Studies of Lactobicillus plantarum A6's biology character and its application on fermented feed[D]. Master's Thesis. Nanning: Guangxi University, 2004. (in Chinese) |
| [12] |
LE M H A, GALLE S, YANG Y, et al. Effects of feeding fermented wheat with Lactobacillus reuteri on gut morphology, intestinal fermentation, nutrient digestibility, and growth performance in weaned pigs[J]. Journal of Animal Science, 2016, 94(11): 4677-4687. DOI:10.2527/jas.2016-0693 |
| [13] |
魏爱彬, 于洁, 王鑫, 等. 益生乳酸菌Lactobacillus casei Zhang和Lactobacillus plantarum P8对全价饲料pH及微生物类群变化的研究[J]. 微生物学杂志, 2012, 32(2): 1-8. WEI A B, YU J, WANG X, et al. Beneficial Lactobacillus casei Zhang and Lactobacillus plantarum P8 on the influence and changes of pH and microbial groups in complete feed[J]. Journal of Microbiology, 2012, 32(2): 1-8 (in Chinese). DOI:10.3969/j.issn.1005-7021.2012.02.001 |
| [14] |
孟碟方, 赵怡凡, 霍建超, 等. 乳酸菌对平菇菌糠发酵饲料品质和发酵进程的影响[J]. 福建农业学报, 2020, 35(10): 1145-1153. MENG D F, ZHAO Y F, HUO J C, et al. Effects of Lactobacillus addition on fermentation and quality of animal feed made with spent substrate from oyster mushroom cultivation[J]. Fujian Journal of Agricultural Sciences, 2020, 35(10): 1145-1153 (in Chinese). |
| [15] |
汪以真, 王成, 靳明亮, 等. 生物发酵饲料与生猪健康养殖[J]. 饲料工业, 2021, 42(2): 1-6. WANG Y Z, WANG C, JIN M L, et al. Biological fermented feed and healthy pig husbandry[J]. Feed Industry, 2021, 42(2): 1-6 (in Chinese). |
| [16] |
王磊, 吴国芳, 周继平, 等. 乳酸菌发酵饲料对八眉三元猪生长性能及肉品质的影响[J]. 青海大学学报(自然科学版), 2020, 38(6): 22-26. WANG L, WU G F, ZHOU J P, et al. Effects of fermented feed of lactic acid bacteria on the growth performance and meat quality of Bamei ternary hybrid pig[J]. Journal of Qinghai University (Natural Science), 2020, 38(6): 22-26 (in Chinese). |
| [17] |
WANG Y, LIU X T, WANG H L, et al. Optimization of processing conditions for solid-state fermented soybean meal and its effects on growth performance and nutrient digestibility of weanling pigs[J]. Livestock Science, 2014, 170: 91-99. DOI:10.1016/j.livsci.2014.07.020 |
| [18] |
VAN WINSEN R L, URLINGS B A P, LIPMAN L J A, et al. Effect of fermented feed on the microbial population of the gastrointestinal tracts of pigs[J]. Applied and Environmental Microbiology, 2001, 67(7): 3071-3076. DOI:10.1128/AEM.67.7.3071-3076.2001 |
| [19] |
CANIBE N, JENSEN B B. Fermented and nonfermented liquid feed to growing pigs: effect on aspects of gastrointestinal ecology and growth performance[J]. Journal of Animal Science, 2003, 81(8): 2019-2031. DOI:10.2527/2003.8182019x |
| [20] |
YIN F G, FARZAN A, WANG Q C, et al. Reduction of Salmonella enterica serovar typhimurium DT104 infection in experimentally challenged weaned pigs fed a lactobacillus-fermented feed[J]. Foodborne Pathogens and Disease, 2014, 11(8): 628-634. DOI:10.1089/fpd.2013.1676 |
| [21] |
HU J K, LU W Q, WANG C L, et al. Characteristics of solid-state fermented feed and its effects on performance and nutrient digestibility in growing-finishing pigs[J]. Asian-Australasian Journal of Animal Sciences, 2018, 21(11): 1635-1641. |
| [22] |
HONG T T T, LINDBERG J E. Effect of cooking and fermentation of a pig diet on gut environment and digestibility in growing pigs[J]. Livestock Science, 2007, 109(1/2/3): 135-137. |
| [23] |
VAN WINSEN R L, KEUZENKAMP D, URLINGS B A P, et al. Effect of fermented feed on shedding of Enterobacteriaceae by fattening pigs[J]. Veterinary Microbiology, 2002, 87(3): 267-276. DOI:10.1016/S0378-1135(02)00066-4 |
| [24] |
DELZENNE N M, CANI P D. Interaction between obesity and the gut microbiota: relevance in nutrition[J]. Annual Review of Nutrition, 2011, 31: 15-31. DOI:10.1146/annurev-nutr-072610-145146 |
| [25] |
WANG C, SHI C Y, ZHANG Y, et al. Microbiota in fermented feed and swine gut[J]. Applied Microbiology and Biotechnology, 2018, 102(7): 2941-2948. DOI:10.1007/s00253-018-8829-4 |
| [26] |
ZHANG D Y, JI H F, LIU H, et al. Changes in the diversity and composition of gut microbiota of weaned piglets after oral administration of Lactobacillus or an antibiotic[J]. Applied Microbiology and Biotechnology, 2016, 100(23): 10081-10093. DOI:10.1007/s00253-016-7845-5 |
| [27] |
TAJIMA K, OHMORI H, AMINOV R I, et al. Fermented liquid feed enhances bacterial diversity in piglet intestine[J]. Anaerobe, 2010, 16(1): 6-11. DOI:10.1016/j.anaerobe.2009.04.002 |
| [28] |
张铮, 朱坤, 朱伟云, 等. 发酵饲料对生长育肥猪结肠微生物发酵及菌群组成的影响[J]. 微生物学报, 2019, 59(1): 93-102. ZHANG Z, ZHU K, ZHU W Y, et al. Effect of a fermented feed on colonic fermentation and microbial composition in finishing pig[J]. Acta Microbiologica Sinica, 2019, 59(1): 93-102 (in Chinese). |
| [29] |
PARK S J, KIM J, LEE J S, et al. Characterization of the fecal microbiome in different swine groups by high-throughput sequencing[J]. Anaerobe, 2014, 28: 157-162. DOI:10.1016/j.anaerobe.2014.06.002 |
| [30] |
WANG J, HAN Y, ZHAO J Z, et al. Consuming fermented distillers' dried grains with solubles (DDGS) feed reveals a shift in the faecal microbiota of growing and fattening pigs using 454 pyrosequencing[J]. Journal of Integrative Agriculture, 2017, 16(4): 900-910. DOI:10.1016/S2095-3119(16)61523-X |
| [31] |
FAN P X, LIU P, SONG P X, et al. Moderate dietary protein restriction alters the composition of gut microbiota and improves ileal barrier function in adult pig model[J]. Scientific Reports, 2017, 7: 43412. DOI:10.1038/srep43412 |
| [32] |
LYE H S, RAHMAT-ALI G R, LIONG M T. Mechanisms of cholesterol removal by lactobacilli under conditions that mimic the human gastrointestinal tract[J]. International Dairy Journal, 2010, 20(3): 169-175. DOI:10.1016/j.idairyj.2009.10.003 |
| [33] |
LI Y H, WEI H K, LI F N, et al. Regulation in free amino acid profile and protein synthesis pathway of growing pig skeletal muscles by low-protein diets for different time periods[J]. Journal of Animal Science, 2016, 94(12): 5192-5205. DOI:10.2527/jas.2016-0917 |
| [34] |
ZHAO D, WU T, YI D, et al. Dietary supplementation with Lactobacillus casei alleviates lipopolysaccharide-induced liver injury in a porcine model[J]. International Journal of Molecular Sciences, 2017, 18(12): 2535. DOI:10.3390/ijms18122535 |
| [35] |
SÁNCHEZ B, DELGADO S, BLANCO-MÍGUEZ A, et al. Probiotics, gut microbiota, and their influence on host health and disease[J]. Molecular Nutrition & Food Research, 2017, 61(1): 1-15. |
| [36] |
GILBERT E R, WONG E A, WEBB K E, J r. Board-invited review: peptide absorption and utilization: implications for animal nutrition and health[J]. Journal of Animal Science, 2008, 86(9): 2135-2155. |
| [37] |
MIZUMACHI K, AOKI R, OHMORI H, et al. Effect of fermented liquid diet prepared with Lactobacillus plantarum LQ80 on the immune response in weaning pigs[J]. Animal, 2009, 3(5): 670-676. |
| [38] |
BAI K W, HUANG Q, ZHANG J F, et al. Supplemental effects of probiotic Bacillus subtilis fmbJ on growth performance, antioxidant capacity, and meat quality of broiler chickens[J]. Poultry Science, 2017, 96(1): 74-82. |
| [39] |
刘志云, 周晓容, 钟晓霞, 等. 长期饲喂发酵全价饲料对猪生长、粪便臭味物质、血清抗氧化及免疫性能指标的影响[J]. 中国畜牧兽医, 2019, 46(4): 1011-1017. LIU Z Y, ZHOU X R, ZHONG X X, et al. Effect of long-term supply of fermented complete feed on the growth performance, fecal mephitis, serum immunity and antioxidation indexes of growing pigs[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(4): 1011-1017 (in Chinese). |
| [40] |
李涛, 曾东, 倪学勤, 等. 乳酸杆菌发酵饲料对猪生长性能和肉质及血清抗氧化性能的影响[J]. 湖南农业大学学报(自然科学版), 2014, 40(2): 192-195. LI T, ZENG D, NI X Q, et al. Effect of lactic acid bacteria fermented feed on growth performance, meat quality and serum antioxidant activity of pigs[J]. Journal of Hunan Agricultural University (Natural Sciences), 2014, 40(2): 192-195 (in Chinese). |




