2. 河北农业大学 动物科技学院, 保定 071000;
3. 中牧实业股份有限公司, 北京 100070
2. College of Animal Science and Technology, Hebei Agricultural University, Baoding 071000, China;
3. China Animal Husbandry Industry Co., Ltd., Beijing 100070, China
革兰氏阴性细菌主要存在于机体的肠道内,而脂多糖(LPS)则是革兰氏阴性细菌的内毒素物质。机体在受到应激或者感染时革兰氏阴性细菌大量繁殖,会破坏肠道屏障,细菌死亡后,大量LPS进入血液,作用于细胞膜受体[1-2],激活某些通路,如Toll样受体4(TLR4)信号通路,通过一系列物质的磷酸化,生成核因子-κB (NF-κB),再诱导机体产生大量促炎因子,导致肠道绒毛脱落,肠道通透性升高,从而使机体出现代谢紊乱、发热等多种炎症症状[3]。研究表明,益生菌通过调节细胞因子,调控紧密连接相关蛋白表达,抑制TLR4信号通路的激活,改善肠道屏障功能,降低肠道通透性,进而阻止有害物质侵入而引起的炎症反应[4-6]。王焱[7]的试验证明,凝结芽孢杆菌LT3通过调控炎症和氧化信号通路以及肠道菌群对LPS诱导的大鼠盲肠损伤起到保护作用。凝结芽孢杆菌作为一种新型益生菌对LPS诱导的肠道损伤作用具有一定的改善效果,其具有良好的耐热性,适合添加在饲粮中[6-7]。而且本课题组同期研究表明,凝结芽孢杆菌BC-HYI通过降低肠道黏膜通透性,提高肠道黏膜屏障的保护作用及吸收功能,降低蛋雏鸡料重比,提升其生长性能[8]。因此,本试验使用本实验室提取并验证后制成的凝结芽孢杆菌BC-HYI菌粉,检测其对30日龄蛋雏鸡灌服2 mg/kg LPS 200 μL 6 h后的肠道黏膜通透性及TLR4信号通路相关基因表达和蛋白表达,旨在探究凝结芽孢杆菌BC-HYI调控LPS损伤肠道的作用机制。
1 材料与方法 1.1 试验材料凝结芽孢杆菌BC-HYI菌粉由北京农学院中兽医实验室提取并验证后制备[8]。
1.2 试验设计选取1日龄京红蛋雏鸡180只,随机分为5组,每组6个重复,每个重复6只,重复之间体重接近。空白对照组(CON组)和模型组(LPS组)饲喂基础饲粮(基础饲粮组成及营养水平同本课题组同期试验[8]),连续灌服生理盐水,3个益生菌组饲喂基础饲粮,同时分别连续灌服低、中、高剂量的凝结芽孢杆菌BC-HYI(浓度分别为106、107、108 CFU/mL),灌服28 d,28 d后灌服LPS,灌服浓度为2 mg/kg,灌服剂量为200 μL/只,试验周期为6 h,分别记为LOW+LPS、MID+LPS、HIGH+LPS组。蛋雏鸡自由采食,充分饮水,按正常免疫程序进行免疫接种。
1.3 样品采集采集蛋雏鸡的十二指肠、空肠和回肠肠道组织,每段约5 cm,用于测定肠道组织结构。用1 mL针管对蛋雏鸡进行心脏采血,采血量3~4 mL,室温放置至少0.5 h,3 000 r/min离心10 min,吸取上层血清转移到1.5 mL灭菌的EP管中,用于测定血清二胺氧化酶(DAO)活性及D-乳酸(D-Lac)、肿瘤坏死因子-α(TNF-α)含量。采集约5 cm的蛋雏鸡空肠纵向剖开,用0.9%生理盐水缓慢冲去食糜,避免将肠绒毛冲掉,用消毒后的无齿镊沿同一方向轻轻刮取黏膜,装入EP管中,包上锡箔纸,放入-80 ℃保存,用于测定空肠黏膜黏液蛋白2(MUC2)和紧密连接蛋白mRNA相对表达量、分泌型免疫球蛋白A(SIgA)和白细胞介素-10(IL-10)含量及TLR4信号通路相关基因与蛋白表达量。
1.4 检测指标及方法 1.4.1 肠道组织结构采集的肠道组织用清水稍微清洗一下,放入4%多聚甲醛固定24 h,制备组织切片、苏木精-伊红(HE)染色,用荧光显微镜观察且测量不同肠道的绒毛长度与隐窝深度,计算肠道绒隐比。
1.4.2 血清DAO活性及D-Lac、TNF-α含量用酶联免疫吸附测定(ELISA)方法测定血清中DAO活性及D-Lac、TNF-α含量,试剂盒购自上海江莱生物科技有限公司,试验按照说明书操作。
1.4.3 空肠黏膜MUC2和紧密连接蛋白mRNA相对表达量用实时荧光定量PCR的方法测定空肠黏膜中MUC2、闭合蛋白(Occludin)和闭锁小带蛋白-1(ZO-1)的mRNA相对表达量。试验步骤以及引物序列信息等参考本课题组同期研究[8]。以磷酸甘油醛脱氢酶(GAPDH)作为内参基因,采用2-△△Ct法计算mRNA相对表达量。
1.4.4 空肠黏膜SIgA和IL-10含量采用ELISA的方法测定空肠黏膜中SIgA和IL-10的含量,试剂盒购自上海江莱生物科技有限公司,试验按照说明书操作。
1.4.5 空肠黏膜TLR4信号通路相关基因与蛋白表达量分别采用实时荧光定量PCR和Western blot的方法测定蛋雏鸡空肠黏膜TLR4信号通路中TLR4、核转录因子-κB(NF-κB)mRNA相对表达量和蛋白表达量。试验步骤以及引物序列信息等参考本课题组同期研究[8]。
1.5 数据统计分析试验数据均用GraphPad Prism 7.00软件进行统计处理,结果用平均值±标准差(mean±SD)表示,用t检验(t-test)分析差异显著性,P > 0.05为无显著差异,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果与分析 2.1 凝结芽孢杆菌BC-HYI对LPS诱导的蛋雏鸡肠道结构的作用LPS组蛋雏鸡灌胃LPS 6 h后出现食欲不振、腹泻等临床症状,益生菌组未出现明显腹泻。
由表 1可知,LPS组十二指肠绒毛长度显著低于CON组(P < 0.05),而回肠的隐窝深度则显著高于CON组(P < 0.05),与CON组相比,各肠道绒隐比显著降低(P < 0.05),高剂量凝结芽孢杆菌BC-HYI极显著提高十二指肠的绒隐比(P < 0.01);与LPS组相比,饲喂不同剂量的凝结芽孢杆菌BC-HYI均提高肠道的绒毛长度,降低隐窝深度,其中高剂量效果显著(P < 0.05),中、高剂量凝结芽孢杆菌BC-HYI极显著提高各肠道的绒隐比(P < 0.01)。
|
|
表 1 蛋雏鸡肠道绒毛长度、隐窝深度及绒隐比 Table 1 Villi length, crypt depth and V/C in intestine of layer chickens |
由表 2可知,与CON组相比,LPS组的血清DAO活性极显著增加(P < 0.01),D-Lac和TNF-α含量显著增加(P < 0.05);与LPS组相比,3个剂量凝结芽孢杆菌BC-HYI均极显著降低血清DAO活性(P < 0.01),显著降低血清TNF-α含量(P < 0.05);中剂量凝结芽孢杆菌BC-HYI显著降低血清D-Lac含量(P < 0.05),高剂量凝结芽孢杆菌BC-HYI极显著降低血清D-Lac含量(P < 0.01)。
|
|
表 2 蛋雏鸡血清中DAO活性及D-Lac、TNF-α含量 Table 2 DAO activity, D-Lac and TNF-α contents in serum of layer chickens |
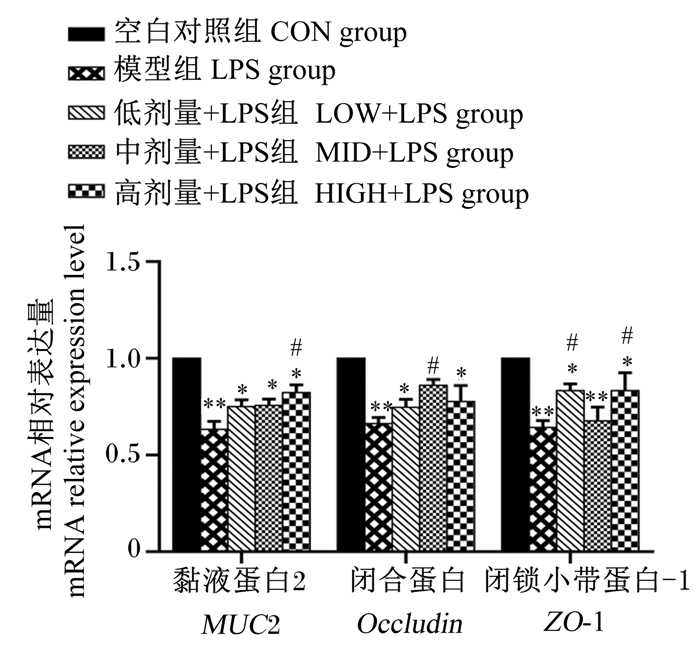
由图 1可知,与CON组相比,LPS组的空肠黏膜MUC2、Occludin和ZO-1的mRNA相对表达量均极显著降低(P < 0.01),低、高剂量+LPS组的空肠黏膜MUC2、Occludin和ZO-1的mRNA相对表达量显著降低(P < 0.05),中剂量+LPS组空肠黏膜MUC2的mRNA相对表达量显著降低(P < 0.05),空肠黏膜ZO-1的mRNA相对表达量极显著降低(P < 0.01);与LPS组相比,高剂量凝结芽孢杆菌BC-HYI可以显著提高空肠黏膜MUC2的mRNA相对表达量(P < 0.05),中剂量凝结芽孢杆菌BC-HYI可以显著提高空肠黏膜Occludin的mRNA相对表达量(P < 0.05),低、高剂量凝结芽孢杆菌BC-HYI可以显著提高空肠黏膜ZO-1的mRNA相对表达量(P < 0.05)。
|
与CON组相比,“*”为P < 0.05;“* *”为P < 0.01;与LPS组相比,“#”为P < 0.05;“##”为P < 0.01。下图同。 Compared with CON group, "*" mean P < 0.05, and "* *" mean P < 0.01; compared with LPS group, "#" mean P < 0.05, and "##" mean P < 0.01. The same as below. 图 1 蛋雏鸡空肠黏膜MUC2、Occludin、ZO-1的mRNA相对表达量 Fig. 1 mRNA relative expression levels of MUC2, Occludin and ZO-1 in jejunal mucosa of layer chickens |
由表 3可知,与CON组相比,LPS能够极显著提高空肠黏膜SIgA含量(P < 0.01),显著提高空肠黏膜中IL-10含量(P < 0.05),凝结芽孢杆菌BC-HYI也能极显著提高空肠黏膜中SIgA含量(P < 0.01),显著提高空肠黏膜中IL-10含量(P < 0.05),但与LPS组相比无显著差异(P > 0.05)。
|
|
表 3 蛋雏鸡空肠黏膜中SIgA和IL-10含量 Table 3 SIgA and IL-10 contents in jejunal mucosa of layer chickens |
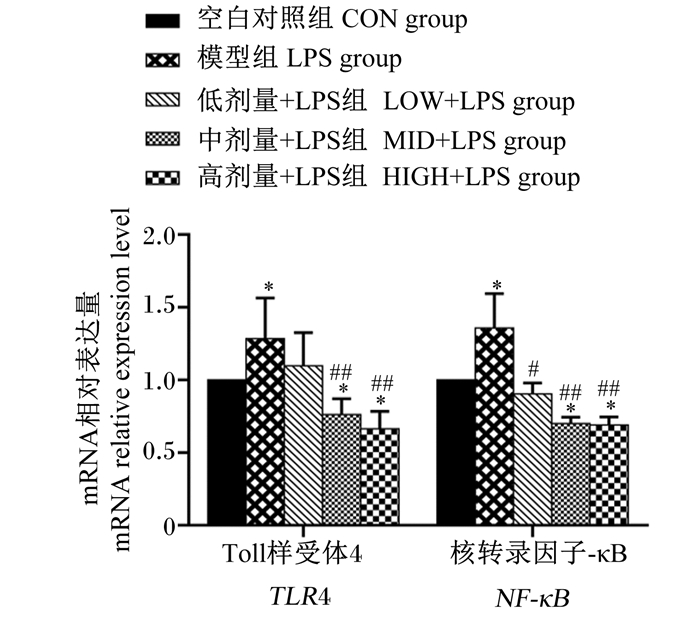
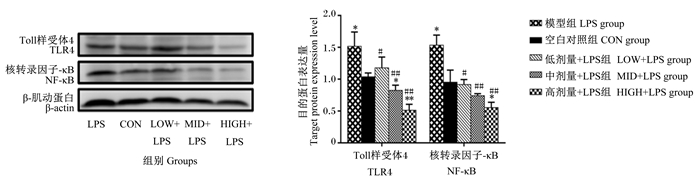
由图 2、图 3可知,与CON组相比,LPS组蛋雏鸡空肠黏膜中TLR4和NF-κB的mRNA相对表达量和NF-κB的蛋白表达量显著上调(P < 0.05);不同剂量凝结芽孢杆菌BC-HYI对空肠黏膜TLR4的mRNA相对表达量和蛋白表达量会有不同程度的抑制作用,尤其是中、高剂量凝结芽孢杆菌BC-HYI抑制作用极显著(P < 0.01),甚至与CON组也出现显著性差异(P < 0.05)。
|
图 2 蛋雏鸡空肠黏膜TLR4、NF-κB的mRNA相对表达量 Fig. 2 mRNA relative expression levels of TLR4 and NF-κB in jejunal mucosa of layer chickens |
|
图 3 蛋雏鸡空肠黏膜TLR4和NF-κB的蛋白表达量 Fig. 3 Protein expression levels of TLR4 and NF-κB in jejunal mucosa of layer chickens |
LPS能使动物机体产生异常生理行为,且影响其正常的饮食消化。其肠道的形态结构决定吸收能力,绒毛长度代表吸收面积,隐窝深度反映上皮细胞的增殖和成熟情况[9-10],而二者的比值更能体现小肠功能的强弱,比值越大,黏膜功能越强,比值越小,消化吸收功能越受限,黏膜损伤越严重[11]。凝结芽孢杆菌能改善LPS作用后的肠道损伤。本试验的结果也表明,LPS作用后,蛋雏鸡肠道绒隐比降低,说明蛋雏鸡肠道受到损伤,而饲喂凝结芽孢杆菌BC-HYI的蛋雏鸡会改善这种损伤现象。
3.2 凝结芽孢杆菌BC-HYI对LPS诱导的蛋雏鸡空肠MUC2和紧密连接蛋白mRNA相对表达量的影响肠黏膜屏障作为机体抵抗外界刺激的第1道关卡,其完整性对于维持微环境稳态尤为重要[12],其中黏液蛋白和紧密连接蛋白是维护上皮细胞极性和调节肠道屏障完整性的重要物质[13]。研究表明,LPS能破坏肠黏膜上皮紧密连接完整性,损伤肠黏膜,增加肠道通透性,导致LPS以细胞旁作用穿过肠道屏障进入肠内,引起促炎细胞因子大量分泌,加剧肠道炎症[14]。Wu等[12]在细胞上的研究表明,用LPS刺激IPEC-J2后,Occludin、紧密连接蛋白-1(Claudin-1)和ZO-1基因表达会下调。益生菌对于肠道屏障功能的改善具有良好效果,它通过增加黏液蛋白和紧密连接蛋白的表达来加强肠道结构完整性,提高肠道黏膜保护作用,降低炎症发病率。在一项研究中,VSL#3(8种不同的革兰氏阳性菌组成的冻干粉)能显著增加Wistar大鼠结肠炎模型中结肠黏液蛋白分泌,主要是MUC2 mRNA的表达,但是对黏液蛋白1 (MUC1)和黏液蛋白3(MUC3)基因表达的调节作用并不明显[15]。宋晓珍[16]的试验证实,复合益生菌能显著提高炎症性肠病小鼠模型下小鼠结肠组织中Occludin的基因表达。本试验发现与CON组相比,LPS组MUC2和紧密连接蛋白(Occludin和ZO-1)的mRNA相对表达量极显著降低;与LPS组相比,中剂量凝结芽孢杆菌BC-HYI能显著提高空肠黏膜Occludin的mRNA相对表达量,高剂量凝结芽孢杆菌BC-HYI能显著提高空肠黏膜MUC2的mRNA相对表达量,中、高剂量凝结芽孢杆菌BC-HYI均能显著提高空肠黏膜ZO-1的mRNA相对表达量,因此,凝结芽孢杆菌BC-HYI能通过提高肠道紧密连接能力来增强肠道通透性,减少LPS的损伤作用。
3.3 凝结芽孢杆菌BC-HYI对LPS诱导的蛋雏鸡血清中DAO活性和D-Lac含量的影响肠黏膜受损时,血液DAO活性会增加[17]。DAO是肠道黏膜中物质,只有当肠黏膜细胞损伤,肠道通透性增加时,才会进入血液,因此,DAO在血清中活性可作为评价肠道黏膜完整性的指标[18]。鸡血清中D-Lac含量与LPS的含量呈正比例变化,也是LPS导致肠道黏膜通透性增加的标志物之一[19]。益生菌通过降低血清DAO活性和D-Lac含量来修复损伤的肠黏膜,降低肠道通透性,促进肠道屏障功能恢复,维护肠道健康[20]。江巧丽等[21]试验证明益生菌制剂(双歧杆菌、嗜酸乳杆菌和粪肠球菌的联用)可降低肝硬化患者血清DAO活性以及LPS含量,降低患者肠道黏膜通透性,改善肝功能。本试验中也得出饲喂不同剂量凝结芽孢杆菌BC-HYI能下调LPS刺激后血清DAO活性和D-Lac的含量,改善肠道损伤的结论。
3.4 凝结芽孢杆菌BC-HYI对LPS诱导的蛋雏鸡空肠黏膜免疫的作用当LPS作用肠道时,易产生大量促炎因子,破坏肠道屏障,进入血液,其中TNF-α是主要因子,其具有多种生物学活性,涉及炎症反应[22]。兰斌等[23]发现与空白组相比,给白兔耳缘注射0.3 mL/kg的LPS使血清TNF-α含量显著升高。在LPS诱导炎症因子产生的同时,也会激活黏膜免疫系统[24],分泌抗体与抑炎因子。SIgA是肠道黏膜中最丰富的非炎性免疫球蛋白抗体,IL-10则是主要抗炎因子[25]。刘绍琼[26]的试验通过饲喂肉鸡500 μg/kg BW的LPS激发免疫应激,增加肠道SIgA含量,其中空肠SIgA含量在15 h有显著增加。也有试验发现经LPS作用后肠道SIgA和IL-10含量会下降,可能的原因是LPS的剂量不同,激发免疫应答的效果也不一样[27]。益生菌具有加强黏膜免疫作用。石梦玄[28]的试验表明,预先口服双歧杆菌BAA6能显著提高结肠炎小鼠结肠组织IL-10含量,尤其高剂量组(1×1010 CFU/mL)效果最佳。本试验LPS灌服后,血清TNF-α、空肠黏膜SIgA和IL-10含量显著增加,而凝结芽孢杆菌BC-HYI能下调血清TNF-α含量,但对空肠黏膜SIgA和IL-10的含量增强效果不显著,从而凝结芽孢杆菌BC-HYI通过增强免疫功能缓解LPS对肠道的损伤。
3.5 凝结芽孢杆菌BC-HYI/NF-κB对LPS诱导蛋雏鸡空肠黏膜TLR4信号通路的作用LPS是诱导TLR4信号通路的主要物质,其含量的增加能促使TLR4信号通路活化,产生一系列促炎因子,包括TNF-α、IL-1β等,从而诱导机体发生炎症。TLR4和NF-κB是LPS作用后发生变化的主要信号物质,其中NF-κB是主要调控炎症因子释放的一种转录因子,当其进入到细胞核内,启动转录程序后就会释放大量炎症因子,造成炎症级联放大反应[29-30],因此二者表达的改变能反映TLR4诱导的炎症信号通路的变化,从而判断炎症发生程度。益生菌会抑制此通路基因表达,从而减少促炎因子产生,降低炎症发生率。郝雅蓉等[31]通过实时荧光定量PCR测定TLR4和NF-κB的mRNA表达发现,经LPS处理的肉鸡其肝脏中的TLR4/NF-κB的信号通路表现出较强活性,从而产生更多如白细胞介素-6(IL-6)等促炎因子,但益生菌处理过则能明显抑制这条通路,降低炎症因子产生的数量,缓解肝脏炎症的发生。本试验中,LPS能显著上调蛋雏鸡空肠黏膜TLR4和NF-κB的mRNA相对表达量和蛋白表达量,而凝结芽孢杆菌BC-HYI则会抑制此通路中这2种基因的mRNA相对表达量和蛋白表达量,因此,凝结芽孢杆菌BC-HYI可能是通过抑制TLR4/NF-κB信号通路的表达来减少促炎因子的生成,避免炎症发生。
4 结论① LPS灌服蛋雏鸡后会导致其肠道黏膜受到损害,提高血清DAO活性及D-Lac、TNF-α含量,同时会降低空肠黏膜MUC2、Occludin和ZO-1的mRNA相对表达量,启动肠道黏膜免疫应答,激活TLR4/NF-κB信号通路。
② 连续饲喂凝结芽孢杆菌BC-HYI可下调TLR4/NF-κB信号通路中TLR4和NF-κB mRNA相对表达量和蛋白表达量,改善LPS灌服后的肠道损伤,提高蛋雏鸡肠道健康。
致谢:
感谢北京农学院动物科学技术学院童津津博士对文稿所提的宝贵意见。
| [1] |
杨一新, 李桂源. LPS所介导的信号转导通路研究进展[J]. 中南大学学报(医学版), 2006, 31(1): 141-145. YANG Y X, LI G Y. Progression of lipopolysaccharide signal pathway[J]. Journal of Central South University(Medical Sciences), 2006, 31(1): 141-145 (in Chinese). DOI:10.3321/j.issn:1672-7347.2006.01.035 |
| [2] |
穆国华, 赵宗江, 蒋里, 等. 黄连-肉桂对db/db小鼠肠道菌群及内毒素影响的研究[J]. 现代中西医结合杂志, 2021, 30(13): 1369-1374. MU G H, ZHAO Z J, JIANG L, et al. Effects of coptis-cinnamon on intestinal microflora and endotoxin in db/db mice[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2021, 30(13): 1369-1374 (in Chinese). DOI:10.3969/j.issn.1008-8849.2021.13.001 |
| [3] |
穆卫涛. LPS诱导鸡几个炎症反应相关基因的表达调控研究[D]. 硕士学位论文. 哈尔滨: 哈尔滨师范大学, 2016. MU W T. Expression and regulation of several inflammatory related genes induced by LPS in chickens[D]. Master's Thesis. Harbin: Harbin Normal University, 2016. (in Chinese) |
| [4] |
刘磊, 曾东, 潘康成, 等. 益生菌调控肠道闭锁蛋白表达的机制[J]. 动物营养学报, 2020, 32(4): 1526-1535. LIU L, ZENG D, PAN K C, et al. Mechanisms of probiotics regulating occludin expression in intestine[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1526-1535 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.04.008 |
| [5] |
张韵, 赵丽娜, 曹琳, 等. 益生凝结芽孢杆菌的筛选及生物学特性研究[J]. 中国畜牧杂志, 2017, 53(1): 109-114. ZHANG Y, ZHAO L N, CAO L, et al. Screening and biological characteristics of probiotic Bacillus coagulans[J]. Chinese Journal of Animal Science, 2017, 53(1): 109-114 (in Chinese). |
| [6] |
柳成东, 肖明霞, 赵平, 等. 饲用凝结芽孢杆菌对感染产肠毒素大肠杆菌K88断奶仔猪生长性能和肠道健康的影响[J]. 动物营养学报, 2021, 33(8): 4373-4383. LIU C D, XIAO M X, ZHAO P, et al. Effect of dietary Bacillus coagulans on growth performance and intestinal health of weaned piglets challenged with enterotoxigenic Escherichia coli K88[J]. Chinese Journal of Animal Nutrition, 2021, 33(8): 4373-4383 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.08.018 |
| [7] |
王焱. 凝结芽孢杆菌LT3的益生特性及对LPS诱导的大鼠盲肠损伤保护作用的研究[D]. 硕士学位论文. 沈阳: 沈阳农业大学, 2020. WANG Y. Study on the probiotic properties of Bacillus coagulans LT3 and its protective effect on LPS-induced cecal injury in rats[D]. Master's Thesis. Shenyang: Shenyang Agricultural University, 2020. (in Chinese) |
| [8] |
胡婷, 刘博文, 张华, 等. 凝结芽孢杆菌BC-HYI对蛋雏鸡促生长作用的研究[J]. 动物营养学报, 2022, 34(2): 939-950. ZHANG T, LIU B W, ZHANG H, et al. Growth promoting effects of Bacillus congealus BC-HYI on layer chickens[J]. Chinese Journal of Animal Nutrition, 2022, 34(2): 939-950 (in Chinese). |
| [9] |
杜红方, 郭玉光, 王敏, 等. 日粮中添加复合酶对肉鸡生长性能、血液生化指标、肠道形态和屠宰性能的影响[J]. 中国畜牧杂志, 2017, 53(11): 96-100. DU H F, GUO Y G, WANG M, et al. Effects of compound enzymes on growth performance, blood biochemical indexes, intestinal morphology and slaughter performance of broilers[J]. Chinese Journal of Animal Science, 2017, 53(11): 96-100 (in Chinese). |
| [10] |
吴正可, 张安荣, 陈志敏, 等. 凝结芽孢杆菌对肉鸡生长性能、血清生化指标和胫骨强度指标的影响[J]. 畜牧兽医学报, 2021, 52(4): 1031-1041. WU Z K, ZHANG A R, CHEN Z M, et al. Effects of Bacillus coagulans on growth performance, serum biochemical indices and tibia strength indices of broilers[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(4): 1031-1041 (in Chinese). |
| [11] |
申维维, 吴琼, 胡迪, 等. 凝结芽孢杆菌BC-HYI对肉鸡生长及肠道形态结构的影响[J]. 北京农学院学报, 2021, 36(3): 50-56. SHEN W W, WU Q, HU D, et al. Effect of Bacillus coagulans BC-HYI on growth and intestinal morphology of broilers[J]. Journal of Beijing University of Agriculture, 2021, 36(3): 50-56 (in Chinese). |
| [12] |
WU H, LUO T, LI Y M, et al. Granny Smith apple procyanidin extract upregulates tight junction protein expression and modulates oxidative stress and inflammation in lipopolysaccharide-induced Caco-2 cells[J]. Food & Function, 2018, 9(6): 3321-3329. |
| [13] |
姚东升, 徐琳, 王骆冰, 等. 肾衰Ⅱ号方对慢性肾功能衰竭模型大鼠肠道紧密连接蛋白的影响[J]. 中医杂志, 2021, 62(10): 898-903. YAO D S, XU L, WANG L B, et al. Effect of Shenshuai Formula Ⅱ on intestinal tight junction protein in chronic renal failure model rats[J]. Journal of Traditional Chinese Medicine, 2021, 62(10): 898-903 (in Chinese). |
| [14] |
王梦竹, 贾军峰, 崔一喆, 等. 脂多糖诱导的肠屏障蛋白及其信号通路研究进展[J]. 动物营养学报, 2020, 32(5): 2060-2065. WANG M Z, JIA J F, CUI Y Z, et al. Research progress on lipopolysaccharide-induced intestinal barrier signaling pathway[J]. Chinese Journal of Animal Nutrition, 2020, 32(5): 2060-2065 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.05.014 |
| [15] |
ZHU H M, LI L, LI S Y, et al. Effect of water extract from Berberis heteropoda Schrenk roots on diarrhea-predominant irritable bowel syndrome by adjusting intestinal flora[J]. Journal of Ethnopharmacology, 2019, 237: 182-191. DOI:10.1016/j.jep.2019.03.045 |
| [16] |
宋晓珍. 复合益生菌对炎症性肠病小鼠肠黏膜屏障的保护机制研究[D]. 硕士学位论文. 沈阳: 中国医科大学, 2019. SONG X Z. Protective mechanism of Yikechang on intestinal mucosal barrier in mice with inflammatory bowel disease[D]. Master's Thesis. Shenyang: China Medical University, 2019. (in Chinese) |
| [17] |
MURRAY M J, GONZE M D, NOWAK L R, et al. Serum D(-)-lactate levels as an aid to diagnosing acute intestinal ischemia[J]. American Journal of Surgery, 1994, 167(6): 575-578. DOI:10.1016/0002-9610(94)90101-5 |
| [18] |
苏璇, 罗开发, 吴亮, 等. 梗阻性黄疸大鼠胆汁内、外引流术后血浆二胺氧化酶活性变化与肠粘膜屏障变化的相关性研究[J]. 现代生物医学进展, 2014, 14(17): 3216-3219, 3247. SU X, LUO K F, WU L, et al. The correlation study of the plasma diamine oxidase activities and the intestinal barrier function in rats with obstructive jaundice after internal and external biliary drainages[J]. Progress in Modern Biomedicine, 2014, 14(17): 3216-3219, 3247 (in Chinese). |
| [19] |
黄启亮, 李丹, 谢莉敏, 等. 肉鸡肠粘膜通透性模型的建立[J]. 家禽科学, 2015(6): 3-6. HUANG Q L, LI D, XIE L M, et al. Construction intestinal permeability model for broilers[J]. Poultry Science, 2015(6): 3-6 (in Chinese). DOI:10.3969/j.issn.1673-1085.2015.06.001 |
| [20] |
韩玉萍, 白亚妮. 微生态制剂对肝硬化伴自发性腹膜炎患者血清炎性因子、肠道屏障功能以及肝功能的影响[J]. 陕西医学杂志, 2017, 46(4): 537-538. HAN Y P, BAI Y N. Effects of probiotics on serum inflammatory factors, intestinal barrier function and liver function in patients with cirrhosis and semi spontaneous peritonitis[J]. Shaanxi Medical Journal, 2017, 46(4): 537-538 (in Chinese). DOI:10.3969/j.issn.1000-7377.2017.04.059 |
| [21] |
江巧丽, 谢齐贵. 益生菌辅助治疗乙肝后肝硬化失代偿期的临床效果[J]. 中国医药导报, 2016, 13(20): 111-114. JIANG Q L, XIE Q G. Clinical effect of assistant intake of probiotics on patients with decompen-sation stage of HBV-related hepatic cirrhosis[J]. China Medical Herald, 2016, 13(20): 111-114 (in Chinese). |
| [22] |
尹馨雪, 兰梦, 郅慧, 等. 鹿茸血酶解肽对脂多糖诱导的H9c2大鼠心肌细胞损伤的保护作用[J]. 现代食品科技, 2021, 37(8): 8-13, 183. YIN X X, LAN M, ZHI H, et al. Protective effect of the enzymatic peptide from deer antler blood against lipopolysaccharide-induced cardiomyocyte damage in H9c2 rats[J]. Modern Food Science & Technology, 2021, 37(8): 8-13, 183 (in Chinese). |
| [23] |
兰斌, 张钰, 龙睿, 等. 小柴胡汤"去滓重煎"对LPS诱导发热白兔模型体温及血清IL-1β、IL-6和TNF-α水平的影响[J]. 湖南中医药大学学报, 2020, 40(12): 1468-1472. LAN B, ZHANG Y, LONG R, et al. Effects of Xiaochaihu Decoction after "deslagging and re-boiling" on body temperatures and serum levels of IL-1β, IL-6 and TNF-α in LPS-induced fever model white rabbits[J]. Journal of Hunan University of Chinese Medicine, 2020, 40(12): 1468-1472 (in Chinese). DOI:10.3969/j.issn.1674-070X.2020.12.006 |
| [24] |
李天珍. LPS致雏鸡炎症模型的建立及其应用初探[D]. 硕士学位论文. 贵阳: 贵州大学, 2019. LI T Z. Establishment of LPS-induced chick inflammation model and its application[D]. Master's Thesis. Guiyang: Guizhou University, 2019. (in Chinese) |
| [25] |
张曼, 金鑫, 田巧珍, 等. 益生菌对肠道先天防御反应调节作用的研究进展[J]. 中国畜牧兽医, 2017, 44(12): 3656-3662. ZHANG M, JIN X, TIAN Q Z, et al. Advances in modulation of intestinal innate defense responses by probiotic bacteria[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(12): 3656-3662 (in Chinese). |
| [26] |
刘绍琼. mTOR信号通路在LPS诱导肉鸡肠道黏膜免疫应激中的作用[D]. 博士学位论文. 泰安: 山东农业大学, 2015. LIU S Q. The role of mTOR pathway in intestinal mucosal immune stress of broilers induced by LPS[D]. Ph. D. Thesis. Tai'an: Shandong Agricultural University, 2015. (in Chinese) |
| [27] |
李园园. 益生菌补充对吡嗪酰胺致大鼠肝脏及肠黏膜损伤影响研究[D]. 硕士学位论文. 青岛: 青岛大学, 2018. LI Y Y. Effects of probiotics supplementation on liver and intestinal mucosal injury induced by pyrazinamide in rats[D]. Master's Thesis. Qingdao: Qingdao University, 2018. (in Chinese) |
| [28] |
石梦玄. 动物双歧杆菌A6对小鼠肠道黏膜损伤的缓解作用及其机理研究[D]. 硕士学位论文. 邯郸: 河北工程大学, 2016. SHI M X. Bifidobacterium animals A6 ameliorates intestinal mucosal injury of mice and study on its mechanism[D]. Master's Thesis. Handan: Hebei Engineering University, 2016. (in Chinese) |
| [29] |
孙林. 富硒酵母对OTA诱导的肉鸡肠道黏膜屏障损伤干预作用的研究[D]. 硕士学位论文. 沈阳: 沈阳农业大学, 2019. SUN L. Interventional effect of selenium-enriched yeast on OTA-induced intestinal mucosal barrier injury in broilers[D]. Master's Thesis. Shenyang: Shenyang Agricultural University, 2019. (in Chinese) |
| [30] |
付志丽, 蒲健, 李龚路, 等. 金骨莲胶囊对炎症模型大鼠的抗炎作用及机制研究[J]. 中国药房, 2021, 32(9): 1077-1082. FU Z L, PU J, LI G L, et al. Study on anti-inflammatory effect and mechanism of Jingulian Capsule on inflammatory model rats[J]. China Pharmacy, 2021, 32(9): 1077-1082 (in Chinese). |
| [31] |
郝雅蓉, 解慧林, 陈渠, 等. 益生菌对肉鸡生长性能及缓解LPS引起的肝脏炎症的研究[J]. 畜牧与兽医, 2019, 51(4): 48-53. HAO Y R, XIE H L, CHEN Q, et al. Probiotics improve growth performance of broilers and alleviate their liver inflammation caused by LPS[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(4): 48-53 (in Chinese). |




