2. 阿坝职业学院, 阿坝 623200;
3. 四川省畜牧科学研究院, 动物遗传育种四川省重点实验室, 成都 610066
2. A'ba Vocational College, A'ba 623200, China;
3. Animal Genetics and Breeding Key Laboratory of Sichuan Province, Animal Science Academy of Sichuan Province, Chengdu 610066, China
解淀粉芽孢杆菌可产生多种抗菌物质,因其具有良好的安全性和益生作用,常被作为生防菌进行研究和应用,并且具有被开发为动物益生菌的潜力[1]。目前解淀粉芽孢杆菌已被广泛应用于医疗[2]、饲料[3]、环境修复[4]、食品[5]等领域。Fei等[6]报道,解淀粉芽孢杆菌GB-9可显著提高杂交鲟血清中过氧化氢酶和溶菌酶活性等免疫指标,并认为该菌可成为水产养殖中的饲料添加剂。Wang等[7]报道,饲喂解淀粉芽孢杆菌SC06可提高黄羽肉鸡机体抗氧化能力和免疫功能。将菌株制备成微生物制剂可长期保持菌株,便于实际生产中的使用和贮藏,已有研究者将微生物制剂应用于家畜和家禽的饲养研究中,并取得了理想的试验结果[8-9]。金堂黑山羊是四川省重要的肉羊品种之一。目前尚未见羊源解淀粉芽孢杆菌对金堂黑山羊生长性能、血清生化指标、肌肉发育相关基因表达影响的报道。因此,本试验以解淀粉芽孢杆菌fsznc-06作为研究对象,将其应用于金堂黑山羊的饲养试验中,探究该菌株对金堂黑山羊生长性能和免疫功能的作用,从而为其在动物饲养中的应用提供科学依据。
1 材料与方法 1.1 试验材料试验菌株为本课题组前期从金堂黑山羊粪便中分离的具有广谱抑菌作用的菌株fsznc-06,经生理生化和分子生物学鉴定该菌株为解淀粉芽孢杆菌,保种于西南民族大学青藏高原动物遗传资源保护与利用重点实验室。已采用冷冻干燥法和响应面分析法将该菌株制备成冻干菌剂,冻干保护剂配方为3.102%丙三醇、2.926%蔗糖和7.096%葡萄糖。试验动物为20只80日龄雄性金堂黑山羊,断奶10 d,平均初始体重为(17.15±0.52) kg,购自四川省某山羊核心育种公司。
1.2 主要试剂及仪器RNAiso Plus、PrimeScriptTM RT Reagent Kit、DL-2000 Marker、TB GreenTM Premix Ex TaqTMⅡ酶均购于宝生物工程(大连)有限公司;QuantStudio 3实时荧光定量PCR仪购自Thermo Fisher(美国)公司;Scan-STAR K胴体肉质切面积扫描仪购自麦特斯(德国)公司。
1.3 试验设计及饲粮将黑山羊随机分为2组,每组10个重复,每个重复1只,单栏(长3.0 m×宽3.0 m×高1.0 m)单饲。将无菌水加入解淀粉芽孢杆菌fsznc-06冻干菌剂中并将其浓度配制为109 CFU/mL(活菌浓度)。试验组每2 d灌服1 mL浓度为109 CFU/mL的解淀粉芽孢杆菌fsznc-06冻干菌剂,对照组每2 d灌服1 mL空白的菌剂保护剂(3.102%丙三醇、2.926%蔗糖和7.096%葡萄糖)。预试期为7 d,正试期为30 d,试验期间自由采食和饮水,试验地点为四川省成都某种羊场。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the experimental diet (air-dry basis) |
饲养30 d后对各组黑山羊体重进行称量,统计采食量,计算平均日采食量(ADFI)、平均日增重(ADG)和饲料转化率(FCR)。禁食、禁水12 h后前颈静脉采血10 mL,立即于4 ℃、3 500×g离心10 min收集血清,-20 ℃保存。解剖并观查各内脏有无病变,取出心脏、肝脏、脾脏、肺脏、肾脏、盲肠、结肠与直肠、小肠、胃,剔除筋膜及脂肪组织后称重,计算各器官指数。分别对胴体、净肉和全骨进行称量,并计算屠宰率、净肉率和骨肉比,Scan-STAR K测定眼肌面积。以上指标计算公式如下:

|

|
采用总超氧化物歧化酶(T-SOD)试剂盒(羟胺法)、碱性磷酸酶(AKP)试剂盒(可见光比色法)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(比色法)、总抗氧化能力(T-AOC)试剂盒(比色法)和丙二醛(MDA)试剂盒(TBA法)测定血清T-SOD、AKP、GSH-Px活性、T-AOC和MDA含量,以上试剂盒均购自南京建成生物工程研究所。采用酶联免疫吸附测定(ELISA)法试剂盒测定血清免疫球蛋白G(IgG)、肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)含量,以上试剂盒均购自江苏宝莱生物科技有限公司。
1.6 肌纤维指标测定取4%多聚甲醛固定液中背最长肌和臀肌组织进行包埋、切片和染色,每个肌肉组织样本采集3张400倍图片,采用图像分析软件Image-Pro Plus 6.0(美国Media Cybernetics公司)测量肌纤维密度以及10个肌纤维直径和面积。
1.7 肌肉发育相关基因表达测定提取背最长肌和臀肌组织总RNA,质检合格后反转录得cDNA。采用王波等[10]、史晓雪等[11]、胡宇超等[12]、尹丽卿[13]使用的纤黏连蛋白1(FN1)、转化生长因子β1(TGFβ1)、脂肪酸合成酶(FAS)、脂蛋白脂酶(LPL)、过氧化物酶体增殖物激活受体-γ(PPAR-γ)、过氧化氢酶(CAT)、肌球蛋白重链Ⅰ(MyHCⅠ)、肌球蛋白重链Ⅱa(MyHCⅡa)、肌球蛋白重链Ⅱb(MyHCⅡb)和肌球蛋白重链Ⅱx(MyHCⅡx)基因引物,并参考GenBank中山羊生肌决定因子1(MYOD1,XM018058990.1)、肌细胞生成素(MYOG,NM001285733.1)、生肌因子5(MYF5,NM001287037.1)和固醇调节元件结合蛋白-1(SREBP-1,DQ455606.1)基因序列,采用Primer Premier 5.0设计引物,采用β-肌动蛋白(ACTB)作为内参基因。以上引物均由上海生工生物工程技术服务有限公司合成。引物序列见表 2。
|
|
表 2 实时荧光定量PCR引物序列 Table 2 Primer sequence for qRT-PCR |
实时荧光定量PCR反应体系10 μL:Primer F 0.8 μL,Primer R 0.8 μL,DEPC H2O 2.2 μL,TB GreenTM Premix Ex TaqTM Ⅱ 5.2 μL,cDNA模板1.0 μL。优化后的反应条件:95 ℃预变性3 min;95 ℃变性10 s,退火20 s(各基因退火温度见表 2),72 ℃延伸30 s,共39个循环;熔解曲线阶段95 ℃ 15 s,60 ℃ 1 min,95 ℃ 5 s。应用QuantStudioTM Design & Analysis Software v1.4.2绘制标准曲线并检测各组背最长肌和臀肌样品表达情况。每个样品进行3次技术重复,并设置无cDNA模板的阴性对照。采用2-ΔΔCt方法计算各基因相对表达量,用QuantStudioTM Design & Analysis Software v1.4.2统计qRT-PCR表达数据和绘制各基因标准曲线。
1.8 数据统计和分析试验数据采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),用Tukey’s-b程序进行多重比较,结果以平均值±标准差(mean±SD)表示。以P < 0.05表示差异显著,以P < 0.01表示差异极显著。用GraphPad Prism 5.0软件制图。
2 结果与分析 2.1 解淀粉芽孢杆菌fsznc-06对金堂黑山羊生长性能和屠宰性能的影响由表 3可知,与对照组相比,试验组平均日增重显著提高35.14%(P < 0.05),平均日采食量显著提高16.30%(P < 0.05),饲料转化率显著提高13.37%(P < 0.05)。
|
|
表 3 解淀粉芽孢杆菌fsznc-06对黑山羊生长性能的影响 Table 3 Effects of Bacillus amyloliquefaciens fsznc-06 on growth performance of black goats (n=10) |
由表 4、表 5可知,与对照组相比,试验组胴体重、屠宰率、净肉重和净肉率显著提高(P < 0.05),而骨重、骨肉比和眼肌面积变化不显著(P>0.05);对各脏器重量进行称量发现,仅心脏指数和肝脏指数显著提高(P < 0.05),而其他脏器指数均不显著(P>0.05)。
|
|
表 4 解淀粉芽孢杆菌fsznc-06对黑山羊屠宰性能的影响 Table 4 Effects of Bacillus amyloliquefaciens fsznc-06 on slaughter performance of black goats (n=10) |
|
|
表 5 解淀粉芽孢杆菌fsznc-06对黑山羊器官指数的影响 Table 5 Effects of Bacillus amyloliquefaciens fsznc-06 on organ indexes of black goats (n=10)g/kg |
由表 6可知,与对照组相比,试验组血清T-AOC、IgG和IFN-γ含量分别提高了81.07%(P < 0.01)、29.17%(P < 0.01)和41.83%(P < 0.05),MDA含量降低了15.72%(P < 0.05),T-SOD、AKP、GSH-Px活性和TNF-α含量变化不显著(P>0.05)。
|
|
表 6 解淀粉芽孢杆菌fsznc-06对黑山羊血清生化和免疫指标的影响 Table 6 Effects of Bacillus amyloliquefaciens fsznc-06 on serum indexes of biochemical and immunological of black goats (n=10) |
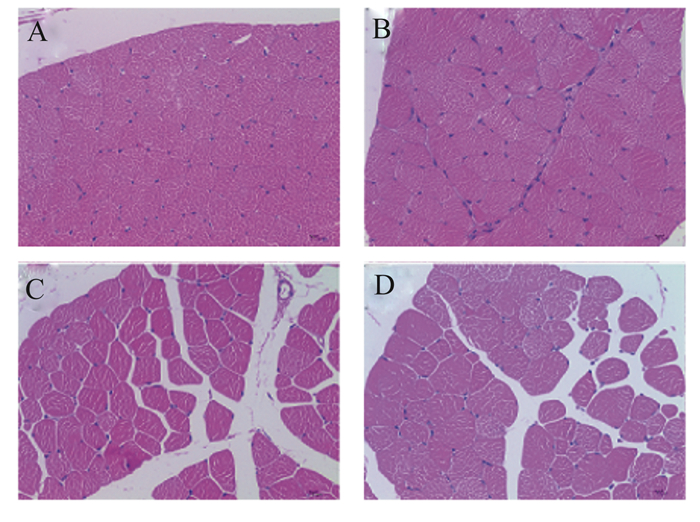
黑山羊背最长肌和臀肌组织石蜡切片如图 1所示,肌肉纤维结构清晰,可用于肌纤维直径、面积和密度的测量,测量结果见表 7。试验组背最长肌纤维直径以及臀肌纤维直径和面积极显著降低(P < 0.01),背最长肌纤维面积显著降低(P < 0.05),背最长肌纤维密度极显著提高(P < 0.01),而臀肌纤维密度较对照组提高12.55%(P>0.05)
|
A和C:试验组背最长肌和臀肌;B和D:对照组背最长肌和臀肌。 A and C: longissimus dorsi and gluteus of experimental group; B and D: longissimus dorsi and gluteus of control group. 图 1 肌肉横切面苏木精-伊红染色结果 Fig. 1 Cross section of HE staining of muscle (400×) |
|
|
表 7 解淀粉芽孢杆菌fsznc-06对黑山羊肌肉纤维的影响 Table 7 Effects of Bacillus amyloliquefaciens fsznc-06 on muscle fiber of black goats (n=10) |
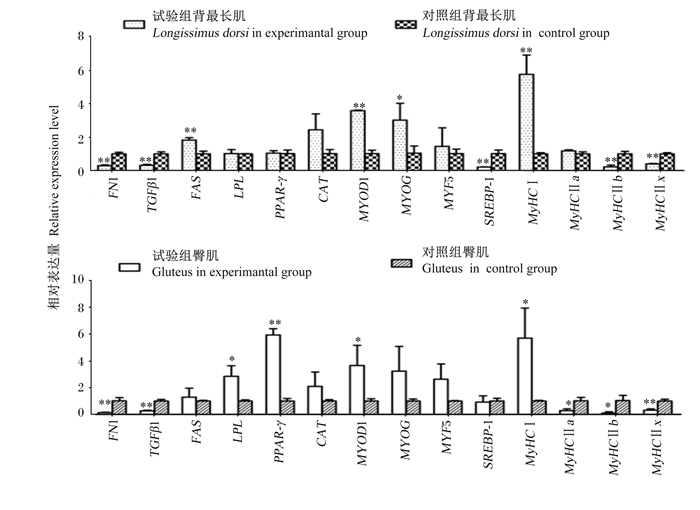
由图 2可知,与对照组相比,试验组背最长肌MYOD1(P < 0.01)和MYOG(P < 0.05)以及臀肌MYOD1(P < 0.05)基因相对表达量显著或极显著提高。试验组背最长肌MYF5基因相对表达量较对照组提高43.14%(P>0.05),而臀肌MYOG和MYOD1基因相对表达量较对照组分别提高220.79%(P>0.05)和163.00%(P>0.05)。另外,试验组背最长肌和臀肌FN1与TGFβ1基因相对表达量极显著降低(P < 0.01)。
|
*: P < 0.05; **: P < 0.01。FN1:纤黏连蛋白1 fibronectin 1;TGFβ1: 转化生长因子β1 transforming growth factor β1;FAS: 脂肪酸合成酶fatty acid synthase;LPL: 脂蛋白脂酶lipoprotein lipase;PPAR-γ: 过氧化物酶体增殖物激活受体-γ peroxisome proliferators-activated receptors-γ;CAT: 过氧化氢酶catalase;MYOD1: 生肌决定因子1 myogenic differentiation 1;MYOG: 肌细胞生成素myogenin;MYF5: 生肌因子5 myogenic factor 5;SREBP-1: 固醇调节元件结合蛋白-1 sterol-regulatory element binding protein-1;MyHCⅠ: 肌球蛋白重链Ⅰ myosin heavy chain Ⅰ;MyHCⅡa: 肌球蛋白重链Ⅱa myosin heavy chain Ⅱa;MyHCⅡb: 肌球蛋白重链Ⅱb myosin heavy chain Ⅱb;MyHCⅡx: 肌球蛋白重链Ⅱx myosin heavy chain Ⅱx。 图 2 解淀粉芽孢杆菌fsznc-06对黑山羊背最长肌和臀肌中各基因相对表达量的影响 Fig. 2 Effects of Bacillus amyloliquefaciens fsznc-06 on relative expression levels of genes in longissimus dorsi and gluteus of black goats (n=10) |
与对照组相比,试验组背最长肌FAS基因相对表达量极显著提高(P < 0.01),SREBP-1基因相对表达量极显著降低(P < 0.01),LPL和PPAR-γ基因相对表达量无显著变化(P>0.05)。另外,试验组臀肌LPL(P < 0.05)和PPAR-γ(P < 0.01)基因相对表达量较对照组显著或极显著提高,FAS基因相对表达量较对照组提高31%(P>0.05),而SREBP-1基因相对表达量较对照组下降8.91%(P>0.05)。
试验组背最长肌MyHCⅠ基因相对表达量极显著高于对照组(P < 0.01),MyHCⅡb和MyHCⅡx基因相对表达量极显著低于对照组(P < 0.01),MyHCⅡa基因相对表达量较对照组有升高趋势(P>0.05)。试验组臀肌MyHCⅠ基因相对表达量显著高于对照组(P < 0.05),MyHCⅡa和MyHCⅡb基因相对表达量显著低于对照组(P < 0.05),MyHCⅡx基因相对表达量极显著低于对照组(P < 0.01)。
3 讨论解淀粉芽孢杆菌不仅具有广谱抑菌作用,还对动物具有良好的安全性和益生作用[14]。郭政宏[15]报道,解淀粉芽孢杆菌SWUN-TP23能在一定程度上提高小鼠生长性能和免疫力。Chaudhari等[16]在饲粮中添加芽孢杆菌发现,其显著提高了球虫病鸡的体重。目前关于解淀粉芽孢杆菌的作用机制尚不清楚。有研究表明,饲喂解淀粉芽孢杆菌后该菌能定植于动物肠道内[17]。该菌能改善肠道环境,促进营养物质的吸收,提高动物健康水平[18-19]。本试验研究发现,灌服解淀粉芽孢杆菌fsznc-06的黑山羊平均日增重、平均日采食量、饲料转化率、胴体重、屠宰率、净肉重和净肉率显著提高,心脏指数和肝脏指数显著提高。这说明灌服30 d解淀粉芽孢杆菌fsznc-06可提高黑山羊生长性能和屠宰性能。血清T-SOD、AKP、GSH-Px活性、T-AOC和MDA含量是评价机体生长和免疫的重要指标。李仕成[20]报道,饲喂1×108 CFU/g的解淀粉芽孢杆菌J4显著提高罗非鱼血清T-SOD、AKP、LZM活性等指标。本试验中,血清T-AOC及IgG和IFN-γ含量显著提高,MDA含量显著降低。这说明灌服30 d解淀粉芽孢杆菌fsznc-06可提高黑山羊机体抗氧化和清除自由基的能力,间接地提高了机体免疫能力。
肌纤维直径、面积和密度可直观评价肌肉组织肉质情况,而对肌肉发育、脂代谢和肌纤维类型相关基因表达的研究可在基因层次对生长、发育和肉质进行评价。根据MyHC基因亚型的不同肌纤维类型可分为MyHCⅠ、MyHCⅡa、MyHCⅡx和MyHCⅡb,动物在出生后随着机体生长,肌肉纤维类型由Ⅰ型转化Ⅱa再转化为Ⅱb型[21]。MyHCⅠ和MyHCⅡa(氧化型)基因表达量与肉质指标呈正相关,MyHCⅡx和MyHCⅡb(酵解型)基因表达量则与肉质指标呈负相关[12]。在本研究中,试验组背最长肌和臀肌MyHCⅠ基因相对表达量均显著提高,而MyHCⅡx和MyHCⅡb基因相对表达量显著低于对照组,这表示试验组背最长肌和臀肌肌纤维均为氧化型。另外,试验组肌纤维直径和面积显著低于对照组,肌纤维面积显著高于对照组,这将有利于提高肌肉嫩度,与肌纤维类型结果相符,说明解淀粉芽孢杆菌fsznc-06可提高黑山羊背最长肌和臀肌的肉质,与杨敏馨等[22]探究解淀粉芽孢杆菌ES-2对肉鸡肉质影响的研究结果相似。MYOD1、MYOG、MYF5是3个重要的肌肉发育基因,它们在羔羊的生长阶段发挥着重要的作用[23-24]。在本试验中,饲喂解淀粉芽孢杆菌fsznc-06的黑山羊背最长肌MYOD1和MYOG以及臀肌MYOD1基因相对表达量高于对照组,这将有助于羔羊早期的肌肉的发育。肌组织的发生和发育要经过分子、细胞、形态等一系列的复杂过程,肌肉发育基因对肉质的影响不是简单的构象改变,涉及到多种细胞因子和转录因子间的调控,这可能是本试验中肌肉发育基因(MYOD1和MYOG)的显著表达与肌肉直径的测量结果存在一定冲突的原因[25]。另外,根据王薇[26]研究发现,MYOD1表达可能会对猪肉品质造成影响,而长期饲喂羔羊或成羊解淀粉芽孢杆菌fsznc-06对MYOD1表达的影响情况以及肌肉发育基因对肌纤维直径的影响尚需进一步验证。FN1基因会使肌肉组织纤维化,TGFβ的表达与肌肉营养不良、损伤、少肌症等疾病有着密切的关系[10, 27]。本试验中,试验组FN1和TGFβ1基因相对表达量显著低于对照组,说明解淀粉芽孢杆菌fsznc-06可抑制FN1和TGFβ1的表达从而降低肌肉疾病的发生。FAS基因可促进肌肉脂肪沉积,PPAR-γ基因可抑制脂肪沉积,LPL是PPAR-γ主要的靶基因、SREBP-1参与着脂肪合成[11, 28]。本试验中,试验组背最长肌LPL和PPAR-γ基因的低表达使得FAS基因出现高表达的情况,而试验组臀肌的试验结果与前者相反。这说明解淀粉芽孢杆菌fsznc-06降低臀肌瘦肉率的效果优于背最长肌。另外,本试验发现解淀粉芽孢杆菌fsznc-06可以提高肌肉CAT基因相对表达量但不显著,这可能有助于提高肌肉抗氧化能力,与杨敏馨等[22]探究解淀粉芽孢杆菌ES-2对鸡肌肉抗氧化能力影响的结果相近。
4 结论本试验结果表明,灌服解淀粉芽孢杆菌fsznc-06可提高金堂黑山羊育肥羊生长性能、屠宰性能、血清生化和免疫指标以及肌肉发育基因的相对表达量。
| [1] |
VAZQUEZ-MENDOZA P, ELGHANDOUR M M M, ALABA P A, et al. Antimicrobial and bactericidal impacts of Bacillus amyloliquefaciens CECT 5940 on fecal shedding of pathogenic bacteria in dairy calves and adult dogs[J]. Microbial Pathogenesis, 2018, 114: 458-463. DOI:10.1016/j.micpath.2017.11.040 |
| [2] |
ALGBURI A, ALAZZAWI S A, AL-EZZY A I A, et al. Potential probiotics Bacillus subtilis KATMIRA1933 and Bacillus amyloliquefaciens B-1895 co-aggregate with clinical isolates of Proteus mirabilis and prevent biofilm formation[J]. Probiotics and Antimicrobial Proteins, 2020. DOI:10.1007/s12602-020-09631-0 |
| [3] |
LIU Y L, XING R G, YANG H Y, et al. Chitin extraction from shrimp (Litopenaeus vannamei) shells by successive two-step fermentation with Lactobacillus rhamnoides and Bacillus amyloliquefaciens[J]. International Journal of Biological Macromolecules, 2020, 148: 424-433. DOI:10.1016/j.ijbiomac.2020.01.124 |
| [4] |
LIU C X, XU Q M, YU S C, et al. Bio-removal of tetracycline antibiotics under the consortium with probiotics Bacillus clausii T and Bacillus amyloliquefaciens producing biosurfactants[J]. Science of the Total Environment, 2020, 710: 136329. DOI:10.1016/j.scitotenv.2019.136329 |
| [5] |
BINDIYA E S, TINA K J, SASIDHARAN R S, et al. BaCf3:highly thermostable bacteriocin from Bacillus amyloliquefaciens BTSS3 antagonistic on food-borne pathogens[J]. Biotech, 2019, 9(4): 136. |
| [6] |
FEI H, LIN G D, ZHENG C C, et al. Effects of Bacillus amyloliquefaciens and Yarrowia lipolytica lipase 2 on immunology and growth performance of Hybrid sturgeon[J]. Fish & Shellfish Immunology, 2018, 82: 250-257. |
| [7] |
WANG Y Y, WANG Y B, XU H, et al. Direct-fed glucose oxidase and its combination with B. amyloliquefaciens SC06 on growth performance, meat quality, intestinal barrier, antioxidative status, and immunity of yellow-feathered broilers[J]. Poultry Science, 2018, 97(10): 3540-3549. DOI:10.3382/ps/pey216 |
| [8] |
朱复跃. 饲料中添加复合微生物制剂对肉鸭生长性能及粪便中NH3和H2S含量的影响[J]. 黑龙江畜牧兽医, 2019(6): 120-122. ZHU F Y. Effects of compound microorganism preparation in feed on growth performance and the content of NH3 and H2S of meat ducks[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(6): 120-122 (in Chinese). |
| [9] |
刘冬姣. 饲料中添加复合微生物制剂对仔猪生长性能及粪便中NH3和H2S含量的影响[J]. 中国饲料, 2018(21): 17-20. LIU D J. Effects of compound microorganism preparation in feed on growth performance and the content of NH3 and H2S of piglet[J]. China Feed, 2018(21): 17-20 (in Chinese). |
| [10] |
王波, 刁志成, 马勇, 等. 日粮添加油脂和出生类型对羔羊肌肉胶原蛋白特性及相关基因表达的影响[J]. 畜牧兽医学报, 2019, 50(4): 771-780. WANG B, DIAO Z C, MA Y, et al. Effects of dietary oil supplementation and birth types on muscle collagen characteristics and related genes expression in muscle of lamb[J]. Chinese Journal of Animal and Veterinary Sciences, 2019, 50(4): 771-780 (in Chinese). |
| [11] |
史晓雪, 牛占宇, 幸超, 等. 梧桐籽油和罗格列酮对绵羊组织中脂代谢相关酶基因表达的影响[J]. 中国农业大学学报, 2018, 23(10): 71-79. SHI X X, NIU Z Y, XING C, et al. Effects of phoenix tree seed oil and rosiglitazone on the expression of enzymes related to lipid metabolism of sheep tissues[J]. Journal of China Agricultural University, 2018, 23(10): 71-79 (in Chinese). DOI:10.11841/j.issn.1007-4333.2018.10.09 |
| [12] |
胡宇超, 王园, 孟子琪, 等. 发酵麸皮多糖对肉羊肉品质、肌肉氨基酸组成及肌肉抗氧化酶和肌纤维类型相关基因表达的影响[J]. 动物营养学报, 2020, 32(2): 932-940. HU Y C, WANG Y, MENG Z Q, et al. Effects of fermented wheat bran polysaccharides on meat quality, muscle amino acid composition and expression of antioxidant enzymes and muscle fiber type-related genes in muscle of mutton sheep[J]. Chinese Journal of Animal Nutrition, 2020, 32(2): 932-940 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.02.049 |
| [13] |
尹丽卿. 不同饲养方式下苏尼特羊肌纤维特性和MyHC基因对肉质的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2016. YIN L Q. The effect of muscle fiber characteristics and MyHC gene on meat quality of Sunit sheep in different feeding conditions[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2016. (in Chinese) |
| [14] |
HÜTT P, SHCHEPETOVA J, LÕIVUKENE K, et al. Antagonistic activity of probiotic Lactobacilli and Bifidobacteria against entero- and uropathogens[J]. Journal of Applied Microbiology, 2006, 100(6): 1324-1332. DOI:10.1111/j.1365-2672.2006.02857.x |
| [15] |
郭政宏. 藏猪源益生芽孢杆菌的分离鉴定及候选益生菌株的筛选[D]. 硕士学位论文. 成都: 西南民族大学, 2016. GUO Z H. Isolation and identification of probiotic Bacillus from Tibetan pigs and screening of candidate probiotic strain[D]. Master's Thesis. Chengdu: Southwest Minzu University, 2016. (in Chinese) |
| [16] |
CHAUDHARI A A, LEE Y, LILLEHOJ H S. Beneficial effects of dietary supplementation of Bacillus strains on growth performance and gut health in chickens with mixed coccidiosis infection[J]. Veterinary Parasitology, 2020, 277: 109009. DOI:10.1016/j.vetpar.2019.109009 |
| [17] |
杨艳红, 余瑛, 胡永强, 等. 解淀粉芽孢杆菌AF1对雏鸡益生性能和肠道菌群的影响[J]. 重庆理工大学学报(自然科学), 2019, 33(11): 199-206. YANG Y H, YU Y, HU Y Q, et al. Effects of Bacillus amyloliquefaciens AF1 on chicken's live performance and intestinal flora[J]. Journal of Chongqing University of Technology (Natural Science), 2019, 33(11): 199-206 (in Chinese). |
| [18] |
栾素军, 邢焕, 孙永波, 等. 解淀粉芽孢杆菌在畜禽养殖中的应用研究进展[J]. 中国畜牧兽医, 2016, 43(10): 2615-2620. LUAN S J, XING H, SUN Y B, et al. Research Progress on Bacillus amyloliquefaciens in animal breeding Industry[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(10): 2615-2620 (in Chinese). |
| [19] |
王美玲, 吴骏晨, 朱赟程, 等. 解淀粉芽孢杆菌在动物生产中应用的研究进展[J]. 中国畜牧杂志, 2017, 53(2): 19-23. WANG M L, WU J C, ZHU C, et al. Research progress on application of Bacillus amyloliquefaciens in animal production[J]. Chinese Journal of Animal Science, 2017, 53(2): 19-23 (in Chinese). |
| [20] |
李仕成. 拮抗罗非鱼无乳链球菌的芽孢杆菌筛选与研究[D]. 硕士学位论文. 长沙: 湖南农业大学, 2016. LI S C. Screening and studies of antagonistic Bacillus against Streptocossus agalactiae[D]. Master's Thesis. Changsha: Hunan Agricultural University, 2016. (in Chinese) |
| [21] |
努孜古丽·图尔荪. 新疆地方绵羊品种肌纤维特性与产肉量及肉品质的相关性研究[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2015. TUERSUN NUZIGULI. The correlation study to muscle fiber characteristics and meat quality with meat production of local sheep breeds in Xinjiang[D]. Master's Thesis. Urumqi: Xinjiang Agricultural University, 2015. (in Chinese) |
| [22] |
杨敏馨, 寇涛, 李悦, 等. 解淀粉芽孢杆菌ES-2对肉鸡屠宰性能和肉品质及肌肉抗氧化能力的影响[J]. 南京农业大学学报, 2016, 39(2): 255-261. YANG M X, KOU T, LI Y, et al. Effect of Bacillus amyloliquefaciens ES-2 on carcass characteristics, meat quality and antioxidative status of broilers[J]. Journal of Nanjing Agricultural University, 2016, 39(2): 255-261 (in Chinese). |
| [23] |
张静, 郭月英, 任霆, 等. 生肌调节因子及其对肉质的影响[J]. 食品与发酵工业, 2014, 40(5): 183-187. ZHANG J, GUO Y Y, REN T, et al. MRFs and the effect of MRFs on meat quality[J]. Food and Fermentation Industries, 2014, 40(5): 183-187 (in Chinese). |
| [24] |
BONNET M, CASSAR-MALEK I, CHILLIARD Y, et al. Ontogenesis of muscle and adipose tissues and their interactions in ruminants and other species[J]. Animal, 2010, 4(7): 1093-1109. DOI:10.1017/S1751731110000601 |
| [25] |
赵广珍. MyoD1基因与猪肉质性状相关性分析[D]. 硕士学位论文. 保定: 河北农业大学, 2012. ZHAO G Z. Relationship analysis between MyoD1 gene and meat quality traits in pig[J]. Master's Thesis. Baoding: Hebei Agricultural University, 2012. (in Chinese) |
| [26] |
王薇. 山猪肉质性状主要相关基因的遗传特性及其对肉质的作用和影响[D]. 博士学位论文. 南京: 南京师范大学, 2012. WANG W. The genetic characteristics of the major genes related to quality traits of mountain pork and their effects on meat quality[D]. Ph. D. Thesis. Nanjing: Nanjing Normal University, 2012. (in Chinese) |
| [27] |
王今越, 王小虹, 冯维斗. 运动训练抑制了TGFβ通路并缓解了D-半乳糖诱导衰老大鼠的肌肉流失[J]. 体育科学, 2014, 34(10): 72-77. WANG J Y, WANG X H, FENG W D. Exercise trainning inhibiting TGFβ pathway and improving D-glactose injection-induced senescent muscle loss in rat[J]. China Sport Science, 2014, 34(10): 72-77 (in Chinese). DOI:10.3969/j.issn.1000-677X.2014.10.009 |
| [28] |
栾兆进, 刘开东, 贺建宁, 等. 绵羊FAM134B、PPARγ、HSL和FAS基因表达量及与肌内脂肪含量的关系[J]. 畜牧兽医学报, 2016, 47(12): 2379-2389. LUAN Z J, LIU K D, HE J N, et al. The FAM134B, PPARγ, HSL and FAS gene expression patterns and their association with intramuscular fat content in sheep[J]. Chinese Journal of Animal and Veterinary Sciences, 2016, 47(12): 2379-2389 (in Chinese). DOI:10.11843/j.issn.0366-6964.2016.12.007 |




