2. 中国科学院 大学现代农业科学学院, 北京 100049;
3. 湖南师范大学生命科学学院, 动物肠道功能调控湖南省重点实验室, 长沙 410081;
4. 湖南农业大学动物科学技术学院, 长沙 410128;
5. 四川省畜牧科学研究院, 动物遗传育种 四川省重点实验室, 畜禽生物制品四川省重点实验室, 四川省畜科饲料有限公司, 成都 610066
2. College of Advanced Agricultural Sciences, University of Chinese Academy of Sciences, Beijing 100049, China;
3. Hunan Province Key Laboratory of Animal Intestinal Function and Regulation, College of Life Sciences, Hunan Normal University, Changsha 410081, China;
4. School of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China;
5. Sichuan Animal Feed Co., Ltd., Sichuan Key Laboratory of Livestock and Poultry Biological Products, Sichuan Key Laboratory of Animal Genetics and Breeding, Sichuan Animal Husbandry Research Institute, Chengdu 610066, China
肠道是动物机体内消化吸收营养物质的主要器官,也是最大的免疫器官,是阻止病原微生物感染的第1道屏障,具有重要的防御功能。进入肠道中的营养物质首先与肠道黏膜直接接触,肠道黏膜屏障主要由健康完整的肠道上皮细胞和细胞间的紧密连接构成,故肠道上皮细胞是维持肠道屏障功能和免疫调节功能的主要执行者[1]。研究表明,肠道屏障功能紊乱会造成肠道上皮细胞通透性的增加,导致有害物质进入细胞后促进炎症因子的表达和分泌,加速动物机体的炎症反应[2-3]。因此,调节肠上皮细胞的紧密连接蛋白表达和细胞因子含量对维持肠道屏障功能具有十分重要的意义[3]。
锌是哺乳动物必需的微量元素之一,是机体多种酶的重要组成成分和激活因子,参与细胞内信号传导和代谢增殖,在细胞生长、免疫功能和营养代谢等生理或病理过程中起着关键作用。锌还是猪饲粮中使用的一种促生长添加剂,能调节肠道菌群和减少组胺释放,有效缓解仔猪断奶应激[4-7]。研究表明,饲粮中添加锌可以降低断奶后仔猪腹泻的发生率,改善肠道屏障的结构和功能[8]。动物缺锌则会损害消化、免疫、神经、内分泌和皮肤系统,导致T淋巴细胞数量减少、氧化应激、肠道功能障碍和炎症细胞浸润等[9-10]。此外,饲粮中添加有机锌对动物生长性能的作用效果要优于无机锌。俞成浩等[11]研究发现,同等剂量的乳酸锌对肉兔生长性能的提高效果要好于硫酸锌。王荣蛟等[12]研究表明,饲粮中添加乳酸锌可极显著提高仔猪小肠绒毛高度,降低隐窝深度,改善养分消化利用率,提高仔猪的生长性能。王彬等[13]研究表明,饲粮中添加纳米氧化锌和普通氧化锌能显著提高生长育肥猪血清中免疫球蛋白A(IgA)含量,显著提高血清中白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)含量,提高生长性能,降低腹泻率。目前关于乳酸锌和硫酸锌对动物肠道健康的作用更多是体现在一些表观指标上,作用机制与效果的对比研究甚少。因此,本研究以仔猪空肠上皮细胞系IPEC-J2细胞为模型,探讨乳酸锌和硫酸锌对猪小肠上皮细胞紧密连接蛋白、炎症细胞因子及锌转运载体的影响,旨在了解两者在调节仔猪小肠细胞屏障和炎症反应方面可能发挥的作用机制。
1 材料与方法 1.1 细胞来源IPEC-J2细胞由中国农业大学农业农村部饲料工业中心惠赠。
1.2 试验材料乳酸锌(锌含量21.5%)、硫酸锌(锌含量21.5%)由四川省某饲料有限公司提供;硫酸锌配制时用基础培养基DMEM溶解,0.22 μm除菌过滤器过滤除菌,现用现配。细胞基础培养基DMEM/F-12(1 ∶ 1)、胎牛血清(FBS)、胰蛋白酶(2.5 g/L)以及青(链)霉素均购自Gibco公司,总RNA提取反转录试剂盒以及荧光定量试剂盒均购于北京TaKaRa公司,细胞活力试剂盒与炎症因子酶联免疫吸附试验(ELISA)试剂盒均购于苏州科铭生物技术有限公司。
1.3 IPEC-J2细胞培养将复苏的IPEC-J2细胞接种于含有1%双抗和10% FBS的DMEM/F-12培养基,放入37 ℃、5%的二氧化碳(CO2)培养箱(Thermo公司,美国)中培养,当细胞密度达到80%~90%时消化传代,进行后续试验。
1.4 细胞活力检测使用细胞计数试剂盒(8肽胆囊收缩素,CCK-8)检测细胞活力(Dojindo,日本)。IPEC-J2细胞以8×103个/孔的密度接种于96孔板中,生长至融合度为80%;然后分别用含0(对照)、1.0、5.0、7.5、10.0和20.0 mg/mL乳酸锌或硫酸锌(以锌计)的DMEM处理细胞,处理时间选择36 h[14],每个浓度水平设置8孔重复。处理完成后,将10 mol/L CCK-8溶液加入96孔板培养的细胞中,37 ℃孵育30 min,用酶标仪在450 nm处测定吸光度(OD)值,并计算细胞活力。计算公式如下:

|
式中:A(加药)表示具有细胞、CCK-8溶液和药物溶液的孔的OD值;A(空白)表示具有培养基和CCK-8溶液而没有细胞的孔的OD值;A(0加药)表示具有细胞、CCK-8溶液而没有药物溶液的孔的OD值。
1.5 IPEC-J2细胞处理试验共分为3组:对照组、乳酸锌组和硫酸锌组,每组3个重复。将消化后的IPEC-J2细胞以均等的浓度接种至6孔板中,共接种6板,待细胞生长至约80%时,弃培养液,用磷酸盐缓冲液(PBS)清洗1次,更换为筛选出的7.5 mg/mL乳酸锌和硫酸锌培养基处理36 h。每孔加入2 mL处理液,收集细胞培养上清液及细胞,-80 ℃保存备用。
1.6 细胞因子含量测定收集培养基于离心管,4 ℃、12 000 r/min离心30 min,取上清待测。根据IL-6、TNF-α、白细胞介素-1β(IL-1β)、富含半胱氨酸肠蛋白1(CRIP1)、富含半胱氨酸肠蛋白2(CRIP2)试剂盒(苏州科铭生物技术有限公司)操作步骤,将标准品工作液和待测样品加入酶标板中,每孔100 μL,于37 ℃培养箱中孵育90 min。弃去液体,每孔加入100 μL的生物素化抗体工作液,覆膜,37 ℃培养箱中孵育60 min。洗板3次。每孔中加入酶结合工作液100 μL,37 ℃培养箱中孵育30 min,重复洗板3次。每孔加入底物溶液90 μL,覆膜置于37 ℃培养箱中避光孵育15 min。最后向每孔加入终止液50 μL,终止反应后30 min之内用酶标仪在波长450 nm处测量各孔的OD值。计算炎症因子IL-1β、IL-6和TNF-α含量。
1.7 mRNA相对表达量测定采用实时荧光定量PCR法测定IPEC-J2细胞TNF-α、IL-6、IL-1β、锌转运蛋白-1(ZNT-1)、CRIP1、CRIP2、封闭蛋白-1(claudin-1)和闭合蛋白(occludin)的mRNA相对表达量。根据GenBank提供的猪基因序列,用Primer Express 5.0软件设计引物。引物序列见表 1,引物由上海生物工程有限公司合成。
|
|
表 1 引物序列 Table 1 Primer sequences |
按照Trizol试剂盒(TaKaRa公司,日本)使用说明提取总RNA。RNA质量和浓度使用超微量核酸分析仪(Biodrop公司,英国)进行检测,其纯度以OD260 nm/OD280 nm值介于1.8~2.0为使用标准。以β-肌动蛋白(β-actin)为内参基因,根据逆转录试剂盒(TaKaRa公司,日本)将RNA反转录为cDNA。以反转录产物cDNA为模板使用荧光定量PCR(CFX96,Bio-Rad公司,英国)进行基因扩增。反应程序为:95 ℃ 3 min预变性,95 ℃ 10 s变性;58 ℃ 30 s延伸;40个循环。各基因的mRNA相对表达量用2-△△Ct法计算。
1.8 蛋白质免疫印迹检测当IPEC-J2细胞融合处理完成后,弃去细胞培养板中的培养基,用PBS冲洗3次,冰上裂解10 min,收集细胞于1.5 mL的EP管中,4 ℃、12 000 r/min离心5 min,取上清置于新的EP管中备用;根据样品数量,按50体积二喹啉甲酸(BCA)试剂A加1体积BCA试剂B(50 ∶ 1)配制适量BCA工作液,充分混匀;完全溶解蛋白标准品,浓度为2 mg/mL,将标准品分别按0(对照)、1、2、4、8、12、16和20 μL加到96孔板的标准品孔中,加标准品稀释液补足到20 μL。加25 μL样品到96孔板的样品孔中;各孔加入200 μL BCA工作液,37 ℃放置30 min;测定550 nm波长的OD值。根据标准曲线计算出蛋白浓度。采用BCA试剂盒(上海碧云天生物技术有限公司)测定550 nm波长的OD值。根据标准曲线计算出样品的蛋白浓度。取60 μL蛋白上清,加入15 μL 5×loading buffer混匀,沸水煮5 min,放入冰盒中速冷备用。制胶电泳后转膜封闭,一抗二抗依次孵育(表 2),增强化学发光(ECL)显色曝光,扫描胶片,用凝胶成像处理系统分析claudin-1和E-钙黏蛋白(E-cadherin)条带灰度值。
|
|
表 2 抗体孵育比例 Table 2 Incubation ratio of antibodies |
试验数据先用Excel 2019软件进行整理和分析,然后使用SPSS 22.0统计软件对数据进行单因素方差分析(one-way ANOVA,LSD),单因素方差分析显著时,采用Duncan氏法对数据进行多重比较,结果数据以平均值(mean)±标准误(standard error,SE)表示,以P>0.05为差异不显著,P<0.05为差异显著,P<0.01为差异极显著,0.05<P<0.10为有差异显著趋势。
2 结果与分析 2.1 乳酸锌和硫酸锌对IPEC-J2细胞活力的影响由图 1可知,与对照组相比,5.0和7.5 mg/mL乳酸锌组细胞活力均显著升高(P<0.05),且7.5 mg/mL乳酸锌组细胞活力较对照组提高近50%;1.0、7.5和10.0 mg/mL硫酸锌组细胞活力均显著升高(P<0.05);当浓度为7.5 mg/mL时,乳酸锌组和硫酸锌组细胞活力均显著高于对照组(P<0.05)。综合考虑,选择7.5 mg/mL乳酸锌或硫酸锌处理36 h进行后续试验。
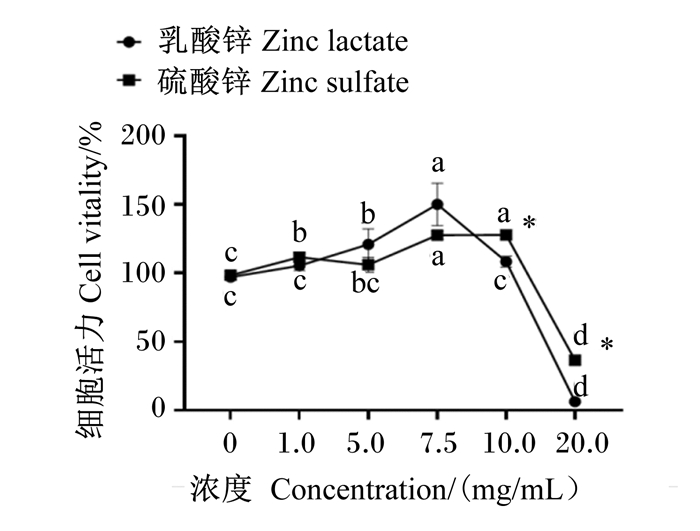
|
同一折线数据点标注相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05);*表示同一浓度不同锌源差异显著(P<0.05)。 In the same broken line, value points with the same letters mean no significant difference (P > 0.05), while with different letters mean significant difference (P < 0.05). * mean significant difference between different zinc sources with the same concentration (P < 0.05). 图 1 乳酸锌和硫酸锌对IPEC-J2细胞活力的影响 Fig. 1 Effects of zinc lactate and zinc sulfate on cell viability of IPEC-J2 cells |
由表 3可知,与对照组相比,乳酸锌组细胞内促炎症因子IL-1β和IL-6含量显著降低(P<0.05),分别下降了21.72%和50.37%,而细胞内TNF-α含量无显著影响(P>0.05);硫酸锌组细胞内IL-1β、IL-6和TNF-α含量显著降低(P<0.05),分别下降了40.62%、38.23%和31.30%。
|
|
表 3 乳酸锌和硫酸锌对IPEC-J2细胞炎性因子含量的影响 Table 3 Effects of zinc lactate and zinc sulfate on inflammatory factor contents in IPEC-J2 cells |
由表 4可知,与对照组相比,乳酸锌组和硫酸锌组细胞内IL-1β、IL-6和TNF-α的mRNA相对表达量均有所降低,其中,乳酸锌组细胞内TNF-α的mRNA相对表达量显著降低(P<0.05),硫酸锌组细胞内IL-6和TNF-α的mRNA相对表达量显著降低(P<0.05)。
|
|
表 4 乳酸锌和硫酸锌对IPEC-J2细胞炎性因子mRNA相对表达量的影响 Table 4 Effects of zinc lactate and zinc sulfate on mRNA relative expression levels of inflammatory factors in IPEC-J2 cells |
由表 5可知,与对照组相比,乳酸锌组和硫酸锌组细胞内锌转运载体CRIP1和CRIP2的含量均有所提高,其中硫酸锌组显著提高(P<0.05)。
|
|
表 5 乳酸锌和硫酸锌对IPEC-J2细胞锌转运载体含量的影响 Table 5 Effects of zinc lactate and zinc sulfate on zinc transporter contents in IPEC-J2 cells |
由表 6可知,与对照组相比,乳酸锌组细胞内锌转运载体ZNT-1、CRIP1和CRIP2的mRNA相对表达量显著提高(P<0.05);硫酸锌组细胞内仅ZNT-1和CRIP2的mRNA相对表达量显著提高(P<0.05),且效果都略低于乳酸锌组。
|
|
表 6 乳酸锌和硫酸锌对IPEC-J2细胞锌转运载体mRNA相对表达量的影响 Table 6 Effects of zinc lactate and zinc sulfate on mRNA relative expression levels of zinc transporters in IPEC-J2 cells |
由图 2-A可知,与对照组相比,乳酸锌组细胞内claudin-1 mRNA相对表达量显著降低(P<0.05),乳酸锌组和硫酸锌组细胞内occludin mRNA相对表达量均无显著差异(P>0.05)。由图 2-B和图 2-C可知,与对照组相比,乳酸锌组细胞内紧密连接蛋白claudin-1的蛋白相对表达量显著提高(P<0.05),硫酸锌组细胞内claudin-1的蛋白相对表达量无显著差异(P>0.05);乳酸锌组和硫酸锌组细胞内E-cadherin的蛋白相对表达量均无显著差异(P>0.05)。
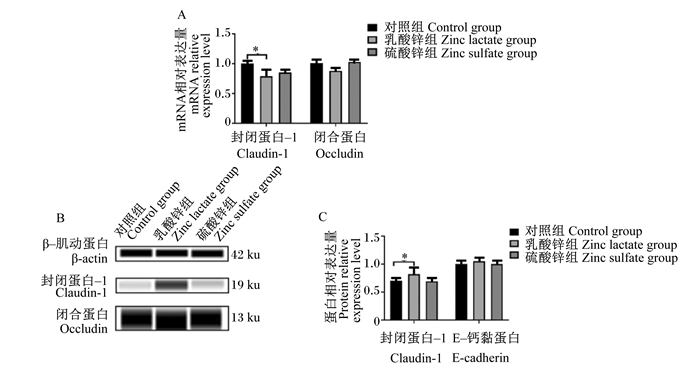
|
*表示差异显著(P<0.05)。 * represented significant difference (P < 0.05). 图 2 乳酸锌和硫酸锌对IPEC-J2细胞紧密连接蛋白的影响 Fig. 2 Effects of zinc lactate and zinc sulfate on tight junction protein in IPEC-J2 cells |
本研究结果表明,IPEC-J2细胞中添加1.0~10.0 mg/mL的乳酸锌或硫酸锌,均能不同程度地提高细胞活力,但当浓度超过10 mg/mL时则会严重影响IPEC-J2细胞活力,这可能是因为过量锌与其他元素如硒、铁、钙和铜产生拮抗性,抑制细胞的增殖并过度影响细胞的通透性,从而破坏了细胞结构[15]。而当浓度为7.5 mg/mL时,细胞活力的提升均达到最高,这可能是因为此时的锌吸收转运和利用的效率最高,并协同其他元素共同促进细胞的增殖分化。
紧密连接位于上皮和内皮侧膜的最顶端,能够调节水和溶质的平衡。claudin-l被鉴定为定位于肠道上皮细胞上紧密连接的完整膜蛋白,可通过减少细胞旁流量来影响细胞屏障功能[16]。E-cadherin是一种在上皮细胞中表达的黏附蛋白,不仅会对组织内部细胞黏附状态造成影响,还能维持上皮细胞正常的组织结构和形态[16]。当紧密连接的结构和功能被破坏的时候,肠道通透性会有所增加,肠道屏障功能受损[17]。锌对肠道屏障功能目前已经有许多发现,万妍等[18]研究发现,饲粮中添加2 000~3 000 mg/kg氧化锌可以上调细胞紧密连接蛋白claudin-1和occludin的表达来维持肠道通透性和完整性。本试验结果表明,添加乳酸锌可显著上调IPEC-J2细胞紧密连接蛋白claudin-1的表达,维护肠道黏膜结构,从而改善小肠上皮细胞的屏障功能;而乳酸锌下调claudin-1 mRNA的表达可能是因为mRNA降解和蛋白量增加负反馈调节mRNA表达。同时,本研究中添加硫酸锌对IPEC-J2细胞claudin-1的表达无显著影响,这可能是由于无机锌在消化过程中释放出的金属离子易与其他物质(如植酸、草酸和磷酸根离子)结合成不溶性盐排除体外,从而降低了硫酸锌的生物利用率。有研究表明,锌缺乏会导致人结肠癌细胞Caco-2的occludin和E-cadherin含量大幅度降低[19];而Davin等[20]研究发现,硫酸锌能上调Caco-2细胞的蛋白激酶C信号分子,提高occludin和E-cadherin的表达。本研究结果与上述结果都不一致,表明添加乳酸锌和硫酸锌对occludin mRNA和E-cadherin的表达均无显著影响,这可能是因为在IPEC-J2细胞中锌对物理屏障功能的影响不涉及此蛋白的变化,而是在其他细胞中发挥作用。
3.2 乳酸锌和硫酸锌对IPEC-J2细胞免疫屏障的影响体内锌缺乏会导致肠黏膜免疫屏障受损并伴随炎症细胞的浸润,过度表达的促炎细胞因子如IL-1β、IL-6和TNF-α会损害肠道的完整性和上皮细胞的功能[9-10]。本试验结果表明,添加乳酸锌和硫酸锌均可显著降低IPEC-J2细胞中IL-1β和IL-6含量,这一结果与刁慧等[8]研究发现饲粮中补充锌可以降低促炎细胞因子IL-1β、IL-6和白细胞介素-8(IL-8)含量的结果相一致。马茂涛[21]研究表明,牡蛎多糖锌配合物能显著提高断奶仔猪空肠黏膜抗炎性因子白细胞介素-2含量,显著降低空肠黏膜TNF-α含量。Zhao等[22]研究表明,金针菇锌多糖对脂多糖诱导的小鼠巨噬细胞促炎症因子TNF-α和IL-6的表达有强烈的抑制作用,提示有机锌可抑制促炎症因子的表达。本试验中,添加乳酸锌对IPEC-J2细胞TNF-α mRNA表达抑制作用较硫酸锌更加明显,这不仅说明锌可能会介导炎症信号的转导过程,降低促炎细胞因子的表达和分泌,缓解肠道炎症反应和提高肠道免疫屏障功能,还说明乳酸锌和硫酸锌可能在促炎症因子转录和翻译水平上发挥的作用并不一致,且乳酸锌的作用效果可能更佳。
3.3 乳酸锌和硫酸锌对IPEC-J2细胞锌转运功能的影响锌离子是亲水性带电离子,在机体内不能以简单的被动扩散方式进行跨膜转运,因此,细胞内外锌离子转运及稳态维持主要依靠锌转运蛋白来实现。ZNT-1是一种双功能蛋白,介导锌从细胞质出口到细胞器或细胞外,在促进胞质内锌外流的同时还可以抑制锌通过L型钙通道[23]。Shusterman等[24]研究发现,将胚胎小鼠的纯合ZNT-1基因敲除,胚胎移植不久后就将死亡,表明ZNT-1是胎儿从母体摄取锌的一种重要蛋白分子。本试验结果表明,乳酸锌和硫酸锌处理显著上调IPEC-J2细胞ZNT-1的mRNA表达,表明两者可能对锌的转运有促进作用,且乳酸锌的效果更加显著,这或是由于有机锌在转录水平上生物利用率更高的原因。富含半胱氨酸肠蛋白(CRIP)主要存在于小肠中,是一种饱和的锌离子转运载体,在锌离子转运吸收、维持管腔结构营养吸收等方面可发挥重要的作用[25-26];并且CRIP可参与细胞因子平衡及免疫细胞的分化或成熟,在宿主的免疫防御反应中发挥重要作用[27-29]。本研究发现,不同锌源处理均能提高IPEC-J2细胞CRIP1、CRIP2锌转运蛋白的含量,但硫酸锌的提高作用更加显著;然而,乳酸锌对CRIP1、CRIP2 mRNA相对表达量的上调作用则更为显著。mRNA和蛋白水平是一个相偶联的过程,但是两者没有必然的一致的趋势,这可能是因为多种影响因素影响这一过程,比如mRNA的降解、蛋白的降解、自身表达产生阻遏、修饰折叠等。综上所述,乳酸锌和硫酸锌均可不同程度提高锌转运载体的表达和分泌,可能对锌从肠细胞顶膜到基底膜的转运有促进作用,因而参与细胞内信号传导和细胞增殖,维持上皮细胞的生长分化,提高机体肠道免疫功能,且硫酸锌的作用效果更优。
4 结论当乳酸锌和硫酸锌添加浓度为7.5 mg/mL时,可最大限度提升IPEC-J2细胞活力,调节炎症细胞因子的分泌和表达,一定程度上促进锌的转运,从而改善肠上皮细胞免疫功能;但仅有添加乳酸锌可上调IPEC-J2细胞紧密连接蛋白的表达,改善肠道屏障功能,故乳酸锌效果优于硫酸锌。
| [1] |
张锦秀, 李书伟, 刁慧, 等. 有机锌对动物肠道健康的调控作用研究进展[J]. 中国畜牧杂志, 2021, 57(1): 49-53. ZHANG J X, LI S W, DIAO H, et al. Research progress on regulation of organic zinc on animal intestinal health[J]. Chinese Journal of Animal Science, 2021, 57(1): 49-53 (in Chinese). |
| [2] |
尹蓝梅. 高蛋白饲粮对仔猪肠道免疫及屏障功能的影响研究[D]. 硕士学位论文. 长沙: 湖南师范大学, 2019. YIN L M. The effects of dietary high protein on intestinal immunity and barrier function in piglets[D]. Master's Thesis. Changsha: Hunan Normal University, 2019. (in Chinese) |
| [3] |
叶晓琳, 孙梅. 肠上皮屏障在炎症性肠病发病机制中的作用[J]. 中国小儿急救医学, 2018, 25(9): 698-702. YE X L, SUN M. The role of intestinal epithelial barrier in the pathogenesis of inflammatory bowel disease[J]. Chinese Pediatric Emergency Medicine, 2018, 25(9): 698-702 (in Chinese). DOI:10.3760/cma.j.issn.1673-4912.2018.09.013 |
| [4] |
郭晓波. 海藻多糖对仔猪小肠上皮细胞屏障功能的调控作用[D]. 硕士学位论文. 南昌: 江西农业大学, 2019. GUO X B. Regulation of seaweed polysaccharide on the barrier function of intestinal porcine epithelial cells[D]. Master's Thesis. Nanchang: Jiangxi Agricultural University, 2019. (in Chinese) |
| [5] |
IBS K H, RINK L. Zinc-altered immune function[J]. The Journal of Nutrition, 2003, 133(5 Suppl 1): 1452S-1456S. |
| [6] |
MCDONALD C M, MANJI K P, KISENGE R, et al. Daily zinc but not multivitamin supplementation reduces diarrhea and upper respiratory infections in Tanzanian infants: a randomized, double-blind, placebo-controlled clinical trial[J]. The Journal of Nutrition, 2015, 145(9): 2153-2160. DOI:10.3945/jn.115.212308 |
| [7] |
FINAMORE A, MASSIMI M, CONTI DEVIRGILIIS L, et al. Zinc deficiency induces membrane barrier damage and increases neutrophil transmigration in Caco-2 cells[J]. The Journal of Nutrition, 2008, 138(9): 1664-1670. DOI:10.1093/jn/138.9.1664 |
| [8] |
刁慧, 张锦秀, 晏家友, 等. 锌对断奶仔猪肠道屏障功能的影响[J]. 饲料工业, 2020, 41(19): 12-17. DIAO H, ZHANG J X, YAN J Y, et al. Effects of zinc on intestinal barrier function of weaned piglets[J]. Feed Industry, 2020, 41(19): 12-17 (in Chinese). |
| [9] |
SHI H N, SCOTT M E, STEVENSON M M, et al. Energy restriction and zinc deficiency impair the functions of murine T cells and antigen-presenting cells during gastrointestinal nematode infection[J]. The Journal of Nutrition, 1998, 128(1): 20-27. DOI:10.1093/jn/128.1.20 |
| [10] |
BAO S Y, KNOELL D L. Zinc modulates cytokine-induced lung epithelial cell barrier permeability[J]. American Journal of Physiology: Lung Cellular and Molecular Physiology, 2006, 291(6): L1132-L1141. DOI:10.1152/ajplung.00207.2006 |
| [11] |
俞成浩, 郭志强, 雷岷, 等. 乳酸锌对断奶肉兔生长性能、肠道发育和血清生化指标的影响[J]. 动物营养学报, 2021, 33(2): 1055-1062. YU C H, GUO Z Q, LEI M, et al. Effects of zinc lactate on growth performance, intestinal development and serum biochemical indexes of weaned rabbits[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 1055-1062 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.02.045 |
| [12] |
王荣蛟, 信爱国, 张春勇, 等. 乳酸锌对仔猪小肠形态学、小肠黏膜金属硫蛋白1和组织急性期蛋白mRNA表达的影响[J]. 动物营养学报, 2014, 26(4): 1068-1076. WANG R J, XIN A G, ZHANG C Y, et al. Effects of zinc lactate on intestinal morphology, mRNA expressions of metallothioneins 1 in intestinal mucosa and acute phase proteins in tissues of weaner piglets[J]. Chinese Journal of Animal Nutrition, 2014, 26(4): 1068-1076 (in Chinese). DOI:10.3969/j.issn.1006-267x.2014.04.028 |
| [13] |
王彬, 刘路杰, 祝佳, 等. 纳米氧化锌对断奶仔猪生长性能、血清免疫和生化指标的影响[J]. 动物营养学报, 2016, 28(11): 3626-3633. WANG B, LIU L, ZHU J, et al. Effects of zinc oxide nanoparticles on growth performance, serum immune and biochemical indices of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2016, 28(11): 3626-3633 (in Chinese). DOI:10.3969/j.issn.1006-267x.2016.11.032 |
| [14] |
韩国全, 余冰, 陈代文, 等. 乳酸锌对猪空肠上皮细胞IPEC-J2增殖及相关调控基因mRNA表达的影响[J]. 畜牧兽医学报, 2012, 43(5): 740-747. HAN G Q, YU B, CHEN D W, et al. Effect of zinc lactate on cell proliferation and related-regulatory genes mRNA expression in porcine jejunal epithelial cells IPEC-J2[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(5): 740-747 (in Chinese). |
| [15] |
洪树涛. 在体外镉与DNA相互作用: 镉结合的协同性和钙、镁、锌竞争的拮抗性[J]. 国外医学(卫生学分册), 1986(1): 44-45. HONG S T. Cadmium-DNA interactions in vitro: synergism of cadmium-binding and antagonism to calcium, magnesium, and zinc competition[J]. Foreign Medical Sciences (Section Hygiene), 1986(1): 44-45 (in Chinese). |
| [16] |
INAI T, KOBAYASHI J, SHIBATA Y. Claudin-1 contributes to the epithelial barrier function in MDCK cells[J]. European Journal of Cell Biology, 1999, 78(12): 849-855. DOI:10.1016/S0171-9335(99)80086-7 |
| [17] |
MA T M, XU N, MA X D, et al. Moxibustion regulates inflammatory mediators and colonic mucosal barrier in ulcerative colitis rats[J]. World Journal of Gastroenterology, 2016, 22(8): 2566-2575. DOI:10.3748/wjg.v22.i8.2566 |
| [18] |
万妍, 邵玉新, 张炳坤. 不同阶段日粮锌营养对肉鸡生长性能及肠黏膜屏障功能的影响[J]. 中国家禽, 2020, 42(9): 54-61. WAN Y, SHAO Y X, ZHANG B K. Effects of dietary zinc nutrition on growth performance and intestinal mucosal barrier function of chickens at different phase[J]. China Poultry, 2020, 42(9): 54-61 (in Chinese). |
| [19] |
ZHANG B K, GUO Y M. Supplemental zinc reduced intestinal permeability by enhancing occludin and zonula occludens protein-1 (ZO-1) expression in weaning piglets[J]. British Journal of Nutrition, 2009, 102(5): 687-693. DOI:10.1017/S0007114509289033 |
| [20] |
DAVIN R, 张永刚. 猪小肠上皮细胞作用的新发现[J]. 中国畜牧杂志, 2015, 51(8): 57-60. DAVIN R, ZHANG Y G. Importance of intestinal cells forgut health-IPEC studies[J]. Chinese Journal of Animal Science, 2015, 51(8): 57-60 (in Chinese). DOI:10.3969/j.issn.0258-7033.2015.08.011 |
| [21] |
马茂涛. 牡蛎多糖螯合锌的制备螯合及其对脂多糖刺激断奶仔猪小肠健康的影响[D]. 硕士学位论文. 福州: 福建农林大学, 2017. MA M T. Preparation of zinc-oyster polysaccharide and the effect to lipid stimulation of small intestine health of weaned piglets[D]. Master's Thesis. Fuzhou: Fujian Agriculture and Forestry University, 2017. (in Chinese) |
| [22] |
ZHAO S W, LI B, CHEN G T, et al. Preparation, characterization, and anti-inflammatory effect of the chelate of Flammulina velutipes polysaccharide with Zn[J]. Food and Agricultural Immunology, 2017, 28(1): 162-177. DOI:10.1080/09540105.2016.1230600 |
| [23] |
THINGHOLM T E, RÖNNSTRAND L, ROSENBERG P A. Why and how to investigate the role of protein phosphorylation in ZIP and ZnT zinc transporter activity and regulation[J]. Cellular and Molecular Life Sciences, 2020, 77(16): 3085-3102. DOI:10.1007/s00018-020-03473-3 |
| [24] |
SHUSTERMAN E, BEHARIER O, LEVY S, et al. Zinc transport and the inhibition of the L-type calcium channel are two separable functions of ZnT-1[J]. Metallomics, 2017, 9(3): 228-238. DOI:10.1039/C6MT00296J |
| [25] |
ESCOBAR O, SANDOVAL M, VARGAS A, et al. Role of metallothionein and cysteine-rich intestinal protein in the regulation of zinc absorption by diabetic rats[J]. Pediatric Research, 1995, 37(3): 321-327. DOI:10.1203/00006450-199503000-00012 |
| [26] |
李明月. CRIP1与相关疾病关联性的研究进展[J]. 当代医药论丛, 2019, 17(23): 83-84. LI M Y. Research progress of CRIP1 and related diseases[J]. Contemporary Medicine Forum, 2019, 17(23): 83-84 (in Chinese). DOI:10.3969/j.issn.2095-7629.2019.23.065 |
| [27] |
DAVIS B A, BLANCHARD R K, LANNINGHAM-FOSTER L, et al. Structural characterization of the rat cysteine-rich intestinal protein gene and overexpression of this LIM-only protein in transgenic mice[J]. DNA and Cell Biology, 1998, 17(12): 1057-1064. DOI:10.1089/dna.1998.17.1057 |
| [28] |
CAI H M, CHEN J W, LIU J, et al. CRIP1, a novel immune-related protein, activated by Enterococcus faecalis in porcine gastrointestinal epithelial cells[J]. Gene, 2017, 598: 84-96. DOI:10.1016/j.gene.2016.11.009 |




