2. 晨光生物科技集团股份有限公司, 邯郸 057250
2. Chenguang Biological Technology Group Co., Ltd., Handan 057250, China
现代集约化养殖方式极大地提高了畜牧业生产效率,但是也带来了很多动物健康问题。肉鸡因具有代谢旺盛、抗应激能力较差等特点,在高度规模化养殖条件下极易遭受外界环境及病原微生物的刺激,导致自由基过量产生,造成氧化损伤,使其生长性能及畜产品品质受到严重影响[1-2]。此外,畜禽饲粮中通常使用大量油脂来满足其较高的能量需求,但是油脂中的多不饱和脂肪酸极易氧化酸败,并同时引起饲粮中蛋白质和维生素的氧化损伤,导致养分溶解度和可消化性降低,饲粮品质和营养价值下降。不仅如此,畜禽采食氧化饲粮还会影响其消化吸收过程,降低机体免疫和抗氧化能力,影响健康生长[3-4]。因此,适量使用抗氧化添加剂来保障饲粮品质,提高畜禽抗氧化能力,使其生长潜能得到最大限度地发挥是提高畜牧业经济效益的关键[5]。
近年来,随着传统合成抗氧化剂效率低、毒副作用强等缺点不断显现[6],研发安全高效无毒的天然抗氧化剂已成为饲料行业的热点问题[7]。研究表明,黄酮类化合物具备抗氧化、降血脂、抗肿瘤以及改善肠道菌群等[8-11]多种生物学功能,在食品、药物等领域均表现出了良好的作用效果[12]。畜禽饲粮中使用黄酮类饲料添加剂可以有效改善机体氧化还原状态[13],在一定程度上缓解氧化损伤[14],促进畜禽健康生长[15]。槲皮万寿菊素(quercetagetin)化学名称为3, 3, 4, 5, 6, 7-六羟基黄酮(化学式为C15H10O8),是提取自万寿菊的主要活性成分之一,属于黄酮类化合物中的黄酮醇类[16]。槲皮万寿菊素的体外抗氧化试验证实其具有较强的清除2, 2-联苯基-1-苦基肼基(DPPH)、2, 2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)和羟基自由基(·OH)的能力[17-18],且关于其对肉鸡生长性能和免疫功能的影响已有部分报道,但其对肉鸡抗氧化能力及作用机制的研究还较少。因此,本试验旨在探究槲皮万寿菊素对肉鸡生长性能、养分表观消化率和抗氧化能力的影响,以期为天然抗氧化剂的研发和槲皮万寿菊素在肉鸡养殖中的合理应用提供依据。
1 材料与方法 1.1 试验动物和试验材料试验动物:爱拔益加(AA)肉鸡,购自河南田中禾农牧有限公司。
试验材料:槲皮万寿菊素,主要功能成分含量为81.88%,由河北某生物科技集团股份有限公司提供,以粉剂的形式拌料添加。
1.2 试验设计试验选用480只健康1日龄AA肉鸡,随机分为4个组,每组6个重复,每个重复20只鸡。对照组饲喂玉米-豆粕型基础饲粮,试验组饲喂在基础饲粮中分别添加10、50和100 mg/kg槲皮万寿菊素的试验饲粮。试验期42 d,分为前期1~21日龄和后期22~42日龄。基础饲粮为参照AA肉鸡饲养标准配制的粉状配合饲料,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验前对鸡舍及器具进行消毒处理。饲养过程采用3层立体笼养,试验期间所有鸡只自由采食和饮水。鸡舍采用锅炉控温,自然光照加人工补光,相对湿度为50%~60%,自然通风结合纵向负压通风,定期打扫鸡舍,常规防疫和免疫。每天观察记录试验鸡采食、饮水及健康状况,及时记录试验鸡死淘情况及耗料量。
1.4 样品采集在试验的第22天和第43天,从每个重复中选取1只接近平均体重的健康鸡,进行翅静脉采血,静置4 h,3 600 r/min离心10 min制备血清,-80 ℃冻存。其中,第43天采血后再进行颈静脉放血处死,解剖得到肝脏、胸肌样品,-80 ℃冻存,测定前使用匀浆机制备肝脏、胸肌匀浆液备用。
1.5 指标测定及方法 1.5.1 生长性能试验第21天和第42天20:00开始禁食,自由饮水,分别在第1、22和43天对肉鸡以重复为单位称重,准确记录肉鸡体重及耗料量。
1.5.2 养分表观消化率采用全收粪法,每个重复随机挑选2只接近平均体重的健康鸡,收集试验第38~41天全部排泄物称重,并准确记录期间采食量。收集粪样后加入10%硫酸溶液混匀,并在60~65 ℃烘干至恒重,自然状态下回潮24 h,称重记录,粉碎后过40目筛备用。饲粮和粪样中粗蛋白质含量采用凯氏定氮法测定,粗脂肪含量采用乙醚浸提法测定,钙含量采用乙二胺四乙酸二钠络合滴定法测定,磷含量采用钼黄比色法测定。
1.5.3 抗氧化能力采用南京建成生物工程研究所生产的试剂盒测定血清、肝脏和胸肌总抗氧化能力(T-AOC)和超氧化物岐化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性以及丙二醛(MDA)含量,测定时严格按照试剂盒说明书操作。
1.5.4 肝脏和胸肌核因子E2相关因子2(Nrf2)/抗氧化反应元件(ARE)信号通路相关基因表达采用Trizol法提取肝脏和胸肌中的总RNA,按照TaKaRa Prime ScriptTM RT Reagent Kit with gDNA Eraser(Perfect Real Time)说明书制备cDNA,采用TaKaRa TB Green® Premix Ex TaqTM Ⅱ说明书进行实时荧光定量PCR测定。引物由生工生物工程(上海)股份有限公司设计合成,选用三磷酸甘油醛脱氢酶(GAPDH)作为内参基因,根据2-ΔΔCt法对定量结果进行计算分析。引物序列见表 2。
|
|
表 2 引物序列 Table 2 Primer sequences |
试验数据采用SPSS 26.0统计软件进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行多重比较,同时对槲皮万寿菊素添加水平与效应进行回归分析。结果数据以“平均值±标准差”表示,以P<0.05为差异显著。
2 结果与分析 2.1 饲粮中添加槲皮万寿菊素对肉鸡生长性能的影响由表 3可知,与对照组相比,50和100 mg/kg槲皮万寿菊素添加组肉鸡42日龄体重显著提高(P<0.05)。1~21日龄,与对照组相比,50和100 mg/kg槲皮万寿菊素添加组料重比(F/G)显著降低(P<0.05)。22~42日龄,与对照组相比,50和100 mg/kg槲皮万寿菊素添加组F/G显著降低(P<0.05)。1~42日龄,与对照组相比,50和100 mg/kg槲皮万寿菊素添加组肉鸡平均日增重(ADG)显著提高(P<0.05),平均日采食量(ADFI)和F/G均显著降低(P<0.05)。各组肉鸡其他生长性能指标之间无显著差异(P>0.05)。
|
|
表 3 饲粮中添加槲皮万寿菊素对肉鸡生长性能的影响 Table 3 Effects of dietary quercetagetin on growth performance of broilers |
由表 4可知,对生长性能相关指标进行二次曲线拟合,以42日龄体重、22~42日龄和1~42日龄ADG以及各阶段F/G为依据,肉鸡饲粮中槲皮万寿菊素的适宜添加水平为64.91~68.42 mg/kg。
|
|
表 4 基于回归模型对肉鸡饲粮中槲皮万寿菊素适宜添加水平的估算 Table 4 Estimation of optimal supplemental level of quercetagetin in broilers diets based on regression model |
由表 5可知,与对照组相比,50 mg/kg槲皮万寿菊素添加组肉鸡粗蛋白质表观消化率显著提高(P<0.05),10 mg/kg槲皮万寿菊素添加组肉鸡粗脂肪表观消化率显著提高(P<0.05)。各组肉鸡钙、磷和粗灰分表观消化率之间均无显著性差异(P>0.05)。
|
|
表 5 饲粮中添加槲皮万寿菊素对肉鸡养分表观消化率的影响 Table 5 Effects of dietary quercetagetin on nutrient apparent digestibility of broilers |
由表 6可知,21日龄时,与对照组相比,50和100 mg/kg槲皮万寿菊素添加组肉鸡血清GSH-Px活性显著提高(P<0.05);此外,饲粮中添加不同水平槲皮万寿菊素对肉鸡血清MDA含量、T-AOC以及SOD活性均无显著影响(P>0.05)。42日龄时,与对照组相比,10、50和100 mg/kg槲皮万寿菊素添加组肉鸡血清GSH-Px活性均显著提高(P<0.05),各组肉鸡血清T-AOC、SOD活性和MDA含量之间均无显著性差异(P>0.05)。
|
|
表 6 饲粮中添加槲皮万寿菊素对肉鸡血清抗氧化指标的影响 Table 6 Effects of dietary quercetagetin on antioxidant indices in serum of broilers |
由表 7可知,与对照组相比,10和50 mg/kg槲皮万寿菊素添加组肉鸡肝脏GSH-Px活性显著提高(P<0.05);但各组肉鸡肝脏T-AOC、MDA含量和SOD活性之间均无显著性差异(P>0.05)。与对照组相比,10 mg/kg槲皮万寿菊素添加组肉鸡胸肌T-AOC和SOD活性显著提高(P<0.05);但各组肉鸡胸肌MDA含量和GSH-Px活性之间均无显著性差异(P>0.05)。
|
|
表 7 饲粮中添加槲皮万寿菊素对肉鸡组织抗氧化指标的影响 Table 7 Effects of dietary quercetagetin on antioxidant indices in tissues of broilers |
由图 1可知,与对照组相比,50 mg/kg槲皮万寿菊素添加组肉鸡肝脏Nrf2的mRNA相对表达量显著提高(P<0.05),10、50和100 mg/kg槲皮万寿菊素添加组肉鸡肝脏谷胱甘肽过氧化物酶1(GPX1)的mRNA相对表达量均显著提高(P<0.05);各组肉鸡肝脏超氧化物歧化酶1(SOD1)和谷氨酸半胱氨酸连接酶调节亚基(GCLm)的mRNA相对表达量之间无显著性差异(P>0.05)。
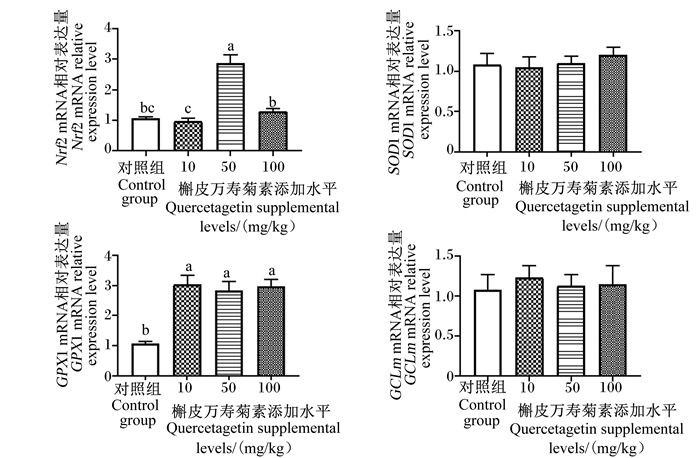
|
数据柱标注不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 饲粮中添加槲皮万寿菊素对肉鸡肝脏Nrf2/ARE信号通路相关基因表达的影响 Fig. 1 Effects of dietary quercetagetin on expression of genes related to Nrf2/ARE signaling pathway in liver of broilers |
由图 2可知,与对照组相比,10、50和100 mg/kg槲皮万寿菊素添加组肉鸡胸肌Nrf2和GPX1的mRNA相对表达量显著提高(P<0.05),50 mg/kg槲皮万寿菊素添加组肉鸡胸肌GCLm的mRNA相对表达量显著提高(P<0.05);各组肉鸡胸肌SOD1的mRNA相对表达量之间无显著性差异(P>0.05)。
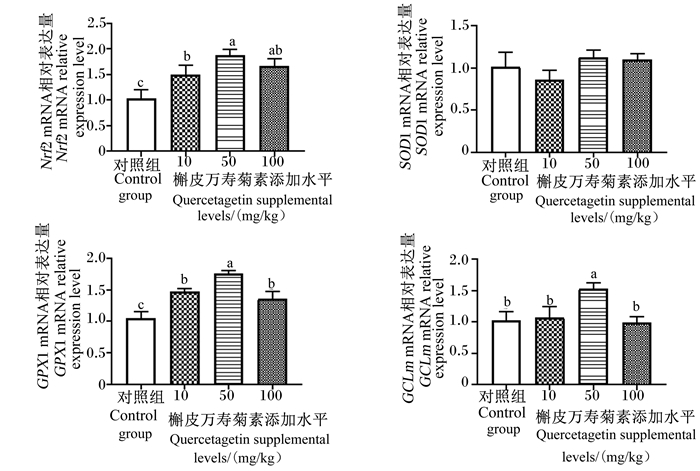
|
图 2 饲粮中添加槲皮万寿菊素对肉鸡胸肌Nrf2/ARE信号通路相关基因表达的影响 Fig. 2 Effects of dietary quercetagetin on expression of genes related to Nrf2/ARE signaling pathway in breast muscle of broilers |
研究表明,黄酮类化合物可以促进生长激素的生成和释放[19],促进畜禽对养分的消化吸收[20],在肉鸡饲粮中使用可以改善其生长性能[21]。Ouyang等[22]在饲粮中添加15 mg/kg苜蓿黄酮提高了AA肉鸡ADG。Goliomytis等[23]研究表明,饲粮添加0.5~1.0 g/kg槲皮素对肉鸡ADG和ADFI无显著影响,但是F/G与对照组相比有所下降。本试验结果发现,在基础饲粮中添加不同水平槲皮万寿菊素同样提高了肉鸡生长性能,其中饲粮添加50和100 mg/kg槲皮万寿菊素显著提高了肉鸡1~42日龄ADG,并显著降低了各阶段F/G;另外,本试验还发现,50和100 mg/kg槲皮万寿菊素添加组肉鸡1~42日龄ADFI较对照组显著下降,此现象在Yang等[24]、李丽平等[25]的试验中也存在,初步分析可能是黄酮类化合物气味酸涩,适口性较差,导致肉鸡采食量略有下降[26]。但是,由于黄酮类化合物的体外抗氧化功能可以有效减缓饲粮中油脂和蛋白质的氧化程度,提高饲粮质量,在一定程度上可以促进肉鸡采食后养分的吸收利用,所以最终反而促进了肉鸡生长[27]。
3.2 饲粮中添加槲皮万寿菊素对肉鸡养分表观消化率的影响黄酮类化合物具有良好的广谱抗菌性,可调控肠道微生物的分布[28],通过促进有益菌群的繁殖抑制有害菌群的生长,进而改善消化道内环境,促进消化酶的分泌[29],最终提高畜禽对饲粮中养分的吸收利用。王盛楠[30]研究表明,饲粮中添加0.02%槲皮素可显著提高AA肉鸡蛋白质表观消化率和胃蛋白酶活性,促进胸肌中蛋白质沉积。李垚等[31]研究发现,饲粮添加0.1%和0.2%沙棘黄酮显著提高了饲粮蛋白质利用率,从而提升肉鸡胴体品质,并显著改善肉品质。本试验结果发现,在肉鸡饲粮中添加10和50 mg/kg槲皮万寿菊素也分别显著提高了粗脂肪和粗蛋白质的表观消化率。其中,饲粮粗蛋白质表观消化率的提高一方面可以节省饲粮成本,缓解粮食资源紧缺问题;另一方面可以促进畜禽体内蛋白质的沉积,改善肉品质[32-33]。结合肉鸡生长情况分析发现,槲皮万寿菊素对饲粮中粗蛋白质和粗脂肪表观消化率的改善作用可能也是肉鸡生长性能有所提高的原因之一。
3.3 饲粮中添加槲皮万寿菊素对肉鸡抗氧化能力的影响氧化还原状态在很大程度上可以反映机体的健康状况,畜禽体内通常存在多种抗氧化酶来调节氧化还原平衡[34-36]。多项研究表明,黄酮类化合物可通过激活抗氧化系统来提高抗氧化酶活性[37],缓解氧化应激[38],提高机体抗氧化能力。丘富安等[39]研究发现,车前子黄酮可以显著提高环磷酰胺诱导的氧化应激蛋鸡的血清T-AOC以及SOD、GSH-Px和过氧化氢酶(CAT)活性,并显著降低血清MDA含量。张毅峰[40]研究表明,饲粮中添加3.75 mg/kg槲皮万寿菊素显著提高了肉鸡42日龄血清SOD和GSH-Px活性以及T-AOC,显著降低了血清MDA含量。本试验结果发现,在肉鸡饲粮中添加10、50和100 mg/kg槲皮万寿菊素也不同程度提高了血清和肝脏GSH-Px活性,并提高了胸肌T-AOC和SOD活性,说明饲粮添加槲皮万寿菊素可以提高组织抗氧化酶活性,同时减少脂质过氧化产物生成,从而增强机体的抗氧化能力,为畜禽生长发育提供更加健康的环境。同时,肌肉抗氧化性能的提升也会缓解组织中蛋白质、核酸等大分子物质的氧化损伤,减少过氧化产物堆积对组织形态功能的破坏,使肉品质有所改善,货架期得到延长。
Nrf2/ARE信号通路是至今为止发现的最为重要的抗氧化和防御信号通路,可调控下游二相解毒酶(GCLm)和抗氧化酶(SOD1、GPX1)基因表达,从而提高机体清除自由基的能力[41],调节机体氧化还原平衡。Nrf2是调控动物体内抗氧化等保护机制的重要核转录因子,Nrf2核转位可激活Nrf2/ARE信号通路[42]。SOD1和GPX1是通路下游重要的抗氧化酶,直接参与机体氧化还原反应;GCLm对非酶抗氧化物谷胱甘肽(GSH)的合成起到重要作用。刘佳人等[43]研究表明,蒲公英黄酮能够显著上调小鼠血清和肝脏中抗氧化基因SOD1、超氧化物歧化酶2(SOD2)、GPX1和谷胱甘肽过氧化物酶4(GPX4)的mRNA表达量。Ishfaq等[44]研究发现,饲粮添加450 mg/kg黄芩苷显著提高了肉鸡脾脏Nrf2的mRNA和蛋白表达水平,激活了Nrf2/ARE信号通路。本试验结果发现,在饲粮中添加10、50和100 mg/kg槲皮万寿菊素不同程度提高了肉鸡肝脏和胸肌中Nrf2、GPX1和GCLm的mRNA相对表达量,这与机体抗氧化酶活性升高的趋势是一致的,说明肉鸡饲粮中添加槲皮万寿菊素可以通过上调组织Nrf2/ARE信号通路相关抗氧化基因的表达水平,以提高抗氧化酶活性,从而增强机体抵御氧化应激的能力。此外,对机体氧化还原状态的调节作用可能也是槲皮万寿菊素发挥免疫调节、抗癌等其他功效的基础,所以本试验对槲皮万寿菊素抗氧化功能及机制的研究也为其后续在畜牧生产领域的研究和应用提供了理论依据。
4 结论① 综上所述,在肉鸡饲粮中添加适宜水平的槲皮万寿菊素能够改善其生长性能,提高饲粮中粗蛋白质和粗脂肪的表观消化率,还可以通过上调Nrf2/ARE信号通路相关基因表达的方式提高抗氧化酶活性,增强机体的抗氧化能力。
② 在本试验条件下,综合考虑ADG、F/G及经济效益等因素,槲皮万寿菊素在肉鸡饲粮中的适宜添加水平为64.91~68.42 mg/kg。
| [1] |
YANG L, LIU G, ZHU X Q, et al. The anti-inflammatory and antioxidant effects of leonurine hydrochloride after lipopolysaccharide challenge in broiler chicks[J]. Poultry Science, 2019, 98(4): 1648-1657. DOI:10.3382/ps/pey532 |
| [2] |
LYKKESFELDT J, SVENDSEN O. Oxidants and antioxidants in disease: oxidative stress in farm animals[J]. Veterinary Journal, 2007, 173(3): 502-511. DOI:10.1016/j.tvjl.2006.06.005 |
| [3] |
DONG Y Y, LEI J Q, ZHANG B K. Effects of dietary quercetin on the antioxidative status and cecal microbiota in broiler chickens fed with oxidized oil[J]. Poultry Science, 2020, 99(10): 4892-4903. DOI:10.1016/j.psj.2020.06.028 |
| [4] |
陆鹏. 豆粕蛋白质氧化对肉鸡消化功能和抗氧化能力及肉品质的影响研究[D]. 博士学位论文. 南京: 南京农业大学, 2018. LU P. Study on the effects of protein oxidation of soybean meal on digestive function, antioxidant status and meat quality in broilers[D]. Ph. D. Thesis. Nanjing: Nanjing Agricultural University, 2018. (in Chinese) |
| [5] |
李杰, 徐彬, 卢敏, 等. 氧化应激对肉鸡的影响及其缓解技术研究进展[J]. 中国畜牧兽医, 2016, 43(2): 507-512. LI J, XU B, LU M, et al. Research progress of effect of oxidative stress on broiler and its mitigation technology[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(2): 507-512 (in Chinese). |
| [6] |
SHIRATSUCHI H, CHANG S, WEI A, et al. Biological activities of low-molecular weight compounds found in foods and plants[J]. Journal of Food and Drug Analysis, 2012, 20(Suppl. 1): 359-365. |
| [7] |
KANATT S R, CHAWLA S P, SHARMA A. Antioxidant and radio-protective activities of lemon grass and star anise extracts[J]. Food Bioscience, 2014, 6: 24-30. DOI:10.1016/j.fbio.2014.03.002 |
| [8] |
CUSHNIE T P T, LAMB A J. Antimicrobial activity of flavonoids[J]. International Journal of Antimicrobial Agents, 2005, 26(5): 343-356. DOI:10.1016/j.ijantimicag.2005.09.002 |
| [9] |
HSU C L, YEN G C. Induction of cell apoptosis in 3T3-L1 pre-adipocytes by flavonoids is associated with their antioxidant activity[J]. Molecular Nutrition & Food Research, 2006, 50(11): 1072-1079. |
| [10] |
XU D, HU M J, WANG Y Q, et al. Antioxidant activities of quercetin and its complexes for medicinal application[J]. Molecules, 2019, 24(6): 1123. DOI:10.3390/molecules24061123 |
| [11] |
陆洪. 万寿菊残渣的成分分离与抗癌活性研究[D]. 硕士学位论文. 天津: 天津大学, 2016. LU H. Study on separation and anticancer activity of compounds from Tagetes erecta L. residue[D]. Master's Thesis. Tianjin: Tianjin University, 2016. (in Chinese) |
| [12] |
BOOTS A W, HAENEN G R M M, BAST A. Health effects of quercetin: from antioxidant to nutraceutical[J]. European Journal of Pharmacology, 2008, 585(2/3): 325-337. |
| [13] |
陈志刚, 雷红宇, 李啟皓, 等. 黄酮类化合物在鸡饲料添加剂中的研究与应用进展[J]. 中国家禽, 2015, 37(14): 49-52. CHEN Z G, LEI H Y, LI Q H, et al. Progress of research and application of flavonoids in chicken feed additives[J]. China Poultry, 2015, 37(14): 49-52 (in Chinese). |
| [14] |
OTT M, GOGVADZE V, ORRENIUS S, et al. Mitochondria, oxidative stress and cell death[J]. Apoptosis, 2007, 12(5): 913-922. DOI:10.1007/s10495-007-0756-2 |
| [15] |
DAFFODIL E D, MOHAN V R. Total phenolics, flavonoids and in vitro antioxidant activity of Nymphaea pubescens wild rhizome[J]. World Journal of Pharmacy and Pharmaceutical Sciences, 2013, 2(5): 3710-3722. |
| [16] |
XU L W, WANG G Y, SHI Y P. Chemical constituents from Tagetes erecta flowers[J]. Chemistry of Natural Compounds, 2011, 47(2): 281-283. DOI:10.1007/s10600-011-9905-5 |
| [17] |
FUENTES J, DE CAMARGO A C, ATALA E, et al. Quercetin oxidation metabolite present in onion peel protects Caco-2 cells against the oxidative stress, NF-κB activation, and loss of epithelial barrier function induced by NSAIDs[J]. Journal of Agricultural and Food Chemistry, 2021, 69(7): 2157-2167. DOI:10.1021/acs.jafc.0c07085 |
| [18] |
程帅, 王欢欢, 吴迪, 等. 槲皮万寿菊素体外抗氧化及色素保护作用研究[J]. 中国食品添加剂, 2021, 32(2): 14-19. CHENG S, WANG H H, WU D, et al. Study on antioxidant and pigment protection in vitro of quercetagetin[J]. China Food Additives, 2021, 32(2): 14-19 (in Chinese). |
| [19] |
郭晓红. 大豆黄酮对肉仔鸡生产性能、免疫机能及其有关内分泌的影响[D]. 硕士学位论文. 太谷: 山西农业大学, 2002. GUO X H. Effect of daidzein on production performance, immune function and related endocrine secretion in broilers[D]. Master's Thesis. Taigu: Shanxi Agricultural University, 2002. (in Chinese) |
| [20] |
CHEN D D, CHEN X L, TU Y, et al. Effects of mulberry leaf flavonoid and resveratrol on methane emission and nutrient digestion in sheep[J]. Animal Nutrition, 2015, 1(4): 362-367. DOI:10.1016/j.aninu.2015.12.008 |
| [21] |
JIANG Z Y, JIANG S Q, LIN Y C, et al. Effects of soybean isoflavone on growth performance, meat quality, and antioxidation in male broilers[J]. Poultry Science, 2007, 86(7): 1356-1362. DOI:10.1093/ps/86.7.1356 |
| [22] |
OUYANG K H, XU M S, JIANG Y, et al. Effects of alfalfa flavonoids on broiler performance, meat quality, and gene expression[J]. Canadian Journal of Animal Science, 2016, 96(3): 332-341. DOI:10.1139/cjas-2015-0132 |
| [23] |
GOLIOMYTIS M, TSOUREKI D, SIMITZIS P E, et al. The effects of quercetin dietary supplementation on broiler growth performance, meat quality, and oxidative stability[J]. Poultry Science, 2014, 93(8): 1957-1962. DOI:10.3382/ps.2013-03585 |
| [24] |
YANG J X, MARIA T C, ZHOU B, et al. Quercetin improves immune function in Arbor Acre broilers through activation of NF-κB signaling pathway[J]. Poultry Science, 2020, 99(2): 906-913. DOI:10.1016/j.psj.2019.12.021 |
| [25] |
李丽平, 邱伟海. 万寿菊提取物对肉鸡生长性能、色素沉积、抗氧化和肉质的影响[J]. 中国饲料, 2020(8): 51-55. LI L P, QIU W H. Effects of marigold extract on growth performance, pigment deposition, antioxidant and meat quality of broiler chickens[J]. China Feed, 2020(8): 51-55 (in Chinese). |
| [26] |
赵伟, 陈鑫, 刘红南, 等. 沙棘叶黄酮对肉鸡生长性能及胴体品质的影响[J]. 动物营养学报, 2012, 24(1): 117-123. ZHAO W, CHEN X, LIU H N, et al. Effects of flavones from sea buckthorn leaves on growth performance and carcass quality of broilers[J]. Chinese Journal of Animal Nutrition, 2012, 24(1): 117-123 (in Chinese). DOI:10.3969/j.issn.1006-267x.2012.01.017 |
| [27] |
WANG W Y, XU H G, CHEN H, et al. In vitro antioxidant, anti-diabetic and antilipemic potentials of quercetagetin extracted from marigold (Tagetes erecta L.) inflorescence residues[J]. Journal of Food Science and Technology, 2016, 53(6): 2614-2624. DOI:10.1007/s13197-016-2228-6 |
| [28] |
WANG S G, YAO J Y, ZHOU B, et al. Bacteriostatic effect of quercetin as an antibiotic alternative in vivo and its antibacterial mechanism in vitro[J]. Journal of Food Protection, 2018, 81(1): 68-78. DOI:10.4315/0362-028X.JFP-17-214 |
| [29] |
梁会丽. 黄酮类化合物与胃蛋白酶的相互作用及其对酶活性影响的研究[D]. 硕士学位论文. 郑州: 郑州大学, 2014. LIANG H L. Studies on the interaction between pepsin and flavonoids and their effects on enzyme activity[D]. Master's Thesis. Zhengzhou: Zhengzhou University, 2014. (in Chinese) |
| [30] |
王盛楠. 槲皮素对AA肉鸡蛋白质消化利用的作用及机制[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2018. WANG S N. Effects and mechanism of quercetin on protein digestion and utilization in AA broilers[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2018. (in Chinese) |
| [31] |
李垚, 付晶, 王宝东, 等. 沙棘黄酮对AA肉仔鸡胴体和肉品质的影响[J]. 畜牧兽医学报, 2008, 39(9): 1217-1223. LI Y, FU J, WANG B D, et al. Effect of flavones of sea buckthorn on carcass characteristics and meat quality of Arbor Acres broilers[J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(9): 1217-1223 (in Chinese). DOI:10.3321/j.issn:0366-6964.2008.09.012 |
| [32] |
ANGEL C R, SAYLOR W, VIEIRA S L, et al. Effects of a monocomponent protease on performance and protein utilization in 7- to 22-day-old broiler chickens[J]. Poultry Science, 2011, 90(10): 2281-2286. DOI:10.3382/ps.2011-01482 |
| [33] |
刘红南, 李垚, 赵伟, 等. 沙棘叶总黄酮对1~21日龄爱拔益加肉鸡蛋白质利用率的影响[J]. 动物营养学报, 2010, 22(4): 1024-1030. LIU H N, LI Y, ZHAO W, et al. Effects of total flavonoids of sea buckthorn leaves on protein utilization in AA broilers aged from 1 to 21 days[J]. Chinese Journal of Animal Nutrition, 2010, 22(4): 1024-1030 (in Chinese). DOI:10.3969/j.issn.1006-267x.2010.04.032 |
| [34] |
KAMBOH A A, HANG S Q, KHAN M A, et al. In vivo immunomodulatory effects of plant flavonoids in lipopolysaccharide-challenged broilers[J]. Animal, 2016, 10(10): 1619-1625. DOI:10.1017/S1751731116000562 |
| [35] |
KAMBOH A A, ZHU W Y. Effect of increasing levels of bioflavonoids in broiler feed on plasma anti-oxidative potential, lipid metabolites, and fatty acid composition of meat[J]. Poultry Science, 2013, 92(2): 454-461. DOI:10.3382/ps.2012-02584 |
| [36] |
PIRINCCIOGLU A G, GÖKALP D, PIRINCCIOGLU M, et al. Malondialdehyde (MDA) and protein carbonyl (PCO) levels as biomarkers of oxidative stress in subjects with familial hypercholesterolemia[J]. Clinical Biochemistry, 2010, 43(15): 1220-1224. DOI:10.1016/j.clinbiochem.2010.07.022 |
| [37] |
杨硕, 金晓, 徐元庆, 等. 黄酮类化合物对肉鸡的免疫调节作用及其机制[J]. 动物营养学报, 2020, 32(9): 4003-4009. YANG S, JIN X, XU Y Q, et al. Immunomodulatory effect of flavonoids on broilers and its mechanism[J]. Chinese Journal of Animal Nutrition, 2020, 32(9): 4003-4009 (in Chinese). |
| [38] |
YUAN D X, HUSSAIN T, TAN B, et al. The evaluation of antioxidant and anti-inflammatory effects of Eucommia ulmoides flavones using diquat-challenged piglet models[J]. Oxidative Medicine and Cellular Longevity, 2017, 2017: 8140962. |
| [39] |
丘富安, 张建龙, 丁育诗, 等. 车前子黄酮的响应面法优化微波提取及其对鸡抗氧化能力的影响[J]. 中国兽医科学, 2017, 47(10): 1315-1325. QIU F A, ZHANG J L, DING Y S, et al. Optimization of microwave-assisted extraction of plantain seed flavonoids by response surface methodology and its effects on antioxidant activities in chickens response to oxidative stress[J]. Chinese Veterinary Science, 2017, 47(10): 1315-1325 (in Chinese). |
| [40] |
张毅峰. 槲皮万寿菊素对肉鸡生长性能、抗氧化能力、免疫性能及血清生化指标影响[D]. 硕士学位论文. 邯郸: 河北工程大学, 2020. ZHANG Y F. Effects of quercetagetin on growth performance, antioxidant capacity, immune performance and serum biochemical indexes of broilers[D]. Master's Thesis. Handan: Hebei University of Engineering, 2020. (in Chinese) |
| [41] |
LEE M S, LEE B, PARK K E, et al. Dieckol enhances the expression of antioxidant and detoxifying enzymes by the activation of Nrf2-MAPK signalling pathway in HepG2 cells[J]. Food Chemistry, 2015, 174: 538-546. DOI:10.1016/j.foodchem.2014.11.090 |
| [42] |
LU Z, HE X F, MA B B, et al. Dietary taurine supplementation improves breast meat quality in chronic heat-stressed broilers via activating the Nrf2 pathway and protecting mitochondria from oxidative attack[J]. Journal of the Science of Food and Agriculture, 2019, 99(3): 1066-1072. DOI:10.1002/jsfa.9273 |
| [43] |
刘佳人, 徐兴军, 康文锦, 等. 蒲公英黄酮对ICR小鼠体内抗氧化酶活性及相关基因表达的影响[J/OL]. 基因组学与应用生物学: 1-14. (2021-05-25)[2021-11-20]. http://kns.cnki.net/kcms/detail/45.1369.Q.20210524.1637.006.html. LIU J R, XU X J, KANG W J, et al. Effects of dandelion flavonoids on antioxidant enzyme activity and related gene expression in ICR mice[J]. Genomics and Applied Biology: 1-14. (2021-05-25)[2021-11-20]. http://kns.cnki.net/kcms/detail/45.1369.Q.20210524.1637.006.html. (in Chinese) |
| [44] |
ISHFAQ M, CHEN C L, BAO J X, et al. Baicalin ameliorates oxidative stress and apoptosis by restoring mitochondrial dynamics in the spleen of chickens via the opposite modulation of NF-κB and Nrf2/HO-1 signaling pathway during Mycoplasma gallisepticum infection[J]. Poultry Science, 2019, 98(12): 6296-6310. DOI:10.3382/ps/pez406 |




