2. 宁夏朔牧盐池滩羊繁育有限公司, 吴忠 751100
2. Ningxia Shuomu Yanchi Tan Sheep Breeding Co., Ltd., Wuzhong 751100, China
黄花菜又名金针菜、萱草、忘忧草,是百合科萱草属多年生草本植物[1]。近年来,宁夏自治区党委政府将黄花菜产业作为盐同红集中连片贫困地区脱贫富民的重要产业之一。宁夏黄花菜种植主要集中在吴忠市的盐池、红寺堡2地。截止2020年底,仅吴忠市黄花菜种植面积达10 672 hm2,约占全国种植面积的17%[2]。大面积的黄花菜种植产生的大量茎叶,未能被合理利用,直接丢弃或者焚烧,造成生态环境破坏和资源浪费,还会成为冬季火灾隐患。因此,探究黄花菜茎叶在畜禽饲料中高效利用成为目前主要的研究目标。
滩羊产业作为宁夏九大优势特色产业之一[3],在脱贫攻坚及乡村振兴中发挥重要作用。滩羊具有肉质细嫩鲜美、膻腥味轻、瘦肉率高(滩羊肉可超过57%,普通羊肉为52%)、肌内脂肪分布均匀等优点,深受广大消费者欢迎[4]。随着滩羊肉口碑大幅提升和饲养量不断增加,饲料短缺现象已成为限制宁夏滩羊产业发展亟待解决的关键问题[5]。因此,探究滩羊饲料中如何科学、合理、有效地利用黄花菜茎叶资源变得尤为重要。
青贮不仅可以改善饲草的适口性,而且还可以保持或者提高饲草的营养价值,同时因其制作过程简单,做好以后可以常年使用[6],因此将黄花菜茎叶做成青贮是一种很好利用途径。梅宁安等[7]进行了瓜薯秧混合青贮及黄花菜茎叶青贮最佳水分质量分数的研究,发现瓜薯秧混合青贮及黄花菜茎叶青贮在水分质量分数为65%时,22~25 ℃包膜青贮45 d,青贮饲料感官评分可达2级,营养价值较高;赵正伟等[8]探究了黄花菜茎叶与玉米混贮挥发性脂肪酸(VFA)含量,发现当黄花菜茎叶与玉米混合比例为2 ∶ 8时,粗蛋白质、VFA含量较优,提高了青贮品质;杨宇为等[9]研究了黄花菜茎叶青贮与全株玉米青贮不同比例混合对滩羊生长性能及屠宰性能影响,结果表明,黄花菜茎叶青贮与全株玉米青贮混合比例为2 ∶ 8时,滩羊的生长性能及屠宰性能较好。
为进一步研究黄花菜茎叶青贮在滩羊饲粮中适宜添加比例及其对滩羊瘤胃微生物区系的影响,本试验选择早期断奶滩羊公羔羊作为试验动物,使用不同混合比例的黄花菜茎叶青贮与玉米青贮饲粮饲喂滩羊,并分析其瘤胃发酵参数和微生物区系的变化,探明黄花菜茎叶青贮的适宜添加比例,探讨其对滩羊瘤胃微生物区系的影响,为黄花菜茎叶青贮在盐池滩羊产业中的高效利用提供数据支撑。
1 材料与方法 1.1 试验动物与试验设计试验于2021年4月至2021年7月在宁夏朔牧盐池滩羊繁育有限公司进行,试验期共100 d,其中预试期10 d,试验期90 d。试验采用单因子随机试验设计,选用3月龄体质健康、体重[(21.60±1.09) kg]相近的滩羊公羔羊80只,按照体重随机分为4组,每组20只。将黄花菜茎叶青贮按照不同比例添加到青贮饲料中,即对照组:100%青贮玉米;试验1组:20%黄花菜茎叶青贮+80%青贮玉米;试验2组:40%黄花菜茎叶青贮+60%玉米青贮;试验3组:60%黄花菜茎叶青贮+40%玉米青贮。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验羊采用全舍饲,饲养在条件一致的圈舍内,专人负责饲喂。通过10 d预试期,将黄花菜青贮逐步添加进去,避免引起试验羊换料应激。预试期结束后进入正式试验。试验羊采用分圈混群饲养的方式,每天饲喂2次(09:00、17:00),先粗后精,自由采食、自由饮水。
1.3 瘤胃液采集与处理试验羊90日龄时,每组随机选取3只进行屠宰并采集瘤胃液2份,1份-20 ℃保存,用于分析瘤胃发酵参数;1份-80 ℃保存以备提取DNA,进行瘤胃微生物区系分析。
1.4 瘤胃发酵参数测定方法瘤胃液氨态氮浓度采用冯宗慈等[10]改进的比色法进行测定;瘤胃液VFA浓度采用气相色谱-质谱联用(GC-MS)的方法进行测定。
1.5 瘤胃液样品测序 1.5.1 瘤胃液基因组DNA提取采用十六烷基三甲基溴化铵(CTAB)方法对样本的基因组DNA进行提取,之后采用琼脂糖凝胶电泳和Nanodrop检测DNA的纯度和浓度。
1.5.2 PCR扩增取适量的样品于离心管中,使用无菌水稀释样品至1 ng/μL。以稀释后的基因组DNA为模板,根据测序区域的选择,以带Barcode的特异引物,使用高效和高保真酶进行PCR,确保扩增效率和准确性。
1.5.3 样本测序使用TIANSeq快速DNA文库构建试剂盒(天根生化科技有限公司)构建测序文库,构建好的文库经过Qubit定量和Agient2100文库检测,合格后,使用Illumina平台进行PE250 bp测序。
1.6 数据统计分析试验数据采用Excel 2010进行整理计算,并采用DPS V9.01统计软件进行单因素方差分析,LSD法进行多重比较,P<0.05为差异显著,P>0.05为差异不显著。
2 结果与分析 2.1 饲粮中添加黄花菜青贮茎叶对滩羊瘤胃液氨态氮和VFA浓度的影响饲粮中添加黄花菜青贮茎叶对滩羊瘤胃液氨态氮和VFA浓度的影响见表 2,各组之间瘤胃液氨态氮、乙酸、丙酸、丁酸和戊酸浓度没有显著差异(P>0.05),但是都呈现试验1组瘤胃液氨态氮、乙酸、丙酸、丁酸和戊酸浓度最高,比对照组分别提高了28.65%、36.34%、26.70%、41.62%和3.00%,说明饲喂20%黄花菜茎叶青贮+80%青贮玉米试验饲粮可以提高瘤胃液氨态氮、乙酸、丙酸、丁酸和戊酸浓度。
|
|
表 2 滩羊瘤胃中氨态氮和VFA浓度 Table 2 Concentrations of NH3-N and VFA in rumen fluid of Tan sheep |
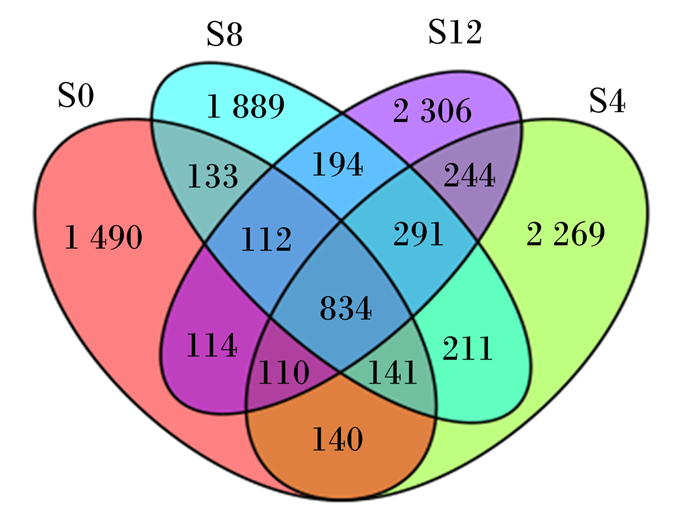
利用Venn图[11]可以展示样品之间共有、特有的OTU[12]数目,直观地表现出样品间OTU的重合情况。结合OTU所代表的物种,可以找出不同环境中的共有微生物。由图 1可以看出,4个组共有10 478个OTU,其中对照组有3 074个OTU,试验1组有4 240个OTU,试验2组有3 805个OTU,试验3组有4 205个OTU,其中4个组共有的OTU数目为834个,占总OTU数目的8.00%,对照组、试验1组、试验2组和试验3组分别独有的OTU数目分别为1 490、2 269、1 889和2 306个,分别占总OTU数目的14.22%、21.65%、18.02%和22.00%。OTU数目顺序为试验1组>试验3组>试验2组>对照组,各试验组的OTU数目均高于对照组,表明饲粮中添加黄花菜青贮茎叶提高了瘤胃内特有微生物的种类,增加了微生物的多样性,其中以试验1组微生物的种类和多样性最高。
|
S0、S4、S8、S12分别代表对照组、试验1组、试验2组、试验3组。下图同。 S0, S4, S8 and S12 represented control group, trial group 1, trial group 2 and trial group 3, respectively. The same as below. 图 1 瘤胃液菌群Venn图 Fig. 1 Venn graph of microflora in rumen fluid |
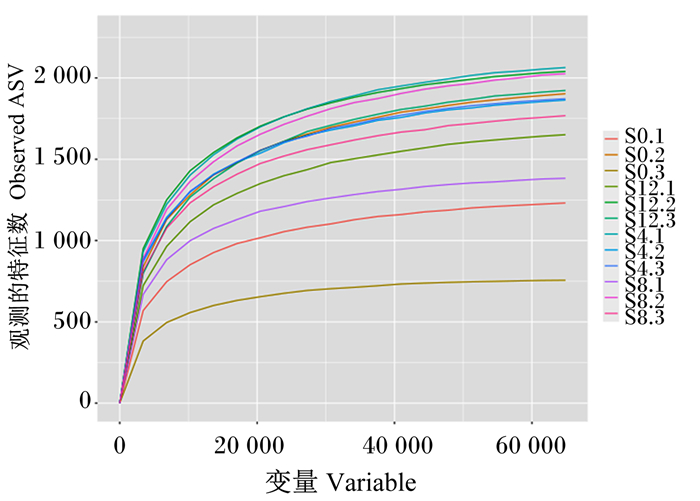
稀释曲线可直接反映测序数据量的合理性,并间接反映样本中物种的丰富程度[13],当稀释曲线趋向平坦时,说明测序数据量渐进合理,更多的数据量只会产生少量新的物种。同时,在相同的测序深度下,比较不同样本中OTU数目的多少,从而在一定程度上衡量每个样本的多样性高低。由图 2可以看出,随着测序深度的增加,新物种出现的增加速度变得缓慢,但是仍然有新物种出现。
|
图 2 样品的稀释曲线 Fig. 2 Dilution curve of samples |
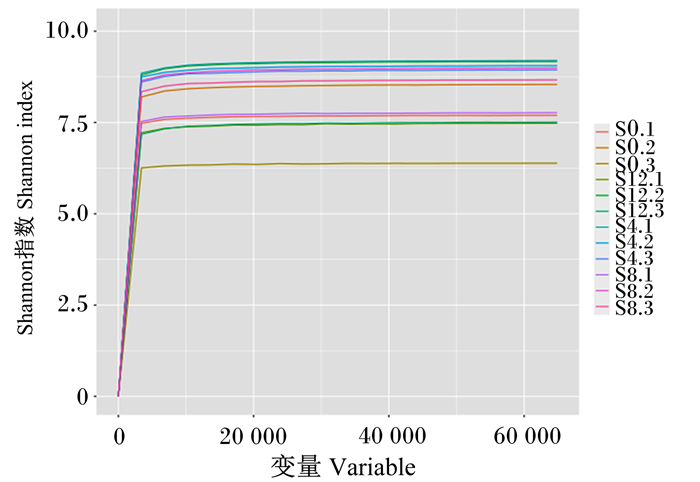
Shannon指数曲线可以反映各样本在不同测序数量时的微生物多样性。Shannon指数越大则OTU数目越多,物种越丰富,表明样品中已涵盖绝大多数的微生物物种信息。当Shannon指数曲线趋向平坦时,说明测序数据量足够大,OTU种类不会再随测序量增加而增长;如果曲线没有趋于平坦,则表明不饱和,增加数据量可以发现更多OTU。由图 3可以看出,当测序深度较小时,Shannon指数曲线急速上升;当测序深度达到8 700 reads时,Shannon指数曲线变化缓慢,已接近饱和,说明测序趋向饱和,即本试验当前测序量足够进行细菌多样性分析。
|
图 3 样品的Shannon指数曲线 Fig. 3 Shannon index curve of samples |
α多样性反映的是样本内的微生物群落多样性,α多样性有多种衡量指标:Ace、Chao1、Shannon、Simpson指数及覆盖率。Chao1和Ace指数用于衡量物种相对丰度,即物种数量的多少。Shannon和Simpson指数用于衡量物种多样性,Shannon和Simpson指数越大,说明样品的物种多样性越高[14]。由表 3可以看出,除试验3组Simpson指数略低于对照组,各试验组的Ace、Chao1、Shannon和Simpson指数均高于对照组,说明试验组的物种丰度和多样性高于对照组;其中,试验1组的Ace、Chao1、Shannon、Simpson指数均最高,且Shannon指数显著高于对照组(P<0.05),说明试验1组中的物种丰度和多样性最高。覆盖率越高,则说明样本中物种被测出的概率越高,而没有被测出的概率越低。本试验各组的覆盖率均高于99%,则足以反映本次测序结果可以代表滩羊瘤胃中微生物菌群的真实情况。
|
|
表 3 α多样性指数 Table 3 α diversity indexes |
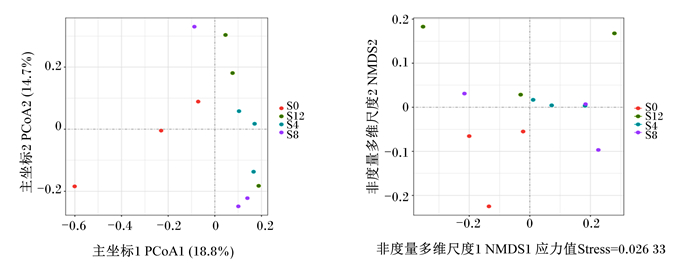
β多样性是指沿着环境梯度变化的不同群落之间,物种组成的相异性或物种沿环境梯度的更替速率,因此也被称为生境间多样性。使用QIIME2软件进行β多样性分析,比较不同样品在物种多样性方面存在的相似程度,各组之间离散的越远,说明各组差异越大。β多样性分析主要采用Binary Jaccard、Bray Curtis、Weighted Unifrac、Unweighted Unifrac4种算法计算样品间的距离,从而获得样本间的β值。这4个算法主要分为两大类:加权(Bray Curtis和Weighted Unifrac)与非加权(Binary Jaccard和Unweightde Unifrac)。本试验要研究对照与试验组之间的关系,故采用加权分析方式。由图 4可以看出,各试验组之间都相距较远,各试验组与对照组相比较相距较远,说明各试验组瘤胃微生物区系存在着差异,也进一步可以说明添加黄花菜茎叶青贮可以使滩羊的瘤胃微生物菌落结构发生改变。
|
图 4 主坐标分析和非度量多维尺度分析图 Fig. 4 Diagram of PCoA and NMDS |
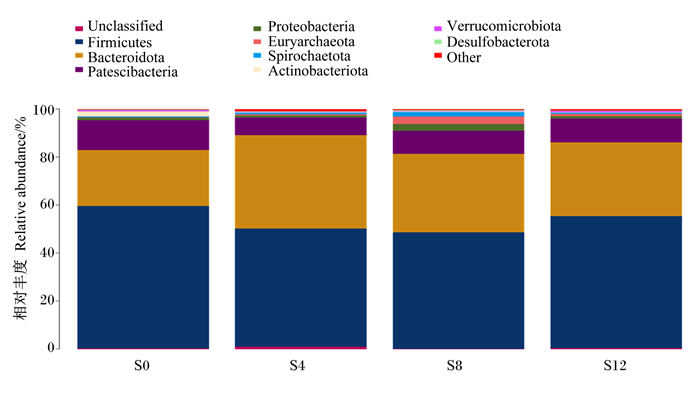
滩羊瘤胃细菌在门水平上的菌落组成和相对丰度见表 4和图 5,共检测到27种菌门,包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、Patescibacteria、放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobiota)、螺旋菌门(Spirochaetota)、未分类(unclassified)、广古菌门(Euryarchaeota)、脱硫菌门(Desulfobacterota)、丝状杆菌门(Fibrobacterota)、蓝细菌(Cyanobacteria)、弯曲杆菌门(Campilobacterota)、洗脱微生物群门(Elusimicrobiota)、互养菌门(Synergistota)、浮霉菌门(Planctomycetota)、蛭弧菌门(Bdellovibrionota)、芽单胞菌门(Gemmatimonadota)、粘液球菌门(Myxococcota)等。4个组滩羊瘤胃中的菌门主要为厚壁菌门、拟杆菌门和Patescibacteria,占到了总细菌的90.77%以上。与相比对照组,试验1组瘤胃液中拟杆菌门、疣微菌门、螺旋菌门、广古菌门、蓝细菌门等相对丰度有所升高,但差异不显著(P>0.05),厚壁菌门、Patescibacteria、放线菌门、变形菌门等相对丰度有所降低,但差异不显著(P>0.05);试验2组瘤胃液中拟杆菌门、螺旋菌门、广古菌门、脱硫菌门、丝状杆菌门、蓝细菌门等相对丰度有所升高,但差异不显著(P>0.05),厚壁菌门、Patescibacteria、放线菌门、变形菌门、疣微菌门等相对丰度有所降低,但差异不显著(P>0.05);试验3组瘤胃液中拟杆菌门、变形菌门、螺旋菌门、广古菌门、脱硫菌门、丝状杆菌门等相对丰度有所升高,但差异不显著(P>0.05),厚壁菌门、Patescibacteria、放线菌门、疣微菌门等相对丰度有所降低,但差异不显著(P>0.05)。
|
|
表 4 黄花菜茎叶青贮对滩羊瘤胃菌群在门水平上相对丰度的影响 Table 4 Effects of daylily stem and leaf silage on rumen microflora relative abundance of Tan sheep at phylum level |
|
Unclassified:未分类;Firmicutes:厚壁菌门;Bacteroidota:拟杆菌门;Patescibacteria;Proteobacteria:变形菌门;Verrucomicrobiota:Euryarchaeota:广古菌门疣微菌门;Spirochaetota:螺旋菌门;Actinobacteriota:放线菌门;Verrucomicrobiota:疣微菌门;Desulfobacterota:脱硫菌门;Other:其他。 图 5 门水平上瘤胃菌群分布图 Fig. 5 Distribution diagram of rumen microflora at phylum level |
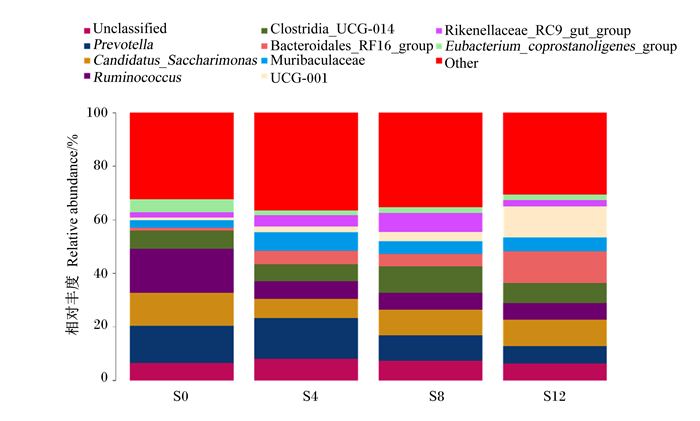
滩羊瘤胃细菌在属上水平上的组成和相对丰度见表 5和图 6,4组滩羊瘤胃液菌群总共包含339个属,其中有18个菌属相对丰度比例在1%以上,分别为瘤胃球菌属(Ruminococcus)、普雷沃氏菌属(Prevotella)、念珠菌糖单胞菌属(Candidatus_Saccharimonas)、梭菌科_UCG-014(Clostridia_UCG-014)、未分类、产粪甾醇真细菌群(Eubacterium_coprostanoligenes_group)、RF39、未培养(uncultured)、Muribaculaceae、理研菌科_RC9肠道群(Ikenellaceae_RC9_gut_group)、Saccharofermentans、瘤胃球菌科_NK4A214群(Ruminococcaceae_NK4A214_group)、韦荣球菌科_UCG-007(Erysipelotrichaceae_UCG-007)、奥尔森菌属(Olsenella)、毛螺菌科_NK3A20群(Lachnospiraceae_NK3A20_group)、拟杆菌类_RF16群(Bacteroidales_RF16_group)、克里斯滕森菌科_R-7群(Christensenellaceae_R-7_group)等。与对照组相比,试验1组瘤胃液中瘤胃球菌属、RF39、奥尔森菌属和毛螺菌科_NK3A20群的相对丰度显著降低(P<0.05),Muribaculaceae的相对丰度显著升高(P<0.05),普雷沃氏菌属、理研菌科_RC9肠道群、瘤胃球菌科_NK4A214群、拟杆菌类_RF16群、克里斯滕森菌科_R-7群、UCG-001的相对丰度有所升高(P>0.05),念珠菌糖单胞菌属、梭菌科_UCG-014、产粪甾醇真细菌群、Saccharofermentans、韦荣球菌科_UCG-007的相对丰度有所降低(P>0.05);试验2组瘤胃液中瘤胃球菌属、奥尔森菌属和毛螺菌科_NK3A20群的相对丰度显著降低(P<0.05);试验3组瘤胃液中瘤胃球菌属、奥尔森菌属和毛螺菌科_NK3A20群的相对丰度显著降低(P<0.05)。
|
|
表 5 黄花菜茎叶青贮对滩羊瘤胃菌群在属水平上相对丰度的影响 Table 5 Effects of daylily stem and leaf silage on rumen microflora relative abundance of Tan sheep at genus level |
|
Unclassified:未分类;Prevotella:普雷沃氏菌属;Candidatus_Saccharimonas:念珠菌糖单胞菌属;Ruminococcus:瘤胃球菌属;Clostridia_UCG-014:梭菌科_UCG-014;Bacteroidales_RF16_group:拟杆菌类_RF16群;Rikenellaceae_RC9_gut_group:理研菌科_RC9肠道群;Eubacterium_coprostanoligenes_group:产粪甾醇真细菌属群;Other:其他。 图 6 属水平上瘤胃菌群分布图 Fig. 6 Distribution diagram of rumen microflora at genus level |
氨态氮是瘤胃微生物合成菌体蛋白的主要原料,适宜浓度为8.5~30.0 mg/dL,如果氨态氮浓度过低,瘤胃微生物的生产能力将会受到抑制[15]。李与琦等[16]研究发现,湖羊瘤胃中的氨态氮浓度随着不同微贮棉秸添加比例的增加呈现先升高再降低趋势。有研究表明,厚壁菌门和拟杆菌门分别参与了纤维物质与非纤维物质的降解,这些物质经瘤胃发酵后分别产生乙酸和丙酸[17]。瘤胃微生物通过分解饲料中的营养物质产生的VFA可以为动物机体提供能量,反刍动物瘤胃微生物发酵能为宿主提供70%日常生命活动所需的能量[18]。金鹿等[19]研究了沙蒿多糖组合制剂对滩羊羔羊瘤胃菌群多样性的影响,其结果显示添加沙蒿多糖组合制剂可以提高瘤胃VFA的含量。本试验中,瘤胃液氨态氮浓度也是先升高后降低,与李与琦等[16]研究结果一致。同时,反刍动物饲粮结构、品质及微生物活性、微生物区系都对瘤胃中的VFA(乙酸、丙酸、丁酸)的组成和浓度产生影响[20]。本试验结果表明,试验1组滩羊瘤胃液中氨态氮、VFA(乙酸、丙酸、丁酸、戊酸)浓度均最高,能为滩羊提供更多的能量,更有利于脂肪的沉积,可提高滩羊的体重和日增重。
瘤胃作为反刍动物重要的消化器官,是天然的发酵罐,内部含有丰富的瘤胃微生物,能够降解单胃动物难以消化的纤维物质。瘤胃中微生物主要以细菌为主,每毫升瘤胃的内容物中有超过百亿个细菌[21]。反刍动物瘤胃微生物的生长代谢不仅可以为其提供能量、蛋白质、必需氨基酸等机体必需的营养物质,同时它还可以将纤维素和半纤维素分解、转化,使其成为可供机体吸收的蛋白质和能量物质,以此来保证自身的营养需要[22]。瘤胃微生物菌群的结构和相对丰度处于相对稳定的动态平衡,该平衡对于维持瘤胃内环境稳定以及在反刍动物的消化和吸收营养物质过程中起着重要的作用[23-24]。众多研究都表明,厚壁菌门和拟杆菌门是反刍动物瘤胃中的优势菌群,其对反刍动物瘤胃发酵过程产生重要的影响[25-26]。本试验中,4组滩羊瘤胃液中的优势菌为厚壁菌门、拟杆菌门、Patescibacteria和放线菌门,与上述研究结果一致。但是本试验发现4组滩羊瘤胃液中还有一种Patescibacteria的细菌,对其在滩羊瘤胃中的作用还鲜有报道,这个细菌是不是滩羊瘤胃中特有的菌群,或许可作为下一步的研究方向。
厚壁菌门主要代表菌科为瘤胃球菌科(Ruminococcaceae)、毛螺菌科(Lachnospiraceae)、和韦荣球菌科(Veronococcaceae),主要代表属为芽孢杆菌属(Bacillus)、梭菌属(Fusobacterium)、瘤胃球菌属(Ruminococcus)乳杆菌属(Lactobacillus)等,拟杆菌门主要以普雷沃氏菌属为主[27]。厚壁菌门中的瘤胃球菌属主要由黄色瘤胃球菌和白色瘤胃球菌组成,是一种瘤胃中重要的纤维降解菌,能产生的纤维素酶、半纤维素酶和木聚糖酶,用来分解粗饲料中的纤维素和半纤维素[28]。普雷沃氏菌在瘤胃中可以降解和利用淀粉和植物细胞壁多糖如木聚糖和果胶,但是不能降解纤维素。普雷沃氏菌的发酵产物主要是乙酸、琥珀酸和丙酸,其中丙酸主要通过丙烯酸途径合成[29]。本研究发现,随着黄花菜茎叶青贮添加比例的增加,占比较高(1%以上)的厚壁菌门、Patescibacteria、放线菌门、变形菌门相对丰度逐渐降低,而只有拟杆菌门相对丰度有升高的趋势,进一步从属水平来看,试验1组中厚壁菌门中瘤胃球菌属的相对丰度较对照组降低,并且拟杆菌门中普雷沃氏菌属的相对丰度较对照组有所升高,说明黄花菜茎叶青贮添加比例并不是越多越好,还是有个适当的添加比例,即以20%黄花菜茎叶青贮+80%青贮玉米为宜。其他几种主要菌门相对丰度降低,而只有拟杆菌门的相对丰度升高,分析其原因可能由于黄花菜茎叶青贮的粗纤维含量低于玉米秸秆青贮,添加黄花菜茎叶青贮相当于降低粗纤维含量,而且饲粮中粗蛋白质、干物质含量反而有所提升,所以瘤胃液厚壁菌门的相对丰度降低,而拟杆菌门的相对丰度升高,同时也印证了添加黄花菜茎叶青贮可以改变滩羊瘤胃中菌群结构和组成。
4 结论综上所述,滩羊饲粮中添加20%黄花菜茎叶青贮+80%青贮玉米时,对滩羊瘤胃微生物菌群结构和功能影响较小,同时可以提高滩羊瘤胃菌群种类和多样性,改变瘤胃菌落结构和组成。在生产实践中,黄花菜茎叶青贮可以作为一种粗饲料补充,但添加比例应不高于20%。
| [1] |
郑家祯, 李和平, 赖正锋, 等. 国内菜用黄花菜种质资源遗传多样性分析[J]. 福建农业学报, 2018, 33(10): 1030-1038. ZHENG J Z, LI H P, LAI Z F, et al. Genetic diversity of vegetable daylily germplasms in China[J]. Fujian Journal of Agricultural Sciences, 2018, 33(10): 1030-1038 (in Chinese). |
| [2] |
沙媛媛, 马玲, 李文婷. 浅谈关于吴忠市黄花菜产业发展的现状、问题及对策[J]. 农家参谋, 2021(20): 99-100. SHA Y Y, MA L, LI W T. Discussion on the status quo, problems and countermeasures of the development of daylily industry in Wuzhong city[J]. The Farmers Consultant, 2021(20): 99-100 (in Chinese). |
| [3] |
宁夏回族自治区人民政府办公厅. 自治区人民政府办公厅关于印发《自治区支持九大重点产业加快发展若干财政措施(暂行)》的通知[J]. 宁夏回族自治区人民政府公报, 2021(9): 19-21. General Office of the People's Government of Ningxia Hui Autonomous Region. Notice of the general office of the people's government of the autonomous region on printing and distributing several financial measures of the autonomous region to support the accelerated development of nine key industries (provisional)[J]. Official gazette of the People's Government of Ningxia Hui Autonomous Region, 2021(9): 19-21 (in Chinese). |
| [4] |
王锦, 马青. 滩羊羔羊早期补饲效果研究[J]. 黑龙江畜牧兽医, 2018(14): 84-86. WANG J, MA Q. Effect of early supplementary feeding of Tan Sheep[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(14): 84-86 (in Chinese). |
| [5] |
孙志强, 玉柱, 寇启芳. "优质青粗饲料资源开发利用示范"项目助力宁夏肉羊产业发展[J]. 中国畜牧业, 2021(19): 20-22. SUN Z Q, YU Z, KOU Q F. Demonstration of the development and utilization of high-quality green forage resources" project to help the development of Ningxia mutton sheep industry[J]. China Animal Industry, 2021(19): 20-22 (in Chinese). DOI:10.3969/j.issn.2095-2473.2021.19.011 |
| [6] |
佟桂娟. 牧草青贮的意义和作用[J]. 中国畜牧兽医文摘, 2014, 30(6): 194. TONG G J. Significance and function of forage silage[J]. Chinese Animal Husbandry and Veterinary Abstracts, 2014, 30(6): 194 (in Chinese). |
| [7] |
梅宁安, 李军国, 辛国省, 等. 饲喂黄花菜茎叶青贮对滩羊生产、屠宰性能及肉品质的影响[J]. 养殖与饲料, 2021, 20(11): 29-32. MEI N A, LI J G, XIN G S, et al. Effects of feeding daylily stem and leaf silage on production, slaughter performance and meat quality of Tan sheep[J]. Animals Breeding and Feed, 2021, 20(11): 29-32 (in Chinese). DOI:10.3969/j.issn.1671-427X.2021.11.007 |
| [8] |
赵正伟, 王占林, 张俊丽, 等. 黄花菜茎叶混贮挥发性脂肪酸含量分析[J]. 饲料研究, 2021, 44(8): 102-105. ZHAO Z W, WANG Z L, ZHANG J L, et al. Analysis of volatile fatty acid content in stem and leaf silage of daylily[J]. Feed Research, 2021, 44(8): 102-105 (in Chinese). |
| [9] |
杨宇为, 赵正伟, 马吉锋, 等. 黄花菜茎叶青贮与全株玉米青贮不同比例混合对滩羊生长性能及屠宰性能影响的研究[J]. 饲料博览, 2021(9): 54-56, 64. YANG Y W, ZHAO Z W, MA J F, et al. Effects of different proportions mixed of daylily stem and leaf silage and whole corn silage on growth performance and slaughter performance of Tan sheep[J]. Feed Review, 2021(9): 54-56, 64 (in Chinese). |
| [10] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(Z1): 37. FENG Z C, GAO M. Improvement on the method of determining ammonia nitrogen content in rumen juice by colorimetry[J]. Animal Husbandry and Feed Science, 2010, 31(Z1): 37 (in Chinese). |
| [11] |
CHEN H B, BOUTROS P C. VennDiagram: a package for the generation of highly-customizable Venn and Euler diagrams in R[J]. BMC Bioinformatics, 2011, 12: 35. DOI:10.1186/1471-2105-12-35 |
| [12] |
EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
| [13] |
WANG Y, SHENG H F, HE Y, et al. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags[J]. Applied and Environmental Microbiology, 2012, 78(23): 8264-8271. DOI:10.1128/AEM.01821-12 |
| [14] |
GRICE E A, KONG H H, CONLAN S, et al. Topographical and temporal diversity of the human skin microbiome[J]. Science, 2009, 324(5931): 1190-1192. DOI:10.1126/science.1171700 |
| [15] |
田雨佳. 苜蓿干草与苜蓿青贮对奶牛瘤胃蛋白质利用的影响及作用机制的研究[D]. 博士学位论文. 北京: 中国农业大学, 2014. TIAN Y J. Study on mechanism of nitrogen utilization in rumen of dairy cows with alfalfa as hay or silage[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2014. (in Chinese) |
| [16] |
李与琦, 阳建华, 张涛, 等. 日粮中添加不同比例微贮棉秆对湖羊瘤胃微生物区系的影响[J]. 微生物学报, 2020, 60(8): 1592-1604. LI Y Q, YANG J H, ZHANG T, et al. Effect of different proportions fermented cotton stalk intake on rumen microflora of lambs[J]. Acta Microbiologica Sinica, 2020, 60(8): 1592-1604 (in Chinese). |
| [17] |
EVANS N J, BROWN J M, MURRAY R D, et al. Characterization of novel bovine gastrointestinal tract Treponema isolates and comparison with bovine digital dermatitis treponemes[J]. Applied and Environmental Microbiology, 2011, 77(1): 138-147. DOI:10.1128/AEM.00993-10 |
| [18] |
FLINT H J, BAYER E A. Plant cell wall breakdown by anaerobic microorganisms from the mammalian digestive tract[J]. Annals of the New York Academy of Sciences, 2008, 1125: 280-288. DOI:10.1196/annals.1419.022 |
| [19] |
金鹿, 李胜利, 桑丹, 等. 沙蒿多糖组合制剂对滩羊羔羊瘤胃菌群多样性的影响[J]. 动物营养学报, 2021, 33(1): 317-329. JIN L, LI S L, SANG D, et al. Effects of Artemisia polysaccharide combination preparation on rumen microflora diversity of Tan lambs[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 317-329 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.01.032 |
| [20] |
金亚倩, 赵俊星, 刘文忠, 等. 酿酒葡萄皮渣对绵羊瘤胃代谢及发育的影响[J]. 畜牧兽医学报, 2017, 48(9): 1683-1693. JIN Y Q, ZHAO J X, LIU W Z, et al. Effect of dietary wine grape pomace supplementation on rumen metabolism and development in lambs[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(9): 1683-1693 (in Chinese). |
| [21] |
MORGAVI D P, KELLY W J, JANSSEN P H, et al. Rumen microbial (meta)genomics and its application to ruminant production[J]. Animal, 2013, 7(Suppl-1): 184-201. |
| [22] |
MULLINS C R, MAMEDOVA L K, CARPENTER A J, et al. Analysis of rumen microbial populations in lactating dairy cattle fed diets varying in carbohydrate profiles and Saccharomyces cerevisiae fermentation product[J]. Journal of Dairy Science, 2013, 96(9): 5872-5881. DOI:10.3168/jds.2013-6775 |
| [23] |
EDWARDS J E, FORSTER R J, CALLAGHAN T M, et al. PCR and omics based techniques to study the diversity, ecology and biology of anaerobic fungi: insights, challenges and opportunities[J]. Frontiers in Microbiology, 2017, 8: 1657. DOI:10.3389/fmicb.2017.01657 |
| [24] |
INDUGU N, VECCHIARELLI B, BAKER L D, et al. Comparison of rumen bacterial communities in dairy herds of different production[J]. BMC Microbiology, 2017, 17(1): 190. DOI:10.1186/s12866-017-1098-z |
| [25] |
SINGH K M, AHIR V B, TRIPATHI A K, et al. Metagenomic analysis of Surti buffalo (Bubalus bubalis) rumen: a preliminary study[J]. Molecular Biology Reports, 2012, 39(4): 4841-4848. |
| [26] |
DE OLIVEIRA M N V, JEWELL K A, FREITAS F S, et al. Characterizing the microbiota across the gastrointestinal tract of a Brazilian Nelore steer[J]. Veterinary Microbiology, 2013, 164(3/4): 307-314. |
| [27] |
毛云睿. 饲草类型对滩羊生长性能、肉品质及胃肠道微生物区系的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2021. MAO Y R. Effects of forage types on growth performance, meat quality and gastrointestinal microbiota in Tan sheep[D]. Master's Thesis. Yangling: Northwest A & F University, 2021. (in Chinese) |
| [28] |
ZHOU R, WU J P, ZHANG L P, et al. Effects of oregano essential oil on the ruminal pH and microbial population of sheep[J]. Plos One, 2019, 14(5): e0217054. |
| [29] |
DAO T K, DO T H, LE N G, et al. Understanding the role of Prevotella genus in the digestion of lignocellulose and other substrates in vietnamese native goats' rumen by metagenomic deep sequencing[J]. Animals, 2021, 11(11): 3257. |




