2. 中国农业科学院与世界农用林业中心农用林业与可持续畜牧业联合实验室, 北京 100193
2. Chinese Academy of Agricultural Sciences and World Agroforestry Center Joint Lab on Agroforestry and Sustainable Animal Husbandry, Beijing 100193, China
犊牛健康关系到牧场可持续发展,由于腹泻造成的犊牛死亡数量占断奶前犊牛死亡数量的百分比高达50%[1],造成了极大的经济损失。在犊牛实际生产中,一般使用抗生素以治疗犊牛腹泻,但也产生了机体耐药性等一系列问题。
微藻是一种在自然界中广泛存在的单细胞光合自养生物[2],种类繁多,具有生产成本低、生长周期短、可持续性强等特点[3],且具有合成和富集多种生物活性物质的功能。裂殖壶藻是一种海洋微藻,富含二十二碳六烯酸(docosahexaenoic acid,DHA)等长链不饱和脂肪酸。DHA是ω-3多不饱和脂肪酸的一种,对大脑及视力发育具有极其重要的作用,同时具有抗氧化、降血压以及预防心脑血管疾病的功能[4-5]。阿拉腾珠拉[6]研究表明,饲粮中添加裂殖壶藻可显著提高犊牛生长性能,显著降低犊牛粪便评分,并一定程度上缓解犊牛腹泻。Meale等[7]研究发现,饲喂裂殖壶藻对羔羊的生长性能影响不大。但Flaga等[8]研究发现,使用较低添加剂量的裂殖壶藻可以改善犊牛的粪便评分,降低血液中细胞因子的mRNA表达量,对犊牛的免疫系统产生有益作用。但是野生型的裂殖壶藻DHA产量较低,在一定程度上限制了其应用。近年来,如何进一步提高裂殖壶藻DHA产量受到研究者的重视。相关研究往往通过优化裂殖壶藻培养基成分及发酵工艺提高裂殖壶藻积累DHA能力,从而提高DHA产量[9-10],但自然界筛选的野生藻种往往无法满足工业生产的需要,因此,获得一株富含DHA的裂殖壶藻生产藻株具有重大研究和应用意义。
目前,通常采用诱变育种的方式,在降低生产成本的同时提高DHA产量,将裂殖壶藻的生物合成代谢朝着生产更多DHA的方向引导,筛选出高产DHA优势藻株。Lian等[11]通过亚硝基胍(nitroso-guanidin,NTG)和紫外线(ultraviolet,UV)复合诱变得到高产裂殖壶藻藻株,含油量提高了34.84%;吕小义等[12]通过钴60(60Co)-γ射线辐照诱变裂殖壶藻藻株,经过多轮筛选,得到DHA产量为5.65 g/L的高产藻株。然而,传统紫外及化学诱变存在正向突变率低、诱变效果差等问题。因此,本研究拟采用新型诱变技术——常压室温等离子体(atmospheric room temperature plasma,ARTP)作为诱变方法开展试验。ARTP是近年来新兴的一种诱变技术,它采用常压辉光放电,产生高能氦气等多种活性粒子,作用于菌体细胞壁或细胞膜,诱发其产生基因突变,具有操作简便、高效安全、正向突变率高等优点,已得到了广泛应用[9]。与此同时,龚定芳等[13]利用丙二酸、碘乙酸等筛选因子筛选诱变藻株,获得了DHA产量达6.59 g/L的高产DHA藻株,比原始藻株提升了46.12%。袁军等[14]利用2, 2’-联吡啶建立高产DHA藻株筛选方法,筛选藻株DHA产量达7.31 g/L,较原始藻株提升了29.8%。因此,建立一种简便高效的藻株筛选方法可以极大地提高目标藻株的筛选效率,针对DHA等不饱和脂肪酸合成机制[15]及其在藻株逆境胁迫中[16]能发挥重要作用等原理,设计采用琥珀酸的结构类似物丙二酸,活性氧诱发剂2, 2’-联吡啶作为藻株的筛选因子开展试验,以期获得富含DHA的高产藻株,为畜牧业新型饲料添加剂开发提供一种新的资源。
1 材料与方法 1.1 试验材料裂殖壶藻原始藻株(ATCC20888)购置于广东省菌种保藏中心。
固体培养基:葡萄糖5 g/L,胰蛋白胨1 g/L,酵母粉1 g/L,琼脂20 g/L,人造海水34.4 g/L。
种子培养基和发酵培养基:参考文献[17]配制。
1.2 试验方法 1.2.1 裂殖壶藻活化与培养藻种活化:将-80 ℃保存的甘油管藻种,吸取500 μL于种子培养基中,28 ℃、200 r/min条件下培养2~3 d,然后取100 μL藻液稀释至适宜浓度后涂布于固体平板培养基上,30 ℃培养至藻落长出。挑取长出的单藻落转接至新的固体平板培养基上,30 ℃培养4 d,置于4 ℃冰箱备用。
种子培养:将固体平板培养基上的藻种用接种环挑取一环接种于装有50 mL种子培养基的250 mL摇瓶中,28 ℃、200 r/min条件下培养48 h。
发酵液培养:按5%接种量,将种子液转接至装有50 mL发酵培养基的250 mL摇瓶中,28 ℃、200 r/min培养120 h。
1.2.2 裂殖壶藻生物量(DCW)及油脂含量的测定取30 mL发酵液于离心管中,8 000 r/min离心15 min,沉淀双蒸水洗涤离心2次,冷冻干燥后称量藻体干重(m1),生物量计算如下:
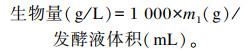
|
采用磷酸香草醛法[14]快速测定油脂含量。
1.2.3 裂殖壶藻油脂提取精确称取1 g冷冻干燥后的藻体于离心管中,加入10 mL浓盐酸和5 mL去离子水,75 ℃水浴1 h,期间每隔10 min振荡1次。冷却后加4 mL无水乙醇与10 mL正己烷,充分摇匀,3 000 r/min离心2 min,萃取油脂[17]。收集上层正己烷层于已知重量(m2)离心管中,重复2~3次,使用氮吹仪(65 ℃水浴)氮吹至正己烷完全蒸发,称离心管总重(m3)。含油量、油脂产量计算公式如下:
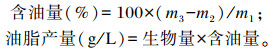
|
脂肪酸甲酯化方法参照文献[18]。气相色谱仪:安捷伦6890N;气相色谱柱:Agilent hp-88(100 m×0.25 mm×0.20 μm)。
1.2.5 诱变藻株的制备及ARTP诱变诱变藻悬液的制备:裂殖壶藻活化种子液,28 ℃、200 r/min培养30~35 h;吸取一定量的藻液至50 mL离心管中,添加玻璃珠振荡打散藻体细胞,4 000 r/min离心5 min,用无菌水洗涤藻体2次,最终重悬于一定量的无菌水和甘油中,同时甘油终浓度为5%,使得测定的吸光度(OD)值在0.9左右,制备为藻悬液。
ARTP诱变:吸取10 μL藻悬液至载片上,涂布均匀,按照诱变条件进行诱变。ARTP仪器型号:IIS(无锡天木源清生物科技有限公司);ARTP诱变条件:功率120 W,气量10 SLM,处理距离2 mm,冷却水循环机设定温度20 ℃;诱变处理按0、5、10、15、20、25、30、35 s梯度诱变。诱变后的载片放入含1 mL无菌水EP管中;将装有载片的EP管振荡1 min,稀释涂平板,28 ℃恒温培养;待藻落长出后,计算致死率,确定最佳诱变时间,绘制致死率曲线,致死率计算公式为:
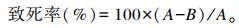
|
式中:A为未经诱变处理的平板上生长的藻落数;B为经过诱变处理的平板上生长的藻落数。
1.2.6 裂殖壶藻藻株的筛选丙二酸筛选方法:将裂殖壶藻藻株涂布在分别添加0.2、0.4、0.6、0.8、1.0、1.2、1.5、2.0 g/L丙二酸的平板培养基上,28 ℃培养3~5 d。根据藻株生长情况,计算裂殖壶藻原始藻株致死率,确定丙二酸对藻株的最低抑制浓度。
2, 2’-联吡啶筛选方法:将裂殖壶藻藻株涂布在分别添加0、20、40、60、80、100、120、150、200 μmol/L的2, 2’-联吡啶平板培养基上,28 ℃培养3~5 d。根据藻株生长情况,计算裂殖壶藻原始藻株致死率,确定2, 2’-联吡啶对藻株的最低抑制浓度。
丙二酸-2, 2’-联吡啶复合筛选方法:将裂殖壶藻藻株涂布在丙二酸及2, 2’-联吡啶2种筛选因子混合的不同浓度的平板培养基上,28 ℃培养3~5 d。根据藻株生长情况,计算裂殖壶藻原始藻株致死率,确定复合筛选对藻株的最低抑制浓度。
1.3 数据统计分析所有试验数据使用SAS 9.4中MIXED模型进行方差分析,再采用Tukey氏法进行多重比较分析。试验数据均以最小二乘均值±标准差(Lsmeans±SD)表示,P < 0.01为差异极显著,P < 0.05为差异显著,0.05≤P < 0.10为存在趋势。
2 结果与分析 2.1 裂殖壶藻活化、培养及诱变将裂殖壶藻原始藻株进行藻株活化、稀释涂布、平板划线及摇瓶培养,后进行ARTP诱变,试验流程如图 1所示。
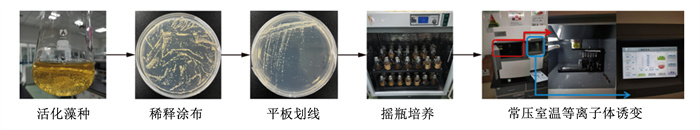
|
图 1 裂殖壶藻活化、培养及诱变流程 Fig. 1 Activation, culture and mutagenesis process of Schizochytrium sp. |
ARTP照射藻体的时间不同,使得藻体的基因突变率也不同。对原始藻株采用不同ARTP照射时间的方法进行诱变,并对藻体致死率进行分析,结果如图 2所示,随着ARTP照射时间的增加,其与藻体致死率之间存在明显的剂量关系。在0~5 s内,随着照射时间的延长,藻体致死率快速上升。5 s以后,随着照射时间延长,藻体致死率缓慢上升。当照射时间为25 s时,藻体致死率达到99%以上。据相关研究报道,藻体致死率在85%~95%之间时,可得到较高的正向突变率[19]。因此,选择诱变照射时间为15 s,在保证较高藻体致死率(95%左右)的同时,也可得到较高的正向突变率。
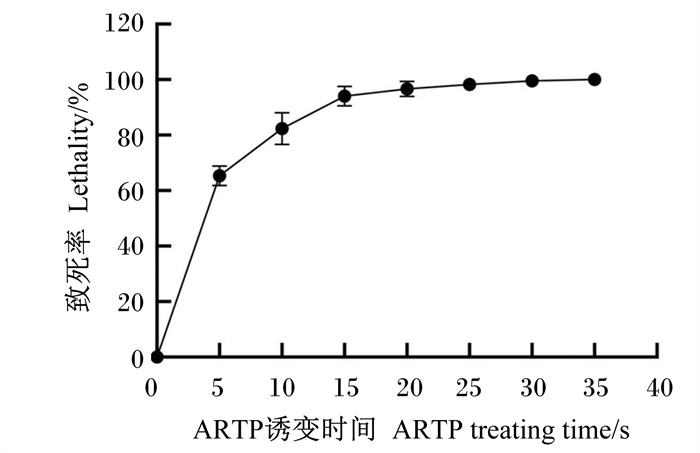
|
图 2 裂殖壶藻ARTP诱变致死率曲线 Fig. 2 Lethality curve of ARTP mutagenesis in Schizochytrium sp. |
丙二酸是琥珀酸的结构类似物,会争夺琥珀酸脱氢酶结合位点,从而抑制藻体三羧酸循环过程,使藻体柠檬酸堆积。柠檬酸转移至线粒体外后,被分解成的大量乙酰辅酶A,乙酰辅酶A可以作为脂肪酸合成前体物质产生更多的脂肪酸[13]。根据裂殖壶藻藻株在丙二酸平板培养基上的生长情况,确定丙二酸对藻株的最低抑制浓度。从表 1可以看出,当丙二酸浓度为0.8 g/L时,藻体生长完全被抑制。赵犇[19]研究结果表明,裂殖壶藻致死率在90%以上为较为合适的筛选浓度。因此,选取0.6 g/L作为筛选平板中丙二酸添加浓度。
|
|
表 1 丙二酸最低抑制浓度测定结果 Table 1 Minimum inhibitory concentration results of malonic acid (n=3) |
2, 2’-联吡啶是活性氧(reactive oxygen species,ROS)的诱发剂之一,可以诱发机体产生ROS,而DHA等长链多不饱和脂肪酸具有抗氧化功能,可缓解由ROS引起的过氧化反应[14]。因此,通过2, 2’-联吡啶诱发的氧化胁迫可能提高DHA藻株的筛选效率。根据裂殖壶藻藻株在2, 2’-联吡啶平板培养基上的生长情况,确定2, 2’-联吡啶对藻株的最低抑制浓度。从表 2可以看出,当2, 2’-联吡啶浓度为80 μmol/L时,藻体生长完全被抑制。有研究表明,藻体致死率在90%以上的筛选因子浓度为合适的筛选浓度[19]。因此,选取60 μmol/L作为筛选平板中2, 2’-联吡啶添加浓度。
|
|
表 2 2, 2’-联吡啶最低抑制浓度测定结果 Table 2 Minimum inhibitory concentration results of 2, 2'-bipyridine (n=3) |
王申强[20]研究发现,通过将多种筛选因子的浓度进行一定比例的混合,可以提高藻株的筛选效率,起到多重作用。根据裂殖壶藻藻株在丙二酸-2, 2’-联吡啶复合平板培养基上的生长情况,确定丙二酸-2, 2’-联吡啶复合因子对藻株的最低抑制浓度。从表 3可以看出,将2种筛选因子进行混合,2, 2’-联吡啶筛选因子的致死效应更高。赵犇[19]的结果也证实选择复合筛选裂殖壶藻原始藻株致死率在90%以上的筛选浓度为合适的藻株筛选浓度。因此,本研究选取0.6 g/L丙二酸、20 μmol/L 2, 2’-联吡啶作为筛选平板中复合因子的添加浓度。
|
|
表 3 藻落在不同浓度丙二酸-2, 2’-联吡啶复合筛选平板上的生长情况 Table 3 Algae flora growth in different concentrations of malonic acid-2, 2'-bipyridine compound screening plate (n=3) |
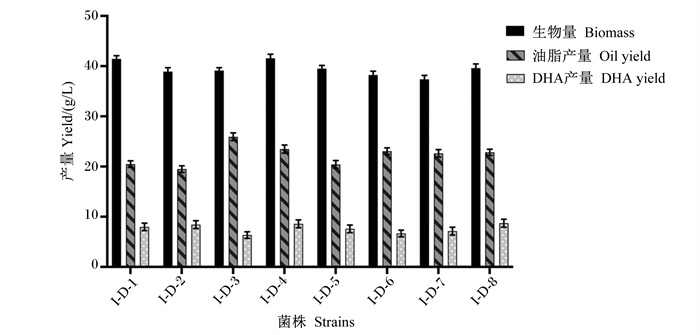
对裂殖壶藻原始藻株进行诱变,分别利用上述3种筛选平板及无筛选因子平板进行筛选,共得到突变藻株43株,分别根据其筛选特性对其进行命名,分别为丙二酸筛选藻株I-B-1~I-B-12,2, 2’-联吡啶筛选藻株I-L-1~I-L-12,复合筛选藻株I-F-1~I-F-11,无筛选因子诱变藻株I-D-1~I-D-8。将所有藻株按培养条件连续培养5 d,摇瓶发酵的藻体生物量、油脂产量及DHA产量的结果如图 3、图 4、图 5和6所示。由图可以看出,相同筛选组内的藻株发酵特性相对稳定,生物量差异较小。
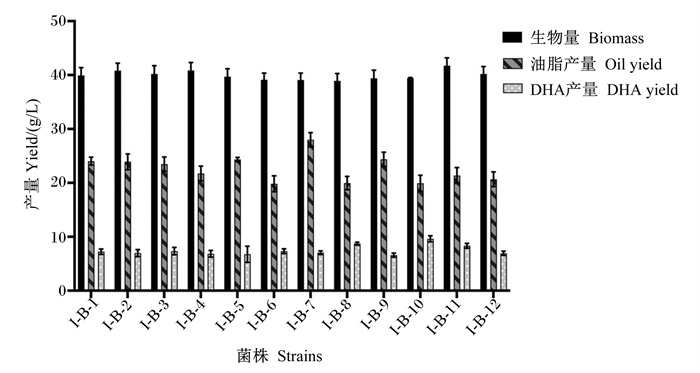
|
图 3 丙二酸筛选裂殖壶藻藻株生物量、油脂产量、DHA产量测定 Fig. 3 Determination of biomass, oil yield and DHA yield of malonic acid screening Schizochytrium sp. strains (n=3) |
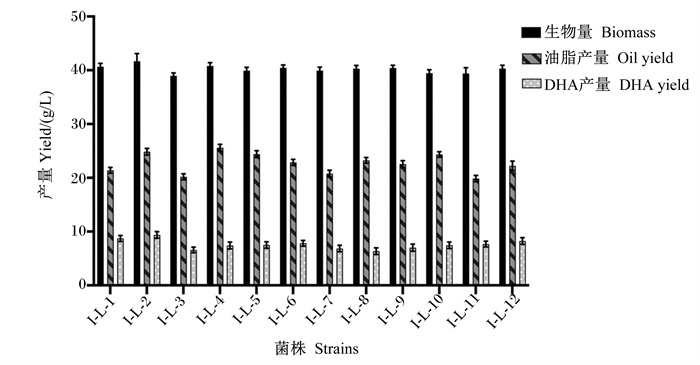
|
图 4 2, 2’-联吡啶筛选裂殖壶藻藻株生物量、油脂产量、DHA产量测定 Fig. 4 Determination of biomass, oil yield and DHA yield of 2, 2'-bipyridine screening Schizochytrium sp. strains (n=3) |
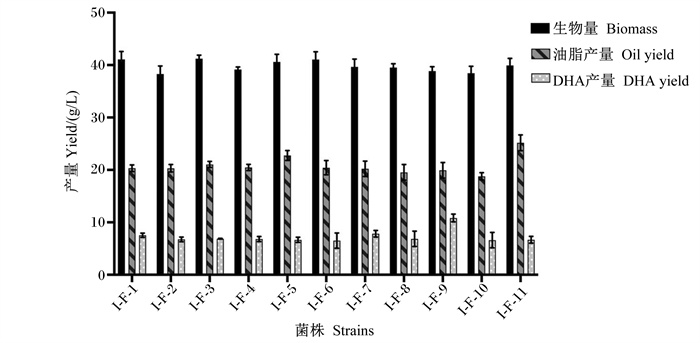
|
图 5 复合筛选裂殖壶藻藻株生物量、油脂产量、DHA产量测定 Fig. 5 Determination of biomass, oil yield and DHA yield of compound screening Schizochytrium sp. strains (n=3) |
|
图 6 无筛选因子筛选裂殖壶藻藻株生物量、油脂产量、DHA产量测定 Fig. 6 Determination of biomass, oil yield and DHA yield of Schizochytrium sp. strains screened without screening factors (n=3) |
分别从各组中选取DHA产量较高的3株藻株进行发酵特性比较,从表 4可以看出,丙二酸筛选藻株、2, 2’-联吡啶筛选藻株、丙二酸-2, 2’-联吡啶复合筛选藻株和无筛选因子诱变藻株的平均DHA产量与原始藻株相比均有显著提高(P<0.05),分别提高了32.20%、25.01%、29.71%和19.25%。同时,丙二酸筛选平板选育的藻株其DHA含量及产量相对稳定,且诱变的效果更好,其DHA平均产量提升显著高于其他筛选平板选育的藻株(P<0.05)。复合筛选组藻株平均DHA产量高于2, 2’联吡啶组、无筛选因子组(P>0.05),但略低于丙二酸组(P>0.05)。试验结果表明,将丙二酸浓度与2, 2’-联吡啶浓度的简单结合并不能完全起到筛选的双重作用效果,但DHA含量及产量最高的菌株I-F-9(DHA含量达54.56%,DHA产量达10.88 g/L)却是从复合平板上筛出的,其DHA含量较原始菌株显著增加了74.62%(P<0.05),DHA产量较原始藻株显著增加了61.17%(P<0.05)。因此,该结果间接表明丙二酸的筛选作用明显优于2, 2’-联吡啶,且通过复合添加多种筛选因子可以提高筛选效率,同时,筛选效率的提高可能与菌体致死率有关,但具体原理还需进一步验证。
|
|
表 4 不同筛选方法裂殖壶藻DHA含量及产量比较 Table 4 Comparison of DHA content and yield of Schizochytrium sp. by different screening methods (n=3) |
ARTP诱变具有诱变温度低、操作简便、活性粒子浓度高且对环境无污染等优点[19]。ARTP可穿过细胞壁直接作用于裂殖壶藻,在保持较高能量传输的同时也可避免温度过高而产生热致死效应,从而产生更强的生物效应[21]。ARTP产生的ROS可以改变细胞膜的结构与通透性,同时能与细胞内DNA等大分子相互作用,改变细胞代谢活动与遗传特征,触发细胞的SOS修复机制,从而产生种类丰富的错配位点,并最终稳定遗传形成突变株[22-23]。因此,本研究采用的ARTP诱变方法能够作为一种简便高效的诱变方法应用到裂殖壶藻的育种中,在提升诱变效率的同时提高藻株DHA产量。
在裂殖壶藻的脂肪酸生物合成中有2条主要合成途径,分别为通过脂肪酸合成酶(fatty acid synthase,FAS)延伸和脱饱和合成短链饱和脂肪酸及其衍生物,以及通过聚酮合酶(polyketide synthase,PKS)合成长链多不饱和脂肪酸[24]。在这2种合成途径中,都需要提供乙酰辅酶A作为脂肪酸合成的前体物质[25]。丙二酸通过抑制藻体三羧酸循环过程以促进细胞内柠檬酸堆积,柠檬酸在线粒体中分解为乙酰辅酶A,为藻体的脂肪酸合成提供了充足的前体物质[15],进而促进藻体DHA等长链不饱和脂肪酸的合成与积累。2, 2’-联吡啶可以作为氧化还原反应中的电子受体,在细胞内经呼吸链传递电子产生氧自由基,氧自由基可诱导超氧化物歧化酶(superoxide dismutase,SOD)的大量产生,进而对ROS毒性产生抵御作用,但SOD对ROS的清除能力是有限的,ROS超出限度后则会产生氧化胁迫对机体产生伤害[26]。DHA等长链不饱和脂肪酸在细胞中可以作为抗氧化剂发挥作用,与SOD共同抵御由ROS诱导的氧化胁迫[16]。经过ARTP诱变的藻体细胞可以通过提高DHA的合成能力,进而提高抗氧化能力,因此,经过高浓度2, 2’-联吡啶筛选的裂殖壶藻藻株,可能具有较高的DHA合成能力。试验结果表明,将丙二酸与2, 2’-联吡啶作为筛选因子可以提高DHA高产藻株的筛选能力,丙二酸筛选藻株平均产量优于2, 2’-联吡啶筛选藻株平均产量,可能是由于ARTP诱变使藻体细胞内产生大量ROS,2, 2’-联吡啶诱导产生的氧自由基使藻体细胞超出自身的调节能力,过量的ROS与藻体细胞内生物大分子反应,导致DNA、蛋白质的损伤和膜脂质的过氧化,提高了细胞的致死率,致死率过高往往产生更多的负突变[14]。同时,将2种筛选因子进行浓度的简单结合并不能显著提高藻体的筛选效率。未来通过连续诱变,多轮组合筛选有望进一步优化诱变方法,并提升藻体的筛选效率。
目前,针对提高裂殖壶藻DHA产量及含量已有较多的研究。通过诱变与强氧化剂施压筛选得到的高产DHA藻种,其DHA产量达到7.3 g/L,相比原始藻株提高了29.8%[14];许永等[27]采用紫外诱变及喹禾灵筛选的方法,筛得的藻株DHA产量为1.2 g/L,DHA含量较原始藻株提高了28.7%。通过本试验建立的诱变筛选方法,诱变藻株较原始藻株在DHA产量及含量上均得到提升(分别提高了61.17%和74.62%),且在相同发酵体系下DHA含量和产量均高于其他的研究结果,相关研究裂殖壶藻DHA含量产量比较如表 5所示。研究表明,不同的发酵体系、发酵时间对藻株的DHA产量有较大影响,在保持发酵时间稳定的情况下,500 mL和5 L的不同发酵体系,藻株的DHA产量从1.35 g/L提高到了20.3 g/L[28];在发酵体系扩大的同时,将发酵时间从61 h延长到96 h,DHA产量从6.53 g/L提高到了28.93 g/L[29]。在相同的250 mL摇瓶发酵体系下,本研究藻株的DHA含量和产量均处于目前同类研究报道的前列,具有极大的开发潜力,后期经过发酵条件及发酵规模的优化调整后,有望进一步提高DHA产量和含量,使其在降低幼龄动物粪便评分、缓解幼龄动物腹泻、提高幼龄动物免疫力等方面发挥更大的作用与功能。
|
|
表 5 相关研究裂殖壶藻DHA含量产量比较 Table 5 Comparison of DHA content and yield of Schizochytrium sp. in related research |
综上所述,本研究采用ARTP诱变及丙二酸、2, 2’-联吡啶和丙二酸-2, 2’-联吡啶复合定向筛选的方式,为高产DHA裂殖壶藻的良种选育提供了一套简便高效的方法。同时,为选育其他提高多不饱和脂肪酸产量的微生物突变体提供了重要参考。
4 结论将裂殖壶藻原始藻株采用ARTP诱变的方法,结合丙二酸、2, 2’-联吡啶及丙二酸-2, 2’-联吡啶复合筛选,极大地提高了DHA藻株的筛选效率,最终从复合平板上筛选出突变藻株I-F-9,在250 mL发酵体系下的生物量、油脂产量及DHA产量分别达到38.82、19.94和10.88 g/L,其中DHA产量较原始藻株提高了61.17%,DHA含量提高了74.62%。
| [1] |
何玉新, 李海燕. 犊牛腹泻的类型、流行与诊治措施[J]. 现代畜牧科技, 2016(5): 107. HE Y X, LI H Y. Types, prevalence, diagnosis and treatment of calf diarrhea[J]. Modern Animal Husbandry Science & Technology, 2016(5): 107 (in Chinese). |
| [2] |
范勇, 胡光荣, 王丽娟, 等. 微藻育种研究进展[J]. 生物学杂志, 2017, 34(2): 3-8, 35. FAN Y, HU G R, WANG L J, et al. Research progress on microalgae breeding[J]. Journal of Biology, 2017, 34(2): 3-8, 35 (in Chinese). |
| [3] |
李润植, 季春丽, 崔红利. 微藻生物技术助力功能农业[J]. 山西农业大学学报(自然科学版), 2018, 38(3): 1-12. LI R Z, JI C L, CUI H L. Microalgal biotechnology promotes functional agriculture[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2018, 38(3): 1-12 (in Chinese). |
| [4] |
HORROCKS L A, YEO Y K. Health benefits of docosahexaenoic acid (DHA)[J]. Pharmacological Research, 1999, 40(3): 211-225. DOI:10.1006/phrs.1999.0495 |
| [5] |
黄明发, 吴桂苹, 焦必宁. 二十二碳六烯酸和二十碳五烯酸的生理功能[J]. 食品与药品, 2007, 9(2): 69-71. HUANG M F, WU G P, JIAO B N. Research advance in physiological function of DHA and EPA[J]. Food and Drug, 2007, 9(2): 69-71 (in Chinese). |
| [6] |
阿拉腾珠拉. 裂壶藻与乳铁蛋白对哺乳犊牛生长和胃肠道健康的影响[D]. 硕士学位论文. 北京: 中国农业科学院, 2020. ALATENGZHULA. Effects of Schizochytrium sp. and lactoferrin on growth and gastrointestinal health of pre-weaning dairy calves[D]. Master's Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2020. (in Chinese) |
| [7] |
MEALE S J, CHAVES A V, HE M L, et al. Dose-response of supplementing marine algae (Schizochytrium spp.) on production performance, fatty acid profiles, and wool parameters of growing lambs[J]. Journal of Animal Science, 2014, 92(5): 2202-2213. DOI:10.2527/jas.2013-7024 |
| [8] |
FLAGA J, KORYTKOWSKI Ł, GÓRKA P, et al. The effect of docosahexaenoic acid-rich algae supplementation in milk replacer on performance and selected immune system functions in calves[J]. Journal of Dairy Science, 2019, 102(10): 8862-8873. DOI:10.3168/jds.2018-16189 |
| [9] |
李婧. 裂殖壶菌利用混合碳源发酵生产DHA的研究[D]. 硕士学位论文. 无锡: 江南大学, 2015. LI J. A strategy of highly DHA production by Aurantiochytrium limacinum SR21 with mixed carbon sources[D]. Master's Thesis. Wuxi: Jiangnan University, 2015. (in Chinese) |
| [10] |
ZHANG M L, WU W B, GUO X L, et al. Mathematical modeling of fed-batch fermentation of Schizochytrium sp. FJU-512 growth and DHA production using a shift control strategy[J]. 3 Biotech, 2018, 8(3): 162. DOI:10.1007/s13205-018-1187-1 |
| [11] |
LIAN M, HUANG H, REN L J, et al. Increase of docosahexaenoic acid production by Schizochytrium sp. through mutagenesis and enzyme assay[J]. Applied Biochemistry and Biotechnology, 2010, 162(4): 935-941. DOI:10.1007/s12010-009-8865-8 |
| [12] |
吕小义, 付杰, 尹佳, 等. 高产DHA裂壶藻突变株的选育[J]. 中国酿造, 2015, 34(4): 106-109. LV X Y, FU J, YIN J, et al. Screening of Schizochytrium limacinum mutant strain with high DHA yield[J]. China Brewing, 2015, 34(4): 106-109 (in Chinese). |
| [13] |
龚定芳, 熊祎楠, 孙佼文, 等. 常压室温等离子体诱变选育DHA高产菌株[J]. 中国油脂, 2019, 44(3): 118-122. GONG D F, XIONG Y N, SUN J W, et al. Mutation breeding Schizochytrium strains producing high-yield DHA via atmospheric and room temperature plasmas[J]. China Oils and Fats, 2019, 44(3): 118-122 (in Chinese). |
| [14] |
袁军, 赵犇, 孙梦玉, 等. 常压室温等离子体(ARTP)诱变快速选育高产DHA的裂殖壶菌突变株[J]. 生物技术通报, 2015, 31(10): 199-204. YUAN J, ZHAO B, SUN M Y, et al. Rapid mutation breeding Schizochytrium strains producing high-yield docosahexenoic acid by atmospheric and room temperature plasmas (ARTP)[J]. Biotechnology Bulletin, 2015, 31(10): 199-204 (in Chinese). |
| [15] |
ZHAO B, LI Y F, LI C L, et al. Enhancement of Schizochytrium DHA synthesis by plasma mutagenesis aided with malonic acid and zeocin screening[J]. Applied Microbiology and Biotechnology, 2018, 102(5): 2351-2361. |
| [16] |
OKUYAMA H, ORIKASA Y, NISHIDA T. Significance of antioxidative functions of eicosapentaenoic and docosahexaenoic acids in marine microorganisms[J]. Applied and Environmental Microbiology, 2008, 74(3): 570-574. |
| [17] |
ZONG H, ZHAN Y, LI X, et al. A new mutation breeding method for Streptomyces albulus by an atmospheric and room temperature plasma[J]. African Journal of Microbiology Research, 2012, 6(13): 3154-3158. |
| [18] |
李仁民, 王菊芳, 马爽, 等. 利用脂肪酸合成酶抑制剂和磷酸香草醛反应筛选高产油脂酵母菌[J]. 微生物学通报, 2008, 35(4): 545-549. LI R M, WANG J F, MA S, et al. Selection of yeast high in lipids-yield by fatty acid synthetase inhibitor and phosphoric acid-vanillin reaction[J]. Microbiology China, 2008, 35(4): 545-549 (in Chinese). |
| [19] |
赵犇. 提高Schizochytrium DHA产量的诱变筛选方法研究及高产机理解析[D]. 博士学位论文. 无锡: 江南大学, 2018. ZHAO B. Specific mutagenesis and screening methods for breeding higher DHA producer of Schizochytrium sp. and the related mechanism analysis[D]. Ph. D. Thesis. Wuxi: Jiangnan University, 2018. (in Chinese) |
| [20] |
王申强. 裂殖壶菌产DHA的发酵工艺研究及高产菌株选育[D]. 硕士学位论文. 无锡: 江南大学, 2013. WANG S Q. Study on DHA fermentation technology by Schizochytrium limacinum SR21and breeding of high-producing strain[D]. Master's Thesis. Wuxi: Jiangnan University, 2013. (in Chinese) |
| [21] |
MA Y B, WANG Z Y, ZHU M, et al. Increased lipid productivity and TAG content in Nannochloropsis by heavy-ion irradiation mutagenesis[J]. Bioresource Technology, 2013, 136: 360-367. |
| [22] |
COOKE M S, EVANS M D, DIZDAROGLU M, et al. Oxidative DNA damage: mechanisms, mutation, and disease[J]. FASEB Journal, 2003, 17(10): 1195-1214. |
| [23] |
GAUNT L F, BEGGS C B, GEORGHIOU G E. Bactericidal action of the reactive species produced by gas-discharge nonthermal plasma at atmospheric pressure: a review[J]. IEEE Transactions on Plasma Science, 2006, 34(4): 1257-1269. |
| [24] |
METZ J G, ROESSLER P, FACCIOTTI D, et al. Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes[J]. Science, 2001, 293(5528): 290-293. |
| [25] |
RATLEDGE C. Fatty acid biosynthesis in microorganisms being used for single cell oil production[J]. Biochimie, 2004, 86(11): 807-815. |
| [26] |
HASSAN H M, SCHRUM L W. Roles of manganese and iron in the regulation of the biosynthesis of manganese-superoxide dismutase in Escherichia coli[J]. FEMS Microbiology Reviews, 1994, 14(4): 315-323. |
| [27] |
许永, 臧晓南, 徐涤, 等. 裂殖壶菌诱变筛选的研究[J]. 中国海洋大学学报(自然科学版), 2012, 42(12): 54-58. XU Y, ZANG X N, XU D, et al. Mutation of Schizochytrium limacinum and screening of elite mutants[J]. Periodical of Ocean University of China, 2012, 42(12): 54-58 (in Chinese). |
| [28] |
JAKOBSEN A N, AASEN I M, JOSEFSEN K D, et al. Accumulation of docosahexaenoic acid-rich lipid in thraustochytrid Aurantiochytrium sp. strain T66:effects of N and P starvation and O2 limitation[J]. Applied Microbiology and Biotechnology, 2008, 80(2): 297-306. |
| [29] |
CHANG G F, GAO N S, TIAN G W, et al. Improvement of docosahexaenoic acid production on glycerol by Schizochytrium sp. S31 with constantly high oxygen transfer coefficient[J]. Bioresource Technology, 2013, 142: 400-406. |
| [30] |
HUANG T Y, LU W C, CHU I M. A fermentation strategy for producing docosahexaenoic acid in Aurantiochytrium limacinum SR21 and increasing C22:6 proportions in total fatty acid[J]. Bioresource Technology, 2012, 123: 8-14. |
| [31] |
CHEN W, ZHOU P P, ZHU Y M, et al. Improvement in the docosahexaenoic acid production of Schizochytrium sp. S056 by replacement of sea salt[J]. Bioprocess and Biosystems Engineering, 2016, 39(2): 315-321. |
| [32] |
赵犇, 王武, 李昌灵, 等. EMS-ARTP复合诱变选育高产DHA裂殖壶菌[J]. 食品与机械, 2018, 34(2): 19-24. ZHAO B, WANG W, LI C L, et al. Enhancement of docosahexaenoic acid production in Schizochytrium sp. 31 combining ethylmethylsulfone and atmospheric and room temperature plasma treatment[J]. Food & Machinery, 2018, 34(2): 19-24 (in Chinese). |




