2. 潍坊加易加生物科技有限公司, 潍坊 261100
2. Weifang Addeasy Bio-Technology Co., Ltd., Weifang 261100, China
支链氨基酸在鱼类生长中具有调节蛋白质合成与降解、氧化供能及提高免疫反应的重要作用[1]。缬氨酸与亮氨酸和异亮氨酸同为支链氨基酸,是鱼类10种必需氨基酸之一,主要在全身肌肉组织中进行氧化代谢,小部分与其他氨基酸相同在肝脏代谢[2]。缬氨酸为生糖氨基酸,经缬氨酸转氨酶脱掉氨基后形成α-酮异戊酸,经缬氨酸脱氢酶复合物催化氧化脱羧生成脂酰辅酶A,脂酰辅酶A通过β氧化作用经β羧酰基辅酶A的中间过程,最终成为琥珀酰辅酶A参与三羧酸循环[3]。
缬氨酸对不同种类水产动物均具有营养调控作用。缬氨酸是人工及野生大西洋鲑(Salmo salar)胚胎和幼鱼发育不可缺少的氨基酸[4],也是中华绒螯蟹生长的第一限制性氨基酸[5]。研究显示,添加1.50%的包膜缬氨酸提高了凡纳滨对虾(Litopenaeus vanamei)虾苗的成活率,缓解了虾苗开口摄食后第9天生长速度的下降[6]。与其他支链氨基酸促进采食的机制不同,脑内注射缬氨酸不仅能够抑制鳜鱼(Siniperca chuatsi)下丘脑的神经元中促食基因刺鼠相关蛋白(agouti-related protein,AGRP)和神经肽Y(neuropeptide Y,NPY)的表达,同时抑制神经元中雷帕霉素靶蛋白(target of rapamycin,mTOR)信号通路基因的表达,从而联合抑制采食[7]。本文对水产动物缬氨酸的需要量、缬氨酸与其他支链氨基酸的相互作用以及缬氨酸对蛋白质代谢、免疫性能、抗氧化功能和肠道健康的影响进行综述,以期为缬氨酸在水产动物营养需求、功能和作用机理与健康养殖方面的深入研究提供参考。
1 水产动物缬氨酸需要量缬氨酸是水产动物的必需氨基酸。缬氨酸缺乏显著降低20和625 g尼罗罗非鱼(Oreochromis niloticus)的体重、体增重、采食量和饲料效率[8-9]。饲料缬氨酸的缺乏通过抑制以肝脏肉毒碱棕榈酰基转移酶-Ⅰ为代表的β氧化基因的表达量,以及肝脏固醇调节元件结合蛋白-1和肝脏脂肪酸合成酶等脂肪合成相关基因的表达量,导致军曹鱼(Rachycentron canadum)体脂肪沉积量降低[10]。饲料中缺乏缬氨酸,显著降低1.41 g大西洋鲑(Salmo salar L.)的增重率、饲料效率和蛋白质利用率[11]。过量缬氨酸对不同种类鱼的生长性能产生的作用不同。饲料中缬氨酸缺乏或过量均可降低卵形鲳鲹(Trachinotus ovatus)的存活率、生长性能、饲料利用率、体蛋白质沉积率及消化酶活性[12]。过量的缬氨酸未对3.15 g红鼓鱼(Sciaenops ocellatus)的生长性能产生显著影响[13]。另有研究表明,在斑点叉尾(Letalurus punetaus)的饲料中过量添加缬氨酸也无法恢复前期缬氨酸缺乏导致的生长抑制和饲料效率的降低[14]。缺缬氨酸乏和过量对鱼类的生长性能、饲料效率、脂肪代谢、蛋白质代谢等产生不同程度的影响,因此,需要开展不同水产动物缬氨酸需要量的研究。
近年来发表的有关水产动物缬氨酸需要量的文献见表 1。由表中数据可知,鱼类对缬氨酸的需要量为0.70%~2.17%,甲壳类对缬氨酸的需要量为1.08%~1.79%,仿刺参对缬氨酸的需要量为1.79%。不同品种鱼对缬氨酸的需要量差异较大,草鱼(Ctenopharyngodon idella)的需要量为1.56%,吉富罗非鱼的需要量为1.41%,鲈鱼(Lateolabrax japonicus)的需要量为2.17%,表明肉食性鱼类缬氨酸需要量高于草食性和杂食性鱼类。同一品种不同规格的鱼类对缬氨酸的需要量不同,不同规格草鱼[15-17]和鲈鱼[1, 18-19]的缬氨酸需要量近似;但大规格尼罗罗非鱼对缬氨酸的需要量为0.78%,低于小规格尼罗罗非鱼的需要量1.15%~1.40%[20-22],大规格虹鳟(Oncorhynchus mykiss)对缬氨酸的需要量为1.41%~1.50%,低于小规格虹鳟的需要量1.57%[23-24]。缬氨酸需要量的表示方式主要有占饲料百分比和占饲料蛋白质百分比2种,表 1采用直接引用或折算为占饲料百分比的方式进行需要量的表示。同一模型下不同评价指标对鱼类缬氨酸的需要量存在影响,研究人员通过多项评价指标,例如同时计算增重率、蛋白质累积率及饲料效率等,综合评估水产动物的缬氨酸需要量,这种方式是应用较为普遍的需要量评价策略[25-26]。此外,二次多项式模型预测异育银鲫(Carassius auratus gibelio)的缬氨酸需要量为1.72%,而折线模型则为1.21%,说明需要量受不同统计模型的影响[27],折线模型一般会比其他模型(指数、曲线模型等)估算的需要量低[2]。在体重、投喂频率、试验时长和循环水环境条件基本相同的情况下,6.5 g尼罗罗非鱼的缬氨酸需要量高于6.48 g尼罗罗非鱼的需要量(表 1),这可能是由于饲养温度(分别为25~27 ℃和27~29 ℃)及饲喂量(每日饲喂量分别占体重的6%~8%和8%~10%)的不同而产生了差异[20-21]。综上所述,水产动物缬氨酸需要量的差异可能受种类、规格、饲料组成、投喂次数及水平、饲养环境条件等多种因素的影响。
|
|
表 1 水产动物缬氨酸需要量 Table 1 Valine requirement of aquatic animals |
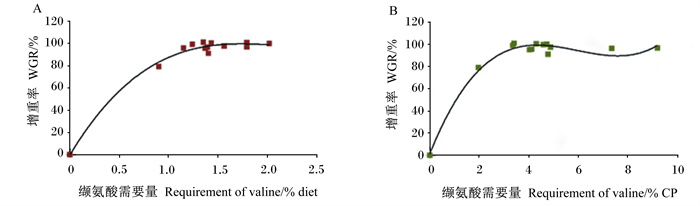
由于不同物种之间有一定程度的同质性[28],因此将鱼类和甲壳类水产动物的缬氨酸需要量共同进行Meta分析。基于不同研究的品种、初始大小、生长速率以及试验条件等的差异,在本文引用的参考文献中,将增重率进行标准化响应处理后与缬氨酸需要量进行分析,如图 1所示。为了分析剂量效应,使用了四参数营养动力学分析方法[29]。根据不同品种对缬氨酸需要量的研究数据,分别采用了增重率与缬氨酸占饲料百分比(% diet,图 1-A)和占饲料中粗蛋白质百分比(% CP)绘制曲线(图 1-B),并尝试采用不同回归分析对曲线进行拟合,最终确定了三次多项式回归分析模型(拟合方程分别为:y=10.73x3-70.38x2+147.34x-0.225 2,R2=0.985 8;y=0.566 8x3-10.13x2+55.866x+1.481,R2=0.979 8),拟合得到鱼类缬氨酸需要量为1.253% diet和3.189% CP,甲壳类缬氨酸需要量为1.736% diet和4.334% CP。
|
图 1 不同鱼类和甲壳类动物缬氨酸需要量的文献数据分析 Fig. 1 Analysis of literature data on valine requirements of different species of fish and crustacean |
有关缬氨酸与支链氨基酸相互作用的研究主要集中在其与亮氨酸的相互作用上。低亮氨酸饲料中添加缬氨酸能够缓解日本牙鲆(Paralichthys olivaceus)的生长抑制,降低氧化应激反应[41]。添加需要量2倍的亮氨酸也无法弥补斑点叉尾因缬氨酸缺乏导致的饲料效率降低的问题;相反的,缬氨酸能够缓解亮氨酸缺乏引发的生长抑制;另外,添加缬氨酸可以缓解过量亮氨酸和低缬氨酸饲料产生的生长抑制,并且提高饲料效率[14]。饲料中添加缬氨酸和异亮氨酸可缓解由过量亮氨酸导致的虹鳟生长性能和代谢的负面影响[42]。综上所述,缬氨酸能够调节饲料中亮氨酸缺乏或过量导致的鱼类的生长抑制,反之,亮氨酸对缬氨酸缺乏造成的生长抑制不具备调节作用。
另外,饲料中2%异亮氨酸与2.27%缬氨酸的相互作用通过阻断肝脏中谷氨酸脱氢酶的活性和基因表达量降低脱氨基作用,同时抑制肌肉中的腺苷单磷酸脱氨酶的活性和基因表达量降低肌肉中氨的产生,从而降低3.57 g牙鲆氨氮的排泄[43]。
3 缬氨酸对水产动物蛋白质代谢的影响缬氨酸可以促进鱼类蛋白质代谢,缬氨酸缺乏或过量均对蛋白质的沉积率和鱼体蛋白质含量产生不良影响。随着饲料中缬氨酸含量的增加,1.35和9.50 g草鱼的蛋白质沉积率显著增加,分别在缬氨酸含量为1.26%和1.63%时达到最大值[15-16];268 g草鱼饲料含有1.31%的缬氨酸时,肌肉中蛋白质含量最高[44]。含有1.317%~1.781%缬氨酸的饲料能够显著提高尼罗罗非鱼幼鱼的蛋白质效率和蛋白质沉积率[20]。饲料中缬氨酸含量达到1.04%~1.40%时,显著提高了红鼓鱼的蛋白质效率和蛋白质沉积率[34]。研究表明,支链氨基酸具有促进多肽链合成的起始来促进蛋白质合成并抑制其分解的作用[45]。脑内注射的缬氨酸通过抑制肝脏中谷氨酸脱氢酶和肌肉中腺苷酸脱氨酶的活性、激活脑-肝回路的肝脏中TOR复合物1(TORC1)的活性来减弱和阻断鳜鱼外周器官蛋白质的水解[46]。表 1显示,对氨基酸需要量的评价不仅局限于增重率、生长率和饲料效率等一般氨基酸的评价指标,蛋白质沉积率被大量的使用,体现了缬氨酸对蛋白质代谢具有重要作用。上述研究表明,缬氨酸通过增加鱼类肌肉中蛋白质含量、提高蛋白质沉积率和抑制蛋白质分解的途径,综合调控蛋白质的代谢。
4 缬氨酸对水产动物免疫功能的影响缬氨酸能够促进水产动物免疫器官的发育,以血清、肝脏和肠道为主要研究对象,提高水产动物的特异性免疫和非特异性免疫能力。饲料中适宜含量的缬氨酸(0.87%~1.49%)可不同程度地提高幼建鲤头肾、后肾和脾脏的重量,促进幼建鲤免疫器官的生长发育;同时,还通过提高白细胞吞噬率、总铁结合力、溶菌酶与酸性磷酸酶(acid phosphatase,ACP)活力、补体3(complement 3,C3)与补体4(complement 4,C4)含量来增强其非特异性免疫能力,以及通过提高抗嗜水气单胞菌抗体效价和水平来增强其特异性免疫能力[33]。饲料中适宜含量的缬氨酸(1.66%~2.07%)与过高或过低缬氨酸含量相比,可提高卵形鲳鲹血清中免疫球蛋白M(immunoglobulin M,IgM)、C3、C4和溶菌酶等免疫指标的含量或活性[12]。缬氨酸通过提高尼罗罗非鱼肝脏溶菌酶的活性,增强肝脏免疫水平[21]。饲料中缬氨酸含量过高或过低均会通过降低肠道溶菌酶、酸性磷酸酶活性及C3含量、提高促炎因子[白细胞介素-8(interleukin-8,IL-8)和肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)]以及降低抑炎因子[白细胞介素-18(interleukin-18,IL-18)和转化生长因子-β(transforming growth factor-beta,TGF-β)]基因表达量抑制草鱼肠道免疫状态;当饲料中含有适量的缬氨酸(0.80%~1.67%)时,抑制核因子-κB(nuclear factor kappa-B,NF-κB)p65/核因子抑制蛋白α(inhibitor α of NF-κB,IκBα)/TOR信号通路基因的表达,进而抑制其下游促炎因子(IL-8和TNF-α)的产生,从而提高肠道免疫状态[17]。在饲料中缬氨酸含量达到1.06%~1.31%时,草鱼鳃中白细胞介素-1β(interleukin-1β,IL-1β)、IL-8、TNF-α和NF-κB p65的表达量显著下降,白细胞介素-10(interleukin-10,IL-10)、TGF-β和IκBα的表达量显著升高,缓解缬氨酸过量或缺乏对草鱼鳃的免疫抑制作用[47]。上述研究表明,饲料中缬氨酸含量过高或过均会引发机体的免疫抑制,适量的缬氨酸可以缓解免疫抑制作用,并且提高动物体的免疫能力。
5 缬氨酸对水产动物抗氧化能力的影响营养物质对动物抗氧化能力影响的评估指标以总抗氧化能力(total antioxidant capacity,T-AOC)、过氧化物酶体标志物[过氧化氢酶(catalase,CAT)]、抗氧化酶体系[超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和谷胱甘肽(glutathione,GSH)等]、脂质氧化产物[丙二醛(malondialdehyde content,MDA)]为主要代表。饲料中缬氨酸缺乏或过量可通过降低卵形鲳鲹血清中T-AOC和SOD活性、增加MDA含量抑制血清抗氧化能力[12]。饲料添加缬氨酸(0.87%~1.49%)可通过降低幼建鲤免疫器官(头肾、后肾和脾脏)中MDA含量、提高SOD和CAT活性增强机体抗氧化能力[33]。饲料添加缬氨酸(1.14%~2.64%)能够通过不同程度地提高仿刺参(Apostichopus japonicus)肠道中T-AOC、总超氧化物歧化酶(total superoxide dismutase,T-SOD)和CAT的活性提高肠道抗氧化能力[37]。缬氨酸(0.80%~1.91%)通过提高草鱼肌肉中SOD、GSH、CAT和GPx活性,降低MDA含量及基因表达量,提高肌肉抗氧化能力[44]。饲喂低亮氨酸(1.6%)和高缬氨酸(2.5%)饲料的日本牙鲆氧化应激强度较低,对氧化应激的耐受能力较高;饲喂低亮氨酸(1.6%)和低缬氨酸(1.2%)饲料的日本牙鲆氧化应激强度较高,对氧化应激的耐受能力较低,说明高缬氨酸能缓解低亮氨酸(1.6%)饲料对日本牙鲆细胞免受氧化应激的影响[41]。在饲料中缬氨酸含量达到1.31%~1.67%时,草鱼鳃中MDA和蛋白质羰基含量显著下降,灭活超氧阴离子和抗羟基自由基含量显著提高;在缬氨酸含量达到1.06%~1.31%时,草鱼鳃中铜锌超氧化物歧化酶(Cu/Zn SOD)和CAT活性显著增加;缬氨酸含量在0.8%以上时,草鱼鳃中GPx、GSH、谷胱甘肽硫转移酶和谷胱甘肽还原酶的活性显著提高[47]。综上所述,缬氨酸在水产动物的免疫器官、血清、肠道和肌肉中都能够发挥抗氧化作用,提高氧化应激的耐受力,并且降低氧化应激水平。
6 缬氨酸对水产动物肠道健康的影响水产动物的生长与肠道健康密不可分。肠道自身的肠道屏障功能和消化能力,决定动物对有害物质的阻隔效应及对营养物质的吸收程度,并影响肠道中菌群的种类和丰度。缬氨酸(0.80%~1.91%)通过提高草鱼肠道紧密连接蛋白的闭合蛋白claudin家族(claudin b、c、3、12和15)、闭锁蛋白(occludin)和闭锁小带蛋白-1(zonula occluden-1,ZO-1)的表达量来改善肠道的物理屏障[44]。饲料含有0.87%~1.49%缬氨酸显著提高了幼建鲤肠道胰蛋白酶、糜蛋白酶、脂肪酶和淀粉酶的活性,饲料含有0.87%~1.87%缬氨酸能够不同程度地提高幼建鲤前肠、中肠和后肠皱襞的高度,并且提高肠道中乳酸菌、降低大肠杆菌和嗜水气单胞菌的数量[33]。缬氨酸能够为肠道菌群提供氮源,饲料中缬氨酸含量为1.49%时可提高建鲤肠道中乳酸菌和芽孢杆菌的丰度,抑制大肠杆菌的生长[48]。综上所述,缬氨酸能从提高肠道防御和消化性能以及调节菌群的种类和丰度2个方向协同促进肠道健康。
7 小结与展望现有研究显示,鱼类对缬氨酸的需要量为0.70%~2.17%,甲壳类对缬氨酸的需要量为1.08%~1.79%,仿刺参对缬氨酸的需要量为1.79%,以目前研究数据为基础拟合得到鱼类缬氨酸需要量为1.253% diet)和3.189% CP,甲壳类缬氨酸需要量1.736% diet)和4.334% CP。缬氨酸对水产动物不同组织器官的蛋白质代谢、免疫性能、抗氧化能力、肠道健康功能都具有良好的促进作用。缬氨酸对水产动物的影响还在持续研究中,其作用机制的深入挖掘、不同种类和规格鱼的需要量的完善、与其他营养物质之间的互作关系以及新的调控功能的探索,都将成为未来缬氨酸研究的方向。
| [1] |
窦秀丽. 鲈鱼(Lateolabrax japonicus)生长中后期缬氨酸、组氨酸和苏氨酸营养需求的研究[D]. 硕士学位论文. 大连: 大连海洋大学, 2014. DOU X L. The study on the optimum requirement of dietary valine, histidine and threonine of Japanese seabass (Lateolabrax Japonicus) in the middle and late growing stage[D]. Master's Thesis. Dalian: Dalian Ocean University, 2014. (in Chinese) |
| [2] |
NRC. Nutrient requirements of fish and shrimp[S]. Washington, D.C. : National Academies Press, 2011.
|
| [3] |
武文一. 吉富罗非鱼对饲料精氨酸、苯丙氨酸和缬氨酸的需要量研究[D]. 硕士学位论文. 上海: 上海海洋大学, 2016. WU W Y. Studies on the requirements of arginine, phenylalanine and valine in the diet to gift tilapia (Oreochromis niloticus)[D]. Master's Thesis. Shanghai: Shanghai Ocean University, 2016. (in Chinese) |
| [4] |
SRIVASTAVA R K, BROWN J A, SHAHIDI F. Changes in the amino acid pool during embryonic development of cultured and wild Atlantic salmon (Salmo salar)[J]. Aquaculture, 1995, 131(1/2): 115-124. |
| [5] |
XIE Q S, LIU Y R. Study on the nutritional quality of ecologically bred Chinese mitten crabs with different body weights[J]. Aquaculture Research, 2020, 51(7): 2948-2961. DOI:10.1111/are.14633 |
| [6] |
黄宝生. 虾片中添加缬氨酸对凡纳滨对虾仔虾生长、存活的影响[D]. 硕士学位论文. 保定: 河北大学, 2010. HUANG B S. Effects of L-valine on growth and survival in Litopenaeus vanamei shrimp[D]. Master's Thesis. Baoding: Hebei University, 2010. (in Chinese) |
| [7] |
CHEN K, ZHANG Z, LI J, et al. Different regulation of branched-chain amino acid on food intake by TOR signaling in Chinese perch (Siniperca chuatsi)[J]. Aquaculture, 2021, 530: 735792. DOI:10.1016/j.aquaculture.2020.735792 |
| [8] |
DIÓGENES A F, FERNANDES J B K, DORIGAM J C P, et al. Establishing the optimal essential amino acid ratios in juveniles of Nile tilapia (Oreochromis niloticus) by the deletion method[J]. Aquaculture Nutrition, 2016, 22(2): 435-443. DOI:10.1111/anu.12262 |
| [9] |
RODRIGUES A T, MANSANO C F M, KHAN K U, et al. Ideal profile of essential amino acids for Nile tilapia (Oreochromis niloticus) in the finishing growth phase[J]. Aquaculture Research, 2020, 51(11): 4724-4735. DOI:10.1111/are.14819 |
| [10] |
王震, 徐玮, 麦康森, 等. 饲料缬氨酸水平对军曹鱼鱼体脂肪含量、血浆生化指标和肝脏脂肪代谢基因表达的影响[J]. 水生生物学报, 2016, 40(4): 744-751. WANG Z, XU W, MAI K S, et al. The effects of valine level on plasma biochemical indexes, lipid content and gene expression involved in lipid metabolism in cobia (Rachycentron canadum)[J]. Acta Hydrobiologica Sinica, 2016, 40(4): 744-751 (in Chinese). |
| [11] |
ROLLIN X, MAMBRINI M, ABBOUDI T, et al. The optimum dietary indispensable amino acid pattern for growing Atlantic salmon (Salmo salar L.) fry[J]. The British Journal of Nutrition, 2003, 90(5): 865-876. DOI:10.1079/BJN2003973 |
| [12] |
HUANG Z, TAN X H, ZHOU C P, et al. Effect of dietary valine levels on the growth performance, feed utilization and immune function of juvenile golden pompano, Trachinotus ovatus[J]. Aquaculture Nutrition, 2018, 24(1): 74-82. DOI:10.1111/anu.12535 |
| [13] |
CASTILLO S, GATLIN D M. Imbalanced dietary levels of branched-chain amino acids affect growth performance and amino acid utilization of juvenile red drum Sciaenops ocellatus[J]. Aquaculture, 2018, 497: 17-23. DOI:10.1016/j.aquaculture.2018.07.029 |
| [14] |
ROBINSON E H, POE W E, WILSON R P. Effects of feeding diets containing an imbalance of branched-chain amino acids on fingerling channel catfish[J]. Aquaculture, 1984, 37(1): 51-62. DOI:10.1016/0044-8486(84)90043-7 |
| [15] |
孙丽慧, 陈建明, 沈斌乾, 等. 草鱼鱼种对饲料中缬氨酸需求量的研究[J]. 上海海洋大学学报, 2017, 26(6): 900-908. SUN L H, CHEN J M, SHEN B Q, et al. Dietary valine requirement for juvenile grass carp (Ctenopharyngodon idella)[J]. Journal of Shanghai Ocean University, 2017, 26(6): 900-908 (in Chinese). |
| [16] |
罗莉, 王亚哥, 李芹, 等. 草鱼幼鱼对缬氨酸需要量的研究[J]. 动物营养学报, 2010, 22(3): 616-624. LUO L, WANG Y G, LI Q, et al. Research on dietary valine requirement of juvenile grass carp (Ctenopharyngodon idella)[J]. Chinese Journal of Animal Nutrition, 2010, 22(3): 616-624 (in Chinese). DOI:10.3969/j.issn.1006-267x.2010.03.015 |
| [17] |
LUO J B, FENG L, JIANG W D, et al. The impaired intestinal mucosal immune system by valine deficiency for young grass carp (Ctenopharyngodon idella) is associated with decreasing immune status and regulating tight junction proteins transcript abundance in the intestine[J]. Fish & Shellfish Immunology, 2014, 40(1): 197-207. |
| [18] |
卫育良, 窦秀丽, 梁萌青, 等. 大规格花鲈对饲料中缬氨酸的需求量研究[J]. 饲料工业, 2021, 42(8): 47-53. WEI Y L, DOU X L, LIANG M Q, et al. Nutrient requirement of valine in large-sized Japanese seabass[J]. Feed Industry, 2021, 42(8): 47-53 (in Chinese). |
| [19] |
李燕. 鲈鱼和大黄鱼支链氨基酸与组氨酸营养生理的研究[D]. 博士学位论文. 青岛: 中国海洋大学, 2010. LI Y. Optimal requirements of branch chain amino acids and histidine in diets of Japanese seabass, Lateolabrax japonicus and large yellow croaker Pesudosciaena crocea R[D]. Ph. D. Thesis. Qingdao: Ocean University of China, 2010. (in Chinese) |
| [20] |
韦庆杰. 尼罗罗非鱼幼鱼对缬氨酸需求量的研究[D]. 硕士学位论文. 南京: 南京农业大学, 2015. WEI Q J. Dietary valine requirement of juvenile Nile tilapia (Orechromis niloticus)[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2015. (in Chinese) |
| [21] |
XIAO W, LI D Y, ZHU J L, et al. Dietary valine requirement of juvenile Nile tilapia, Oreochromis niloticus[J]. Aquaculture Nutrition, 2018, 24(1): 315-323. DOI:10.1111/anu.12562 |
| [22] |
SANTIAGO C B, LOVELL R T. Amino acid requirements for growth of Nile tilapia[J]. The Journal of Nutrition, 1988, 118(12): 1540-1546. DOI:10.1093/jn/118.12.1540 |
| [23] |
RODEHUTSCORD M, BECKER A, PACK M, et al. Response of rainbow trout (Oncorhynchus mykiss) to supplements of individual essential amino acids in a semipurified diet, including an estimate of the maintenance requirement for essential amino acids[J]. The Journal of Nutrition, 1997, 127(6): 1166-1175. DOI:10.1093/jn/127.6.1166 |
| [24] |
BAE J Y, PARK G, YUN H, et al. The dietary valine requirement for rainbow trout, Oncorhynchus mykiss, can be estimated by plasma free valine and ammonia concentrations after dorsal aorta cannulation[J]. Journal of Applied Animal Research, 2012, 40(1): 73-79. DOI:10.1080/09712119.2011.628395 |
| [25] |
AHMED I, KHAN M A. Dietary branched-chain amino acid valine, isoleucine and leucine requirements of fingerling Indian major carp, Cirrhinus mrigala (Hamilton)[J]. The British Journal of Nutrition, 2006, 96(3): 450-460. |
| [26] |
ABIDI S F, KHAN M A. Dietary valine requirement of Indian major carp, Labeo rohita (Hamilton) fry[J]. Journal of Applied Ichthyology, 2004, 20(2): 118-122. DOI:10.1046/j.1439-0426.2003.00526.x |
| [27] |
李桂梅, 解绶启, 雷武, 等. 异育银鲫幼鱼对饲料中缬氨酸需求量的研究[J]. 水生生物学报, 2010, 34(6): 1157-1165. LI G M, XIE S Q, LEI W, et al. Dietary valine requirement for juvenile gibel carp (Carassius auratus gibelio)[J]. Acta Hydrobiologica Sinica, 2010, 34(6): 1157-1165 (in Chinese). |
| [28] |
KAUSHIK S J, SEILIEZ I. Protein and amino acid nutrition and metabolism in fish: current knowledge and future needs[J]. Aquaculture Research, 2010, 41(3): 322-332. DOI:10.1111/j.1365-2109.2009.02174.x |
| [29] |
MERCER L P. The quantitative nutrient-response relationship[J]. The Journal of Nutrition, 1982, 112(3): 560-566. DOI:10.1093/jn/112.3.560 |
| [30] |
RAHIMNEJAD S, LEE K J. Dietary valine requirement of juvenile red sea bream Pagrus major[J]. Aquaculture, 2013, 416/417: 212-218. DOI:10.1016/j.aquaculture.2013.09.026 |
| [31] |
REN M C, HABTE-TSION H M, LIU B, et al. Dietary valine requirement of juvenile blunt snout bream (Megalobrama amblycephala Yih, 1955)[J]. Journal of Applied Ichthyology, 2015, 31(6): 1086-1092. DOI:10.1111/jai.12911 |
| [32] |
RAVI J, DEVARAJ K V. Quantitative essential amino acid requirements for growth of catla, Catla catla (Hamilton)[J]. Aquaculture, 1991, 96(3/4): 281-291. |
| [33] |
董敏. 缬氨酸与幼建鲤消化吸收能力, 免疫能力以及氧化能力之间的关系[D]. 硕士学位论文. 雅安: 四川农业大学, 2011. DONG M. Effects of dietary valine digestive ability, immune function and antioxidative ability of juvenile Jian carp (Cyprinus carpio var. Jian)[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2011. (in Chinese) |
| [34] |
CASTILLO S, GATLIN D M. Dietary requirements for leucine, isoleucine and valine (branched-chain amino acids) by juvenile red drum Sciaenops ocellatus[J]. Aquaculture Nutrition, 2018, 24(3): 1056-1065. DOI:10.1111/anu.12644 |
| [35] |
WILSON R P, POE W E, ROBINSON E H. Leucine, isoleucine, valine and histidine requirements of fingerling channel catfish[J]. The Journal of Nutrition, 1980, 110(4): 627-633. DOI:10.1093/jn/110.4.627 |
| [36] |
BORLONGAN I G, COLOSO R M. Requirements of juvenile milkfish (Chanos chanos Forsskal) for essential amino acids[J]. The Journal of Nutrition, 1993, 123(1): 125-132. DOI:10.1093/jn/123.1.125 |
| [37] |
王用黎. 凡纳滨对虾幼虾对苏氨酸、亮氨酸、色氨酸和缬氨酸需要量的研究[D]. 硕士学位论文. 湛江: 广东海洋大学, 2013. WANG Y L. Study on the requirements of threonine, leucine, tryptophanand valine for juvenile Pacific white shrimp, Litopenaeus vannamei[D]. Master's Thesis. Zhanjiang: Guangdong Ocean University, 2013. (in Chinese) |
| [38] |
MILLAMENA O M, BAUTISTA-TERUEL M N, KANAZAWA A. Valine requirement of postlarval tiger shrimp, Penaeus monodon Fabricius[J]. Aquaculture Nutrition, 1996, 2(3): 129-132. DOI:10.1111/j.1365-2095.1996.tb00051.x |
| [39] |
TESHIMA S, ALAM M S, KOSHIO S, et al. Assessment of requirement values for essential amino acids in the prawn, Marsupenaeus japonicus (Bate)[J]. Aquaculture Research, 2002, 33(6): 395-402. DOI:10.1046/j.1365-2109.2002.00684.x |
| [40] |
韩秀杰. 仿刺参(Apostichopus japonicus)幼参对蛋氨酸、缬氨酸和异亮氨酸最适需求量的研究[D]. 硕士学位论文. 上海: 上海海洋大学, 2018. HAN X J. Study on dietary optimum methionine, valine and isoleucine requirements of juvenile sea cucumber Apostichopus japonicus Selenka[D]. Master's Thesis. Shanghai: Shanghai Ocean University, 2018. (in Chinese) |
| [41] |
HAN Y Z, HAN R Z, KOSHIO S, et al. Interactive effects of dietary valine and leucine on two sizes of Japanese flounder Paralichthys olivaceus[J]. Aquaculture, 2014, 432: 130-138. DOI:10.1016/j.aquaculture.2014.05.004 |
| [42] |
YAMAMOTO T, SHIMA T K, FURUITA H. Antagonistic effects of branched-chain amino acids induced by excess protein-bound leucine in diets for rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2004, 232(1/4): 539-550. |
| [43] |
王旭, 周婧, 薛晓强, 等. 牙鲆饲料中异亮氨酸与缬氨酸的交互作用对消化酶和部分免疫酶的影响[J]. 饲料工业, 2018, 39(20): 23-28. WANG X, ZHOU J, XUE X Q, et al. Interactive effect of dietary isoleucine and valine on digestive enzyme and immune-related enzyme activities of Paralichthys olivaceus[J]. Feed Industry, 2018, 39(20): 23-28 (in Chinese). |
| [44] |
罗建波. 缬氨酸对生长中期草鱼生长、肉质和肠道免疫及其相关基因表达的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2014. LUO J B. Effects of dietary valine on growth, meat quality, intestinal immune and gene expression for young grass carp (Ctenopharyngodon idella)[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2014. (in Chinese) |
| [45] |
代腊, 邹晓庭. 缬氨酸在畜禽生产中的应用[J]. 饲料与畜牧, 2012(12): 20-23. DAI L, ZOU X T. Application of valine in livestock and poultry production[J]. Feed and Animal Husbandry, 2012(12): 20-23 (in Chinese). |
| [46] |
WANG J, LIANG X F, HE S, et al. Valine acts as a nutritional signal in brain to activate TORC1 and attenuate postprandial ammonia-N excretion in Chinese perch (Siniperca chuatsi)[J]. Fish Physiology and Biochemistry, 2020, 46(6): 2015-2025. DOI:10.1007/s10695-020-00767-y |
| [47] |
FENG L, LUO J B, JIANG W D, et al. Changes in barrier health status of the gill for grass carp (Ctenopharyngodon idella) during valine deficiency: regulation of tight junction protein transcript, antioxidant status and apoptosis-related gene expression[J]. Fish & Shellfish Immunology, 2015, 45(2): 239-249. |
| [48] |
DONG M, FENG L, KUANG S Y, et al. Growth, body composition, intestinal enzyme activities and microflora of juvenile Jian carp (Cyprinus carpio var. Jian) fed graded levels of dietary valine[J]. Aquaculture Nutrition, 2012, 19(1): 1-14. |




