黄芩苷(baicalin)又名贝加灵、黄芩甙,属葡萄糖醛酸苷类,分布于黄芩(Scutellaria baicalensis Georgi)的根茎叶中,是黄芩中含量最丰富的黄酮类化合物之一[1-2]。随着对黄芩有效成分的深入研究,黄芩中的活性物质被广泛认知,谱效关系显示黄芩苷在黄芩发挥生物学功能的过程中具有重要的作用[3-4]。研究表明,黄芩苷具有抗菌、抗炎、抗氧化应激和调节机体免疫等生物学功能[5]。在当今全面禁抗的大背景下,绿色健康养殖受到人们广泛关注,植物提取物作为新型饲料添加剂替代抗生素,具有预防动物疾病发生、促进动物健康生长的潜力,逐渐成为研究热点[6]。对黄芩苷的深入研究与应用,将对畜牧养殖的健康发展具有重要意义。本文就黄芩苷的理化性质与代谢特点、生物学功能及其在奶牛生产上的应用进行了阐述,以期为其在奶牛生产中的开发利用提供新的思路和指导。
1 黄芩苷的理化性质与消化代谢特点黄芩苷化学名称为5, 6-二羟基-7-O-葡萄糖醛酸苷黄酮(化学式为C21H18O11),结构式如图 1所示,为淡黄色细针晶,熔点223 ℃,相对分子质量为446.36,易溶于N, N-二甲基甲酰胺、吡啶,不溶于水、乙醚、苯和氯仿等[7-8]。常见的黄芩苷提取方法有水提法、醇回流法、超声法和微波提取法等,不同的提取方法对黄芩苷的提取率有显著影响,同时对其活性也有一定的影响[9-11]。王仁广等[12]以水为提取溶剂,采用Box-Behnken试验设计优化提取工艺,得到最佳提取工艺条件为物料粒度过100目筛,提取时间2.41 min,液料比33 mL/g,此条件高速高效、绿色环保,且黄芩苷提取率可达12.21%。另有研究表明,当料液比为1 ∶ 18、乙醇浓度为55%、pH为4.0、超声功率为59 kHz时,黄芩苷的提取率可达到16.52%[13]。随着科技的发展,黄芩苷的提取技术也在不断发展,其提取纯度和提取率不断提高。传统的水提法和醇回流提取法具有工艺简单、操作简便和提取成本低廉等优点,便于大规模工业生产。超声法和微波提取法因其自身特点目前只限于实验室操作。因此,寻求和探索一种高效、简洁、方便的黄芩苷提取技术也是未来主要研究方向。
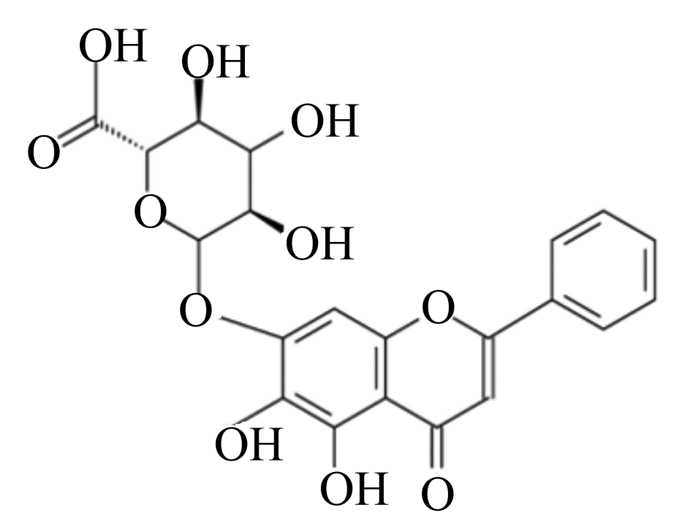
|
图 1 黄芩苷的结构式 Fig. 1 Structural formula of baicalin |
黄芩苷具有较强的极性,故其不能通过被动运输通过细胞膜,需要在多耐药相关蛋白(MRP)2和乳腺癌耐药蛋白(BCRP)等转运蛋白的作用下进入细胞内[14]。黄芩苷主要在肝脏和肠道中进行代谢,在肝脏中代谢途径主要为羟基化、脱羟基化、甲基化和脱葡萄糖醛酸化;在肠道中黄芩苷经脱糖反应生成黄芩素,再经羟基化、脱羟基化、甲基化进行代谢反应[15],其在肝脏和肠道中的代谢途径与产物分别如图 2和图 3所示。Huang等[16]研究发现,黄芩苷在血液中经β-葡萄糖醛酸酶、葡萄糖醛酸转移酶、硫酸酯酶和儿茶酚氧位甲基转移酶等酶的作用进一步代谢,代谢物经血液运输到达肝脏、肾脏和脾脏等部位。Zhang等[17]在大鼠中鉴定出黄芩苷的代谢产物有32种,其中尿液中检测到23种,血浆中检测到26种,肾脏和肝脏含有的黄芩苷代谢物最多,分别有10种和9种,而在心脏、脾脏、肺脏和脑中仅观察到5种代谢物,这也表明黄芩苷代谢的主要器官在肝脏。Zhang等[18]研究发现,黄芩苷在消化道内很难被吸收,但容易被肠道细菌产生的β-葡萄糖醛酸酶水解为容易吸收进入血液的黄芩素,黄芩素进入血液后可在体循环中被尿苷二磷酸-葡萄糖醛酸转移酶还原为黄芩苷。黄芩苷进入肠道后先在小肠上段吸收,随后以苷元的形式在结肠被吸收,经一系列代谢反应后最终在MRP2的作用下以葡萄糖醛酸苷的形式在胆汁中排泄[19]。黄芩苷与黄芩素在体内相互转化共同发挥抗炎、抗氧化等生物学功能[20]。
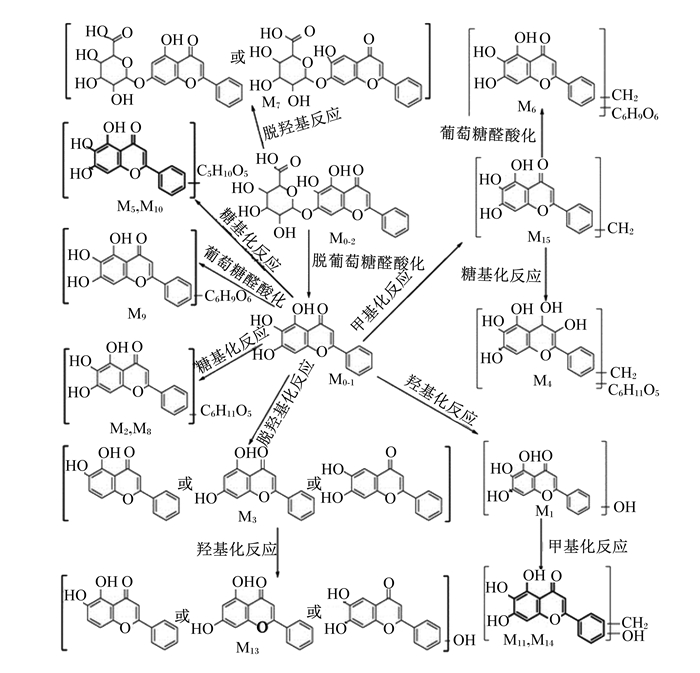
|
图 2 黄芩苷在肝脏中的代谢途径与产物 Fig. 2 Metabolic pathway and products of baicalin in liver[15] |
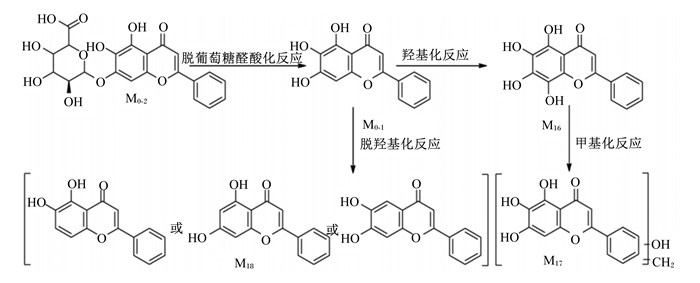
|
图 3 黄芩苷在肠道中的代谢途径与产物 Fig. 3 Metabolic pathway and products of baicalin in intestine[15] |
黄芩苷具有显著的抗菌作用,其生物抑菌机制包括破坏细菌细胞膜、抑制细菌的脱氧核糖核酸、抑制菌蛋白质生物合成和降解内毒素等,对金黄色葡萄球菌、大肠杆菌、白色念球菌等有害菌具有显著的抑制作用[21]。黄芩苷结构中的羟基在抗菌作用中发挥着显著作用[22]。研究表明,黄芩苷可以阻止金黄色葡萄球菌对细胞黏附,并直接结合到金黄色葡萄球菌的活性部位,以阻断与其底物的结合,导致金黄色葡萄球菌的活性降低,达到抑菌作用[23]。Zhao等[24]研究发现,黄芩苷通过改变乳房炎病原菌大肠杆菌的细胞膜通透性,使细菌表面凹陷、皱缩发生形变,降低细菌体内耐药基因的表达,达到抗菌作用。在白色念珠菌生物膜体外抗真菌活性的研究中发现,黄芩苷能抑制琥珀酸脱氢酶活性,增加细胞内钙离子含量,加速细胞凋亡,并伴有明显的超微结构改变,调控生物膜的通透性以达到抗菌作用[25]。黄芩苷代谢产物黄芩素和木蝴蝶素具有抑制侵袭能力、生成硝酸盐、转录表达炎症反应的相关毒力基因的作用,通过调节宿主反应和病原体毒力来保护机体免受细菌感染[26]。Zhang等[27]研究表明,黄芩苷可以通过抑制群体感应系统来调节金黄色葡萄球菌的感染,抑制金黄色葡萄球菌毒力相关因子α溶血素(hla)和argA的表达,使细菌细胞壁明显折叠,部分细胞壁裂开,胞内物质渗出,细菌毒性降低。通过以上研究结果分析得出,黄芩苷的抑菌效果非常明显,但对黄芩苷化学结构与菌体细胞结构结合的机理,还有待进一步的研究。
2.2 抗炎黄芩苷结构中Δ2平面的双键结构在抗炎反应中发挥着重要作用,其可以作用于环氧化酶起到抗炎效果,同时其结构中的自由酚羟基和羰基也具有一定的抗炎作用[28]。黄芩苷可以通过抑制炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-17(IL-17)、基质金属蛋白酶-9和调节核因子-κB(NF-κB)信号通路等发挥抗炎作用[29]。Cheng等[30]研究表明,脂多糖(LPS)能够通过激活Toll样受体4(TLR4)引起细胞损伤,将炎症因子NF-κB转移到细胞核中并改变相关炎症基因的表达。黄芩苷一方面可以显著降低诱导型一氧化氮合酶(iNOS)和环氧化酶-2(COX-2)的基因表达发挥抗炎功能,另一方面可以通过下调细胞中磷酸核因子NF-κB p65和磷酸NF-κB抑制激酶的表达来抑制LPS诱导的TNF-α、IL-6和白细胞介素-8(IL-8)的产生,并以剂量依赖的方式减轻炎症细胞浸润、充血和上皮细胞脱落等[31-32]。Ye等[33]研究表明,50~100 mg/mL的黄芩苷能显著抑制LPS诱导的仔猪单核吞噬细胞产生TNF-α、白细胞介素-18(IL-18)及IL-1β,其发挥抗炎活性与抑制LPS刺激下的含有3的Nod样受体家族pyrin结构域(NLRP3)炎症体通路相关,但具体信号通路还有待探究。以上研究表明,黄芩苷可通过多种代谢通路发挥抗炎作用,但如果对这些代谢通路进行调控,更好地发挥黄芩苷的抗炎功能,还需进一步的研究。由细菌、病毒等病原体感染引起的炎症反应会破坏机体的自由基稳态,从而产生活性氧(ROS)和活性氮(RNS),进一步参与病原体的复制、基因突变并诱发宿主细胞凋亡,从而促使炎症进一步发生。自由基导致的氧化应激与炎症和免疫失衡通过调控转录水平进而相互影响,形成由自由基稳态失衡主导产生的三方联动效应[34]。动物许多疾病产生深层次营养代谢根本原因是机体内部自由基稳态失衡引起的氧化应激,氧化应激和炎症通常是畜群出现的健康问题2个重要引爆点,其中由自由基稳态失衡造成的氧化应激是源头引爆点。炎症是这一联动效应中重要的一方。氧化应激加重炎症反应,而炎症通过炎症介质促进氧化,反过来又加重氧化应激,形成恶性联动循环。
2.3 抗氧化应激黄芩苷具有清除超氧自由基、抑制脂质过氧化和提高抗氧化酶活性的能力,具有保护生物膜和延缓衰老的作用,其发挥抗氧化活性是黄芩苷结构中6-酚羟基基团起主要作用,6-酚羟基易断裂发生抽氢反应进而发挥抗氧化作用[35-36]。Guo等[37]研究表明,在小鼠模型中热休克蛋白(Hsp)是一种应激反应蛋白,黄芩苷可以通过Fas/Fas配体途径和调节Hsp7家族基因在支持细胞中的表达并改善干细胞因子(SCF)和胶质细胞源性神经营养因子(GDNF)的表达来阻止热应激诱导的细胞凋亡,达到抗氧化应激的目的。吴宜艳等[38]研究表明,50~100 μmol/L的黄芩苷可以通过调节硫氧还蛋白(Trx)氧化还原系统和细胞凋亡途径,提高超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性,降低丙二醛(MDA)含量,进而发挥对细胞的保护作用。黄芩苷可以逆转应激引起的细胞损伤,其通过降低MDA和4-羟基醛(4-HNE)含量,抑制内源性ROS的产生,提高线粒体乙醛脱氢酶2(ALDH2)的mRNA表达和蛋白水平及ALDH2活性,具有显著的抗氧化作用[39]。Qian等[40]研究表明,黄芩苷具有清除自由基和减少脂质过氧化的能力,可以显著提高动物体内SOD和GSH-Px活性,降低MDA含量,下调蛋白激酶D1和NF-κB蛋白表达从而发挥缓解氧化应激的作用。
2.4 免疫调节黄芩苷对动物机体免疫器官和组织具有调节和保护作用。Toll样受体(TLRs)可启动宿主免疫反应,黄芩苷对TLR4信号通路的阻断始于对其内源性配体高迁移率族蛋白B1(HMGB1)的抑制作用,其通过调节NF-κB和丝裂原活化蛋白激酶(MAPK)[p38、细胞外信号调节激酶(ERK)和c-Jun氨基末端激酶(JNK)],以及它们各自的靶分子,促炎细胞因子或激活蛋白-1(AP-1)产生从而达到调节免疫的作用[41]。马雁南等[42]研究黄芩苷对小鼠子宫局部免疫调节作用时发现,0.4 mL/(mg·d)的黄芩苷在小鼠子宫局部免疫调节中,可通过促进Th2型途径安胎作用,抑制Th1型免疫细胞产生TNF-α,在避免胚胎丢失方面发挥作用。黄芩苷可提高动物吞噬细胞的吞噬指数,促进T、B淋巴细胞增殖,从而增强机体抗微生物感染能力。Gong等[43]研究发现,100 μg/mL黄芩苷可以通过增加白细胞介素-2(IL-2)mRNA的表达刺激T、B细胞增殖,参与先天性和适应性免疫反应,从而增强机体抗微生物感染能力,同时可以通过上调T、B淋巴细胞中TLR3、TLR7、TLR8和TLR9基因的表达来提高免疫调节作用。在动物体内,巨噬细胞对清除凋亡细胞、维持组织稳态、保护免疫应答方面起核心作用,黄芩苷通过上调M2D型巨噬细胞特征因子血管内皮生长因子以及显著上调MER原癌基因酪氨酸蛋白激酶(MERTK)和正五聚蛋白3(PTX3)等基因的表达,促进M2C型巨噬细胞极化,提高机体免疫能力[44]。
黄芩苷还可以通过靶向凋亡途径、MAPK途径、磷脂酰肌醇-3-羟激酶(PI3K)-Akt-哺乳动物雷帕霉素靶蛋白(mTOR)信号通路和肿瘤相关巨噬细胞来抑制肿瘤生长,对肿瘤生长具有显著的抑制作用[45-46]。不同浓度的黄芩苷处理人骨肉瘤细胞后,线粒体膜电位明显下降,ROS产生,激活半胱氨酸天冬氨酸蛋白酶(caspase)-9和caspase-3,并以剂量和时间依赖的方式降低宿主细胞的生存能力,以及通过活性氧诱导细胞凋亡[47]。黄芩苷可以激活MAPK途径,通过积累ROS、激活p38抑制剂和增强肿瘤坏死因子相关凋亡诱导配体(TRAIL)的抗癌活性,进而达到抗癌的目的[48]。Diao等[49]研究表明,黄芩苷可以抑制剂的方式下调肿瘤组织中PDZ结合激酶(PBK)/托普卡下游信号分子组蛋白H3和ERK2的表达,抑制肺癌细胞增长。同时,黄芩苷也可以上调孕酮诱导的蜕膜蛋白(DEPP),激活体内Ras/Raf/丝裂原活化蛋白激酶激酶(MEK)/ERK信号通路,调节肿瘤细胞中衰老相关β-半乳糖苷酶(SA-β-Gal)的活性,提高体内SOD活性,降低ROS水平,诱导肿瘤细胞衰老[50]。当机体发生免疫应激时,体内抗氧化系统随之也会失衡从而激活氧化应激系统,其中NF-κB信号通路是连接这2个系统的桥梁。LPS在激活NF-κB信号通路的同时会释放大量ROS,抑制或减少细胞的氧化损伤,增强细胞的抗氧化能力。
3 黄芩苷在奶牛生产中的应用 3.1 提高奶牛的抗热应激能力将黄芩苷作为饲料添加剂添加到饲粮中可有效缓解奶牛的热应激。当动物暴露于高温的时候,机体就会由于热应激合成Hsp70,来保护动物体自身。焦玉兰[51]研究复合黄芩苷制剂治疗奶牛热应激时发现,添加黄芩苷治疗可以提高机体Hsp70水平,从而使机体更早更快地适应热应激状态,更好地保护机体器官免受热应激的损伤。在热应激状态下,动物机体的甲状腺活动减弱、代谢降低,导致甲状腺激素和三碘甲腺原氨酸的分泌量减少;皮质醇的重要作用是提高机体抵抗力,增强体液免疫,进而提高动物对热应激的适应性。研究发现,黄芩添加剂组中奶牛血液中的皮质醇、甲状腺素和三碘甲腺原氨酸分别比对照组提高24.71%、3.25%和27.78%,这说明黄芩添加剂具有预防和减轻奶牛热应激的作用[52]。国晓瞳等[53]研究表明,黄芩苷通过提高热应激下睾丸支持细胞表达胶质细胞源性神经生长因子和干细胞因子的表达,保护热应激导致的牛睾丸支持细胞的损伤。以上研究表明,黄芩苷添加剂可通过提高血液生化指标和Hsp的水平,使机体提早适应热应激更好地保护机体免受热应激损害。
3.2 治疗奶牛的乳房炎奶牛乳房炎是机体代谢和生理状态改变,乳房损伤以及接触传染性病原微生物等引起的乳腺炎症反应。黄芩苷被广泛用于中药配伍治疗奶牛乳房炎。芩红灌注剂是治疗奶牛乳房炎的一种中药混合物,芩红灌注剂中的黄芩苷可以用来作为该药药效的质量评价标准[54]。同时,高翔[55]的研究也表明,黄芩苷可以作为中药灌注剂的主要成分来治疗奶牛乳房炎。此外,黄芩苷可以降低血管通透性,通过抑制释放组胺、白细胞介素以及5-羟色胺等介质,减轻细胞损伤,起到抗炎的作用,当发生急性炎症时,它能明显减少炎症介质的含量,对治疗奶牛乳房炎具有明显作用[56]。
乳腺上皮细胞是构成乳腺组织的主要组成细胞,在乳腺的发育、退化、泌乳及炎症的发生中起着重要的作用。Perruchot等[57]研究表明,1~10 μg/mL的黄芩苷能减弱H2O2诱导的活性氧产生,并显著提高过氧化氢酶活性和核因子E2相关因子2(Nrf2)蛋白表达,通过调节细胞增殖、凋亡、细胞活力和氧化反应促进奶牛乳腺上皮细胞的发育。同样,黄芩苷可以抑制LPS诱导的TNF-α和IL-1β细胞因子的产生和基因表达,阻止NF-κB的活化,增加Hsp72的表达,以保护奶牛乳腺上皮细胞免受LPS诱导的炎症和凋亡,从而提高细胞活力[58]。在金黄色葡萄球菌诱导的奶牛乳腺上皮细胞凋亡和坏死过程中,黄芩苷可抑制金黄色葡萄球菌产生潘顿-瓦伦丁白细胞介素(PVL)和重组PVL 2种毒素,降低金黄色葡萄球菌中LukS-PV蛋白表达水平,揭示了黄芩苷对PVL毒素引起的奶牛乳房炎具有治疗作用[59]。马维武[60]研究表明,高浓度的黄芩苷(大于25 μg/mL)具有一定的细胞毒性,低浓度的黄芩苷(2.5~10.0 μg/mL)可以缓解金黄色葡萄球菌诱导的奶牛乳腺上皮细胞损伤。以上研究结果表明,黄芩苷可通过减轻细胞损伤、减少炎症介质含量和抑制金黄色葡萄球菌的活性,从而达到预防和治疗奶牛乳房炎的效果。
3.3 提高奶牛的泌乳性能将黄芩作为饲料添加剂添加到饲粮中可以提高奶牛的泌乳性能。火东晓等[61]研究黄芩添加剂对泌乳奶牛泌乳性能的影响,结果表明,添加含黄芩的中草药组奶牛的脉搏数较对照组显著降低,产奶量提高了15.67%,说明黄芩添加剂可有效缓解热应激对奶牛的不良影响。胡美华[62]研究发现,将含黄芩的中草药添加到饲粮中,结果表明,试验组比对照组平均每头牛每日多产奶1.08 kg,比对照组提高了8.81%,且试验组的各种乳成分含量明显提高,其中乳蛋白、总固形物、非脂固形物含量均显著增加;试验组的乳脂率和乳蛋白比对照组分别提高6.32%和16.61%。赖雨宏等[63]研究山花黄芩提取物对奶牛生产性能、乳品质及经济效益的影响时发现,在饲粮中添加10、20、40 g/d的山花黄芩提取物,奶牛平均产奶量分别比对照组提高18.7%、28.7%、31.8%,乳蛋白率分别提高4.2%、13.5%、18.5%,该试验结果表明,山花黄芩提取物可有效提高奶牛产奶量和乳品质。另外,用复合黄芩苷制剂治疗奶牛,与热应激组相比,平均日产奶量可提高4.6%,乳脂率提高0.8%,乳蛋白率提高1.0%[51]。由此可见,复合黄芩苷具有提高奶牛产奶量和乳品质的作用。因此,在奶牛饲粮中添加适量的黄芩苷可有效提高奶牛泌乳性能,同时改善乳品质。
4 小结黄芩苷作为黄芩的主要提取物,具有抗菌、抗炎和抗氧化应激等生物学功能,在奶牛生产中具有很好的应用前景。它既可以作为活性饲料添加剂,提高奶牛的抗应激能力和泌乳性能,也可以作为复方中草药用来治疗奶牛疾病,总体提高动物的生产性能和抗病力,从而提高养殖场的总体经济效益。然而,黄芩苷在奶牛体内如何代谢以及其调控机理还有待进一步研究,因此需要加强黄芩苷在奶牛生产中的应用效果及其作用机制研究,为进一步开发黄芩苷作为生物活性物质在奶牛中的应用提供理论依据。
| [1] |
MAKINO T, HISHIDA A, GODA Y, et al. Comparison of the major flavonoid content of S. baicalensis, S. lateriflora, and their commercial products[J]. Journal of Natural Medicines, 2008, 62(3): 294-299. DOI:10.1007/s11418-008-0230-7 |
| [2] |
TUAN P A, KIM Y S, KIM Y, et al. Molecular characterization of flavonoid biosynthetic genes and accumulation of baicalin, baicalein, and wogonin in plant and hairy root of Scutellaria lateriflora[J]. Saudi Journal of Biological Sciences, 2018, 25(8): 1639-1647. DOI:10.1016/j.sjbs.2016.08.011 |
| [3] |
ZHAO J J, GAO X J, WANG Y H, et al. Comparative studies on HPLC fingerprint and near-infrared spectra of cultivated and reference crude Scutellaria baicalensis[J]. China Journal of Chinese Materia Medica, 2016, 41(22): 4204-4209. |
| [4] |
王钰乐, 刘文, 杨道斌, 等. 黄芩的谱效关系研究[J]. 中华中医药学刊, 2017, 35(12): 3110-3113. WANG Y L, LIU W, YANG D B, et al. Research on spectrum-effect relationship of Scutellaria baicalensis Georgi[J]. Chinese Archives of Traditional Chinese Medicine, 2017, 35(12): 3110-3113 (in Chinese). |
| [5] |
LI C R, LIN G, ZUO Z. Pharmacological effects and pharmacokinetics properties of Radix scutellariae and its bioactive flavones[J]. Biopharmaceutics & Drug Disposition, 2011, 32(8): 427-445. |
| [6] |
MUROTA K, NAKAMURA Y, UEHARA M. Flavonoid metabolism: the interaction of metabolites and gut microbiota[J]. Bioscience, Biotechnology, and Biochemistry, 2018, 82(4): 600-610. DOI:10.1080/09168451.2018.1444467 |
| [7] |
SHI C, BAO J X, SUN Y, et al. Discovery of baicalin as NDM-1 inhibitor: virtual screening, biological evaluation and molecular simulation[J]. Bioorganic Chemistry, 2019, 88: 102953. DOI:10.1016/j.bioorg.2019.102953 |
| [8] |
辛明慧, 华会明, 张予阳, 等. 黄芩苷衍生物的合成及其生物活性研究[J]. 中国药物化学杂志, 2014, 24(1): 14-18. XIN M H, HUA H M, ZHANG Y Y, et al. Synthesis and evaluation of biological activity of baicalin derivatives[J]. Chinese Journal of Medicinal Chemistry, 2014, 24(1): 14-18 (in Chinese). |
| [9] |
ROSHANAK S, RAHIMMALEK M, GOLI S A H. Evaluation of seven different drying treatments in respect to total flavonoid, phenolic, vitamin C content, chlorophyll, antioxidant activity and color of green tea (Camellia sinensis or C. assamica) leaves[J]. Journal of Food Science and Technology, 2016, 53(1): 721-729. DOI:10.1007/s13197-015-2030-x |
| [10] |
吴史博. 不同提取方法对黄芩苷提取率的影响[J]. 安徽农业科学, 2017, 45(15): 134-136. WU S B. Effects of different extraction methods on the extraction rate of baicalin[J]. Journal of Anhui Agricultural Sciences, 2017, 45(15): 134-136 (in Chinese). DOI:10.3969/j.issn.0517-6611.2017.15.042 |
| [11] |
赵明明, 王艺文, 李婼楠, 等. 黄芩中黄芩苷提取方法研究进展[J]. 现代农业科技, 2020(8): 233-234, 236. ZHAO M M, WANG Y W, LI R N, et al. Research progress on extraction methods of baicalin from Scutellaria baicalensis Georgi[J]. Modern Agricultural Science and Technology, 2020(8): 233-234, 236 (in Chinese). DOI:10.3969/j.issn.1007-5739.2020.08.144 |
| [12] |
王仁广, 贾艾玲, 邱智东, 等. 响应面法优化黄芩中黄芩苷的电磁裂解提取工艺[J]. 中国实验方剂学杂志, 2019, 25(21): 106-111. WANG R G, JIA A L, QIU Z D, et al. Optimization of electromagnetic cracking extraction technology of baicalin in Scutellariae radix by response surface methodology[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(21): 106-111 (in Chinese). |
| [13] |
刘昊, 常仁旭, 陈博, 等. 正交试验优化黄芩中黄芩苷超声提取工艺[J]. 黑龙江畜牧兽医, 2017(22): 162-164. LIU H, CHANG R X, CHEN B, et al. Optimization of ultrasonic extraction process of baicalin from Scutellaria baicalensis[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(22): 162-164 (in Chinese). |
| [14] |
KALAPOS-KOVÁCS B, MAGDA B, JANI M, et al. Multiple ABC transporters efflux baicalin[J]. Phytotherapy Research, 2015, 29(12): 1987-1990. DOI:10.1002/ptr.5477 |
| [15] |
解立科, 田小亭, 郭小珍, 等. 黄芩素与黄芩苷微生物和肝脏代谢异同研究[J]. 中成药, 2020, 42(7): 1830-1836. XIE L K, TIAN X T, GUO X Z, et al. Differences and similarities in microbial and liver metabolisms between baicalein and baicalin[J]. Chinese Traditional Patent Medicine, 2020, 42(7): 1830-1836 (in Chinese). |
| [16] |
HUANG T, LIU Y A, ZHANG C L. Pharmacokinetics and bioavailability enhancement of baicalin: a review[J]. European Journal of Drug Metabolism and Pharmacokinetics, 2019, 44(2): 159-168. DOI:10.1007/s13318-018-0509-3 |
| [17] |
ZHANG J Y, CAI W, ZHOU Y, et al. Profiling and identification of the metabolites of baicalin and study on their tissue distribution in rats by ultra-high-performance liquid chromatography with linear ion trap-orbitrap mass spectrometer[J]. Journal of Chromatography.B, Analytical Technologies in the Biomedical and Life Sciences, 2015, 985: 91-102. DOI:10.1016/j.jchromb.2015.01.018 |
| [18] |
ZHANG R Y, CUI Y L, WANG Y, et al. Catechol-O-methyltransferase and UDP-glucuronosyltransferases in the metabolism of baicalein in different species[J]. European Journal of Drug Metabolism and Pharmacokinetics, 2017, 42(6): 981-992. DOI:10.1007/s13318-017-0419-9 |
| [19] |
LU T, SONG J, HUANG F, et al. Comparative pharmacokinetics of baicalin after oral administration of pure baicalin, Radix scutellariae extract and Huang-Lian-Jie-Du-Tang to rats[J]. Journal of Ethnopharmacology, 2007, 110(3): 412-418. DOI:10.1016/j.jep.2006.09.036 |
| [20] |
杨迪, 袁婷婷, 干舒蕾, 等. 静脉注射黄芩苷、黄芩素在大鼠体内的药代规律比较研究[J]. 中国临床药理学与治疗学, 2017, 22(4): 394-400. YANG D, YUAN T T, GAN S L, et al. Comparative study on the pharmacokinetics of baicalin and baicalein in rats after intravenous administration[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2017, 22(4): 394-400 (in Chinese). |
| [21] |
刘昊, 赵自冰, 王新. 黄芩苷抗菌作用研究进展[J]. 畜牧与饲料科学, 2017, 38(7): 61-63. LIU H, ZHAO Z B, WANG X. Research progress on antibacterial activity of baicalin[J]. Journal of Animal Husbandry and Feed Science, 2017, 38(7): 61-63 (in Chinese). DOI:10.3969/j.issn.1672-5190.2017.07.022 |
| [22] |
黄鑫, 梁剑平, 郝宝成. 黄酮类化合物的分子修饰与构效关系的研究[J]. 安徽农业科学, 2015, 43(11): 57-61. HUANG X, LIANG J P, HAO B C. Study on molecular modification and structure-activity relationship of flavonoids[J]. Journal of Anhui Agricultural Sciences, 2015, 43(11): 57-61 (in Chinese). DOI:10.3969/j.issn.0517-6611.2015.11.022 |
| [23] |
WANG G Z, GAO Y W, WANG H S, et al. Baicalin weakens Staphylococcus aureus pathogenicity by targeting sortase B[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 418. DOI:10.3389/fcimb.2018.00418 |
| [24] |
ZHAO Q Y, YUAN F W, LIANG T, et al. Baicalin inhibits Escherichia coli isolates in bovine mastitic milk and reduces antimicrobial resistance[J]. Journal of Dairy Science, 2018, 101(3): 2415-2422. DOI:10.3168/jds.2017-13349 |
| [25] |
WANG T M, SHI G X, SHAO J, et al. In vitro antifungal activity of baicalin against Candida albicans biofilms via apoptotic induction[J]. Microbial Pathogenesis, 2015, 87: 21-29. DOI:10.1016/j.micpath.2015.07.006 |
| [26] |
WU S C, CHU X L, SU J Q, et al. Baicalin protects mice against Salmonella typhimurium infection via the modulation of both bacterial virulence and host response[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2018, 48: 21-31. DOI:10.1016/j.phymed.2018.04.063 |
| [27] |
ZHANG S P, HU B, XU J F, et al. Baicalin suppress growth and virulence-related factors of methicillin-resistant Staphylococcus aureus in vitro and in vivo[J]. Microbial Pathogenesis, 2020, 139: 103899. DOI:10.1016/j.micpath.2019.103899 |
| [28] |
俞文英, 张欢欢, 吴月国, 等. 黄酮类化合物的构效关系及其在肺部炎症疾病中的应用[J]. 中草药, 2018, 49(20): 4912-4918. YU W Y, ZHANG H H, WU Y G, et al. Structure-activity relationship of flavonoids and its application in pulmonary inflammatory diseases[J]. Chinese Traditional and Herbal Drugs, 2018, 49(20): 4912-4918 (in Chinese). |
| [29] |
DINDA B, DINDA S, DASSHARMA S, et al. Therapeutic potentials of baicalin and its aglycone, baicalein against inflammatory disorders[J]. European Journal of Medicinal Chemistry, 2017, 131: 68-80. DOI:10.1016/j.ejmech.2017.03.004 |
| [30] |
CHENG P, WANG T, LI W, et al. Baicalin alleviates lipopolysaccharide-induced liver inflammation in chicken by suppressing TLR4-mediated NF-κB pathway[J]. Frontiers in Pharmacology, 2017, 8: 547. DOI:10.3389/fphar.2017.00547 |
| [31] |
YE L, TAO Y H, WANG Y M, et al. The effects of baicalin on the TLR2/4 signaling pathway in the peripheral blood mononuclear cells of a lipopolysaccharide-induced rat fever model[J]. International Immunopharmacology, 2015, 25(1): 106-111. DOI:10.1016/j.intimp.2014.12.028 |
| [32] |
MIAO Y, ISHFAQ M, LIU Y, et al. Baicalin attenuates endometritis in a rabbit model induced by infection with Escherichia coli and Staphylococcus aureus via NF-κB and JNK signaling pathways[J]. Domestic Animal Endocrinology, 2021, 74: 106508. DOI:10.1016/j.domaniend.2020.106508 |
| [33] |
YE C, LI S L, YAO W X, et al. The anti-inflammatory effects of baicalin through suppression of NLRP3 inflammasome pathway in LPS-challenged piglet mononuclear phagocytes[J]. Innate Immunity, 2016, 22(3): 196-204. DOI:10.1177/1753425916631032 |
| [34] |
卢德勋. 动物营养学科发展在战略方向上的重大突破: 构建动物健康营养理论和技术体系及其实际应用[J]. 动物营养学报, 2021, 33(1): 1-12. LU D X. A major breakthrough in development of animal nutrition in strategic direction: building an animal health and nutrition theory and technology system and its application[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 1-12 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.01.001 |
| [35] |
韩宝瑞. 黄芩苷结构修饰及抗氧化构效关系[J]. 食品科学, 2011, 32(1): 49-51. HAN B R. Baicalin: chemical modification and structure-antioxidant activity relationship[J]. Food Science, 2011, 32(1): 49-51 (in Chinese). |
| [36] |
刘靖丽, 崔莹超. 黄芩素和黄芩苷抗氧化活性与结构关系的密度泛函理论研究[J]. 云南民族大学学报(自然科学版), 2017, 26(6): 461-464. LIU J L, CUI Y C. The density functional theory studies on the relationship between antioxidant activity and structure of baicalein and baicalin[J]. Journal of Yunnan University of Nationalities (Natural Sciences Edition), 2017, 26(6): 461-464 (in Chinese). DOI:10.3969/j.issn.1672-8513.2017.06.006 |
| [37] |
GUO X T, CHI S K, CONG X, et al. Baicalin protects sertoli cells from heat stress-induced apoptosis via activation of the Fas/FasL pathway and Hsp72 expression[J]. Reproductive Toxicology, 2015, 57: 196-203. DOI:10.1016/j.reprotox.2015.06.049 |
| [38] |
吴宜艳, 韩杨, 李玲玉, 等. 黄芩苷通过抗氧化对H2O2诱导的SH-SY5Y细胞损伤的保护作用[J]. 中国医药导报, 2018, 15(27): 8-11. WU Y Y, HAN Y, LI L Y, et al. The protective effect of baicalin on the damaged SH-SY5Y cells induced by H2O2 through antioxygenation[J]. China Medical Herald, 2018, 15(27): 8-11 (in Chinese). |
| [39] |
JIANG W B, ZHAO W, CHEN H, et al. Baicalin protects H9c2 cardiomyocytes against hypoxia/reoxygenation-induced apoptosis and oxidative stress through activation of mitochondrial aldehyde dehydrogenase 2[J]. Clinical and Experimental Pharmacology and Physiology, 2018, 45(3): 303-311. DOI:10.1111/1440-1681.12876 |
| [40] |
QIAN Y Z, CHEN Y, WANG L Y, et al. Effects of baicalin on inflammatory reaction, oxidative stress and PKDl and NF-kB protein expressions in rats with severe acute pancreatitis1[J]. Acta Cirurgica Brasileira, 2018, 33(7): 556-564. DOI:10.1590/s0102-865020180070000001 |
| [41] |
JIANG M, LI Z N, ZHU G X. Immunological regulatory effect of flavonoid baicalin on innate immune Toll-like receptors[J]. Pharmacological Research, 2020, 158: 104890. DOI:10.1016/j.phrs.2020.104890 |
| [42] |
马雁南, 杨小颀. 黄芩苷对LPS致流产小鼠的子宫局部免疫调节机制研究[J]. 天津中医药大学学报, 2018, 37(4): 314-317. MA Y N, YANG X Q. Mechanism research of baicalin regulating the local immunomodulatory mechanism of uterus by LPS induced abortion mice[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(4): 314-317 (in Chinese). |
| [43] |
GONG S Q, SUN W, WANG M, et al. Role of TLR4 and TCR or BCR against baicalin-induced responses in T and B cells[J]. International Immunopharmacology, 2011, 11(12): 2176-2180. DOI:10.1016/j.intimp.2011.09.015 |
| [44] |
LAI Y S, PUTRA R B D S, AUI S P, et al. M2C polarization by baicalin enhances efferocytosis via upregulation of MERTK receptor[J]. The American Journal of Chinese Medicine, 2018, 46(8): 1899-1914. DOI:10.1142/S0192415X18500957 |
| [45] |
CHENG C S, CHEN J, TAN H Y, et al. Scutellaria baicalensis and cancer treatment: recent progress and perspectives in biomedical and clinical studies[J]. The American Journal of Chinese Medicine, 2018, 46(1): 25-54. DOI:10.1142/S0192415X18500027 |
| [46] |
GONG W Y, ZHAO Z X, LIU B J, et al. Exploring the chemopreventive properties and perspectives of baicalin and its aglycone baicalein in solid tumors[J]. European Journal of Medicinal Chemistry, 2017, 126: 844-852. DOI:10.1016/j.ejmech.2016.11.058 |
| [47] |
WAN D Q, OUYANG H N. Baicalin induces apoptosis in human osteosarcoma cell through ROS-mediated mitochondrial pathway[J]. Natural Product Research, 2018, 32(16): 1996-2000. DOI:10.1080/14786419.2017.1359173 |
| [48] |
ZHANG L, WANG X, WANG R X, et al. Baicalin potentiates TRAIL-induced apoptosis through p38 MAPK activation and intracellular reactive oxygen species production[J]. Molecular Medicine Reports, 2017, 16(6): 8549-8555. DOI:10.3892/mmr.2017.7633 |
| [49] |
DIAO X, YANG D F, CHEN Y, et al. Baicalin suppresses lung cancer growth by targeting PDZ-binding kinase/T-LAK cell-originated protein kinase[J]. Bioscience Reports, 2019, 39(4): BSR20181692. DOI:10.1042/BSR20181692 |
| [50] |
WANG Z, MA L M, SU M Q, et al. Baicalin induces cellular senescence in human colon cancer cells via upregulation of DEPP and the activation of Ras/Raf/MEK/ERK signaling[J]. Cell Death & Disease, 2018, 9(2): 217. |
| [51] |
焦玉兰. 抗奶牛热应激中药组方的筛选及其机理研究[D]. 硕士学位论文. 保定: 河北农业大学, 2010. JIAO Y L. Study on mechanism and screening on Chinese medicine prescriptions of dairy cows under heat stress[D]. Master's Thesis. Baoding: Agricultural University of Hebei, 2010. (in Chinese) |
| [52] |
黄健晖. 中草药添加剂对奶牛抗热应激和提高产奶量的影响[D]. 硕士学位论文. 福州: 福建农林大学, 2009. HUANG J H. Effect of traditional Chinese herbal medicine additive on thermoresistant stress alleviation and raising productivity in dairy cow[D]. Master's Thesis. Fuzhou: Fujian Agriculture and Forestry University, 2009. (in Chinese) |
| [53] |
国晓瞳, 张倩, 于枫, 等. 黄芩苷对热应激犊牛睾丸支持细胞胶质细胞源性神经生长因子(GDNF)和干细胞因子(SCF)表达的影响[J]. 农业生物技术学报, 2015, 23(4): 441-449. GUO X T, ZHANG Q, YU F, et al. Baicalin affects glial cell line-derived neurotrophic factor (GDNF) and stem cell factor (SCF) expression in heat-stressed calf (Bos taurus) sertoli cells[J]. Journal of Agricultural Biotechnology, 2015, 23(4): 441-449 (in Chinese). DOI:10.3969/j.issn.1674-7968.2015.04.003 |
| [54] |
李海华, 陈志强, 蔡小利, 等. 治疗乳房炎的中药芩红灌注剂质量标准的建立[J]. 中国畜牧兽医, 2019, 46(12): 3775-3784. LI H H, CHEN Z Q, CAI X L, et al. Establishment a Chinese medicine quality standard of Qinhong perfusate for the treatment of mastiffs[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(12): 3775-3784 (in Chinese). |
| [55] |
高翔. 奶牛乳房炎中药注射剂的制备及质量控制[D]. 硕士学位论文. 晋中: 山西农业大学, 2019. GAO X. Preparation and quality control of traditional Chinese medicine injection for dairy cow mastitis[D]. Master's Thesis. Jinzhong: Shanxi Agricultural University, 2019. (in Chinese) |
| [56] |
王雯卿. 吉林省白城市奶牛隐性乳腺炎流行病学调查及致病菌的耐药分析[D]. 硕士学位论文. 长春: 吉林大学, 2018. WANG W Q. The epidemiological investigation of cattle recessive mastitis and drug resistance analysis of pathogens in Baicheng city, Jilin province[D]. Master's Thesis. Changchun: Jilin University, 2018. (in Chinese) |
| [57] |
PERRUCHOT M H, GONDRET F, ROBERT F, et al. Effect of the flavonoid baicalin on the proliferative capacity of bovine mammary cells and their ability to regulate oxidative stress[J]. PeerJ, 2019, 7: e6565. DOI:10.7717/peerj.6565 |
| [58] |
YANG W H, LI H T, CONG X, et al. Baicalin attenuates lipopolysaccharide induced inflammation and apoptosis of cow mammary epithelial cells by regulating NF-κB and HSP72[J]. International Immunopharmacology, 2016, 40: 139-145. DOI:10.1016/j.intimp.2016.08.032 |
| [59] |
JIA F, MA W W, ZHANG X J, et al. Matrine and baicalin inhibit apoptosis induced by Panton-Valentine leukocidin of Staphylococcus aureus in bovine mammary epithelial cells[J]. Journal of Dairy Science, 2020, 103(3): 2731-2742. DOI:10.3168/jds.2019-17619 |
| [60] |
马维武. 苦参碱、黄芩苷干预金黄色葡萄球菌PV-杀白细胞素损伤奶牛乳腺上皮细胞的作用机制[D]. 硕士学位论文. 银川: 宁夏大学, 2019. MA W W. Mechanism of matrine and baicalin intervening in Staphylococcus aureus Panton-Valentine leukocidin-induced to bovine mammary epithelial cells[D]. Master's Thesis. Yinchuan: Ningxia University, 2019. (in Chinese) |
| [61] |
火东晓, 蔡冀, 刘思维, 等. 抗热应激剂对夏季奶牛生理及乳成分的影响[J]. 饲料研究, 2012(3): 7-9. HUO D X, CAI J, LIU S W, et al. Effects of anti-heat stress agents on physiology and milk composition of summer dairy cows[J]. Feed Research, 2012(3): 7-9 (in Chinese). DOI:10.3969/j.issn.1002-2813.2012.03.003 |
| [62] |
胡美华. 抗热应激中草药饲料添加剂对奶牛泌乳性能影响的研究[D]. 硕士学位论文. 福州: 福建农林大学, 2003. HU M H. Studies on thermoresistant stress alleviating of Chinese herbal feed additive to dairy cows[D]. Master's Thesis. Fuzhou: Fujian Agriculture and Forestry University, 2003. (in Chinese) |
| [63] |
赖雨宏, 田雨, 吴寒若. 山花黄芩提取物散对奶牛生产性能、乳品质及经济效益的影响[J]. 饲料研究, 2021, 44(9): 37-40. LAI Y H, TIAN Y, WU H R. Effects of Radix scutellariae extract powder on performance, milk quality and economic benefit of dairy cows[J]. Feed Research, 2021, 44(9): 37-40 (in Chinese). |




