2. 中化云龙有限公司, 成都 655204;
3. 福建商学院工商管理学院, 福州 350016;
4. 福建省新闽科生物科技开发有限公司博士后工作站, 福州 350008
2. Sinochem Yunlong Co., Ltd., Chengdu 655204, China;
3. School of Business Administration, Fujian College of Commerce, Fuzhou 350016, China;
4. Postdoctoral Workstation of Fujian Xinminke Biology Science and Technology Development Co., Ltd., Fuzhou 350008, China
磷是动物体内除钙以外含量最为丰富的矿物元素,其参与并促进机体体内新陈代谢,能够提高动物生长和生产性能,并能防治疾病[1]。目前,饲料中的磷酸盐添加剂产品主要有磷酸氢钙(DCP)、磷酸二氢钙(MCP)和脱氟磷酸钙(DFP),其次是磷酸一二钙(MDCP);此外还有磷酸一铵(MAP)、磷酸二铵(DAP)、磷酸钙镁以及尿素磷酸盐等专用的饲料磷酸盐,但市场使用量相对较少[2]。DCP难溶于水,动物对其有效成分的吸收率低(< 60%),其余钙、磷随粪便排出体外,造成生态环境磷污染[3]。MDCP是MCP和DCP的共晶结合物,动物对其有效成分的吸收率较DCP高(>75%),且其在粪便中残留的磷较少[4]。发达国家在畜禽饲粮中常选用磷利用效率较高的MDCP和MCP,而我国仍采用利用率较低的DCP。中国农业科学院饲料研究所用小鸡和乳猪对MDCP的生物学效价进行研究发现,MDCP在消化吸收率方面比传统的DCP高8个百分点,MDCP正越来越受到青睐[5]。MCP和MDCP呈酸性,系酸力低;DCP偏碱性,系酸力高。对于肠道未完全发育幼畜,断奶等应激导致胃酸分泌不足,肠道消化酶活性降低,低系酸力饲粮能够提高其肠道消化率,减缓断奶应激[6],因此,MCP和MDCP与DCP相比水溶解性更好,酸性更强,更有利于肠道健康。此外,微酸性MCP和MDCP比偏碱性的DCP适口性好,可提高采食量[7]。基于此,本研究在无植酸酶添加的新型饲粮条件下,旨在研究育肥猪饲粮中用MDCP和MCP替代DCP的应用效果及适宜添加量,为育肥猪饲粮配制磷源的选择提供科学依据和理论参考。
1 材料与方法 1.1 试验材料试验作用MDCP、MCP和DCP由某公司提供,均为颗粒状。其中,MDCP中钙和无机磷含量分别为14.7%和21.4%;MCP中钙和无机磷含量分别为13.8%和23.0%;DCP纯度为99%,钙和无机磷含量分别为23.0%和17.7%。试验所用饲粮中除钙和磷水平不同外,其他营养水平均保持一致,钙与总磷比值(钙磷比)保持在1.2~1.4。
1.2 试验场地和试验期本试验在福建省福州市晋安区宦溪镇弥高村福建弥高种猪有限公司独栋猪场进行,试验期从2019年10月15日至2020年1月12日,共90 d,其中预试期10 d、正试期80 d。
1.3 试验设计和试验动物试验选用640头体重为(63.10±2.32) kg、遗传背景一致、健康的“杜×长×大”三元杂交猪,随机分为5个组,每组8个重复,每个重复16头(公母各占1/2)。对照组饲喂基础饲粮,磷源为DCP;试验1组磷源为MDCP,其中MDCP提供的磷水平为对照组DCP提供磷水平的80%;试验2组磷源为MDCP,其中MDCP提供的磷水平为对照组DCP提供磷水平的60%;试验3组磷源为MCP,其中MCP提供的磷水平为对照组DCP提供磷水平的80%;试验4组磷源为MCP,其中MCP提供的磷水平为对照组DCP提供磷水平的60%。试验设计见表 1。
|
|
表 1 试验设计 Table 1 Experiment design |
试验基础饲粮参照《猪饲养标准》(NY/T 65—2004)进行配制,并根据规模养猪实际情况进行调整,其中钙水平为0.55%、总磷水平为0.44%、有效磷水平为0.20%、钙/有效磷为2.75 ∶ 1.00;试验组饲粮根据表 1所示MDCP或MCP替代DCP提供磷的比例来计算相应的调整,各组间饲粮其他营养水平保持一致。各组饲粮组成及营养水平见表 2。
|
|
表 2 饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of diets (air-dry basis) |
预试期前完成免疫注射及驱虫,随时观察供试猪的食欲、精神状况和粪便等情况,发现异常及时将非正常猪剔除。试验猪每天定时饲喂2次(09:00和16:00),每次饲喂量以下次饲喂时食槽剩少许饲粮为准,自由饮水,半漏粪地面饲养,每天清粪1次,每周冲圈消毒1次。
1.6 样品制备饲粮样品:以组为单位从每个包装袋取饲粮150 g,混合均匀后按照四分法采集饲粮样品,冷藏保存待测钙和磷含量。
粪便样品:在正试期的第78~80天,每重复连续收集全粪3 d,称重后每重复取500 g,滴加50 mL 10%的盐酸,置于-20 ℃冻存。将粪样解冻,105 ℃快速烘干60 min,再65 ℃烘干至恒重,室温下回潮24 h,粉碎过40目筛,以组为单位将3 d的粪样混匀,按10%的比例取样,装入磨口瓶中-20 ℃保存,待测钙和磷含量。
血清样品:每个重复随机抽取3头猪(2公+1母)进行耳缘静脉采血10 mL,静置30 min后,将血液3 000 r /min离心10 min,取血清分2份装于1.5 mL冷冻管于-20 ℃保存,待测血清钙、磷含量及其他生化指标。
胫骨样品:将抽血的3头猪进行屠宰,采集前腿左右2根胫骨,去除肌肉和结缔组织,测定左右胫骨的重量、长度和直径,再将右胫骨放入-20 ℃保存以备分析胫骨强度和胫骨密度;左胫骨用乙醇脱脂48 h,再于105 ℃烘干,粉碎以备检测钙和磷含量。
组织样品:猪开膛后立即用无菌手术剪刀、镊子和剪刀采集里脊肉、肝脏组织,迅速放入液氮保存,待测胰岛素样生长因子-Ⅰ(IGF-Ⅰ)和生长激素(GH)含量及其基因表达量。
肠道内容物样品:空肠、回肠和盲肠各段用灭菌麻线扎紧,将内容物挤至一端后,开小口,再挤入冻存管中,放入液氮保存,待测肠道微生物。
1.7 测定指标及方法生长性能指标:预试期结束时,试验猪禁食16 h测定初始体重;试验结束时,试验猪禁食16 h测定终末体重,并计算平均日增重。
采用高锰酸钾法(GB/T 6436—2002)测定钙含量,采用磷钼钒酸比色法(GB/T 6437—2002)测定磷含量;按照张忠远等[8]推荐的常规全收粪法计算饲粮中钙和磷的表观消化率;采用DIRUI 600全自动生化分析仪测定血清钙、磷含量及其他生化指标;采用日本岛津AG-IC 20KN骨强度测定仪,对解剖剥净的右胫骨进行骨强度测定。
血清生化指标以及组织IGF-Ⅰ和GH含量及其基因表达量委托上海恒远生物科技有限公司测定完成。采用实时荧光定量PCR仪(Applied Biosystems ViiA7,ABI,美国),设计引物为猪GH(M1095f,5′ CTC AAG CAA ACC TAC GAC AAA 3′;M1095r,5′ TAG CCC GCA GGT ATG TCT C 3′)和猪IGF-Ⅰ(M1096f,5′ TTC CTG AAG AGT GAA GAA TGA C 3′;M1096r,5′ GAA TGC CCA TCT TTT GAA AT 3′),由Invitrogen合成;反应体系(20 μL):1×定量PCR Premix 10 μL,模板cDNA 1.0 μL,0.2 μmol/L上、下游引物各2 μL,ddH2O 5 μL。反应条件:95 ℃预热1 min;95 ℃ 5 s,60 ℃ 30 s,40个循环;熔解曲线95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。每个样品重复3次,选用2-ΔΔCt定量方法[9]对GH和IGF-Ⅰ相对表达量进行分析。
按照粪便基因组提取试剂盒(Omega D4015)操作说明,提取空场、回肠和盲肠内容物总DNA,用核酸浓度测定仪检测其浓度和纯度。采用0.8%琼脂糖凝胶电泳检测DNA完整性;16S rRNA V3~V4区扩增、基因测序文库构建和Illumina MiSeq测序及数据生物学分析部分委托诺禾致源生物信息科技有限公司完成。
1.8 数据统计分析利用Excel 2010对原始数据进行初步整理,采用SPSS 19.0对数据进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行多重比较,P < 0.05为差异显著,结果用“平均值±标准差”表示。
微生物测序数据通过使用FLASH(1.2.7)、Qiime(1.9.1)等软件对reads进行拼接、处理得到最终的有效数据。通过Uparse(7.0.1001)软件对所有样本的全部有效数据进行聚类、选取、筛选和注释,用Mothur方法与SILVA132的SSUrRNA数据库进行物种注释分析,获得分类学信息并统计各样本的群落组成。
2 结果与分析 2.1 不同磷源对育肥猪生长性能的影响由表 3可知,与对照组相比,试验1组和试验4组育肥猪终末体重显著提高(P < 0.05),试验1组平均日增重显著提高(P < 0.05)。
|
|
表 3 不同磷源对育肥猪生长性能的影响 Table 3 Effects of different phosphorus sources on growth performance of finishing pigs |
由表 4可知,与对照组相比,各试验组育肥猪钙表观消化率无显著差异(P>0.05),试验2组磷表观消化率显著提高(P < 0.05)。
|
|
表 4 不同磷源对育肥猪钙和磷表观消化率的影响 Table 4 Effects of different phosphorus sources on apparent digestibility of calcium and phosphorus of finishing pigs |
由表 5可知,与对照组相比,各试验组育肥猪胫骨钙含量、磷含量、强度、密度、平均长度、平均重量和平均直径均无显著差异(P>0.05)。
|
|
表 5 不同磷源对育肥猪胫骨指标的影响 Table 5 Effects of different phosphorus sources on tibia indices of finishing pigs |
由表 6可知,与对照组相比,试验3组和试验4组育肥猪血清钙含量均显著升高(P < 0.05),试验1组血清磷含量显著降低(P < 0.05);各组血清总蛋白和白蛋白含量、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、谷氨酰转肽酶、碱性磷酸酶、乳酸脱氢酶和肌酸激酶活性以及肌酐含量均无显著差异(P>0.05)。
|
|
表 6 不同磷源对育肥猪血清生化指标的影响 Table 6 Effects of different phosphorus sources on serum biochemical indices of finishing pigs |
由表 7可知,与对照组相比,试验组育肥猪肌肉、肝脏和血清IGF-Ⅰ含量均显著提高(P < 0.05),其中试验3组和试验4组肌肉IGF-Ⅰ含量显著高于试验1组和试验2组(P < 0.05),试验2组、试验3组和试验4组肝脏IGF-Ⅰ含量显著高于试验1组(P < 0.05),试验3组血清IGF-Ⅰ含量显著高于试验1组、试验2组和试验4组(P < 0.05),且试验4组血清IGF-Ⅰ含量显著高于试验1组(P < 0.05)。
|
|
表 7 不同磷源对育肥猪组织和血清IGF-Ⅰ和GH含量的影响 Table 7 Effects of different phosphorus sources on contents of IGF-Ⅰ and GH in serum of finishing pigs |
与对照组相比,试验组肌肉和血清GH含量均显著提高(P < 0.05),其中试验3组和试验4组肌肉GH含量显著高于试验1组和试验2组(P < 0.05),试验3组血清GH含量显著高于试验1组和试验4组(P < 0.05),试验2组和试验4组血清GH含量显著高于试验1组(P < 0.05);与对照组相比,试验2组、试验3组和试验4组肝脏GH含量均显著提高(P < 0.05),其中试验3组和试验4组肝脏GH含量显著高于试验1组和试验2组(P < 0.05),且试验2组肝脏GH含量显著高于试验1组(P < 0.05)。
2.6 不同磷源对育肥猪组织IGF-Ⅰ和GH相对表达量的影响由图 1可知,与对照组相比,试验3组育肥猪肌肉GH相对表达量显著降低(P < 0.05);各试验组肝脏GH相对表达量无显著差异(P>0.05),但试验3组肝脏GH相对表达量显著高于试验1组、试验2组和试验4组(P < 0.05)。
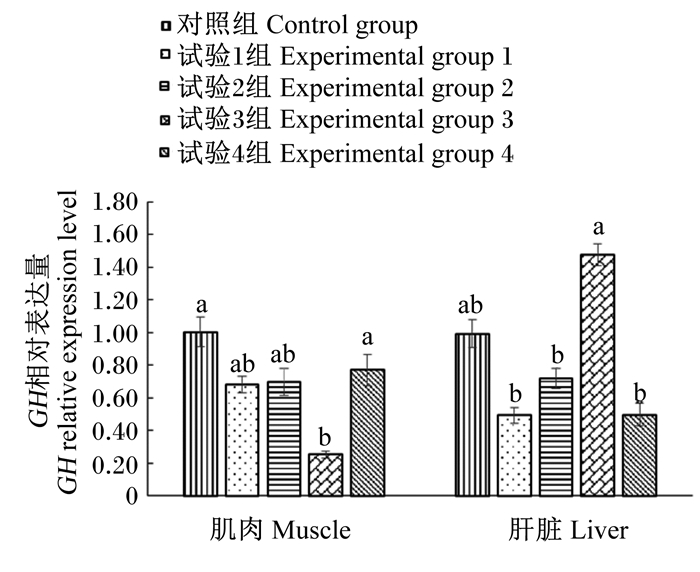
|
数据柱标注不同小写字母表示差异显著(P < 0.05)。图 2同。 Data columns with different small letters mean significant difference (P < 0.05). The same as Fig. 2. 图 1 不同磷源对育肥猪组织GH相对表达量的影响 Fig. 1 Effects of different phosphorus sources on GH relative expression level in tissue of finishing pigs |
由图 2可知,与对照组相比,试验2组育肥猪肌肉IGF-Ⅰ相对表达量显著提高(P < 0.05),且显著高于其他试验组(P < 0.05);试验2组肝脏IGF-Ⅰ相对表达量显著降低(P < 0.05),但试验3组和试验4组肝脏IGF-Ⅰ相对表达量显著提高(P < 0.05)。
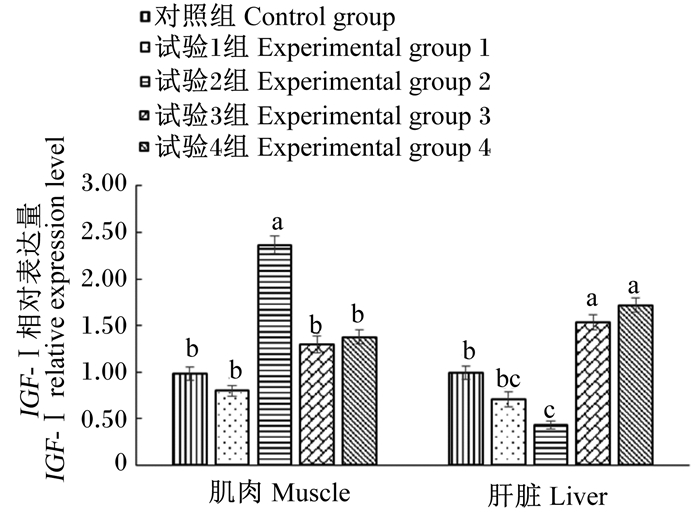
|
图 2 不同磷源对育肥猪组织IGF-Ⅰ相对表达量的影响 Fig. 2 Effects of different phosphorus sources on IGF-Ⅰ relative expression level in tissue of finishing pigs |
由图 3可知,相比空肠和回肠,育肥猪盲肠微生物物种箱线图位置较高且趋于平缓,这说明盲肠中微生物的物种较丰富,组内样本物种差异较小,微生物较稳定。在空肠中,与对照组相比,试验1组、试验3组和试验4组的微生物种类显著增加,其中试验1组最高;在回肠中,与对照组相比,各试验组的微生物种类均显著增加,其中试验2组最高;而在盲肠中,各组的微生物种类差异不显著。结果说明,不同磷源对育肥猪空肠和回肠的微生物组成有较显著的影响。
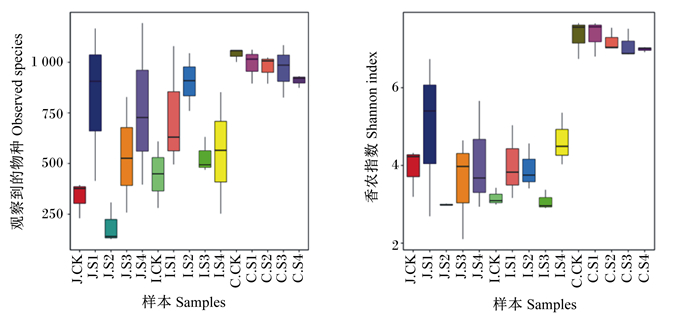
|
J:空肠jejunum;I:回肠ileum;C:盲肠cecum;CK:对照组control group;S1:试验1组experimental group 1;S2:试验2组experimental group 2;S3:试验3组experimental group 3;S4:试验4组experimental group 4。图 4同the same as Fig. 4。 图 3 不同磷源对育肥猪肠道微生物的物种累积箱线图 Fig. 3 Effects of different phosphorus sources on species accumulation boxplot in intestinal microbes of finishing pigs |
由图 4可知,不同磷酸对育肥猪各段肠道的微生物种类和数量均有一定的影响,其中,空肠和回肠的微生物变化较明显。与对照组相比,各试验组空肠和回肠的微生物多样性显著增加。在空肠中,各试验组的未鉴定的肠杆菌科(unidentified Enterobacteriaceae)、未鉴定的梭菌目(unidentified Clostridiales)、Terrisporobacter、罗姆布茨菌属(Romboutsia)、链球菌属(Streptococcus)、放线杆菌属(Actinobacillus)、Turicibacter、未鉴定的念珠藻目(unidentified Nostocales)属于新增菌种;试验2组的未鉴定的梭菌目和Terrisporobacter、试验3组的未鉴定的肠杆菌科和放线杆菌属以及试验4组的红球菌属(Rhodococcus)相对丰度提高较高,试验1组、试验2组和4组的乳酸杆菌属(Lactobacillus)相对丰度降低;在回肠中,各试验组的未鉴定的肠杆菌相对丰度明显降低,未鉴定的梭菌目、Terrisporobacter、罗姆布茨菌属相对丰度明显提高,红球菌属相对丰度急剧降低;试验1组的链球菌属和试验4组的未鉴定的念珠藻目相对丰度提高较高。在盲肠中,各试验组的其他(others)菌种的相对丰度占比较大,链球菌属相对丰度明显降低,Terrisporobacter和未鉴定的念珠藻目相对丰度提高。
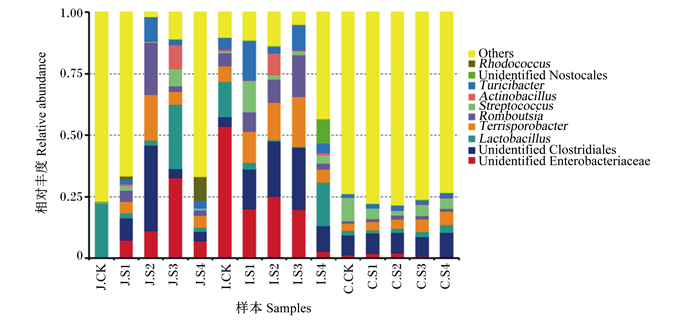
|
Others:其他;Rhodococcus:红球菌属;Unidentified Nostocales:未鉴定的念珠藻目;Actinobacillus:放线杆菌属;Streptococcus:链球菌属;Romboutsia:罗姆布茨菌属;Lactobacillus:乳酸杆菌属;Unidentified Clostridiales:未鉴定的梭菌目;Unidentified Enterobacteriaceae:未鉴定的肠杆菌科。 图 4 不同磷源对育肥猪肠道微生物在属水平上的影响 Fig. 4 Effects of different phosphorus sources on intestinal microbes of finishing pigs at genus level |
夏良宙等[10]和屠焰等[11]均报道,MCP的生物学效价为高于DCP,而MDCP是MCP与DCP的络合物,因此,理论上认为MDCP中磷的消化率应高于DCP。曹慧[12]报道,MCP和MDCP中磷的表观消化率要高于DCP。MCP和MDCP为弱酸性,当其随饲粮进入动物胃中时,其释放的氢离子激活胃肠道消化酶,从而提高饲粮中磷的表观消化率[10]。但不同的原料及其性状、在不同动物种类的不同阶段的研究报道不完全一致。早期Bertelson[13]报道,动物的生产性能与饲粮磷水平并不存在显著的线性关系,不能作为评定磷相对生物学效价的指标。王秀静[5]报道,粒状和粉状MDCP和MCP无机磷源的系酸力和料重比显著低于粉状DCP,粉状MCP饲粮的系酸力最低,平均日增重显著高于粉状DCP,粉状MCP无机磷能较好促进断奶仔猪的生长性能。黄阿彬[14]报道,育肥猪饲粮中添加不同磷源,MCP组与DCP组的平均日采食量、料重比和平均日增重等生长性能差异不显著。本试验中,MDCP和MCP均为粒状,且与对照组相比,80%MDCP组(试验1组)和60%MCP组(试验4组)育肥猪终末体重显著提高,80%MDCP组平均日增重显著提高,60%MDCP组(试验2组)磷表观消化率显著提高,80%MCP组(试验3组)和60%MCP组血清钙、IGF-Ⅰ和GH含量显著提高,结果表明MDCP和MCP作用效果较佳。磷的吸收受很多因素影响,主要有钙磷比例、磷的存在形式、小肠pH、动物年龄及与其他矿物元素的互作等[15]。随着磷的生产工艺的改进,粒状能够延长在动物肠胃停留时间,增加反应机率,特别是在当断奶仔猪遭受断奶应激时,胃酸分泌不足,消化酶活性降低,因此需要低系酸力的饲粮[5]。系酸力较低的MDCP、MCP能够作用于肠胃的pH,有助于动物机体对营养物质的全面吸收,增强免疫力和降低腹泻率。研究表明,钠磷协同转运蛋白对肠道中磷的吸收以及肾脏中磷的重吸收等代谢过程具有非常重要的调节作用,许多试验为对钠离子进行测定[16],本试验未对钠离子进行相关研究,这可能也是不同研究结果存在差异的原因。
研究普遍认为,猪肠道磷吸收的主要位点是小肠,而大肠在磷稳态中无显著作用[17-19]。与DCP相比,MDCP能够显著提高肉鸡的生长性能,提高42日龄肉鸡盲肠微生物的多样性和有益菌的数量,提高肠道的微生物稳定性和肠道健康[2]。不同无机磷源之间的空肠总菌数量差异显著,MDCP粒状组的大肠杆菌数量显著低于MCP粒状组,且MDCP粒状组的乳酸杆菌和双歧杆菌数量最高,MDCP和MCP均可改善断奶仔猪肠道微生态[20]。代述均[20]研究表明,相比DCP,MDCP和MCP能够提高肉鸭肠道绒毛高度,其中MCP粉状组作用效果更好。本试验获得相似的结果,不同磷源对育肥猪各段肠道的微生物种类和数量均有一定的影响,相比空肠和回肠,盲肠微生物的物种较丰富,且组内样本物种差异较小。空肠和回肠的微生物变化较明显,且MDCP和MCP新增的菌群也不同,MDCP主要新增未鉴定的梭菌目和Terrisporobacter,而MCP主要新增未鉴定的肠杆菌科、放线杆菌属和红球菌属,而盲肠微生物较稳定。目前推测可能的原因是无机磷体外摄入后大部分存在于猪的小肠后端,即回肠中,对磷源的吸收受动物日龄、钠离子浓度、肠道pH、饲粮含磷水平、维生素D3、三碘甲状腺氨酸和甲状腺氨酸等因素影响[21-22]。
4 结论饲粮选用MDCP或MCP替代DCP来补充磷源,以MDCP或MCP提供的磷水平为DCP提供磷水平的80%或60%为替代比例,对育肥猪胫骨指标和大部分血清生化指标无显著影响,在一定程度上能够提高育肥猪的生长性能,增加肠道微生物的多样性,是替代DCP的良好磷源。
| [1] |
计成. 动物营养学[M]. 北京: 高等教育出版社, 2011: 119-126. JI C. Animal nutrition[M]. Beijing: Higher Education Press, 2011: 119-126 (in Chinese). |
| [2] |
刘景, 陈炳钿, 李忠荣, 等. 不同添加水平的磷酸一二钙对肉鸡生产性能、钙磷代谢及盲肠微生物的影响[J]. 畜牧兽医学报, 2020, 51(6): 1306-1319. LIU J, CHEN B D, LI Z R, et al. Effects of different dietary mono-dicalcium phosphate supplementation on production performance, blood parameters, bone calcium, phosphorus metabolism and cecal microecology in broilers[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(6): 1306-1319 (in Chinese). |
| [3] |
李文静. 磷源与磷水平对肉鸭磷相对生物学利用率的研究[D]. 硕士学位论文. 邯郸: 河北工程大学, 2018. LI W J. Research on relative biological utilization rate of phosphorus sources and levels in the ducks[D]. Master's Thesis. Handan: Hebei University of Engineering, 2018. (in Chinese) |
| [4] |
敖翔, 何健. 磷在肉仔鸡上的营养作用及其生物学利用率的研究进展[J]. 饲料与畜牧, 2018(5): 59-64. AO X, HE J. Research progress of phosphorus's nutritional effect on broilers and its biological utilization[J]. Feed and Husbandry, 2018(5): 59-64 (in Chinese). |
| [5] |
王秀静. 不同无机磷源对断奶仔猪生长性能、肠道形态结构及肠道稳态的影响[D]. 硕士学位论文. 南昌: 江西农业大学, 2015. WANG X J. Regulation of different inorganic phosphorus source on growth performance, intestinal morphology structure and intestinal steady state of weaned piglets[D]. Master's Thesis. Nanchang: Jiangxi Agricultural University, 2015. (in Chinese) |
| [6] |
张永成, 李德发, 邢建军. 新型饲料在断奶仔猪中的应用[J]. 中国动物保健, 1999(4): 30. ZHANG Y C, LI D F, XING J J. Application of new feed in weaning piglets[J]. China Animal Health, 1999(4): 30 (in Chinese). |
| [7] |
STEIN H H, KADZERE C T, KIM S W, 等. 日粮磷水平对生长育肥猪日粮中磷酸二氢钙磷消化率的影响[J]. 饲料广角, 2014(12): 12-15. STEIN H H, KADZERE C T, KIM S W, et al. Influence of dietary phosphorus concentration on the digestibility of phosphorus in monocalcium phosphate by growing pigs[J]. Feed China, 2014(12): 12-15 (in Chinese). DOI:10.3969/j.issn.1002-8358.2014.12.004 |
| [8] |
张忠远, 徐宝成. 饲料中营养物质表观消化率的计算公式[J]. 饲料博览, 2004(4): 48. ZHANG Z Y, XU B C. The formula for calculating the apparent digestibility of nutrients in feed[J]. Feed Review, 2004(4): 48 (in Chinese). DOI:10.3969/j.issn.1001-0084.2004.04.028 |
| [9] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [10] |
夏良宙, 李霞, 万荣. 不同种类和来源磷酸钙盐对肉鸡生产性能和养分代谢的影响[J]. 饲料工业, 2014(S1): 48-52. XIA L Z, LI X, WAN R. Influence of phosphorus source on growth performance and nutrient utilization of broilers[J]. Feed Industry, 2014(S1): 48-52 (in Chinese). |
| [11] |
屠焰, 范先国, 霍启光. 影响磷酸盐中磷生物学利用率的因素[J]. 中国饲料, 1998(9): 6-8. TU Y, FAN X G, HUO Q G. The factors of affecting biological utilization of phosphorus in phosphate[J]. China Feed, 1998(9): 6-8 (in Chinese). |
| [12] |
曹慧. 猪对饲料级磷酸盐磷生物学利用率的研究[D]. 硕士学位论文. 雅安: 四川农业大学, 2003. CAO H. The research of relative bioavailability of phosphorus in feed phosphates[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2003. (in Chinese) |
| [13] |
BERTELSON A. Altemate phosphours source valuable for growing swine[J]. Feedsutffs, 1982, 53(40): 12-13. |
| [14] |
黄阿彬. 不同磷源及水平对育肥猪生长性能和骨骼质量的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2013. HUANG A B. Effects of dietary phosphorus level and phosphorus sources on growth performance and tibia quality of finishing pigs[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2013. (in Chinese) |
| [15] |
王晓鹃, 林海. 我国蛋鸡营养与饲料研究进展[J]. 动物营养学报, 2020, 32(10): 4602-4610. WANG X J, LIN H. Recent progress in nutrition and feed of laying hens in China[J]. Chinese Journal of Animal Nutrition, 2020, 32(10): 4602-4610 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.10.013 |
| [16] |
胡龙昌, 项智锋, 方热军. 磷在动物小肠中的吸收转运及其调控机制的研究进展[J]. 饲料与畜牧, 2012(10): 34-36. HU L C, XIANG Z F, FANG R J. Research progress on absorption and transport of phosphorus in small intestine and its regulatory mechanism[J]. Feed and Husbandry, 2012(10): 34-36 (in Chinese). |
| [17] |
DILGER R N, ADEOLA O. Estimation of true phosphorus digestibility and endogenous phosphorus loss in growing pigs fed conventional and low-phytate soybean meals[J]. Journal of Animal Science, 2006, 84(3): 627-634. |
| [18] |
YÁÑEZ J L, BELTRANENA E, CERVANTES M, et al. Effect of phytase and xylanase supplementation or particle size on nutrient digestibility of diets containing distillers dried grains with solubles cofermented from wheat and corn in ileal-cannulated grower pigs[J]. Journal of Animal Science, 2011, 89(1): 113-123. |
| [19] |
BOHLKE R A, THALER R C, STEIN H H. Calcium, phosphorus, and amino acid digestibility in low-phytate corn, normal corn, and soybean meal by growing pigs[J]. Journal of Animal Science, 2005, 83(10): 2396-2403. |
| [20] |
代述均. 饲粮非植酸磷水平对肉鸭生产性能、盲肠微生物及胫骨质量的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2017. DAI S J. Effect of dietary non-phytate phosphorus levels on performance, caecal microflora and tibia characteristics in meat ducks[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2017. (in Chinese) |
| [21] |
孙杰. 断奶仔猪颗粒料加工工艺比较研究[D]. 硕士学位论文. 北京: 中国农业科学院, 2014. SUN J. Comparative studies of the different processing technologies on the weaned piglet's feed pellet[D]. Master's Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese) |
| [22] |
刘静. 饲粮磷来源和水平以及生长阶段对猪后肠磷消化的影响[D]. 硕士学位论文. 绵阳: 西南科技大学, 2020. LIU J. Effects of dietary phosphorus sources, concentration and growth stage on postileal phosphorus digestion in pigs[D]. Master's Thesis. Mianyang: Southwest University of Science and Technology, 2020. (in Chinese) |




