众所周知,肠道菌群在调节宿主肠道功能和肠道健康中起着十分重要的作用[1-2]。肠道微生物群落的定植始于生命早期,出生后的第1周为肠道微生物群落定植的关键时期[3]。而在生命早期,所摄入营养成分的变化可以有效地影响哺乳期幼体的肠道菌群组成[4],因此,在生命早期通过营养干预的手段来获得更佳的肠道微生态环境,对于仔猪的肠道健康和后续的生长发育都具有重要意义。
低聚半乳糖(galacto-oligosaccharides,GOS)是一种具有天然属性的功能性寡糖,在人母乳中含量较为丰富,在动物乳汁中仅微量存在[5]。作为一种常见的益生元,由于其结构特性,GOS在小肠中不易被消化水解,而是进入后肠被微生物利用,促进有益菌的大量增殖,有助于肠道微生态的稳定,因此GOS越来越受到人们的关注[6]。脂多糖(lipopolysaccharides,LPS)是革兰氏阴性细菌细胞壁最外层由脂质和多糖构成的物质,是一种强烈的炎症刺激物[7]。研究已经发现,LPS主要通过诱导信号级联反应最终激活核转录因子-κB(NF-κB),从而促进一系列炎症因子分泌增多,包括肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)和白细胞介素-6(IL-6)等,造成肠道产生炎症反应[8]。因此,目前,使用LPS刺激构建动物肠道炎症损伤模型是一种常用手段[9]。根据以往的研究报道,GOS已被证明可以改善仔猪的生长性能和肠道健康,但GOS在肠道炎症损伤模型中的作用尚不清楚[10-12]。目前,GOS在饲料添加剂中还未得到广泛使用。因此,研究GOS对LPS刺激哺乳仔猪肠道健康的影响可以为GOS作为仔猪饲料添加剂的开发和利用提供更有力的理论支持。
随着对肠道微生物的研究不断深入,发现仔猪肠道微生物与仔猪肠道健康和肠道功能之间存在着密切联系[13]。因此,研究人员更加关注于通过调节仔猪肠道微生物来促进仔猪的肠道功能和维持肠道健康。目前,GOS已在一些动物试验上取得了初步成效。Wang等[14]研究发现,早期GOS干预可以通过调节哺乳仔猪的肠道微生物群来发挥有益作用,包括改善肠道炎症状态和维持肠道屏障功能。但GOS在LPS刺激诱导的仔猪肠道炎症损伤模型中的作用尚不清楚。因此,本试验旨在研究GOS是否可以调节LPS刺激哺乳仔猪的盲肠微生物区系,改善肠道炎症和屏障功能。
1 材料与方法 1.1 试验材料本试验所用GOS为食品级,购于量子高科(中国)生物股份有限公司。LPS来源于大肠杆菌(E.coli)055 ∶ B5,购于美国Sigma-Aldrich公司,纯度≥99%。
1.2 试验动物与试验设计试验选取2窝新生的“杜×长×大”哺乳仔猪,每窝9头,初始体重为(1.57±0.05) kg。将每窝仔猪分为3个组,分别为对照组(CON组)、LPS刺激组(LPS-CON组)和GOS添加组(LPS-GOS组),每组3头。在进行研究之前,参考了一些先前的研究,以确保GOS的浓度安全有效。在先前的研究中,Pan等[15]研究发现,给小鼠每天喂食1 g/kg BW的GOS可以增加小鼠的盲肠总重和壁重;但Anthony等[16]研究发现,给大鼠每天喂食2.5或5.0 g/kg BW的GOS会降低大鼠的摄食量。此外,在本实验室先前的研究中,已经发现每天给哺乳仔猪喂食1 g/kg BW的GOS可以提高哺乳仔猪的生长性能,调节仔猪肠道微生物区系和改善肠道功能[12, 14]。因此,综合考虑之前研究中使用的GOS浓度,本研究使用的GOS浓度为1 g/kg BW。从出生后第1天开始,LPS-GOS组的仔猪每天灌喂1 g/kg BW的GOS溶液,对照组和LPS-CON组的仔猪则灌喂等量的无菌生理盐水,连续灌喂13 d。第14天,LPS-CON组和LPS-GOS组的仔猪腹腔注射80 μg/kg BW的LPS溶液,对照组的仔猪注射等量的无菌生理盐水。腹腔注射LPS溶液或无菌生理盐水2 h后,对仔猪进行屠宰取样。
1.3 饲养管理试验在湖北省恩施市大石堡农业专业合作社猪场完成。试验期间仔猪由母猪照料,自由采食母乳和饮水。灌喂GOS溶液或无菌生理盐水时使用无菌医用注射器将溶液缓慢注入仔猪口腔,避免操作损伤仔猪。卫生防疫、断尾、免疫等操作按照猪场相关规章制度进行。
1.4 样品采集腹腔注射LPS溶液或无菌生理盐水2 h后进行屠宰采样,将仔猪解剖后分离盲肠,收集盲肠食糜置于无菌冻存管中并存于-80 ℃液氮中直至分析。将盲肠组织用预冷的无菌磷酸盐缓冲液(PBS)进行冲洗,清洗干净后用无菌载玻片刮取盲肠黏膜并保存于-80 ℃液氮中直至分析。
1.5 测定指标及方法 1.5.1 盲肠食糜微生物16S rRNA测序首先称取0.3 g盲肠食糜样品用于提取细菌总DNA,使用PowerSoil DNA提取试剂盒(MO Bio Laboratories,美国)并按其操作说明提取总DNA。接着使用Nano-Drop 1 000分光光度计(Thermo Fisher Scientific,美国)测定DNA的浓度和质量,提取的DNA保存于-80 ℃直至下一步分析。采用ABI GeneAmp 9700 ® PCR仪(Applied Biosystems, Inc.,美国)对DNA进行PCR扩增,使用正向引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增细菌16S rRNA基因的V3~V4区域。PCR反应具体参数为:先是预变性阶段(95 ℃进行3 min);然后以95 ℃进行30 s,55 ℃进行30 s,72 ℃进行45 s, 循环29次;最后以72 ℃进行10 min。接着,将PCR产物用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(Axygen,美国)并按其使用说明切胶回收纯化PCR产物。参照电泳初步定量结果,将PCR产物用QuantiFluor-ST紫外线/蓝色通道手持式荧光计(Promega,美国)进行检测定量。最后,经浓度归一化后将PCR产物在MiSeq(Illumina Inc.,美国)平台上进行测序。
1.5.2 生物信息学分析将测序得到的序列按照重叠关系进行拼接,同时对序列进行质控和过滤。使用Usearch 7.0.1090(http://www.drive5.com/uparse/)将操作分类单元(OTU)以97%的一致性进行OTU聚类。为了得到每个OTU对应的物种分类信息,采用RDP classifier 2.2 (http://sourceforge.net/projects/rdp-classifier/)贝叶斯算法对97%相似水平的OTU代表序列进行分类学比对,比对的数据库为Sliva 132(http://www.arb-silva.de),物种分类比对的置信度值是70%。使用Mothur1.30.2(https://www.mothur.org/wiki/Download_mothur)分析盲肠食糜微生物群的α多样性指数,包括Shannon指数、Simpson指数、Ace指数和Chao1指数。用R 3.5.1软件进行主成分分析(PCA),并对样品进行相似性分析(ANOSIM)以评估样本间的显著差异。
1.5.3 盲肠食糜pH测定在解剖盲肠采集样品过程中,用灭菌的离心管收集结肠食糜后立即用pH计(pb-10,Sartorius Group,德国)测定pH。
1.5.4 盲肠食糜微生物代谢物测定根据Shi等[17]所描述的方法,使用气相色谱法测定盲肠食糜中乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸和总短链脂肪酸含量。使用乳酸试剂盒(南京建成生物工程研究所)并按其操作说明测定盲肠食糜中乳酸含量。
1.5.5 盲肠黏膜细胞因子含量测定称取0.1 g盲肠黏膜组织,加入1 000 μL预冷的磷酸盐缓冲液后用匀浆机粉碎提取总蛋白。粉碎后的组织在4 ℃条件下以10 000 r/min离心15 min,然后吸取上层清液备用。提取总蛋白后,用BCA蛋白检测试剂盒(白鲨生物科技有限公司)测定蛋白浓度,然后用酶联免疫吸附测定试剂盒(R&D Systems Inc.,美国)测定盲肠黏膜中白细胞介素-1β(IL-1β)、IL-6、白细胞介素-8(IL-8)、白细胞介素-10(IL-10)、TNF-α和转化生长因子-β(TGF-β)含量。
1.5.6 盲肠黏膜紧密连接蛋白表达测定称取0.1 g盲肠黏膜组织,加入900 μL含1%蛋白酶抑制剂的RIPA裂解缓冲液(菲尔特生物技术有限公司),然后4 ℃匀浆,将组织彻底破碎。接着将匀浆液12 000×g、4 ℃离心15 min。吸取上清液用于蛋白质免疫印迹法(Western blot)检测。提取总蛋白后,用BCA蛋白定量试剂盒(白鲨生物科技有限公司)测定蛋白浓度。将浓度归一化后,煮沸蛋白,然后用12%的聚丙烯酰胺凝胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白。接着将蛋白印迹转移到聚偏二氟乙烯(PVDF)膜上。随后,用含5%脱脂奶粉的1×Tris-buffered saline-Tween(TBST)缓冲液在室温下封闭膜1 h,然后用一抗在4 ℃下孵育过夜。使用的特异性一抗包括β-肌动蛋白(β-actin)(Cell Signaling Technology,美国),闭合小环蛋白-1(ZO-1)、闭锁蛋白(occludin)和闭合蛋白-1(claudin-1)(Proteintech Group,美国)。过夜后,将膜用1×TBST清洗3次,每次10 min,然后用Antirabbit IgG HRP-conjugated二抗(Cell Signaling Technology,美国)在常温下孵育1 h,孵育完成后再次用1×TBST清洗3次,每次10 min。最后,按1 ∶ 1的比例配制显影发光液,现用现配并在避光环境下操作,然后在曝光机中显影记录条带。用Image J 1.8.0软件处理目的条带测量灰度值,目标蛋白的蛋白表达水平为目标蛋白灰度值/内参灰度值。
1.6 数据统计分析利用Excel 2016对试验数据进行初步处理,随后利用SPSS 20.0对其进行单因素方差分析,选用Tukey检验进行多重比较。各组数据表示为平均值和均值标准误(SEM)。P < 0.05表示差异显著,P < 0.01表示差异极显著,0.05≤P < 0.10表示具有趋势。
2 结果 2.1 GOS对LPS刺激哺乳仔猪盲肠食糜微生物多样性的影响如表 1所示,盲肠食糜微生物α多样性指数结果表明,LPS-GOS组的Shannon指数有高于LPS-CON组的趋势(P=0.051),各组之间Simpson指数、Ace指数和Chao1指数没有显著差异(P>0.05)。
|
|
表 1 GOS对LPS刺激哺乳仔猪盲肠食糜微生物α多样性的影响 Table 1 Effects of GOS on cecal digesta microbial α diversity of suckling piglets stimulated by LPS (n=6) |
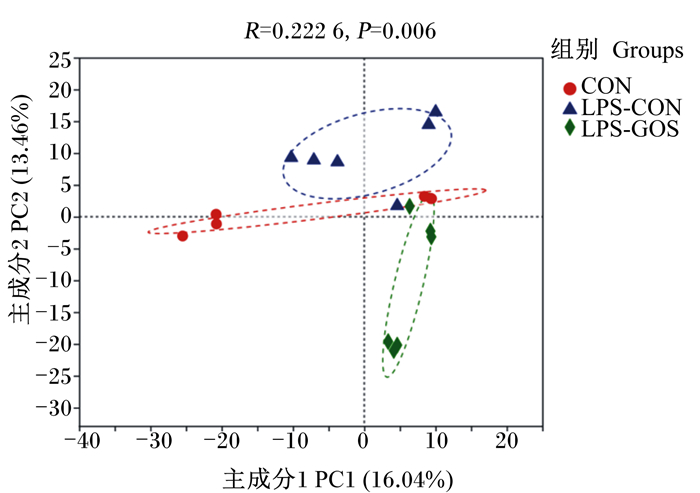
如图 1所示,PCA结果表明,3个组的微生物区系显示出明显的聚类。
|
图 1 盲肠食糜微生物区系PCA Fig. 1 PCA of cecal digesta microbiota |
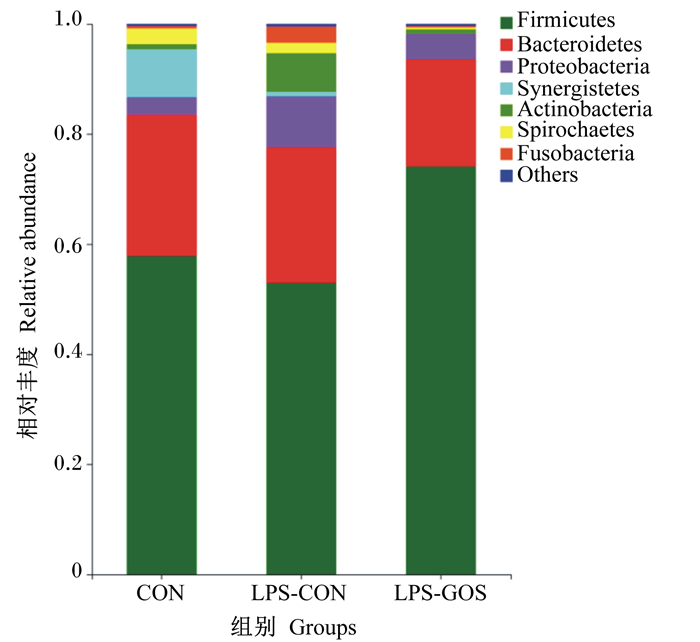
如图 2所示,通过对盲肠食糜微生物进行16S rRNA测序发现,在门水平上,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是3组盲肠食糜中主要的优势菌群,其次是变形菌门(Proteobacteria)、互养菌门(Synergistetes)、螺旋体门(Spirochaetes)和梭杆菌门(Fusobacteria)。
|
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Proteobacteria:变形菌门;Synergistetes:互养菌门;Actinobacteria:放线菌门;Spirochaetes:螺旋体门;Fusobacteria:梭杆菌门;Others:其他。 图 2 GOS对LPS刺激哺乳仔猪盲肠食糜微生物在门水平组成的影响 Fig. 2 Effects of GOS on cecal digesta microbial composition at phylum level of suckling piglets stimulated by LPS (n=6) |
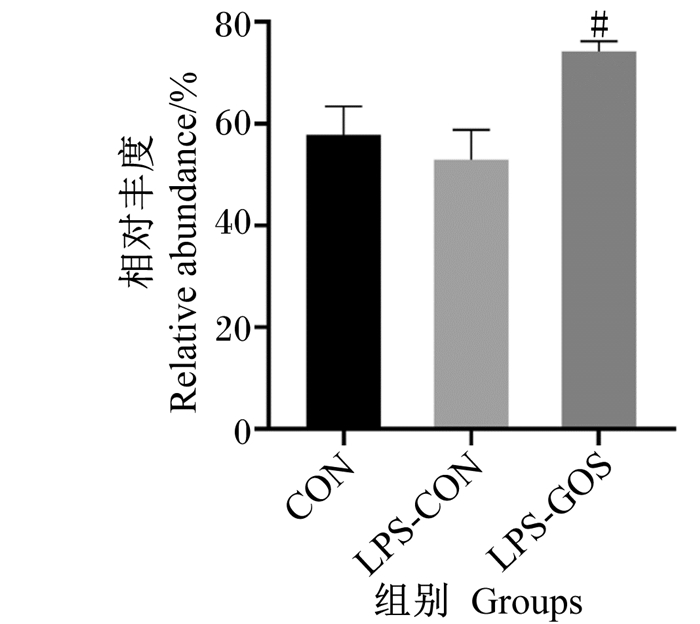
如图 3所示,与LPS-CON组相比,LPS-GOS组盲肠食糜中厚壁菌门的相对丰度显著提高(P < 0.05)。
|
#表示与LPS-CON组相比差异显著(P < 0.05)。 # mean significant difference compared with the LPS-CON group (P < 0.05). 图 3 GOS对LPS刺激哺乳仔猪盲肠食糜厚壁菌门的差异影响 Fig. 3 Differential effects of GOS on Firmicutes in cecal digesta of LPS-stimulated suckling piglets (n=6) |
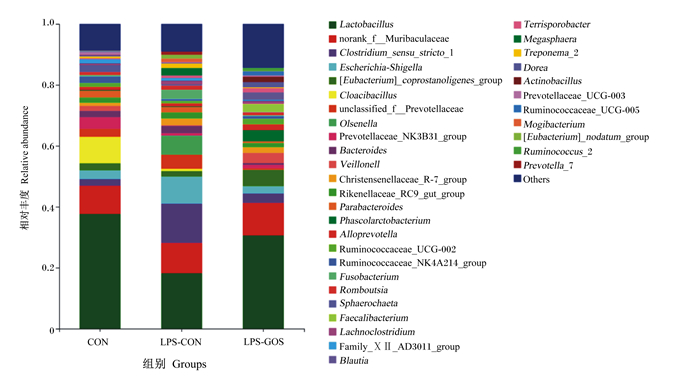
如图 4所示,在属水平上,将在所有样本中相对丰度占比均小于1%的菌属归为其他(others),乳杆菌属(Lactobacillus)、未分类的拟杆菌门S24-7菌科(norank_f_Muribaculaceae)、狭窄梭菌属1(Clostridium_sensu_stricto_1)、大肠杆菌贺氏菌属(Escherichia-Shigella)和粪杆菌真核菌群([Eubacterium]_coprostanoligenes_group)是3组盲肠食糜中主要的优势菌属。
|
Lactobacillus:乳杆菌属;norank_f_Muribaculaceae:未分类的拟杆菌门S24-7菌科;Clostridium_sensu_stricto_1:狭窄梭菌属1;Escherichia-Shigella:大肠杆菌贺氏菌属;[Eubacterium]_coprostanoligenes_group:粪杆菌真核菌群;Cloacibacillus:氯酸杆菌属;unclassified_f_Prevotellaceae:未分类的普雷沃氏菌科;Olsenella:欧陆森氏菌属;Prevotellaceae_NK3B31_group:普雷沃氏菌科NK3B31群;Bacteroides:拟杆菌属;Veillonell:韦荣球菌属;Christensenellaceae_R-7_group:克里斯滕森菌科R-7群;Rikenellaceae_RC9_gut_group:理研氏菌科RC9肠道群;Parabacteroides:副拟杆菌属;Phascolarctobacterium:考拉杆菌属;Alloprevotella:拟普雷沃氏菌属;Ruminococcaceae_UCG-002:瘤胃球菌科UCG-002菌属;Ruminococcaceae_NK4A214_group:瘤胃球菌科NK4A214群;Fusobacterium:梭菌属;Romboutsia:罗姆布茨菌属;Sphaerochaeta:螺旋体属;Faecalibacterium:粪杆菌属;Lachnoclostridium:腔隙杆菌属;Family_ⅩⅡ_AD3011_group:ⅩⅡ_AD3011族群;Blautia:布劳特氏菌属;Terrisporobacter:土孢杆菌属;Megasphaera:巨球型菌属;Treponema_2:密螺旋体属_2;Dorea:多雷亚菌属;Actinobacillus:放线杆菌属;Prevotellaceae_UCG-003:普雷沃氏菌科UCG-003菌属;Ruminococcaceae_UCG-005:瘤胃球菌科UCG-005菌属;Mogibacterium:艰难杆菌属;[Eubacterium]_nodatum_group:缠结真杆菌属;Ruminococcus_2:瘤胃球菌属2;Prevotella_7:普氏菌属7;unclassified_f_Lachnospiraceae:未分类的毛螺菌科;Lachnospiraceae_NK4A136_group:毛螺菌科NK4A136群;Prevotella_2:普氏菌属2。 图 4 GOS对LPS刺激哺乳仔猪盲肠食糜微生物在属水平组成的影响 Fig. 4 Effects of GOS on cecal digesta microbial composition at genus level of suckling piglets stimulated by LPS (n=6) |
如图 5所示,与对照组相比,LPS-CON组盲肠食糜中瘤胃球菌科NK4A214群(Ruminococcaceae_NK4A214_group)和普雷沃氏菌科NK3B31群(Prevotellaceae_NK3B31_group)的相对丰度极显著降低(P < 0.01),乳杆菌属(Lactobacillus)(P=0.054)和未分类的毛螺菌科(unclassified_f_Lachnospiraceae)(P=0.051)的相对丰度有降低趋势。与LPS-CON组相比,LPS-GOS组盲肠食糜中粪杆菌真核菌群和粪杆菌属(Faecalibacterium)的相对丰度极显著提高(P < 0.01),考拉杆菌属(Phascolarctobacterium)、普氏菌属2(Prevotella_2)和毛螺菌科NK4A136群(Lachnospiraceae_NK4A136_group)的相对丰度显著提高(P < 0.05)。
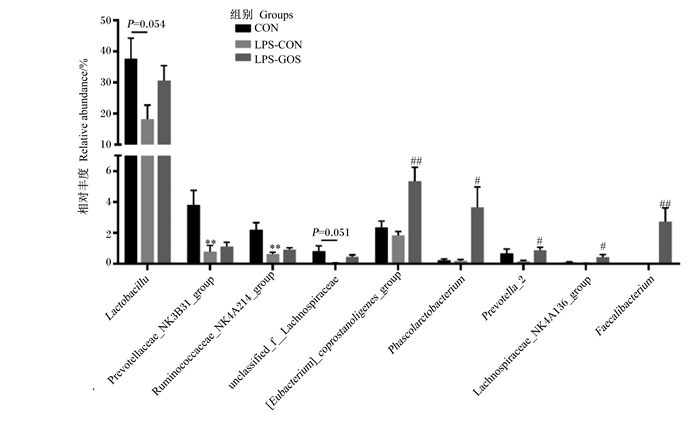
|
Lactobacillus:乳杆菌属;Prevotellaceae_NK3B31_group:普雷沃氏菌科NK3B31群;Ruminococcaceae_NK4A214_group:瘤胃球菌科NK4A214群;unclassified_f_Lachnospiraceae:未分类的毛螺菌科;[Eubacterium]_coprostanoligenes_group:粪杆菌真核菌群;Phascolarctobacterium:考拉杆菌属;Prevotella_2:普氏菌属2;Lachnospiraceae_NK4A136_group:毛螺菌科NK4A136群;Faecalibacterium:粪杆菌属。 *表示与CON组相比差异显著(P < 0.05),* *表示与CON组相比差异极显著(P < 0.01);#表示与LPS-CON组相比差异显著(P < 0.05),##表示与LPS-CON组相比差异极显著(P < 0.01)。下图同。 * mean significant difference compared with the CON group (P < 0.05), and * * mean extremely significant difference compared with the CON group (P < 0.01); # mean significant difference compared with the LPS-CON group (P < 0.05), and ## mean extremely significant difference compared with the LPS-CON group (P < 0.01). The same as below. 图 5 GOS对LPS刺激哺乳仔猪盲肠食糜微生物组成在属水平的差异影响 Fig. 5 Differential effects of GOS on cecal digesta microbial composition at genus level of suckling piglets stimulated by LPS (n=6) |
如表 2所示,与对照组相比,LPS-CON组盲肠食糜pH有升高的趋势(P=0.052),而LPS-GOS组仔猪盲肠食糜pH显著低于LPS-CON组(P < 0.05)。与对照组相比,LPS-CON组盲肠食糜中乙酸、丁酸、总短链脂肪酸以及乳酸含量显著降低(P < 0.05)。与LPS-CON组相比,LPS-GOS组盲肠食糜中乙酸含量显著升高(P < 0.05),丁酸和总短链脂肪酸含量极显著升高(P < 0.01)。
|
|
表 2 GOS对LPS刺激哺乳仔猪盲肠食糜pH和微生物代谢产物含量的影响 Table 2 Effects of GOS on cecal digesta pH and microbial metabolites contents of suckling piglets stimulated by LPS (n=6) |
如表 3所示,与对照组相比,LPS-CON组盲肠黏膜中IL-1β和TNF-α含量极显著升高(P < 0.01),IL-6和IL-8含量显著升高(P < 0.05)。与LPS-CON组相比,LPS-GOS组盲肠黏膜中IL-1β、IL-6和TNF-α含量显著降低(P < 0.05)。各组之间盲肠黏膜中IL-10和TGF-β含量无显著差异(P>0.05)。
|
|
表 3 GOS对LPS刺激哺乳仔猪盲肠黏膜细胞因子含量的影响 Table 3 Effects of GOS on cecal mucosa cytokine contents of suckling piglets stimulated by LPS (n=6) |
如图 6所示,与对照组相比,LPS-CON组盲肠黏膜中claudin-1的蛋白表达水平极显著降低(P < 0.05),ZO-1的蛋白表达水平显著降低(P < 0.05),occludin的蛋白表达水平有降低的趋势(P=0.088)。与LPS-CON组相比,LPS-GOS组盲肠黏膜中claudin-1的蛋白表达水平显著提高(P < 0.05),ZO-1的蛋白表达水平有提高的趋势(P=0.075)。
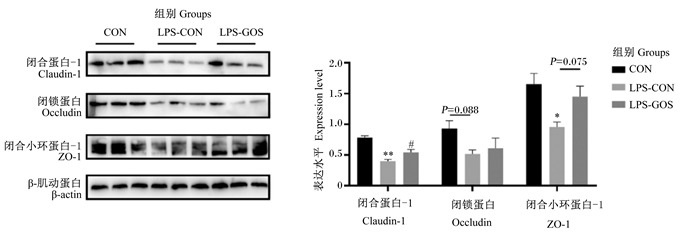
|
图 6 GOS对LPS刺激哺乳仔猪盲肠黏膜紧密连接蛋白表达的影响 Fig. 6 Effects of GOS on expression of tight junction proteins in cecal mucosa of suckling piglets stimulated by LPS |
仔猪在出生后第1周是肠道微生物群落定植的关键时期,并且肠道菌群在宿主肠道内的定植和演替是影响新生儿建立特定微生物群组成和塑造表型的关键因素[2]。有研究发现,肠道微生物在很大程度上影响了宿主的先天性免疫功能与适应性免疫功能的发育以及肠道屏障功能的稳态[18]。盲肠作为机体内微生物发酵的重要场所,其中微生物的数量远超前肠[19]。腹腔注射LPS会引起仔猪肠道炎症,破坏仔猪肠道屏障功能,已被广泛用于构建仔猪肠道炎症损伤模型[9]。由于肠道菌群和肠道炎症以及屏障功能之间存在密切的联系,因此,在本研究中,我们着重关注GOS对LPS刺激哺乳仔猪盲肠微生物群、肠道炎症和屏障功能的影响,并且探讨它们之间可能存在的联系。本试验中,LPS-GOS组中盲肠食糜微生物Shannon指数高于LPS-CON组。通常情况下,Shannon指数常被用于衡量环境内的微生物多样性,肠道内高水平的微生物多样性有利于肠道的健康,因为在肠道受到体外应激时,高水平的微生物多样性有助于维持肠道生态系统的稳定性和抵抗性[20]。如,早期使用抗生素会降低人类婴儿肠道微生物多样性,并导致其在学龄期患过敏性疾病和哮喘的风险增高[21]。本试验结果显示GOS提高了LPS刺激哺乳仔猪的盲肠微生物多样性,这表明GOS有利于维持仔猪肠道健康,降低患病风险。
GOS作为一种益生元,已有研究发现它可以改变大鼠和仔猪的肠道微生物组成[22-23]。在本试验中,3组哺乳仔猪盲肠食糜中最主要的优势菌门是厚壁菌门和拟杆菌门,这与赵方舟等[24]的研究结果一致。与LPS-CON组相比,LPS-GOS组哺乳仔猪盲肠食糜中厚壁菌门的的相对丰度更高,厚壁菌门相对丰度的提高对于肠道健康有益,因为厚壁菌门包含大量的短链脂肪酸产生细菌,如产丁酸细菌直肠真杆菌(Eubacterium rectale)和霍氏真杆菌(Eubacterium hallii)[25]。由此可见,早期GOS干预提高了LPS刺激哺乳仔猪盲肠中厚壁菌门的相对丰度,有助于提高仔猪盲肠中短链脂肪酸含量。
进一步分析盲肠食糜微生物在属水平上的变化,发现LPS刺激降低了乳杆菌属的相对丰度。作为一种常见的益生菌,乳杆菌属在仔猪出生后不久就会在肠道内定植并成为整个肠道微生态环境中稳定的一员[26]。有研究发现,乳杆菌属可以通过下调一些炎症因子如TNF-α来缓解结肠炎模型大鼠的肠道炎症反应[27]。此外,乳杆菌属可以与弯曲杆菌等病原菌争夺黏膜结合位点来防止肠道病原体感染,保护肠道健康[28]。因此,LPS对于乳杆菌属的抑制在一定程度不利于肠道的健康,并且可能加重LPS的刺激作用。而在LPS-GOS组中,未发现乳杆菌属的相对丰度发生显著变化,表明了GOS可以维持LPS刺激哺乳仔猪盲肠中乳杆菌属的稳定,从而有利于仔猪的肠道健康。此外,LPS刺激主要造成了短链脂肪酸产生菌包括瘤胃球菌科NK4A214菌群、普雷沃氏菌科NK3B31菌群和未分类的毛螺菌科相对丰度的降低。与LPS-CON组相比,LPS-GOS组哺乳仔猪盲肠食糜中则显示出更高相对丰度的粪杆菌真核菌群。研究发现,粪杆菌真核菌群是一种厌氧菌,可以催化胆固醇转化为粪甾醇,具有降低胆固醇的作用[29-30]。此外,有研究报道,粪便中粪杆菌真核菌群的相对丰度与仔猪的腹泻发生率呈负相关[31]。因此,粪杆菌真核菌群可能是肠道内具有一定益处的细菌,而GOS对它生长增殖的促进作用可能有利于维持LPS刺激仔猪的肠道微生态稳定。除此之外,本试验发现与LPS-CON组相比,LPS-GOS组中短链脂肪酸产生菌考拉杆菌属、普氏菌属2、毛螺菌科NK4A136群和粪杆菌属的相对丰度显著提高。因此,GOS改变了LPS刺激哺乳仔猪的盲肠菌群组成,通过提高粪杆菌真核菌群和短链脂肪酸产生菌的相对丰度在一定程度上有利于维持仔猪的肠道健康。
短链脂肪酸、乳酸、胆汁酸等是肠道微生物的主要代谢产物,能将肠道微生物与宿主的各项生理功能和免疫反应建立密切的联系[32]。从上述结果发现,LPS刺激以及GOS添加对于短链脂肪酸产生菌产生了较大的影响,因此,本试验进一步分析了盲肠中微生物代谢产物含量的变化,结果表明,与对照组相比,LPS-CON组哺乳仔猪盲肠食糜中乙酸、丁酸和总短链脂肪酸含量显著降低,这可能主要是因为LPS刺激降低了盲肠中瘤胃球菌科NK4A214菌群、普雷沃氏菌科NK3B31菌群和未分类的毛螺菌科的相对丰度,而这些细菌可以分解膳食中纤维多糖和低聚糖等成分,产生乙酸和丁酸等短链脂肪酸[33-35]。而与LPS-CON组相比,LPS-GOS组哺乳仔猪盲肠食糜中乙酸、丁酸和总短链脂肪酸含量极显著升高,这可能是由于GOS提高了短链脂肪酸产生菌考拉杆菌属、普氏菌属2、毛螺菌科NK4A136菌群和粪杆菌属的相对丰度,进而增加了盲肠中短链脂肪酸含量[35-36]。短链脂肪酸是调节宿主肠道功能和肠道免疫的关键因子,对宿主有多种有益作用,包括维持肠道水平屏障功能和抗炎作用[37]。值得注意的是,乙酸在肠道中不仅可以发挥抗炎作用,而且在一项研究中发现,小鼠肠道中乙酸含量的提高可以抑制大肠杆菌毒素从肠腔内转移到血液中,改善小鼠肠道上皮细胞介导的肠道免疫,保护宿主的肠道健康[38]。丁酸是大肠上皮细胞的主要能量来源,参与肠道上皮细胞的修复和再生,对维持肠道屏障功能并抑制炎症十分重要[39]。Yan等[40]研究发现,丁酸通过调节肠道上皮细胞能量状态,促进肠上皮紧密连接蛋白的表达,对LPS刺激导致的肠上皮损伤具有保护作用。因此,GOS通过提高盲肠食糜中的乙酸和丁酸等短链脂肪酸含量,可能有助于改善LPS刺激的哺乳仔猪的肠道屏障功能和肠道健康。此外,与对照组相比,LPS刺激降低了哺乳仔猪盲肠食糜中乳酸含量,这与盲肠食糜中乳酸杆菌相对丰度的降低结果一致。Neal-Mckinney等[41]研究指出,乳酸是减少牲畜病原菌弯曲杆菌生长的重要因素。因此,LPS刺激造成了乳酸含量的下降可能导致病原体的快速入侵,从而损害肠道健康。但在LPS-GOS组中,并未发现LPS刺激导致盲肠食糜中乳酸含量发生显著变化,因此GOS对于LPS刺激哺乳仔猪乳酸含量的维持作用在一定程度上有利于仔猪的肠道健康。随着LPS刺激后盲肠中短链脂肪酸和乳酸含量的降低,以及LPS-GOS组中短链脂肪酸和乳酸含量的升高,本试验相对应地发现LPS-CON组与对照组相比盲肠食糜pH提高,而LPS-GOS组与LPS-CON组相比盲肠食糜pH降低。pH是反映肠道内环境稳态的重要指标,较低的pH意味着盲肠内酸性环境的维持,这有利于抵御病原体入侵,抑制大肠杆菌和沙门氏菌等潜在致病菌的生长与定植[42]。因此,GOS可以通过提高LPS刺激哺乳仔猪盲肠中微生物代谢产物含量来发挥对肠道的有益作用,同时,GOS降低了LPS刺激哺乳仔猪盲肠的pH,有利于维持盲肠内环境的稳态。
基于短链脂肪酸的抗炎作用,本试验进一步分析了盲肠的炎症状态,结果表明,LPS刺激显著提高了哺乳仔猪盲肠黏膜中促炎细胞因子IL-1β、IL-6、IL-8和TNF-α含量,对于抑炎细胞因子IL-10和TGF-β含量没有产生显著影响,这在一定程度上表明了LPS刺激造成了仔猪盲肠炎症反应。但与LPS-CON组相比,LPS-GOS组哺乳仔猪盲肠黏膜中IL-1β、IL-6、IL-8和TNF-α含量显著降低,表明了GOS对LPS刺激造成的盲肠炎症具有缓解作用。研究发现,LPS主要通过信号级联反应最终激活NF-κB,导致促炎细胞因子分泌增多,从而诱导肠道炎症反应[8]。而Meijer等[43]研究报道,短链脂肪酸可以通过抑制NF-κB的激活来下调炎症细胞因子的分泌。此外,短链脂肪酸已被证明在肠道内可以发挥抗炎活性。因此,GOS可以缓解LPS刺激哺乳仔猪的盲肠炎症,这可能主要与GOS提高了盲肠中短链脂肪酸的含量有关。
肠道微生物及其代谢产物以及肠道炎症和肠道屏障功能之间都存在密切联系。有研究报道,IL-1β、IL-6、IL-8可以通过重组肠道上皮紧密连接蛋白来降低肠道屏障功能,而TNF-α则会显著破坏肠上皮细胞之间的紧密连接[44]。这可能解释了为何LPS刺激造成了紧密连接蛋白claudin-1、occludin和ZO-1的蛋白表达水平降低。紧密连接是构成仔猪肠道屏障功能的重要组分,其蛋白表达水平的降低直接削弱了肠道的屏障功能,容易导致病原体和大分子物质如内毒素不受调控地进入肠黏膜进行转运,导致局部或全身炎症[45]。有研究报道,给仔猪补充乳酸杆菌等益生菌可以提高仔猪肠道紧密连接蛋白的表达,改善大肠杆菌攻毒仔猪的肠道屏障功能[46]。此外,有研究发现,短链脂肪酸可以通过激活腺苷酸活化蛋白激酶(AMPK)信号通路来增强肠道屏障功能[47]。因此,早期GOS干预提高了LPS刺激哺乳仔猪盲肠中紧密连接蛋白的表达,改善了仔猪的肠道屏障功能,这可能与GOS改善了LPS刺激哺乳仔猪盲肠微生物组成、提高了短链脂肪酸的含量和缓解了盲肠炎症反应有关。
综上所述,本试验结果表明了GOS可以调节LPS刺激哺乳仔猪的盲肠微生物群组成,并且提高了盲肠食糜中短链脂肪酸含量,降低了盲肠pH,维持了健康的盲肠内环境。此外,GOS对盲肠微生物和短链脂肪酸的调节作用有利于缓解LPS刺激造成的肠道炎症反应和维持LPS刺激哺乳仔猪的肠道屏障功能。
4 结论① 早期GOS干预调节了LPS刺激哺乳仔猪的盲肠微生物群组成,并且提高了盲肠食糜中短链脂肪酸含量,降低了盲肠pH,有利于维持盲肠健康的内环境。
② 早期GOS干预降低了LPS刺激哺乳仔猪盲肠黏膜中促炎细胞因子含量,有利于缓解肠道炎症反应。
③ 早期GOS干预提高了LPS刺激哺乳仔猪盲肠黏膜中紧密连接的蛋白表达水平,有利于改善仔猪的肠道屏障功能。
| [1] |
STINSON L F. Establishment of the early-life microbiome: a DOHaD perspective[J]. Journal of Developmental Origins of Health and Disease, 2020, 11(3): 201-210. DOI:10.1017/S2040174419000588 |
| [2] |
GENSOLLEN T, IYER S S, KASPER D L, et al. How colonization by microbiota in early life shapes the immune system[J]. Science, 2016, 352(6285): 539-544. DOI:10.1126/science.aad9378 |
| [3] |
MACH N, BERRI M, ESTELLÉ J, et al. Early-life establishment of the swine gut microbiome and impact on host phenotypes[J]. Environmental Microbiology Reports, 2015, 7(3): 554-569. DOI:10.1111/1758-2229.12285 |
| [4] |
刘作华, 杜蕾, 齐仁立. 仔猪早期肠道微生物变化特点及饲养管理措施[J]. 饲料工业, 2020, 41(19): 5-11. LIU Z H, DU L, QI R L. The dynamic changes of gut microbiota and feed managements in piglets at early life[J]. Feed Industry, 2020, 41(19): 5-11 (in Chinese). |
| [5] |
VANDENPLAS Y. Oligosaccharides in infant formula[J]. The British Journal of Nutrition, 2002, 87(Suppl.2): S293-S296. |
| [6] |
WILSON B, ROSSI M, KANNO T, et al. β-galactooligosaccharide in conjunction with low FODMAP diet improves irritable bowel syndrome symptoms but reduces fecal Bifidobacteria[J]. The American Journal of Gastroenterology, 2020, 115(6): 906-915. DOI:10.14309/ajg.0000000000000641 |
| [7] |
ZHANG M, PAN H C, XU Y J, et al. Allicin decreases lipopolysaccharide-induced oxidative stress and inflammation in human umbilical vein endothelial cells through suppression of mitochondrial dysfunction and activation of Nrf2[J]. Cellular Physiology and Biochemistry, 2017, 41(6): 2255-2267. DOI:10.1159/000475640 |
| [8] |
GIL-CARDOSO K, COMITATO R, GINÉS I, et al. Protective effect of proanthocyanidins in a rat model of mild intestinal inflammation and impaired intestinal permeability induced by LPS[J]. Molecular Nutrition & Food Research, 2019, 63(8): e1800720. |
| [9] |
WANG X Y, WANG W J, WANG L M, et al. Lentinan modulates intestinal microbiota and enhances barrier integrity in a piglet model challenged with lipopolysaccharide[J]. Food & Function, 2019, 10(1): 479-489. |
| [10] |
李科南. 低聚半乳糖对断奶仔猪生长性能、免疫和抗氧化功能的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2018. LI K N. Effects of galacto-oligosaccharide on growth performance, immune and antioxidative function in weaned piglets[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2018. (in Chinese) |
| [11] |
ALIZADEH A, AKBARI P, DIFILIPPO E, et al. The piglet as a model for studying dietary components in infant diets: effects of galacto-oligosaccharides on intestinal functions[J]. The British Journal of Nutrition, 2016, 115(4): 605-618. DOI:10.1017/S0007114515004997 |
| [12] |
TIAN S Y, WANG J, YU H, et al. Effects of galacto-oligosaccharides on growth and gut function of newborn suckling piglets[J]. Journal of Animal Science and Biotechnology, 2018, 9: 75. DOI:10.1186/s40104-018-0290-9 |
| [13] |
SHEN Z H, ZHU C X, QUAN Y S, et al. Relationship between intestinal microbiota and ulcerative colitis: mechanisms and clinical application of probiotics and fecal microbiota transplantation[J]. World Journal of Gastroenterology, 2018, 24(1): 5-14. DOI:10.3748/wjg.v24.i1.5 |
| [14] |
WANG J, TIAN S Y, YU H, et al. Response of colonic mucosa-associated microbiota composition, mucosal immune homeostasis, and barrier function to early life galactooligosaccharides intervention in suckling piglets[J]. Journal of Agricultural and Food Chemistry, 2019, 67(2): 578-588. DOI:10.1021/acs.jafc.8b05679 |
| [15] |
PAN X D, CHEN F Q, WU T X, et al. Prebiotic oligosaccharides change the concentrations of short-chain fatty acids and the microbial population of mouse bowel[J]. Journal of Zhejiang University.Science.B, 2009, 10(4): 258-263. DOI:10.1631/jzus.B0820261 |
| [16] |
ANTHONY J C, MERRIMAN T N, HEIMBACH J T. 90-day oral (gavage) study in rats with galactooligosaccharides syrup[J]. Food and Chemical Toxicology, 2006, 44(6): 819-826. DOI:10.1016/j.fct.2005.10.012 |
| [17] |
SHI C, ZHU Y Z, NIU Q Y, et al. The changes of colonic bacterial composition and bacterial metabolism induced by an early food introduction in a neonatal porcine model[J]. Current Microbiology, 2018, 75(6): 745-751. DOI:10.1007/s00284-018-1442-z |
| [18] |
KOGUT M H, LEE A, SANTIN E. Microbiome and pathogen interaction with the immune system[J]. Poultry Science, 2020, 99(4): 1906-1913. DOI:10.1016/j.psj.2019.12.011 |
| [19] |
SEKIROV I, RUSSELL S L, ANTUNES L C M, et al. Gut microbiota in health and disease[J]. Physiological Reviews, 2010, 90(3): 859-904. DOI:10.1152/physrev.00045.2009 |
| [20] |
CHEN L M, XU Y S, CHEN X Y, et al. The maturing development of gut microbiota in commercial piglets during the weaning transition[J]. Frontiers in Microbiology, 2017, 8: 1688. DOI:10.3389/fmicb.2017.01688 |
| [21] |
ABRAHAMSSON T R, JAKOBSSON H E, ANDERSSON A F, et al. Low gut microbiota diversity in early infancy precedes asthma at school age[J]. Clinical and Experimental Allergy, 2014, 44(6): 842-850. DOI:10.1111/cea.12253 |
| [22] |
王艺苑, 林姗姗, 热依拉·阿巴拜克热, 等. 不同浓度低聚半乳糖对初断乳大鼠肠道菌群的影响[J]. 食品研究与开发, 2019, 40(5): 17-22. WANG Y Y, LIN S S, ABABAIKERE R Y L, et al. Effects of different concentration of galacto-ligosaccharide on the intestinal microbiome of newly weaned rats[J]. Food Research and Development, 2019, 40(5): 17-22 (in Chinese). DOI:10.3969/j.issn.1005-6521.2019.05.004 |
| [23] |
常金金, 胡平, 王珏, 等. 低聚半乳糖对断奶仔猪回肠形态、消化吸收功能及菌群结构的影响[J]. 畜牧与兽医, 2020, 52(2): 47-53. CHANG J J, HU P, WANG J, et al. Effects of galacto-oligosaccharides on ileal morphology, digestion and absorption and bacterial composition in weaned piglets[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(2): 47-53 (in Chinese). |
| [24] |
赵方舟, 胡平, 汪晶, 等. 早期乳铁蛋白干预对哺乳仔猪盲肠菌群结构、短链脂肪酸含量及黏膜炎症因子水平的影响[J]. 南京农业大学学报, 2021, 44(1): 151-159. ZHAO F Z, HU P, WANG J, et al. Effects of early life lactoferrin intervention on cecal microbiota, the concentration of short chain fatty acids and the level of mucosal cytokines in suckling piglets[J]. Journal of Nanjing Agricultural University, 2021, 44(1): 151-159 (in Chinese). |
| [25] |
LOUIS P, FLINT H J. Formation of propionate and butyrate by the human colonic microbiota[J]. Environmental Microbiology, 2017, 19(1): 29-41. DOI:10.1111/1462-2920.13589 |
| [26] |
KENWORTHY R, CRABB W E. The intestinal flora of young pigs, with reference to early weaning, Escherichia coli and scours[J]. Journal of Comparative Pathology, 1963, 73: 215-228. DOI:10.1016/S0368-1742(63)80025-9 |
| [27] |
PERAN L, CAMUESCO D, COMALADA M, et al. Lactobacillus fermentum, a probiotic capable to release glutathione, prevents colonic inflammation in the TNBS model of rat colitis[J]. International Journal of Colorectal Disease, 2006, 21(8): 737-746. DOI:10.1007/s00384-005-0773-y |
| [28] |
SAVADOGO A, OUATTARA CHEIK A T, BASSOLE IMAEL H N, et al. Bacteriocins and lactic acid bacteria-a minireview[J]. African Journal of Biotechnology, 2006, 5(9): 678-683. |
| [29] |
REN D, LI L, SCHWABACHER A W, et al. Mechanism of cholesterol reduction to coprostanol by Eubacterium coprostanoligenes ATCC 51222[J]. Steroids, 1996, 61(1): 33-40. DOI:10.1016/0039-128X(95)00173-N |
| [30] |
MADDEN U A, OSWEILER G D, KNIPE L, et al. Effects of Eubacterium coprostanoligenes and lactobacillus on pH, lipid content, and cholesterol of fermented pork and mutton sausage-type mixes[J]. Journal of Food Science, 1999, 64(5): 903-908. DOI:10.1111/j.1365-2621.1999.tb15937.x |
| [31] |
SUN J, DU L, LI X L, et al. Identification of the core bacteria in rectums of diarrheic and non-diarrheic piglets[J]. Scientific Reports, 2019, 9(1): 18675. DOI:10.1038/s41598-019-55328-y |
| [32] |
LIU B S, WANG W J, ZHU X Y, et al. Response of gut microbiota to dietary fiber and metabolic interaction with SCFAs in piglets[J]. Frontiers in Microbiology, 2018, 9: 2344. DOI:10.3389/fmicb.2018.02344 |
| [33] |
KANG C, WANG B, KALIANNAN K, et al. Gut microbiota mediates the protective effects of dietary capsaicin against chronic low-grade inflammation and associated obesity induced by high-fat diet[J]. mBio, 2017, 8(3): e00470-17. |
| [34] |
WEI X Y, TAO J H, XIAO S W, et al. Xiexin Tang improves the symptom of type 2 diabetic rats by modulation of the gut microbiota[J]. Scientific Reports, 2018, 8(1): 3685. DOI:10.1038/s41598-018-22094-2 |
| [35] |
ZHAO L J, LOU H X, PENG Y, et al. Comprehensive relationships between gut microbiome and faecal metabolome in individuals with type 2 diabetes and its complications[J]. Endocrine, 2019, 66(3): 526-537. DOI:10.1007/s12020-019-02103-8 |
| [36] |
LIU C S, LIANG X, WEI X H, et al. Gegen Qinlian decoction treats diarrhea in piglets by modulating gut microbiota and short-chain fatty acids[J]. Frontiers in Microbiology, 2019, 10: 825. DOI:10.3389/fmicb.2019.00825 |
| [37] |
LIU P Y, WANG Y B, YANG G, et al. The role of short-chain fatty acids in intestinal barrier function, inflammation, oxidative stress, and colonic carcinogenesis[J]. Pharmacological Research, 2021, 165: 105420. DOI:10.1016/j.phrs.2021.105420 |
| [38] |
FUKUDA S, TOH H, HASE K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate[J]. Nature, 2011, 469(7331): 543-547. DOI:10.1038/nature09646 |
| [39] |
LOPEZ-SILES M, DUNCAN S H, GARCIA-GIL L J, et al. Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics[J]. ISME Journal, 2017, 11(4): 841-852. DOI:10.1038/ismej.2016.176 |
| [40] |
YAN H, AJUWON K M. Butyrate modifies intestinal barrier function in IPEC-J2 cells through a selective upregulation of tight junction proteins and activation of the Akt signaling pathway[J]. PLoS One, 2017, 12(6): e0179586. DOI:10.1371/journal.pone.0179586 |
| [41] |
NEAL-MCKINNEY J M, LU X N, DUONG T, et al. Production of organic acids by probiotic lactobacilli can be used to reduce pathogen load in poultry[J]. PLoS One, 2012, 7(9): e43928. DOI:10.1371/journal.pone.0043928 |
| [42] |
SHIBATA N, KUNISAWA J, KIYONO H. Dietary and microbial metabolites in the regulation of host immunity[J]. Frontiers in Microbiology, 2017, 8: 2171. DOI:10.3389/fmicb.2017.02171 |
| [43] |
MEIJER K, DE VOS P, PRIEBE M G. Butyrate and other short-chain fatty acids as modulators of immunity: what relevance for health?[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2010, 13(6): 715-721. DOI:10.1097/MCO.0b013e32833eebe5 |
| [44] |
XIONG W, MA H Y, ZHANG Z, et al. Icariin enhances intestinal barrier function by inhibiting NF-κB signaling pathways and modulating gut microbiota in a piglet model[J]. RSC Advances, 2019, 9(65): 37947-37956. DOI:10.1039/C9RA07176H |
| [45] |
YANG J J, QIAN K, WANG C L, et al. Roles of probiotic lactobacilli inclusion in helping piglets establish healthy intestinal inter-environment for pathogen defense[J]. Probiotics and Antimicrobial Proteins, 2018, 10(2): 243-250. DOI:10.1007/s12602-017-9273-y |
| [46] |
WANG J, JI H F, WANG S X, et al. Probiotic Lactobacillus plantarum promotes intestinal barrier function by strengthening the epithelium and modulating gut microbiota[J]. Frontiers in Microbiology, 2018, 9: 1953. DOI:10.3389/fmicb.2018.01953 |
| [47] |
LI Q, CHEN H X, ZHANG M, et al. Altered short chain fatty acid profiles induced by dietary fiber intervention regulate AMPK levels and intestinal homeostasis[J]. Food & Function, 2019, 10(11): 7174-7187. |




