2. 温氏食品集团股份有限公司, 云浮 527400;
3. 上海农林职业技术学院, 上海 201699
2. Wens Foodstuff Group Co., Ltd., Yunfu 527400, China;
3. Shanghai Vocational College of Agriculture and Forestry, Shanghai 201699, China
长期以来,抗生素在动物饲料中的使用在促进畜禽生长、提高饲料利用率以及防治动物疾病等方面发挥了重要作用,但与此同时抗生素的长期大量使用甚至滥用,不仅破坏了动物肠道内的菌群平衡,降低了动物自身的免疫力,而且由抗生素引起的耐药性和药物残留以及环境污染等问题也日益引起人们的担心;世界各国先后开始限制甚至禁止抗生素作为添加剂在畜禽饲料中的使用,寻找能够替代抗生素的安全绿色添加剂具有重要的意义[1-3]。乳酸菌是一类能够以碳水化合物为原料发酵,产生乳酸等有机酸以及细菌素等抑菌活性物质的革兰氏阳性菌,能够耐受胃肠道中的酸性环境,具有厌氧或兼性厌氧等特征。乳酸菌在进入宿主胃肠道后能够与肠黏膜上皮细胞结合,占据上皮细胞的黏附位点,形成一层保护性生物膜,从而竞争性地排斥、抑制病原菌的定植和生长。此外,乳酸菌在代谢过程中产生的乳酸、乙酸、丙酸和苯乳酸等有机酸也可以降低动物肠道的pH,创造有利于有益菌群生长的酸性环境,抑制有害菌的增殖。大量研究表明,饲粮添加乳酸菌可以改善动物肠道形态和微生物平衡,提高机体免疫功能,促进营养物质消化吸收,从而促进畜禽生长,提高饲料转化效率[4-6]。目前关于乳酸菌在肉鸡饲粮中的应用多集中在对单一乳酸菌的研究,且大多应用在白羽肉鸡上,有关复合乳酸菌制剂(compound Lactobacillus preparation,CLP)在黄羽肉鸡饲粮中的应用研究相对比较少。因此,本试验以复合乳酸菌制剂为研究对象,探究了其替代抗生素使用对黄羽肉鸡生长性能、组织器官指数、胃肠道pH、肠道形态以及盲肠微生物数量等方面的影响,以期为乳酸菌制剂在黄羽肉鸡饲粮中的应用提供一定的理论依据和参考价值。
1 材料与方法 1.1 试验材料试验所用复合乳酸菌制剂由某公司提供,采用乳酸杆菌代谢生产,主要有效成分包括:乳酸杆菌1.0×106 CFU/g、乳酸150 g/kg和苯乳酸400 mg/kg。所用“矮脚黄”中速型黄羽肉鸡和恩拉霉素由广东温氏食品集团股份有限公司提供。
1.2 试验设计和饲养管理试验采用单因素完全随机设计,选取1日龄体重相近、健康状况良好的“矮脚黄”中速型黄羽肉鸡母鸡2 100只,随机分为5组,每组6个重复,每个重复70只。对照组(CON组)饲喂基础饲粮,抗生素组(ANT组)在基础饲粮中添加120 mg/kg的恩拉霉素,试验组分别在基础饲粮中添加0.1%(0.1%CLP组)、0.2%(0.2%CLP组)和0.3%(0.3%CLP组)的复合乳酸菌制剂。试验期72 d,分为1~25日龄、26~50日龄和51~72日龄3个阶段。饲养试验在广东温氏食品集团股份有限公司肉鸡试验场进行,试验肉鸡采用网上平养方式,24 h连续光照,自由采食和饮水,按照试验鸡场常规免疫程序进行免疫接种。
1.3 基础饲粮基础饲粮为玉米-豆粕型饲粮,参照NY/T 33—2004《鸡饲养标准》并结合试验鸡场企业标准设计,1~25日龄为粉料,26~50日龄和51~72日龄为颗粒料。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验期间每天观察肉鸡生长状况并记录料耗量,各阶段结束时肉鸡禁食12 h(自由饮水)后进行空腹称重,以重复为单位计算各阶段试验肉鸡的平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.4.2 组织器官指数饲养试验全期结束时每个重复随机选取1只肉鸡,颈静脉放血处死后进行屠宰,完整游离心脏、肝脏、脾脏、胸腺和法氏囊等组织器官并称重,计算组织器官指数:
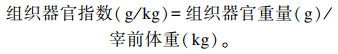
|
试验肉鸡屠宰后分离消化道各部分,使用Test-205便携式pH计分别测定肉鸡腺胃、十二指肠、空肠、回肠和盲肠内容物的pH,每个肠段测定前、中、后3个位置数据,计算平均值。
1.4.4 空肠组织形态试验肉鸡屠宰后取空肠中段相同位置1.5 cm左右,放在磷酸盐缓冲液中轻微反复冲洗去掉食糜,然后置于4%多聚甲醛固定液中固定备用,经过常规乙醇脱水、二甲苯透明和石蜡包被等制作组织切片,经苏木精-伊红(HE)染色后,在显微镜下观察肠道黏膜形态结构,每张切片选取3个典型视野测量空肠绒毛高度以及与之相连的隐窝深度并计算绒毛高度与隐窝深度比值(V/C)。
1.4.5 盲肠食糜微生物数量试验肉鸡屠宰后分离盲肠,取盲肠食糜适量装入10 mL离心管放入液氮中带回实验室-80 ℃保存。采用北京天根生物科技有限公司粪便基因组DNA提取试剂盒对盲肠食糜微生物总DNA进行提取,得到食糜微生物总DNA后,根据细菌16S rRNA序列设计各细菌通用引物,由生工生物工程(上海)有限公司合成,各引物序列见表 2。用各目的菌引物进行PCR扩增,然后使用生工生物工程(上海)有限公司试剂盒得到各目的菌DNA标准品,依次进行6~7个梯度的10倍稀释。根据细菌拷贝数和标准品荧光定量PCR得到的Ct值制作标准曲线,再根据用提取的细菌总DNA进行荧光定量PCR得到的Ct值,对比标准曲线进行绝对定量结果分析。拷贝数计算公式为:
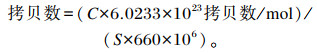
|
|
|
表 2 PCR引物序列 Table 2 Primer sequences for PCR |
式中:C表示标准品浓度,单位为μg/μL;S表示待测细菌基因组DNA定量PCR产物的碱基数。
结果用每克食糜中细菌拷贝数的常用对数值[lg(拷贝数/g)]表示。
1.5 数据统计分析试验数据采用SPSS 23软件进行单因素方差分析和LSD多重比较,结果用平均值±标准误表示,P < 0.05表示差异显著,0.05≤P < 0.10表示存在差异显著的趋势,P≥0.10表示差异不显著。
2 结果与分析 2.1 复合乳酸菌制剂对黄羽肉鸡生长性能的影响由表 3可知,1~25日龄,0.3%CLP组肉鸡ADFI与对照组相比有降低的趋势(P=0.058),与抗生素组相比显著降低(P < 0.05)。26~50日龄,与抗生素组相比,0.3%CLP组肉鸡ADFI显著降低(P < 0.05)。1~72日龄,与对照组相比,抗生素组肉鸡ADFI有提高的趋势(P=0.075),0.3%CLP组ADFI显著降低(P < 0.05);与抗生素组相比,0.2%和0.3%CLP组肉鸡ADFI显著降低(P < 0.05)。各阶段各组肉鸡ADG之间无显著差异(P>0.05)。26~50日龄,与对照组相比,抗生素组和各CLP组肉鸡F/G均显著降低(P < 0.05)。
|
|
表 3 复合乳酸菌制剂对黄羽肉鸡生长性能的影响 Table 3 Effects of CLP on growth performance of yellow-feathered broilers |
由表 4可知,与对照组相比,抗生素组肉鸡脾脏指数、胸腺指数和法氏囊指数在数值上有所降低(P>0.05);而与抗生素组相比,0.1%CLP组肉鸡脾脏指数显著提高(P < 0.05),0.2%CLP组法氏囊指数显著提高(P < 0.05)。各组肉鸡心脏指数、肝脏指数和胸腺指数之间均无显著差异(P>0.05)
|
|
表 4 复合乳酸菌制剂对黄羽肉鸡组织器官指数的影响 Table 4 Effects of CLP on tissue organ indices of yellow-feathered broilers |
由表 5可知,抗生素组和对照组肉鸡胃肠道pH之间无显著差异(P>0.05);与对照组相比,0.3%CLP组肉鸡腺胃pH显著降低(P < 0.05),0.2%和0.3%CLP组十二指肠pH显著降低(P < 0.05),各CLP组肉鸡空肠、回肠和盲肠pH也均在数值上有所降低,但未达到显著水平(P>0.05)。
|
|
表 5 复合乳酸菌制剂对黄羽肉鸡胃肠道pH的影响 Table 5 Effects of CLP on gastrointestinal pH of yellow-feathered broilers |
由表 6可知,与对照组相比,抗生素组和各CLP组肉鸡空肠绒毛高度在数值上有所提高,但未达到显著水平(P>0.05);抗生素组和0.3%CLP组肉鸡空肠绒毛高度与隐窝深度比值显著提高(P < 0.05)。
|
|
表 6 复合乳酸菌制剂对黄羽肉鸡空肠组织形态的影响 Table 6 Effects of CLP on jejunal tissue morphology of yellow-feathered broilers |
由表 7可知,与对照组相比,0.3%CLP组肉鸡盲肠食糜中大肠杆菌数量显著减少(P < 0.05),且显著低于0.1%CLP组(P < 0.05);各CLP组肉鸡盲肠食糜中双歧杆菌和乳酸杆菌数量在数值上有所增加,但未达到显著水平(P>0.05)。
|
|
表 7 复合乳酸菌制剂对黄羽肉鸡盲肠食糜微生物数量的影响 Table 7 Effects of CLP on the number of cecal chyme bacteria of yellow-feathered broilers |
乳酸菌作为一类常见的益生菌,能够定植于动物的消化道,分泌多种消化酶,通过代谢活动改善消化道环境,促进营养物质吸收,从而提高饲料转化效率,促进畜禽生长[7-9]。Shokryazdan等[10]研究发现,在饲粮中添加0.5和1.0 g/kg的唾液乳杆菌混合菌(1.0×109 CFU/g)均显著提高了22~42日龄和1~42日龄科宝(Cobb)肉鸡的ADG,降低了F/G,提高了饲料转化效率。Peng等[11]在饲粮中添加2.0×109 CFU/kg的植物乳杆菌B1后发现22~42日龄和1~42日龄爱拔益加(AA)肉鸡的ADG均显著增加,22~42日龄肉鸡F/G显著降低。本试验结果发现,在饲粮中添加0.3%的复合乳酸菌制剂显著降低了1~25日龄、26~50日龄和1~72日龄黄羽肉鸡的ADFI,饲粮添加抗生素和不同水平的复合乳酸菌制剂均显著降低了26~50日龄肉鸡的F/G,但各阶段各组肉鸡的ADG均无显著差异,与Wang等[12]的研究结果类似,这可能是由于本试验中所用的复合乳酸菌制剂中含有乳酸菌、乳酸以及苯乳酸复合成分,影响了饲粮的气味,降低了肉鸡的采食量,但其进入肉鸡体内后可以通过降低胃肠道pH、提高消化酶活性、改善肠道形态以及微生态平衡等途径提高机体对营养物质的消化利用效率,进而使得肉鸡的体增重得以维持在相同的水平,从而降低了肉鸡的F/G,提高了饲料转化效率。
3.2 复合乳酸菌制剂对黄羽肉鸡组织器官指数的影响组织器官指数是动物机体重要的生物学指标之一,其大小可以在一定程度上反映动物相应器官的成熟度、功能强弱和受损情况。发育成熟的组织器官能更好地发挥其在机体内的功能,其中胸腺、脾脏和法氏囊分别作为家禽中枢免疫、外周免疫和体液免疫的主要器官,其发育和成熟状况可以直接反映机体的免疫水平[13]。研究表明,长期使用抗生素会抑制肉鸡免疫器官的发育,导致肉鸡自身的免疫功能降低[14]。本试验也发现,饲粮长期添加抗生素后肉鸡的免疫器官指数在数值上有所降低,这可能是由于抗生素的长期使用抑制或杀灭了大量的肠道微生物,减少了其对肠上皮以及淋巴组织的刺激,从而降低了机体免疫系统的活化状态。研究表明,饲粮添加乳酸菌制剂能够促进肉鸡免疫器官的发育,增强机体免疫功能。付丽等[15]研究发现,在饲粮中添加0.16%的乳酸菌培养物L1显著提高了21日龄AA肉鸡的脾脏、胸腺和法氏囊指数。郭欣怡等[16]在饲粮中添加1 mL/kg的乳酸菌制剂后发现26日龄和40日龄AA肉鸡的胸腺、脾脏和法氏囊指数均显著提高。本试验中,与抗生素组相比,饲粮添加0.1%的复合乳酸菌制剂显著提高了72日龄黄羽肉鸡的脾脏指数,添加0.2%的复合乳酸菌制剂显著提高了法氏囊指数,表明在饲粮中添加复合乳酸菌制剂能够在一定程度上促进肉鸡免疫器官的发育,加快免疫系统的成熟。
3.3 复合乳酸菌制剂对黄羽肉鸡胃肠道pH的影响胃肠道作为动物机体消化吸收营养物质最主要的场所,其pH只有维持在一定的范围才能保证各种消化酶的活性,从而发挥其消化吸收功能。幼龄动物由于消化系统尚未成熟,胃酸分泌不足,而成年动物也常常因生理和环境等因素导致消化道pH升高,导致消化酶难以发挥其最佳作用效果,有益菌群的生长也受到抑制,因此必须依靠外源饲粮来改善消化道中的pH环境[17]。有研究指出,饲粮添加酸性物质对于改善动物胃肠道前段的酸性环境作用更加明显,这可能与酸性物质随着食糜在消化道内的消耗代谢有关[18]。本试验所用复合乳酸菌制剂除了含有乳酸杆菌外还包含乳酸和苯乳酸,而乳酸杆菌在机体内代谢可以产生乳酸等有机酸,试验发现在饲粮中添加0.3%的复合乳酸菌制剂显著降低了72日龄黄羽肉鸡腺胃pH,添加0.2%和0.3%的复合乳酸菌制剂显著降低了肉鸡十二指肠pH,对其他肠段pH也有一定的降低作用,虽然未达到显著水平,表明在饲粮中添加复合乳酸菌制剂可以在一定程度上降低肉鸡的胃肠道pH,改善消化道酸性环境,这种作用在消化道前段相对更加明显。
3.4 复合乳酸菌制剂对黄羽肉鸡肠道形态的影响大量研究表明,肠道黏膜良好的形态结构是维持其消化吸收功能的必要条件。肠道黏膜微绒毛结构的存在使得肠道表面积扩大了20~30倍,这极大地增加了肠道与食糜的接触面积,从而增强了肠道的吸收功能,而隐窝深度是反映肠上皮细胞发育成熟率的主要指标,绒毛高度和隐窝深度可以直接反映肠道对营养物质消化吸收的能力,而绒毛高度与隐窝深度的比值能够综合反映肠道的功能状态,比值越高,消化吸收能力越强[19-21]。玄家洁[22]在饮水中添加3%的复合乳酸菌菌液(1.0×107 CFU/mL)后发现14日龄和28日龄罗斯308肉鸡十二指肠、空肠绒毛高度以及绒毛高度与隐窝深度比值均显著升高。本试验结果发现,在饲粮中添加抗生素和0.3%的复合乳酸菌制剂均显著提高了72日龄黄羽肉鸡空肠绒毛高度与隐窝深度比值,且对空肠绒毛高度在数值上也有一定程度的提高,表明在饲粮中添加复合乳酸菌制剂可以在一定程度上改善肉鸡肠道形态结构,提高肠道的消化吸收功能。
3.5 复合乳酸菌制剂对黄羽肉鸡盲肠微生物数量的影响肉鸡盲肠中存在着大量的微生物,其组成会随着日龄增加而变化,直至达到动态平衡。然而,当下密集的饲养模式很容易引起肉鸡肠道菌群失衡,导致肠道正常的生理功能被破坏,从而使得对饲粮的消化利用率降低。大多数肠道有害菌群适宜生长在中性偏碱的环境中,例如大肠杆菌适宜生长的pH为6.0~8.0,而乳酸杆菌等有益菌群则适宜在偏酸性的环境中生长繁殖。研究表明,饲粮添加乳酸菌能够改善动物肠道中的菌群平衡,增加有益菌数量,降低致病菌的增殖[23-25]。Zhang等[26]研究发现,在饲粮中添加3×109 CFU/kg的格氏乳球菌显著减少了14日龄罗斯308肉鸡盲肠中大肠杆菌的数量,显著增加了14日龄和28日龄肉鸡盲肠中乳酸菌的数量。刘凤美等[27]在饲粮中添加0.5%的乳酸菌(5×109 CFU/g),结果发现21日龄和42日龄AA肉鸡盲肠中大肠杆菌和沙门氏菌的数量均显著减少,乳酸杆菌的数量显著增加。本试验结果发现,饲粮添加0.3%的复合乳酸菌制剂显著降低了72日龄黄羽肉鸡盲肠食糜中大肠杆菌的数量,而乳酸杆菌和双歧杆菌数量在数值上有所增加,虽然未达到显著水平。本试验所用的复合乳酸菌制剂含有乳酸杆菌、乳酸和苯乳酸,其中乳酸杆菌可能增加了肠道内乳酸杆菌的定植数量,同时促进了机体内源性乳酸杆菌的繁殖,从而形成了乳酸杆菌优势菌群;此外,乳酸杆菌代谢产生的乳酸等有机酸可能与外源乳酸、苯乳酸一起作用,共同降低了胃肠道pH,从而促进了有益菌的增殖,抑制了有害菌的定植和生长。
4 结论① 饲粮添加复合乳酸菌制剂能够降低黄羽肉鸡ADFI,但对ADG无显著影响,从而降低肉鸡F/G,提高饲料转化效率,达到了与抗生素相似的效果,且以0.3%添加水平效果较好。
② 饲粮添加复合乳酸菌制剂可以在一定程度上提高黄羽肉鸡免疫器官指数,降低胃肠道pH,改善肠道黏膜形态并调节盲肠微生物平衡,从而改善黄羽肉鸡肠道健康。
| [1] |
LIU Y H, ESPINOSA C D, ABELILLA J J, et al. Non-antibiotic feed additives in diets for pigs: a review[J]. Animal Nutrition, 2018, 4(2): 113-125. DOI:10.1016/j.aninu.2018.01.007 |
| [2] |
ZHANG L, GU J, WANG X J, et al. Fate of antibiotic resistance genes and mobile genetic elements during anaerobic co-digestion of Chinese medicinal herbal residues and swine manure[J]. Bioresource Technology, 2018, 250: 799-805. DOI:10.1016/j.biortech.2017.10.100 |
| [3] |
PARENT E, ARCHAMBAULT M, MOORE R J, et al. Impacts of antibiotic reduction strategies on zootechnical performances, health control, and Eimeria spp. excretion compared with conventional antibiotic programs in commercial broiler chicken flocks[J]. Poultry Science, 2020, 99(9): 4303-4313. DOI:10.1016/j.psj.2020.05.037 |
| [4] |
BLAJMAN J E, OLIVERO C A, FUSARI M L, et al. Impact of lyophilized Lactobacillus salivarius DSPV 001P administration on growth performance, microbial translocation, and gastrointestinal microbiota of broilers reared under low ambient temperature[J]. Research in Veterinary Science, 2017, 114: 388-394. DOI:10.1016/j.rvsc.2017.07.011 |
| [5] |
LAN R X, LEE S I, KIM I H. Effects of Enterococcus faecium SLB 120 on growth performance, blood parameters, relative organ weight, breast muscle meat quality, excreta microbiota shedding, and noxious gas emission in broilers[J]. Poultry Science, 2017, 96(9): 3246-3253. DOI:10.3382/ps/pex101 |
| [6] |
DE SOUZA L F A, ARAÚJO D N, STEFANI L M, et al. Probiotics on performance, intestinal morphology and carcass characteristics of broiler chickens raised with lower or higher environmental challenge[J]. Austral Journal of Veterinary Sciences, 2018, 50(1): 35-41. DOI:10.4067/S0719-81322018000100107 |
| [7] |
ZHANG L, LI J, YUN T T, et al. Effects of pre-encapsulated and pro-encapsulated Enterococcus faecalis on growth performance, blood characteristics, and cecal microflora in broiler chickens[J]. Poultry Science, 2015, 94(11): 2821-2830. DOI:10.3382/ps/pev262 |
| [8] |
FORTE C, MANUALI E, ABBATE Y, et al. Dietary Lactobacillus acidophilus positively influences growth performance, gut morphology, and gut microbiology in rurally reared chickens[J]. Poultry Science, 2018, 97(3): 930-936. DOI:10.3382/ps/pex396 |
| [9] |
CHEN F, GAO S S, ZHU L Q, et al. Effects of dietary Lactobacillus rhamnosus CF supplementation on growth, meat quality, and microenvironment in specific pathogen-free chickens[J]. Poultry Science, 2018, 97(1): 118-123. DOI:10.3382/ps/pex261 |
| [10] |
SHOKRYAZDAN P, FASELEH JAHROMI M, LIANG J B, et al. Effects of a Lactobacillus salivarius mixture on performance, intestinal health and serum lipids of broiler chickens[J]. PLoS One, 2017, 12(5): e0175959. DOI:10.1371/journal.pone.0175959 |
| [11] |
PENG Q, ZENG X F, ZHU J L, et al. Effects of dietary Lactobacillus plantarum B1 on growth performance, intestinal microbiota, and short chain fatty acid profiles in broiler chickens[J]. Poultry Science, 2016, 95(4): 893-900. DOI:10.3382/ps/pev435 |
| [12] |
WANG L F, LIU C H, CHEN M, et al. A novel Lactobacillus plantarum strain P-8 activates beneficial immune response of broiler chickens[J]. International Immunopharmacology, 2015, 29(2): 901-907. DOI:10.1016/j.intimp.2015.07.024 |
| [13] |
ZHANG Z F, CHO J H, KIM I H. Effects of Bacillus subtilis UBT-MO2 on growth performance, relative immune organ weight, gas concentration in excreta, and intestinal microbial shedding in broiler chickens[J]. Livestock Science, 2013, 155(2/3): 343-347. |
| [14] |
韩庆彦, 贺泂杰, 郭慧琳. 抗生素在养鸡生产中的应用及影响研究进展[J]. 国外畜牧学(猪与禽), 2019, 39(1): 56-58. HAN Q Y, HE J J, GUO H L. Research progress on the application and effect of antibiotics in chicken production[J]. Pigs and Poultry, 2019, 39(1): 56-58 (in Chinese). DOI:10.3969/j.issn.1001-0769.2019.01.020 |
| [15] |
付丽, 赵巍, 李立佳, 等. 乳酸菌培养物对肉鸡生长性能及免疫功能的影响[J]. 中国畜牧兽医, 2015, 42(9): 2337-2344. FU L, ZHAO W, LI L J, et al. Effects of lactic acid bacteria cultures on growth performance and immunity function of broilers[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(9): 2337-2344 (in Chinese). |
| [16] |
郭欣怡, 张曼, 韩飞, 等. 不同益生菌制剂对肉鸡生产性能、免疫功能和肠道菌群的影响[J]. 家畜生态学报, 2016, 37(11): 79-83. GUO X Y, ZHANG M, HAN F, et al. Effects of different probiotics on production performance, immunologic function and gut bacteria of broiler chickens[J]. Acta Ecologae Animalis Domastici, 2016, 37(11): 79-83 (in Chinese). DOI:10.3969/j.issn.1673-1182.2016.11.014 |
| [17] |
肖芹, 常玲玲, 沈一茹, 等. 磷酸对肉鸡消化道pH值、消化酶活性和蛋白消化率的影响[J]. 中国家禽, 2016, 38(4): 23-28. XIAO Q, CHANG L L, SHEN Y R, et al. Effects of dietary phosphoric acid on pH, enzymatic activity of digestive tract and protein digestibility in broilers[J]. China Poultry, 2016, 38(4): 23-28 (in Chinese). |
| [18] |
许金根, 车传燕, 闻爱友, 等. 酸化剂对肉鸡免疫器官指数、肠道pH值和血清生化指标的影响[J]. 饲料工业, 2016, 37(8): 12-15. XU J G, CHE C Y, WEN A Y, et al. Effects of acidifier on immune organ indexes, intestinal pH values and serum biochemical indexes of broilers[J]. Feed Industry, 2016, 37(8): 12-15 (in Chinese). |
| [19] |
LILBURN M S, LOEFFLER S. Early intestinal growth and development in poultry[J]. Poultry Science, 2015, 94(7): 1569-1576. DOI:10.3382/ps/pev104 |
| [20] |
CHAMORRO S, ROMERO C, BRENES A, et al. Impact of a sustained consumption of grape extract on digestion, gut microbial metabolism and intestinal barrier in broiler chickens[J]. Food & Function, 2019, 10(3): 1444-1454. |
| [21] |
CSERNUS B, CZEGLÉDI L. Physiological, antimicrobial, intestine morphological, and immunological effects of fructooligosaccharides in pigs[J]. Archives Animal Breeding, 2020, 63(2): 325-335. DOI:10.5194/aab-63-325-2020 |
| [22] |
玄家洁. 乳酸菌复合物对肉鸡肠道形态结构及其生产性能的影响[D]. 硕士学位论文. 邯郸: 河北工程大学, 2016. XUAN J J. Effect of Lactobacillus complex on the intestinal structure and the performance of broiler[D]. Master's Thesis. Handan: Hebei University of Engineering, 2016. (in Chinese) |
| [23] |
DE CESARE A, SIRRI F, MANFREDA G, et al. Effect of dietary supplementation with Lactobacillus acidophilus D2/CSL (CECT 4529) on caecum microbioma and productive performance in broiler chickens[J]. PLoS One, 2017, 12(5): e0176309. DOI:10.1371/journal.pone.0176309 |
| [24] |
RANGAN K J, HANG H C. Biochemical mechanisms of pathogen restriction by intestinal bacteria[J]. Trends in Biochemical Sciences, 2017, 42(11): 887-898. DOI:10.1016/j.tibs.2017.08.005 |
| [25] |
ZHANG L, LI J, YUN T T, et al. Evaluation of pilot-scale microencapsulation of probiotics and product effect on broilers[J]. Journal of Animal Science, 2015, 93(10): 4796-4807. DOI:10.2527/jas.2015-9243 |
| [26] |
ZHANG T, XIE J, ZHANG M, et al. Effect of a potential probiotics Lactococcus garvieae B301 on the growth performance, immune parameters and caecum microflora of broiler chickens[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(3): 413-421. DOI:10.1111/jpn.12388 |
| [27] |
刘凤美, 张磊, 黄彬. 日粮添加益生菌对肉鸡生产性能、免疫功能和肠道菌群的影响[J]. 中国饲料, 2018(24): 39-43. LIU F M, ZHANG L, HUANG B. Effects of probiotics on production performance, immunologic function and gut bacteria of broiler chickens[J]. China Feed, 2018(24): 39-43 (in Chinese). |




