提高肉制品的质量一直是科学家关注的焦点。肌原纤维蛋白作为肉类蛋白质的主要成分,其功能、凝胶和消化特性对最终产品的品质、感官和营养特性起着重要作用[1]。天然或人工的修饰可以通过改变蛋白质结构,从而在很大程度上影响肌原纤维蛋白功能,导致有利或不利的结果。这种对肌原纤维蛋白的修饰,主要分为宰前修饰和宰后修饰[2]。宰前修饰一般包括动物饲养方式、饲粮、性别、品种、年龄和屠宰方式差异等[3];宰后修饰一般是指宰后成熟的方式、时间和宰后处理等[4-5]。硒是家禽营养的必需元素,对动物机体的抗氧化、免疫和繁殖等生物过程至关重要[6]。酵母硒因其特殊的生物学组成可以在机体内被主动吸收,显示出更高的生物利用率,且低毒、高效等优势更使得其作为硒饲料添加剂的主要形式而受到广泛关注[7]。大量研究发现,饲粮中添加酵母硒可以显著提高肉鸡平均日增重[8],提高蛋鸡血液中谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性和总抗氧化能力(T-AOC)[9],降低鸡肉的滴水损失,稳定肉色[10]等。
近年来,对动物产品的巨大需求导致谷物和粗粮的需求增加,随着玉米短缺及价格上涨,家禽养殖效益不断下降,寻找玉米替代品尤为重要。2019年我国红枣产量为746.4万t[11],其中低于销售或加工标准的红枣副产物数量极为可观,可以用作动物饲粮中健康廉价的能量饲料替代来源。红枣因其含有大量功能性糖类、黄酮类、芦丁和多酚类化合物等活性成分[12],已被逐渐应用于畜禽养殖中。冯平等[13]研究发现,饲粮中添加20%的枣粉可以提高山羊肌肉的抗氧化能力。Xie等[14]研究发现,饲粮中添加15%的枣粉能提高山羊的产肉性能,增加肉中氨基酸和矿物质含量,改善肉的嫩度。
目前,关于酵母硒和枣粉对畜禽的影响大都集中在动物机体的抗氧化能力、免疫功能及生产性能等方面,暂未发现宰前饲喂过程中添加酵母硒和枣粉对肌肉肌原纤维蛋白构象及功能特性变化影响的研究。因此,本试验通过在饲粮中添加不同水平的酵母硒和枣粉饲喂白羽肉鸡,研究酵母硒和枣粉对宰后肉鸡肌原纤维蛋白构象、功能和消化特性的影响,以期为饲喂策略改善鸡肉功能特性及营养价值提供理论参考,也为酵母硒和枣粉作为饲料添加剂的开发和应用提供数据支撑。
1 材料与方法 1.1 试验设计试验选用1日龄、体重相近、健康的肉用白羽雏鸡180只,随机分成6组,每组3个重复,每个重复10只。采用玉米-杂粕型基础饲粮,参照NRC(1994)营养需要配制粉状配合饲料,按添加枣粉(大枣采自甘肃省武威市民勤县勤峰滩枣园)和酵母硒(购自某试剂公司,硒含量为2 mg/g)水平的不同分为6个组,分别为CK组(基础饲粮)、J组(基础饲粮+8%枣粉替换8%玉米)、0.3S组(基础饲粮+0.3 mg/kg酵母硒)、0.6S组(基础饲粮+0.6 mg/kg酵母硒)、0.3S+J组(基础饲粮+0.3 mg/kg酵母硒+8%枣粉替换8%玉米)和0.6S+J组(基础饲粮+0.6 mg/kg酵母硒+8%枣粉替换8%玉米)。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of experimental diets (as-fed basis) |
在相同笼养、温度、自由采食和饮水环境中饲养42 d后,参考GB/T 19478—2018屠宰标准进行屠宰后立即取鸡胸肉,剔除表面脂肪和结缔组织,分割成3 g大小的肉块,装入(4±1) ℃的保温箱中,在6 h内带回实验室,进行各指标的测定。
主要仪器设备包括:XHF-DY高速分散器,宁波新芝生物科技有限公司;UV754N紫外可见分光光度计,上海奥析科学仪器有限公司;TGL-16M台式高速冷冻离心机,湖南湘仪实验室仪器有限公司;FTIR-650傅里叶变换红外光谱,天津港东科技发展股份有限公司;RF-5301PC荧光分光光度计,日本岛津公司;Bettersize2600激光粒度分布仪,丹东百特仪器有限公司。
1.3 肌原纤维蛋白的提取参考Park等[15]的方法并稍作修改。称取1 g肉样,加入10倍(体积质量比)pH 6.8的标准盐溶液[20 mmol/L磷酸盐缓冲液,0.1 mol/L氯化钾(KCl),2 mmol/L乙二醇二乙醚二胺四乙酸(EGTA),2 mmol/L氯化镁(MgCl2)]进行匀浆,4 ℃条件下离心10 min(1 000×g),弃去上清,沉淀用8倍(体积质量比)pH 6.8的标准盐溶液溶解后重复上述离心2次。再用8倍(体积质量比)100 mmol/L KCl溶液溶解沉淀,4 ℃离心10 min(1 000×g)弃上清。采用双缩脲法测定肌原纤维蛋白浓度。
1.4 肌原纤维蛋白构象测定 1.4.1 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)测定将提取的肌原纤维蛋白真空冷冻干燥,冻干样品采用碘化钾压片后置于傅立叶变换红外光谱仪中扫描,扫描范围为4 000~400 cm-1,扫描64次,扫描的分辨率为4 cm-1,以空气为背景,获取样品红外光谱图。利用Peakfit 4.2软件对肌原纤维蛋白样品二级结构含量进行计算。
1.4.2 内源性荧光光谱测定参考Xu等[16]的方法略作修改。调节蛋白质溶液为0.5 mg/mL,以0.6 mol/L氯化钠(NaCl)磷酸盐缓冲液作为空白。设置激发波长为295 nm,发射光谱范围为300~400 nm,扫描速度设为1 200 nm/min,激发和发射狭缝均为2.5 nm,扫描3次。
1.5 肌原纤维蛋白功能特性测定 1.5.1 溶解度测定参考Agyare等[17]的方法并稍作修改。用磷酸盐缓冲液(25 mmol/L,pH 6.25)调节蛋白质溶液浓度为2.5 mg/mL。4 ℃静置1 h后离心(5 500 r/min,15 min),用双缩脉法测定上清液中肌原纤维蛋白浓度,根据下列公式计算溶解度:

|
参照Agyare等[18]的方法并稍作修改。肌原纤维蛋白乳浊液的乳化性和乳化稳定性的计算公式如下:

|
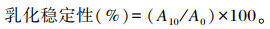
|
式中:ρ为蛋白质质量浓度(g/mL);φ为油相体积分数(油的体积/乳浊液的体积);A500为乳浊液在500 nm波长处的吸光值;A0为乳浊液在0 min的吸光值;A10为乳浊液在10 min的吸光值。
1.5.3 起泡性(FC)和泡沫稳定性(FS)测定参照Jiang等[19]的方法并稍作修改。用磷酸盐缓冲液(50 mmol/L,pH 7.0)调整肌原纤维蛋白溶液浓度为1 mg/mL,取20 mL溶液匀浆1 min(10 000 r/min)后立即测定泡沫的体积(V0);静置30 min后,再次测定泡沫的体积(V30)。肌原纤维蛋白的起泡性和泡沫稳定性的计算公式如下:
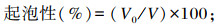
|
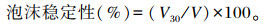
|
式中:V为溶液原始体积(mL)。
1.5.4 浊度测定参照韩敏义等[20]的方法并稍作修改。用磷酸盐缓冲液(25 mmol/L,pH 6.25)分散肌原纤维蛋白沉淀,调整其浓度为2.5 mg/mL,置于室温下20 min后,在340 nm处测定吸光值。
1.6 肌原纤维蛋白凝胶特性测定 1.6.1 热诱导凝胶的制备肌原纤维蛋白溶液用0.6 mol/L NaCl磷酸盐缓冲液(25 mmol/L,pH 7.0)稀释至浓度为60 mg/mL,加入到50 mL平底离心管中,水浴加热从25 ℃以1 ℃/min线性升温,并在80 ℃保温20 min形成凝胶。迅速取出凝胶将其冷却,放置于4 ℃冰箱中冷藏12 h后取出,在室温下平衡30 min,再进行后续指标的测定。
1.6.2 凝胶强度和弹性测定采用弱凝胶模式测定肌原纤维蛋白热诱导凝胶的强度和弹性,质构仪参数如下:探头型号选择P/0.5,测前速度为1 mm/s,测定速度1 mm/s,测后速度为10 mm/s,压缩率为25%。保持时间为40 s,触发力为5 g,每组测定3个重复。
1.6.3 凝胶持水力测定参考于Kocher等[21]的方法,将制备的肌原纤维蛋白热诱导凝胶称重,于0~4 ℃下离心(10 000×g)10 min后,去除离心出的液体,记录离心管的重量以及离心前后离心管与凝胶的总重。凝胶持水力的计算公式如下:
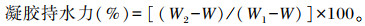
|
式中:W为离心管重(g);W1为离心前的凝胶与离心管总重(g);W2为离心后的凝胶与离心管总重(g)。
1.7 肌原纤维蛋白体外消化特性测定 1.7.1 消化率测定参考Wen等[22]的方法并稍作修改。用甘氨酸缓冲液(33 mmol/L,pH 1.8)将肌原纤维蛋白溶液稀释至4 mg/mL。吸取3 mL溶液加入6 mL胃蛋白酶(5 U/mg),共6份,在37 ℃下消化90 min后用15%的三氯乙酸终止反应,离心(8 000 r/min,7 min),用双缩脲法测定其中3份剩余的不溶蛋白浓度。其余用3份甘氨酸缓冲液(33 mmol/L,pH 8.0)冲洗2遍,最后用3 mL甘氨酸缓冲液(33 mmol/L,pH 8.0)溶解后加入1 mL胰蛋白酶(6.6 U/mg)和凝乳蛋白酶(0.33 U/mg)的混合液,酶解60 min(37 ℃)。结束后立即加入15%的三氯乙酸终止反应,离心用双缩脲法测定剩余的不溶蛋白浓度。计算肌原纤维蛋白的胃、肠消化率。
1.7.2 粒径测定参照Li等[23]的方法并稍作修改。对模拟胃、胃肠消化后的蛋白酶解液的粒径大小进行测定。参数设置如下:以水作为分散介质,分散相折射率1.33,遮光度8%~20%,样品折射率和吸收率分别设定为1.540和0.001。
1.8 统计分析利用SPSS 19.0软件对数据进行统计分析,采用方差分析和邓肯多重范围检验来确定差异显著性,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果与分析 2.1 酵母硒和枣粉对白羽肉鸡肌原纤维蛋白构象的影响 2.1.1 酵母硒和枣粉对肌原纤维蛋白二级结构的影响由表 1可知,饲粮中添加酵母硒和枣粉对肌原纤维蛋白中α-螺旋和β-折叠含量存在极显著影响(P < 0.01),且二者间存在极显著互作(P < 0.01);与CK组相比,0.6S组、0.3S+J组和0.6S+J组肌原纤维蛋白中α-螺旋含量显著增加(P < 0.05),β-折叠含量显著降低(P < 0.05);CK组、J组和0.3S组之间肌原纤维蛋白中α-螺旋和β-折叠含量差异不显著(P>0.05)。α-螺旋含量的增加说明饲粮中添加酵母硒和枣粉可以维持肌原纤维蛋白二级结构不被破坏,提高蛋白质结构的稳定性。饲粮中添加酵母硒和枣粉对肌原纤维蛋白中β转角含量存在显著或极显著影响(P < 0.05或P < 0.01),且二者间存在显著互作(P < 0.05);0.3S组和0.3S+J组肌原纤维蛋白中β转角含量显著高于J组和0.6S+J组(P < 0.05)。各组之间肌原纤维蛋白中无规则卷曲含量差异不显著(P>0.05)。以上结果表明,0.6 mg/kg的酵母硒和枣粉复配饲喂后,鸡肉的肌原纤维中α-螺旋含量最高,β-折叠含量最低,蛋白质结构稳定性最高。
2.1.2 酵母硒和枣粉对肌原纤维蛋白内源性荧光光谱的影响通过监测色氨酸残基固有荧光强度的变化可评价饲粮中添加酵母硒和枣粉引起的肌原纤维蛋白三级结构的变化。当色氨酸处于折叠状态时,色氨酸残基通常位于核心(疏水环境),表现出高荧光强度;当色氨酸变成部分或完全未折叠状态时,色氨酸残基暴露于溶剂(亲水环境),导致荧光强度降低[24]。从图 1中可以看出,饲粮中添加酵母硒和枣粉可以提高肌原纤维蛋白荧光强度,这可能是由于酵母硒和枣粉的抗氧化作用可维持机体肌肉中蛋白质结构稳定不被氧化。CK组肌原纤维蛋白荧光强度明显低于其他各组,0.6S+J组肌原纤维蛋白荧光强度最高。
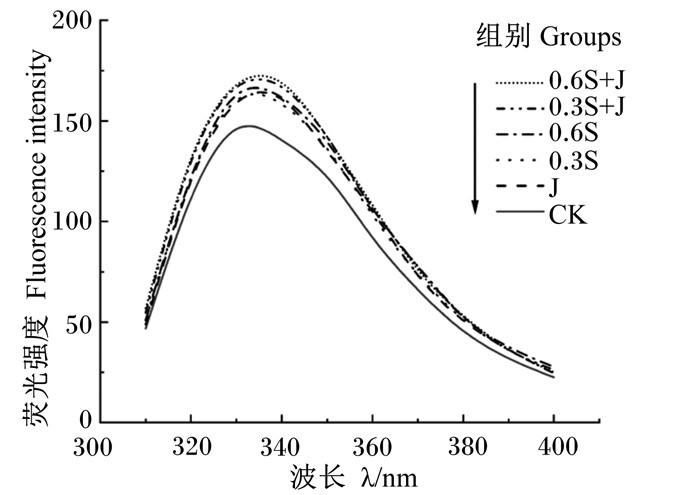
|
图 1 酵母硒和枣粉对肌原纤维蛋白内源性荧光光谱的影响 Fig. 1 Effects of selenium yeast and jujube powder on endogenous fluorescence spectrum of myofibrillar protein |
浊度能够反映蛋白质在溶液中的分散状态,是表征蛋白质聚集程度的关键指标[25]。由表 2可知,饲粮中添加酵母硒和枣粉对肌原纤维蛋白浊度存在极显著影响(P < 0.01),且二者间存在显著互作(P < 0.05);与CK组相比,J组、0.3S组、0.6S组、0.3S+J组和0.6S+J组肌原纤维蛋白浊度显著降低(P < 0.05),且0.6S+J组肌原纤维蛋白浊度最低。以上结果表明,0.6 mg/kg的酵母硒和枣粉复配饲喂后,鸡肉的肌原纤维蛋白表现出较高的聚集程度。
|
|
表 2 酵母硒和枣粉对肌原纤维蛋白二级结构的影响 Table 2 Effects of selenium yeast and jujube powder on secondary structure of myofibrillar protein |
溶解度是衡量蛋白质变性和聚集的一个实用指标,它可以影响蛋白质许多其他功能特性[26]。由表 2可知,饲粮中添加枣粉对肌原纤维蛋白溶解度存在显著影响(P < 0.05),但酵母硒和枣粉之间不存在显著互作(P>0.05);与CK组相比,0.3S组、0.6S组、0.3S+J组和0.6S+J组肌原纤维蛋白溶解度显著升高(P < 0.05),且0.6S+J组肌原纤维蛋白溶解度最高。J组、0.3S组、0.6S组、0.3S+J组和0.6S+J组之间肌原纤维蛋白溶解度无显著差异(P>0.05)。以上结果表明,0.6 mg/kg的酵母硒和枣粉复配饲喂对鸡肉的肌原纤维蛋白溶解度改善效果最佳。
蛋白质形成及稳定乳状液的能力主要依赖于2个方面:通过吸附至表面而降低表面张力;通过静电空间作用力等形成高黏弹性保护膜,稳定乳状液[28]。由表 2可知,饲粮中添加酵母硒和枣粉对肌原纤维蛋白乳化性、乳化稳定性存在极显著影响(P < 0.01),二者对肌原纤维蛋白乳化性存在显著互作(P < 0.05);肌原纤维蛋白乳化性和乳化稳定性的变化趋势相似,与CK组相比,0.3S组、0.6S组、0.3S+J组和0.6S+J组肌原纤维蛋白乳化性和乳化稳定性均显著增加(P < 0.05),且0.6S+J组肌原纤维蛋白乳化性和乳化稳定性均最高。J组、0.3S组、0.6S组之间肌原纤维蛋白乳化性和乳化稳定性无显著差异(P>0.05)。以上结果表明,0.6 mg/kg的酵母硒和枣粉复配饲喂对鸡肉的肌原纤维蛋白乳化性特性改善效果最佳。
起泡性取决于溶液的最终体积和形成的泡沫体积之间的关系,而泡沫稳定性基于蛋白质抵抗重力应力稳定泡沫的能力[27]。由表 2可知,饲粮中添加酵母硒对肌原纤维蛋白起泡性和泡沫稳定性存在显著影响(P < 0.05),饲粮中添加枣粉对肌原纤维蛋白起泡性和泡沫稳定性存在极显著影响(P < 0.01),二者对肌原纤维蛋白泡沫稳定性存在极显著互作(P < 0.01);与CK组相比,0.3S+J组和0.6S+J组肌原纤维蛋白起泡性显著增加(P < 0.05),J组、0.3S组、0.6S组、0.3S+J组和0.6S+J组肌原纤维蛋白泡沫稳定性显著增加(P < 0.05),且0.6S+J组肌原纤维蛋白起泡性和泡沫稳定性最高。J组、0.3S组、0.6S组和0.3S+J组之间肌原纤维蛋白起泡性和泡沫稳定性无显著差异(P>0.05)。以上结果表明,0.6 mg/kg的酵母硒和枣粉复配饲喂对鸡肉的肌原纤维蛋白起泡特性改善效果最佳。
|
|
表 3 酵母硒和枣粉对肌原纤维蛋白功能特性的影响 Table 3 Effects of selenium yeast and jujube powder on functional properties of myofibrillar protein |
凝胶强度是肌原纤维蛋白凝胶的重要功能特性之一,蛋白质凝胶化是加工肉制品中最重要的质构形成特性[28]。由表 4可知,饲粮中添加酵母硒和枣粉对肌原纤维蛋白凝胶特性均不存在显著影响(P>0.05);二者间也不存在显著互作(P>0.05)。随着饲粮中酵母硒和枣粉添加水平的增加,肌原纤维蛋白凝胶硬度、凝胶弹性和凝胶持水力均呈现出升高趋势。与CK组相比,0.6S组、0.3S+J组、0.6S+J组肌原纤维蛋白凝胶硬度和凝胶弹性显著升高(P < 0.05),0.6S+J组肌原纤维蛋白凝胶持水力显著升高(P < 0.05)。与CK组相比,0.6S+J组肌原纤维蛋白凝胶强度增加了21.00 g,凝胶弹性升高了0.04%,凝胶持水力升高了0.10%。以上结果表明,0.6 mg/kg的酵母硒和枣粉复配饲喂可以显著提高宰后鸡肉的肌原纤维蛋白凝胶硬度、凝胶弹性和凝胶持水力。
|
|
表 4 酵母硒和枣粉对肌原纤维蛋白凝胶特性的影响 Table 4 Effects of selenium yeast and jujube powder on gel properties of myofibrillar protein |
通过诱导蛋白质结构(四级、三级甚至二级)的改变,导致蛋白质的展开和聚集,从而影响胃、肠蛋白酶向蛋白质基质深处的扩散,也影响其进入裂解位点的机会,因此,蛋白质构象变化也会影响其消化率[29]。由表 4可知,饲粮中添加酵母硒和枣粉对肌原纤维蛋白肠消化率存在显著或极显著影响(P < 0.05或P < 0.01);与CK组相比,J组、0.3S+J组和0.6S+J组肌原纤维蛋白肠消化率显著增加(P < 0.05),且0.6S+J组肌原纤维蛋白肠消化率最高,但0.3S+J组和0.6S+J组之间肌原纤维蛋白肠消化率差异不显著(P>0.05)。各组之间肌原纤维蛋白胃消化率和总消化率无显著差异(P>0.05),但均以0.6S+J组的肌原纤维蛋白胃消化率和总消化率最高。以上结果表明,0.6 mg/kg的酵母硒和枣粉复配饲喂后,鸡肉的肌原纤维蛋白胃消化率、肠消化率和总消化率最高,消化特性得到改善。
2.4.2 粒径消化产物的粒径大小反映了蛋白质在消化后的降解程度,与其在体内的吸收能力有关系。Dx(10)、Dx(50)和Dx(90)分别表示1个样品的累计粒度分布数达到10%、50%、90%时所对应的粒径,D3, 2表示表面积平均粒径,D4, 3表示体积平均粒径。由表 5可知,饲粮中添加酵母硒和枣粉对全蛋白中、胃消化后、肠消化后肌原纤维蛋白Dx(10)、Dx(50)、Dx(90)、D3, 2和D4, 3存在显著或极显著影响(P < 0.05或P < 0.01),二者对全蛋白中肌原纤维蛋白D4, 3和肠消化后肌原纤维蛋白Dx(90)存在极显著互作(P < 0.01)。与CK组相比,0.3S组、0.6S组、0.3S+J组、0.6S+J组的全蛋白中、胃消化后、肠消化后肌原纤维蛋白Dx(10)、Dx(50)、Dx(90)、D3, 2和D4, 3均显著降低(P < 0.05),且0.6S+J组的全蛋白中、胃消化后、肠消化后肌原纤维蛋白Dx(10)、Dx(50)、Dx(90)、D3, 2和D4, 3最低。以上结果表明,0.6 mg/kg的酵母硒和枣粉复配饲喂后,鸡肉的肌原纤维蛋白将更容易被人体消化吸收。
|
|
表 5 酵母硒和枣粉对肌原纤维蛋白体外消化率的影响 Table 5 Effects of selenium yeast and jujube powder on in vitro digestibility of myofibrillar protein |
|
|
表 6 酵母硒和枣粉对肌原纤维蛋白体外消化粒径的影响 Table 6 Effects of selenium yeast and jujube powder on in vitro digestion particle sizes of myofibrillar protein |
肌原纤维蛋白中α-螺旋结构含量丰富,通过分子内的氢键来维持稳定,当氢键作用力减弱时,部分α-螺旋转变成β-折叠和β-转角,最终导致不稳定的二级结构。研究发现,在猪背最长肌肌原纤维蛋白缓冲液中加入不同浓度的芦丁溶液,能够减少肌原纤维蛋白中α-螺旋的含量,并且高浓度芦丁处理对肌原纤维蛋白中α-螺旋含量的降低更显著[12]。然而本研究中,随着枣粉添加水平的升高,鸡肉肌原纤维蛋白中α-螺旋含量增加,β-折叠含量减少。这可能是由于宰后芦丁处理是通过多酚-蛋白质之间的相互作用,引起肌原纤维蛋白解折叠化,破坏α-螺旋的氢键,促进α-螺旋向其他3种二级结构的转化,表现为蛋白质分子结构的展开。而宰前枣粉饲喂是通过多酚的抗氧化作用抑制机体蛋白氧化,从而维持宰后肌原纤维蛋白结构稳定。Mahan等[30]也报道称,饲粮补充硒可以有效延缓猪机体宰后氧化反应的发生。色氨酸的亲核侧链极易被氧化,因此当蛋白质受到活性氧攻击时,色氨酸结构也可能受到影响,从而引起蛋白质内源性荧光强度变化。Cao等[31]研究发现,将没食子酸溶液加入到猪肉肌原纤维蛋白中,可以促进其固有荧光的损失,这可能与没食子酸和色氨酸残基之间的相互作用有关。而本试验中,饲粮中添加枣粉能够提高宰后鸡肉肌原纤维蛋白的荧光强度。这说明当通过测定色氨酸荧光来评价蛋白质结构变化时,色氨酸的损失可能不完全是由宰后处理中色氨酸和抗氧化剂之间的相互作用引起的[32],也可以由宰前抗氧化剂处理对色氨酸氧化程度的影响来解释。
食品的整体质量和感官特性会受到蛋白质功能特性的影响,肌原纤维蛋白属于盐溶性蛋白质,其溶解度是决定蛋白质的乳化、起泡和凝胶性等各种功能的重要特性。Wang等[33]的研究发现,添加300 μmol/g迷迭香酸能够使猪肉肌原纤维蛋白的溶解度显著降低,内部疏水基团外露,导致亲水基团与水之间的相互作用被减弱,而蛋白质分子间疏水相互作用增强,进而易引起蛋白质交联聚集,溶解度下降。然而本研究发现,与CK组相比,饲粮添加酵母硒和枣粉的试验组鸡肉肌原纤维蛋白溶解度显著增加,意味着蛋白质处于折叠状态,其结构未破坏,核心的疏水性氨基酸未被暴露与蛋白质表面,因此蛋白质表现出良好的溶解性。这可能是由于酵母硒和枣粉在机体宰前氧化过程中起关键的调控作用,提高机体抗氧化能力,稳定蛋白质结构,从而提高了蛋白质溶解度,这也与Li等[34]的研究结果一致,即有机硒的补充能够保护蛋白质高级结构不被破坏,提高鸡肉肌原纤维蛋白溶解度。张典[35]研究报道,高浓度的绿原酸会导致鸡肉肌原纤维蛋白形成少量不溶物,引起肌原纤维蛋白的不良聚集,难以形成稳定的界面膜,从而降低其乳化和起泡性能。本研究中,饲粮中添加酵母硒和枣粉能够改善鸡肉肌原纤维蛋白的乳化和起泡特性,使其提高,是由于饲粮中抗氧化剂的加入,能够有效抑制肌原纤维蛋白的氧化变性,使其能够形成具有良好黏弹性的界面蛋白膜,进而改善其功能特性。蛋白质良好的凝胶特性有利于其形成致密的凝胶网络,并有助于脂质和水在连续的蛋白质相中保持良好的分散状态,从而形成稳定的肉糜;反之则会促进粗糙且无序的蛋白质网络或凝结物的形成。杨豫菘[36]研究表明,向羊肉肌原纤维蛋白中添加茶多酚可以显著提高凝胶硬度和保水性,并且由于茶多酚的较多结合位点与肌原纤维蛋白交联形成胶束,使得凝胶网状结构更加紧密且均匀。这与本研究结果一致,饲粮中添加酵母硒和枣粉使得肌原纤维蛋白热诱导凝胶强度、弹性和持水力均有所提高,这可能是因为酵母硒和枣粉的抗氧化作用可以抑制蛋白质的氧化程度,避免其结构破坏引起其不良聚集妨碍凝胶形成;并且多酚羟基的亲水性能够使多酚-蛋白质复合物的水合性增强,进而增加了凝胶结构的致密化,提高了凝胶强度、弹性和持水力。
食物蛋白质的营养价值取决于多个因素,包括氨基酸组成、必需氨基酸的比例、消化过程中对水解的敏感性等[14]。目前暂未有通过宰前饲喂调控宰后肌肉蛋白质消化特性的研究,而在多酚对特定蛋白质处理的研究中,Rawel等[37]观察发现,酚类化合物如绿原酸、没食子酸和咖啡酸与大豆蛋白相互作用后,大豆蛋白中赖氨酸、色氨酸等必需氨基酸的含量有所降低,导致其营养特性下降。Emmambux等[38]报道,缩合单宁的存在会导致高粱醇溶蛋白消化率下降,这可能是因为高粱醇溶蛋白独特的结构特性导致的。在本试验中,饲粮中添加酵母硒和枣粉的提高宰后鸡肉肌原纤维蛋白的胃、肠消化率,并降低了其粒径,使之更容易被人体吸收利用。这可能是由于酵母硒和枣粉作为抗氧化剂,一方面能够增强白羽肉鸡机体生成代谢,促进氨基酸的合成,提高了肉中氨基酸含量,现有研究已证实,饲粮添加硒可提高罗非鱼[39]、黑猪[40]和滩羊肉[41]中的氨基酸含量;另一方面能够抑制鸡肉肌原纤维蛋白氧化,避免了蛋白质交联聚集形成大分子,掩埋胃蛋白酶等消化酶作用位点,从而降低其消化特性的发生[42]。
4 结论白羽肉鸡饲粮中添加酵母硒和枣粉,可作为宰前氧化修饰的重要手段,对机体产生抗氧化作用,延缓宰后氧化反应的速度,维持宰后鸡肉肌原纤维蛋白结构稳定,调节蛋白质构象变化,对改善宰后鸡肉肌原纤维蛋白功能特性和消化特性产生积极影响。在本试验条件下,饲粮中0.6 mg/kg酵母硒和8%枣粉复配添加对白羽肉鸡宰后肌原纤维蛋白构象、功能及消化特性改善效果最佳。
| [1] |
XU Y J, XU X L. Modification of myofibrillar protein functional properties prepared by various strategies: a comprehensive review[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1): 458-500. DOI:10.1111/1541-4337.12665 |
| [2] |
李文博. 饲养方式对苏尼特羊宰后肌原纤维蛋白与肉品质的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2020. LI W B. Effects of feeding regimen on myofibrillar protein and meat quality after Sunit sheep slaughter[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2020. (in Chinese) |
| [3] |
JIANG J, XIONG Y L. Natural antioxidants as food and feed additives to promote health benefits and quality of meat products: a review[J]. Meat Science, 2016, 120: 107-117. DOI:10.1016/j.meatsci.2016.04.005 |
| [4] |
陈立娟, 李欣, 李铮, 等. 蛋白质磷酸化调控羊肉肌原纤维蛋白的功能[J]. 中国农业科学, 2016, 49(7): 142-152. CHEN L J, LI X, LI Z, et al. Protein phosphorylation on the function of myofibrillar proteins in mutton muscle[J]. Scientia Agricultura Sinica, 2016, 49(7): 142-152 (in Chinese). |
| [5] |
张勇, 沈丙权, 秦伟捷, 等. 糖基化蛋白质组学: 结构、功能和研究方法[J]. 生命科学, 2018, 30(4): 480-490. ZHANG Y, SHEN B Q, QIN W J, et al. Glycoproteomics: structure, function and methods[J]. Chinese Bulletin of Life Sciences, 2018, 30(4): 480-490 (in Chinese). |
| [6] |
ZOU Y X, SHAO J J, LI Y X, et al. Protective effects of inorganic and organic selenium on heat stress in bovine mammary epithelial cells[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 1503478. |
| [7] |
黄正洋, 王钱保, 李春苗, 等. 日粮添加酵母硒及维生素E对苏禽3号肉鸡肉品质和抗氧化能力的影响[J]. 中国家禽, 2021, 43(3): 35-41. HUANG Z Y, WANG Q B, LI C M, et al. Effects of selenium yeast and vitamin E on meat quality and antioxidant ability in suqin No.3 broiler[J]. China Poultry, 2021, 43(3): 35-41 (in Chinese). |
| [8] |
MARKOVIC R, CIRIC J, DRLJACIC A, et al. The effects of dietary selenium-yeast level on glutathione peroxidase activity, tissue selenium content, growth performance, and carcass and meat quality of broilers[J]. Poultry Science, 2018, 97(8): 2861-2870. DOI:10.3382/ps/pey117 |
| [9] |
AHMAD H, TIAN J K, WANG J J, et al. Effects of dietary sodium selenite and selenium yeast on antioxidant enzyme activities and oxidative stability of chicken breast meat[J]. Journal of Agricultural and Food Chemistry, 2012, 60(29): 7111-7120. DOI:10.1021/jf3017207 |
| [10] |
SILVA V A, BERTECHINI A G, NOGUEIRA B R F, et al. Selenium yeast supplementation for broilers at different ages[J]. Journal of Applied Poultry Research, 2019, 28(4): 1021-1027. DOI:10.3382/japr/pfz063 |
| [11] |
中华人民共和国统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2014. National Bureau of Statistics of the People's Republic of China. China statistical yearbook[M]. Beijing: China Statistics Press, 2014 (in Chinese). |
| [12] |
朱梅芳, 覃建基, 彭辉才. 红枣富硒饲料对灵山土鸡肌肉品质的影响[J]. 中国饲料, 2020(19): 57-59, 63. ZHU M F, QIN J J, PENG H C. Effects of selenium-enriched jujube feed on selenium content and physical index in muscle of Lingshan local chicken[J]. China Feed, 2020(19): 57-59, 63 (in Chinese). |
| [13] |
冯平, 孙旺斌, 张骞, 等. 枣粉对陕北白绒山羊肉抗氧化性能的影响[J]. 农业工程学报, 2020, 36(11): 310-317. FENG P, SUN W B, ZHANG Q, et al. Effects of jujube powder on the antioxidant capability of north Shaanxi white cashmere goat meat[J]. Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(11): 310-317 (in Chinese). DOI:10.11975/j.issn.1002-6819.2020.11.037 |
| [14] |
XIE B, WANG P J, YAN Z W, et al. Growth performance, nutrient digestibility, carcass traits, body composition, and meat quality of goat fed Chinese jujube (Ziziphus jujuba Mill) fruit as a replacement for maize in diet[J]. Animal Feed Science and Technology, 2018, 246: 127-136. DOI:10.1016/j.anifeedsci.2018.10.005 |
| [15] |
PARK D, XIONG Y L, ALDERTON A L, et al. Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems[J]. Journal of Agricultural and Food Chemistry, 2006, 54(12): 4445-4451. DOI:10.1021/jf0531813 |
| [16] |
XU Y S, XIA W S, JIANG Q X. Aggregation and structural changes of silver carp actomyosin as affected by mild acidification with D-gluconic acid δ-lactone[J]. Food Chemistry, 2012, 134(2): 1005-1010. DOI:10.1016/j.foodchem.2012.02.216 |
| [17] |
AGYARE K K, XIONG Y L, ADDO K. Influence of salt and pH on the solubility and structural characteristics of transglutaminase-treated wheat gluten hydrolysate[J]. Food Chemistry, 2008, 107(3): 1131-1137. |
| [18] |
AGYARE K K, ADDO K, XIONG Y L. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81. DOI:10.1016/j.foodhyd.2007.11.012 |
| [19] |
JIANG S J, ZHAO X H. Transglutaminase-induced cross-linking and glucosamine conjugation of casein and some functional properties of the modified product[J]. International Dairy Journal, 2011, 21(4): 198-205. DOI:10.1016/j.idairyj.2010.12.004 |
| [20] |
韩敏义, 徐幸莲, 林丽军, 等. 兔骨骼肌肌球蛋白的纯化及溶液浊度和溶解度研究[J]. 食品科学, 2004, 25(12): 50-54. HAN M Y, XU X L, LIN L J, et al. Extraction and purification of myosin from rabbit skeletal muscles and its solution turbidity and solublility[J]. Food Science, 2004, 25(12): 50-54 (in Chinese). DOI:10.3321/j.issn:1002-6630.2004.12.006 |
| [21] |
KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science, 1993, 58(5): 1040-1046. DOI:10.1111/j.1365-2621.1993.tb06107.x |
| [22] |
WEN S Y, ZHOU G H, LI L, et al. Effect of cooking on in vitro digestion of pork proteins: a peptidomic perspective[J]. Journal of Agricultural and Food Chemistry, 2015, 63(1): 250-261. DOI:10.1021/jf505323g |
| [23] |
LI L, LIU Y, ZOU X Y, et al. In vitro protein digestibility of pork products is affected by the method of processing[J]. Food Research International, 2017, 92: 88-94. DOI:10.1016/j.foodres.2016.12.024 |
| [24] |
DONG Z Y, LI M Y, TIAN G, et al. Effects of ultrasonic pretreatment on the structure and functionality of chicken bone protein prepared by enzymatic method[J]. Food Chemistry, 2019, 299: 125103. DOI:10.1016/j.foodchem.2019.125103 |
| [25] |
齐宝坤, 李杨, 王中江, 等. 不同品种大豆分离蛋白Zeta电位和粒径分布与表面疏水性的关系[J]. 食品科学, 2017, 38(3): 114-118. QI B K, LI Y, WANG Z J, et al. Relationship between surface hydrophobicity and zeta potential as well as particle size distribution of soybean protein isolates from different varieties[J]. Food Science, 2017, 38(3): 114-118 (in Chinese). |
| [26] |
李亚丽, 许玉娟, 徐幸莲. 多酚对肌原纤维蛋白结构与功能特性的影响研究进展[J/OL]. 食品与发酵工业: 1-13. (2021-04-09)[2021-05-16]. https://kns.cnki.net/kcms/detail/detail.aspx?FileName=SPFX2021040800I&DbName=CAPJ2021. DOI: 10.13995/j.cnki.11-1802/ts.026950. LI Y L, XU Y J, XU X L. Research progress on the effect of polyphenols on the structural and functional properties of myofibrillar protein[J/OL]. Food and Fermentation Industries: 1-13. (2021-04-09)[2021-05-16]. https://kns.cnki.net/kcms/detail/detail.aspx?FileName=SPFX2021040800I&DbName=CAPJ2021. DOI: 10.13995/j.cnki.11-1802/ts.026950.(in Chinese) |
| [27] |
李弓中, 赵英, 王俊彤, 等. 超声处理对蛋清蛋白结构性质及蛋清液起泡性的影响[J]. 食品科学, 2019, 40(9): 68-75. LI G Z, ZHAO Y, WANG J T, et al. Effect of ultrasonic treatment on protein structure and physicochemical and foaming properties of liquid egg white[J]. Food Science, 2019, 40(9): 68-75 (in Chinese). |
| [28] |
贾娜, 刘丹, 谢振峰. 植物多酚与食品蛋白质的相互作用[J]. 食品与发酵工业, 2016, 42(7): 277-282. JIA N, LIU D, XIE Z F. The interactions of plant polyphenol and food proteins[J]. Food and Fermentation Industries, 2016, 42(7): 277-282 (in Chinese). |
| [29] |
BHAT Z F, MORTON J D, BEKHIT A E D A, et al. Emerging processing technologies for improved digestibility of muscle proteins[J]. Trends in Food Science & Technology, 2021, 110: 226-239. |
| [30] |
MAHAN D C, AZAIN M, CRENSHAW T D, et al. Supplementation of organic and inorganic selenium to diets using grains grown in various regions of the United States with differing natural Se concentrations and fed to grower-finisher swine[J]. Journal of Animal Science, 2014, 92(11): 4991-4997. DOI:10.2527/jas.2014-7735 |
| [31] |
CAO Y G, XIONG Y L. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry, 2015, 180: 235-243. DOI:10.1016/j.foodchem.2015.02.036 |
| [32] |
QUAN T H, BENJAKUL S, SAE-LEAW T, et al. Protein-polyphenol conjugates: antioxidant property, functionalities and their applications[J]. Trends in Food Science & Technology, 2019, 91: 507-517. |
| [33] |
WANG S X, ZHANG Y M, CHEN L, et al. Dose-dependent effects of rosmarinic acid on formation of oxidatively stressed myofibrillar protein emulsion gel at different NaCl concentrations[J]. Food Chemistry, 2018, 243: 50-57. DOI:10.1016/j.foodchem.2017.09.114 |
| [34] |
LI J L, ZHANG L, YANG Z Y, et al. Effects of different selenium sources on growth performance, antioxidant capacity and meat quality of local Chinese Subei chickens[J]. Biological Trace Element Research, 2018, 181(2): 340-346. DOI:10.1007/s12011-017-1049-4 |
| [35] |
张典. 没食子酸和绿原酸对磷酸化鸡胸肉肌原纤维蛋白性质的作用研究[D]. 硕士学位论文. 天津: 天津商业大学, 2019. ZHANG D. Effects of gallic acid and chlorogenic acid on the properties of phosphorylated myofibrin from chicken breast[D]. Master's Thesis. Tianjin: Tianjin University of Commerce, 2019. (in Chinese) |
| [36] |
杨豫菘. 茶多酚对羊肉肌原纤维蛋白凝胶体系功能特性的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2019. YANG Y S. Effects of tea polyphenols on the functional properties of mutton myofibrillar protein gel[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2019. (in Chinese) |
| [37] |
RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3/4): 137-150. |
| [38] |
EMMAMBUX N M, TAYLOR J R. Sorghum kafirin interaction with various phenolic compounds[J]. Journal of the Science of Food and Agriculture, 2003, 83(5): 402-407. DOI:10.1002/jsfa.1379 |
| [39] |
李柳清, 罗永巨, 肖俊, 等. 人工添加酵母硒对吉富罗非鱼肌肉蛋白、脂肪及氨基酸的影响[J]. 南方农业学报, 2020, 51(11): 2856-2864. LI L Q, LUO Y J, XIAO J, et al. Effects of artificial addition of yeast selenium on protein, fat and amino acids in muscle of GITF tilapia[J]. Journal of Southern Agriculture, 2020, 51(11): 2856-2864 (in Chinese). DOI:10.3969/j.issn.2095-1191.2020.11.030 |
| [40] |
唐敏, 宋俊霖, 李少宁, 等. 营养水平和酵母硒对烟台黑猪屠宰性能及肉品质的影响[J]. 中国畜牧杂志, 2018, 54(5): 84-90. TANG M, SONG J L, LI S N, et al. Effects of nutrient level and yeast selenium on slaughter performance and meat quality of Yantai black pigs[J]. Chinese Journal of Animal Science, 2018, 54(5): 84-90 (in Chinese). |
| [41] |
刘彩凤, 伏映萍. 日粮中添加硒对滩羊胴体品质的影响[J]. 安徽农业科学, 2013, 41(17): 7565-7567. LIU C F, FU Y P. Effects of adding selenium in the diet on the carcass quality of Tan sheep[J]. Journal of Anhui Agricultural Sciences, 2013, 41(17): 7565-7567 (in Chinese). DOI:10.3969/j.issn.0517-6611.2013.17.063 |
| [42] |
WANG W L, LI Y, ZHOU X R, et al. Changes in the extent and products of in vitro protein digestion during the ripening periods of Chinese dry-cured hams[J]. Meat Science, 2021, 171: 108290. DOI:10.1016/j.meatsci.2020.108290 |




