2. 中国农业大学动物科技学院, 北京 100193;
3. 河北农业大学动物科技学院, 保定 071001
2. College of Animal Science and Technology, China Agricultural University, Beijing 100193, China;
3. College of Animal Science and Technology, Agricultural University of Hebei, Baoding 071001, China
近年来我国草食动物畜牧业发展迅速,饲草料资源不足导致人畜争粮矛盾日益严重,冬季饲草料缺口问题尤为突出[1],在当地经济作物副产物的基础上开发非常规饲料是解决该问题的有效措施之一。菌糠是食用菌生产过程中产生的副产品,是一类数量多、适口性好、营养价值高、成本低廉且具有特定香味的优质饲料,但其合理利用率极低,大部分以焚烧或露天堆积的形式被处理,造成严重的环境污染[2]。因此,高效合理地利用菌糠资源是缓解饲料资源短缺、降低饲料成本、减轻环境压力及推进畜牧业发展进程的重要措施。前人研究表明,用杏鲍菇菌糠分别替代奶牛饲粮中11%~22%精饲料、肉牛精饲料中10%~20%玉米和肉羊粗饲料中30%~50%小麦秸秆,对动物机体及其生产性能均无不良影响[3];潘军[4]研究表明,用百灵菇菌糠替代饲粮中20%~60%麦秸,对育肥牛(西门塔尔杂交牛)生长性能有提高趋势,同时能降低饲料成本,提高饲料报酬和经济效益;刘多才[5]研究表明,用发酵菌糠替代奶牛饲粮中15%~20%精饲料,不影响奶牛产奶性能,同时能取得较好的经济效益;Youngkyoon等[6]研究表明,用菌糠(杏鲍菇或平菇)替代粗饲料中40%的稻草,对寒武黄牛瘤胃发酵和血液代谢产物无不良影响;Kim等[7]研究表明,在断奶犊牛饲粮中添加10%的发酵菌糠(平菇),能改善其生长性能。目前,关于发酵菌糠对育肥牛瘤胃微生物菌群结构和功能的影响尚未见报道。因此,本研究以育肥期西杂牛为研究对象,通过16S rRNA高通量测序技术研究发酵菌糠对育肥牛瘤胃菌群结构和功能的影响,为探索瘤胃微生物功能、发掘饲用发酵菌糠的优势菌群及发酵菌糠在肉牛生产中的应用提供科学依据。
1 材料与方法 1.1 试验动物与设计试验在湖北丰联佳沃农业科技有限公司进行,试验动物为西门塔尔牛×本地黄牛杂交牛。试验采用单因素试验设计,将18月龄、体重[(350±30) kg]接近且健康的育肥牛24头,随机分为3组,每组8头。对照组粗饲料以白酒糟、稻草和全株玉米青贮组成,记为白酒糟组(distiller’s grains, DG组)、试验I和II组分别用发酵菌糠替代对照组50%和100%白酒糟(干物质基础),分别记为白酒糟-发酵菌糠组(distiller’s grains-fermented spent mushroom substrate, DG-FSMS组)和发酵菌糠组(fermented spent mushroom substrate, FSMS组)。
1.2 试验饲粮白酒糟购自枝江酒厂。发酵菌糠是金针菇菌糠(购自武汉如意情金针菇场)加入发酵剂(每吨新鲜菌糠添加1011 CFU枯草芽孢杆菌、5×109 CFU活酵母、2 g乳酸菌)后,密封袋贮,常温发酵7 d,供整个试验用。基础饲粮的配制参考《日本饲养标准肉用牛》(2008),按照等能原则进行配制,试验饲粮组成及营养水平见表 1,白酒糟及发酵菌糠营养成分见表 2。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
|
|
表 2 白酒糟及发酵菌糠营养成分(风干基础) Table 2 Nutritional composition of distiller's grains and fermented spent mushroom substrate (air-dry basis) |
试验牛采用舍饲散养的方式,单栏饲养,试验牛统一管理,每天08:00和16:00定时饲喂全混和日粮,自由采食,自由饮水,保证日剩料量为投料量的5%左右,记录采食量,牛舍每2周消毒1次,试验期74 d,其中预试期14 d,正试期60 d。
1.4 瘤胃液的采集于正试期第60天晨饲前用口腔导管通过真空泵抽取瘤胃液,将采集的瘤胃液用4层纱布进行过滤后,装于已灭菌的离心管,立即投入液氮中,送回实验室后于-80 ℃冰箱保存,用于瘤胃发酵参数和微生物多样性检测。
1.5 瘤胃发酵参数的测定氨态氮(NH3-N)含量参照Broderick等[8]方法,利用碱性次氯酸钠-苯酚比色法测定。挥发性脂肪酸(VFA)含量利用气相色谱仪(GC-2010 plus,日本Shimadzu公司)测定。
1.6 微生物多样性的测定与分析将采集的瘤胃液样品送到苏州协云基因科技有限公司利用Illumina Hiseq 2500高通量测序平台进行测序,将测序后得的原始测序序列经过PE reads拼接、Tags过滤和Usearch软件(8.1.1861版本)的UCHME算法去除嵌合标记等得到最终有效序列,再使用QIIME软件(1.9.1版本)中的UCLUST算法将每个样本的标记按97%的相似度聚成操作分类单元(operational taxonomic unit, OTU),并将生成的OTU代表序列与微生物参考数据库进行对比得到每个OTU对应的物种分类信息,进而在各水平统计各样品群落组成,利用QIIME软件(1.9.1版本)生成不同分类(门和属)水平的物种分类表,使用Mothur软件(1.31.2版本)对样品α多样性指数进行评估。采用R软件(3.3.3版本)进行主坐标分析(principle coordination analysis, PCoA),通过重建未观测状态(phylogenetic investigation of communities by reconstruction of unobserved states, PICRUSt)对群落进行了系统发育调查预测宏基因组功能。
1.7 数据统计与分析数据经Excel 2010整理后,利用SPSS 23.0统计软件进行单因素方差分析(one-way ANOVA),用Duncan氏法进行多重比较,试验结果以“平均值±标准差”的形式表示。P < 0.05表示差异显著,P < 0.01表示差异极显著,P>0.05表示差异不显著。对于微生物多样性、微生物相对丰度和代谢通路相关功能基因数据进行非参数检验中的Kruskal-Wallis检验。
2 结果与分析 2.1 瘤胃发酵参数由表 3可知,发酵菌糠替代白酒糟对育肥牛瘤胃VFA(乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、总挥发性脂肪酸)和NH3-N含量和乙酸/丙酸均无显著影响(P>0.05)。
|
|
表 3 发酵菌糠替代白酒糟对育肥牛瘤胃发酵参数的影响 Table 3 Effects of replacing distiller's grains with fermented spent mushroom substrate on rumen fermentation parameters of fattening cattle |
测序分析发现,24份瘤胃液共获得有效序列1 629 727条,平均每个样品67 905条,不考虑处理效益,基于相似度大于97%的原则,对所有有效序列进行OTU聚类,再根据阈值为0.1%的中位数筛选后,共获217个OTU,其中3组间共享的OTU有215个。
2.3 门和属水平微生物组成分析由表 4可知,在门水平上,相对丰度>0.1%的门共有10个,DG、DG-FSMS和FSMS组共有优势菌门均为拟杆菌门和厚壁菌门,二者总量占总菌门的90%以上。DG-FSMS组TM7相对丰度显著低于FSMS组(P < 0.05),而DG-FSMS和FSMS组TM7相对丰度与DG组均无显著差异(P>0.05)。3组间其他菌门相对丰度均无显著差异(P>0.05)。
|
|
表 4 门水平菌群分布(占总细菌比例>0.1%) Table 4 Distribution of microflora at phylum level (proportion of total bacteria higher than 0.1%) |
由表 5可知,在属水平上,相对丰度>0.1%的共享属共有20个,分别源于7个门。DG、DG-FSMS和FSMS组共有的优势菌属均为普雷沃氏菌属。DG组瘤胃球菌属相对丰度显著高于DG-FSMS和FSMS组(P < 0.05),而DG-FSMS和FSMS组之间没有显著差异(P>0.05)。DG组假丁酸弧菌属相对丰度显著低于DG-FSMS组(P < 0.05),而与FSMS组差异不显著(P>0.05)。DG组脱硫弧菌属相对丰度极显著高于DG-FSMS组(P < 0.01),而与FSMS组差异不显著(P>0.05),FSMS组显著高于DG-FSMS组(P < 0.05)。
|
|
表 5 属水平菌群分布(占总细菌比例>0.1%) Table 5 Distribution of microflora at genus level (proportion of total bacteria higher than 0.1%) |
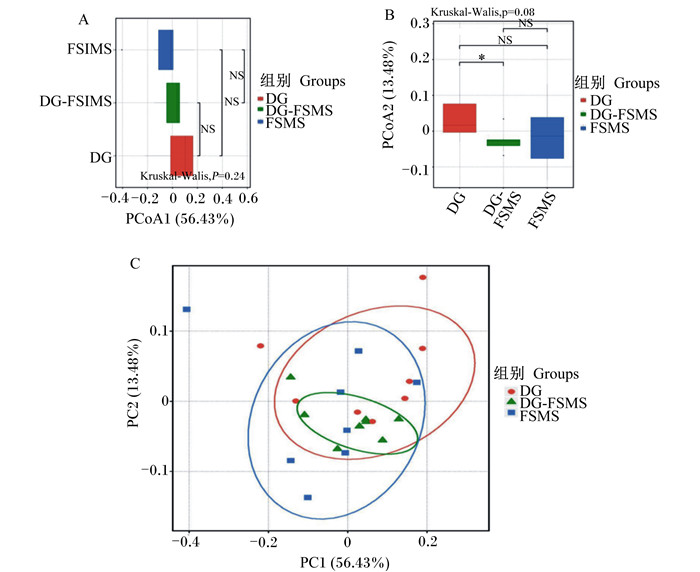
α多样性是对单个样品中物种多样性的分析,可以反映瘤胃微生物的丰富度和均匀度。由表 6可知,在同一测序深度,DG、DG-FSMS和FSMS组Observed_OTUs指数、Chao 1指数、香浓指数和辛普森指数均无显著差异(P>0.05)。β多样性主要是为了研究不同样品或组别之间的菌群结构差异,通过图中样品点的距离来判断个体或群体间的差异,样本点距离越远说明样品间微生物群落组成差异越大,距离越近说明样品间微生物群落组成越相似。如图 1-C所示,基于Weighted Unifrac加权距离主坐标分析,其中主成分1(PC1)和主成分2(PC2)对样品差异的贡献值分别为56.43%和13.48%,其中只有DG和DG-FSMS组的PC2差异显著(P < 0.05)(图 1-B),说明其微生物群落组成差异不大。
|
|
表 6 α多样性指数分析 Table 6 Analysis of α diversity indexes |
|
*表示差异显著(P < 0.05);NS表示差异不显著(P>0.05);PCoA1和PC1表示主成分1;PCoA2和PC2表示主成分2;Kruskal-Wallis表示秩和检验。 * mean significant difference(P < 0.05); NS mean no significant difference(P>0.05);PCoA1 and PC1 are principal component 1; PCoA2 and PC2 are principal component 2; Kruskal-Wallis is the KW test. 图 1 瘤胃微生物的主坐标分析图 Fig. 1 Principal co-ordinates analysis plot of microbiota |
对瘤胃微生物进行功能基因注释分析,将预测到的基因与KEGG数据库进行对比,通过Pathway层级分类统计发现,在第2层级中,3组间有4条代谢通路相关功能基因丰度有显著差异(P < 0.05),DG组脂类代谢极显著高于DG-FSMS和FSMS组(P < 0.01)。DG组其他氨基酸代谢和其他次生代谢产物的生物合成显著低于DG-FSMS和FSMS组(P < 0.05)。DG组遗传信息处理显著高于DG-FSMS和FSMS组(P < 0.05),这4条代谢通路相关功能基因丰度DG-FSMS和FSMS组之间均无显著差异(P>0.05)(表 7)。
|
|
表 7 FSMS、DG-FSMS和DG组之间瘤胃微生物KEGG二级代谢通路相关功能差异分析 Table 7 Analysis of functional difference of rumen microbiota KEGG metabolic pathway at level 2 among FSMS, DG-FSMS and DG groups |
由表 8可知,在第3层级中,3组共有24条代谢通路相关功能基因丰度有显著差异(P < 0.05),其中DG组RNA聚合酶、脂肪酸合成和丙酮酸代谢极显著高于DG-FSMS和FSMS组(P < 0.01),且DG-FSMS和FSMS组间无显著差异(P>0.05)。DG组脂肪酸代谢、糖酵解和糖质新生极显著高于DG-FSMS组(P < 0.01),显著高于FSMS组(P < 0.05),且DG-FSMS和FSMS组间无显著差异(P>0.05)。DG组氨基糖和核苷酸糖代谢、光合作用蛋白和光合作用极显著低于DG-FSMS和FSMS组(P < 0.01),且DG-FSMS和FSMS组间无显著差异(P>0.05)。DG组硫代谢、氰氨基酸代谢、鞘脂代谢、苯丙烷生物合成、其他离子耦合转运蛋白和硒化合物代谢显著低于DG-FSMS和FSMS组(P < 0.05),且DG-FSMS和FSMS组间无显著差异(P>0.05)。DG组丙酸酯代谢、丁酸酯代谢、苯甲酸酯降解和蛋白质翻译、四环素生物合成、氯烷和氯烯降解、缬氨酸、亮氨酸和异亮氨酸生物合成、磷酸戊糖途径和氨酰基-tRNA生物合成显著高于DG-FSMS和FSMS组(P < 0.05),且DG-FSMS和FSMS组间无显著差异(P>0.05)。DG组赖氨酸降解显著高于DG-FSMS组(P < 0.05),而与FSMS组间无显著差异(P>0.05)。
|
|
表 8 FSMS、DG-FSMS和DG组之间瘤胃微生物KEGG三级代谢通路相关功能差异分析 Table 8 Analysis of functional difference of rumen microbiota KEGG metabolic pathway at level 3 among FSMS, DG-FSMS and DG groups |
本研究中,发酵菌糠干物质(40.59%)和中性洗涤纤维(58.89%)含量与白酒糟干物质(40.05%)和中性洗涤纤维(58.04%)含量相近,而发酵菌糠粗蛋白质含量(11.12%)比白酒糟(14.09%)少2.97%,而发酵菌糠酸性洗涤纤维含量(38.08%)比白酒糟(36.12%)多1.96%,用发酵菌糠替代白酒糟后,各组饲粮中除干物质含量相差为1.97%外,其他养分含量相差均 < 1.10%,对基础饲粮主要组成成分影响不大。本研究中,通过对两者主要营养物质含量分析,表明发酵菌糠替代白酒糟在主要营养物质水平上不影响饲粮主要营养水平,可进行直接替代。
3.2 发酵菌糠替代白酒糟对育肥牛瘤胃发酵参数的影响瘤胃内环境的稳定对于育肥牛的健康至关重要,而氨态氮和VFA是评价瘤胃内环境的主要指标之一,也反映瘤胃发酵状况和健康水平[9]。史陈博等[10]研究表明,在饲粮中添加杏鲍菇菌糠能提高湖羊瘤胃液总挥发性脂肪酸和乙酸的含量,而在本研究中,发酵菌康替代白酒糟对育肥牛瘤胃VFA含量均无显著影响,可能原因是史陈博等[10]是直接在饲粮中添加不同比例(20%、25%和30%)杏鲍菇菌糠,各组饲粮中纤维含量差异较大(对照组、20%组、25%组和30%组NDF和ADF含量分别为:35.13%、39.66%、40.79%和41.91%,23.50%、26.14%、26.79%和27.44%)[10]。而本研究是用发酵菌糠替代饲粮中白酒糟,各组饲粮中纤维含量相近,对瘤胃VFA含量的影响结果不一致。本研究结果表明,用发菌糠替代白酒糟不会影响VFA和氨态氮含量,说明发酵菌糠可以作为肉牛非常规粗饲料资源进行开发利用。
3.3 发酵菌糠替代白酒糟对育肥牛瘤胃中微生物菌群的影响瘤胃微生物主要分为细菌、原虫和真菌三大类,它们只有在严格厌氧条件下才能降解植物纤维、非纤维碳水化合物和蛋白等,产生VFA和氨态氮,为机体提供能量和碳源[11-12]。高通量测序技术作为一种研究微生物生态学的全新技术手段,可全面地反映样品微生物的结构与组成[13]。本研究以育肥期西杂牛为研究对象,利用16S rRNA高通量测序技术探讨发酵菌糠替代白酒糟对育肥期西杂牛瘤胃微生物多样性的影响。本研究中3组瘤胃液从共享的OTU(占OTU总数的99.08%)、α多样性指数分析,组间菌群物种组成相似性很高,除β多样性分析中DG和DG-FSMS组PC2差异显著外,发酵菌糠替代育肥期肉牛饲粮中的白酒糟在瘤胃微生物组成和多样性方面无不良影响,为发酵菌糠在肉牛生产中的应用提供了一定的科学依据。
前人研究发现,在门水平上,水牛、云南大额牛、草原红牛、西门塔尔牛、奶水牛和水牛瘤胃优势菌门中均含有拟杆菌门和厚壁菌门[14-19],表明牛瘤胃优势菌门(拟杆菌门和厚壁菌门)不受物种、年龄和饲粮成分的影响,本研究结果表明,3组育肥牛瘤胃优势菌门均为拟杆菌门和厚壁菌门,与前人研究结果一致。本研究中,非优势菌门TM7相对丰度为1.962%,含量较低,与前人研究结果相似,但其在瘤胃中的作用尚不清楚[20]。发酵菌糠对其他菌门也无显著影响,这表明发酵菌糠替代白酒糟对育肥牛瘤胃中相对丰度>0.1%菌门无不良影响,为发酵菌糠在肉牛饲粮中的应用提供了可能。
在属水平上,研究发现普雷沃氏菌属是瘤胃中优势菌属,且其优势地位与饲粮结构无关[21-24],普雷沃氏菌属虽不能分解纤维素,但可以降解瘤胃中的蛋白质和淀粉等高分子物质,是主要的蛋白降解菌之一[25]。本研究结果表明,FSMS、DG-FSMS和DG组育肥牛瘤胃中的优势菌属均为普雷沃氏菌属,这与前人研究结果[21-24]一致,表明发酵菌糠替代白酒糟对育肥牛瘤胃优势菌属无显著影响;瘤胃球菌属是瘤胃中主要的纤维降解菌,其所含的白色瘤胃球菌和黄色瘤胃球菌可分泌大量的纤维素酶和半纤维素酶[26]。本研究中,随着发酵菌糠替代白酒糟的比例增加,育肥牛瘤胃中瘤胃球菌属相对丰度显著下降,可能因为菌糠中含有一定量具有降解纤维素和木质素能力的饲用酶(纤维素酶和木聚酶等)[27-28],被育肥牛采食后,能起到类似瘤胃中瘤胃球菌属细菌的作用,从而满足肉牛对饲粮中纤维物质吸收利用的要求。假丁酸弧菌属、丁酸弧菌属和普雷沃氏菌属的数量与VFA的产生有关[29-31],程明等[32]研究表明,在饲粮中添加杏鲍菇菌糠能提高湖羊瘤胃液总挥发性脂肪酸、丁酸和乙酸的含量。本研究结果表明,丁酸弧菌属和普雷沃氏菌属相对丰度各组间均无显著差异,DG-FSMS组假丁酸弧菌属相对丰度显著高于DG组,但各组VFA含量无显著变化,间接表明VFA的产生还与其他菌属有关。脱硫弧菌属是菌群中主要的硫酸盐还原菌(sulfate reducting bacteria, SRB),SRB在厌氧呼吸过程中将硫酸盐还原为硫化氢,干扰上皮细胞氧化代谢,可能导致上皮细胞损伤死亡以及黏膜炎症[33-34]。Rowan等[35]研究发现,溃疡性结肠炎患者结肠脱硫弧菌属相对丰度显著增加。在本试验中,DG-FSMS组脱硫弧菌属相对丰度显著低于DG和FSMS组,表明用发酵菌糠替代50%白酒糟可能更有利于育肥牛瘤胃健康。从属水平上可知,饲喂发酵菌糠替代50%白酒糟饲粮比饲喂替代100%白酒糟饲粮对育肥牛瘤胃微生物菌群结构影响更小,且可能更利于育肥牛瘤胃健康。
3.4 发酵菌糠替代白酒糟对育肥牛瘤胃微生物功能的影响瘤胃微生物作为瘤胃发酵的领导者,可将反刍动物采食的饲粮大分子分解为小分子物质,不仅可以为自身的生长繁殖提供能量,还可加快饲粮降解[36],挖掘与重要营养生理功能相关的瘤胃菌群功能基因是提高反刍动物消化吸收的有效措施。KEGG分析是基于KEGG通路数据库,从复杂的代谢网络调控出发,对差异基因进行代谢通路富集分析,是研究生物功能的重要手段[37],PICRUSt能将不可视的微生物通过与KEGG等数据库比对和生物功能联系起来[38]。本研究通过PICRUSt对FSMS、FSMS-DG和DG组所测的微生物与KEGG数据库进行对比发现,在第2层级中,用发酵菌糠替代白酒糟降低了脂类代谢和遗传信息处理相关功能基因丰度,提高了其他氨基酸代谢和其他次生代谢产物的生物合成相关功能基因丰度。进一步分析第3层级发现,用发酵菌糠替代白酒糟主要降低了丙酮酸代谢、脂肪酸代谢、脂肪酸合成、糖酵解和糖质新生、磷酸戊糖途径、氨酰基-tRNA生物合成、蛋白质翻译和缬氨酸,亮氨酸和异亮氨酸生物合成等相关功能基因的丰度,同时提高了氨基糖和核苷酸糖代谢和其他离子耦合转运蛋白等相关功能基因丰度,这说明饲喂发酵菌糠改变了育肥牛瘤胃中与碳水化合物、脂类、能量和氨基酸代谢等与新陈代谢有关的微生物。有研究发现,氨基酸代谢和次生代谢产物的合成代谢主要受饲粮中粗饲料水平的影响[37],本研究在相同的粗饲料水平下,推测造成这些代谢通路的差异可能与瘤胃中瘤胃球菌属和假丁酸弧菌属等能降解纤维物质,产生VFA的细菌相对丰度变化有关。
4 结论本研究表明,饲喂发酵菌糠替代饲粮中白酒糟对育肥牛瘤胃中VFA和氨态氮含量、微生物多样性、优势菌门和菌属均无显著影响,仅改变了部分菌属和代谢通路相关功能基因的相对丰度;本研究中,用发酵菌糠部分替代(50%)白酒糟饲喂育肥牛对瘤胃微生物菌群结构影响更小,推荐生产中发酵菌糠替代白酒糟量以50%为宜。
| [1] |
张振玲, 张海涛, 张善芳. 非常规植物源饲料添加对育肥猪影响的研究[J]. 家畜生态学报, 2019, 40(2): 86-89. ZHANG Z L, ZHANG H T, ZHANG S F. The effect of additive of unconventional plant feed on fattening pigs[J]. Acta Ecologae Animalis Domastici, 2019, 40(2): 86-89 (in Chinese). DOI:10.3969/j.issn.1673-1182.2019.02.016 |
| [2] |
唐阳阳, 段雨, 袁崇善, 等. 菌糠饲料应用价值及加工处理方法研究进展[J]. 家畜生态学报, 2019, 40(10): 88-90. TANG Y Y, DUAN Y, YUAN C S, et al. Processing and treatment of spent mushroom substrate as animal feed[J]. Acta Ecologae Animalis Domastici, 2019, 40(10): 88-90 (in Chinese). DOI:10.3969/j.issn.1673-1182.2019.10.016 |
| [3] |
刘志芳, 王建武, 杨瑞基, 等. 杏鲍菇菌糠对奶牛、肉牛、肉羊饲喂效果研究[J]. 饲料工业, 2013, 34(9): 33-37. LIU Z F, WANG J W, YANG R J, et al. Study on feeding effect of Pleurotus eryngii chaff on dairy cows beef cattle and mutton sheep[J]. Feed Industry, 2013, 34(9): 33-37 (in Chinese). |
| [4] |
潘军. 菌糠营养价值评定及其在肉牛日粮中的应用研究[D]. 硕士学位论文. 郑州: 河南农业大学, 2010. PAN J. Study on nutritional evaluation of spent mushroom substrate and its utilization in beef cattle diet[D]. Master's Thesis. Zhengzhou: Henan Agricultural University, 2010. (in Chinese) |
| [5] |
刘多才. 菌糠饲料在奶牛养殖中的应用研究[J]. 饲料工业, 2011, 32(7): 52-53. LIU D C. Study on application of fungus bran feed in dairy cattle breeding[J]. Feed Industry, 2011, 32(7): 52-53 (in Chinese). DOI:10.3969/j.issn.1001-991X.2011.07.015 |
| [6] |
YOUNGKYOON O, WONMAN L, CHANGWEON C, et al. Effects of spent mushroom substrates supplementation on rumen fermentation and blood metabolites in Hanwoo steers[J]. Asian-Australasian Journal of Animal Sciences, 2010, 23(12): 1608-1613. DOI:10.5713/ajas.2010.10200 |
| [7] |
KIM K K, LEE H G, PARK J A, et al. Recycling of fermented sawdust-based oyster mushroom spent substrate as a feed supplement for postweaning calves[J]. Asian-Australasian Journal of Animal Sciences, 2011, 24(4): 493-499. DOI:10.5713/ajas.2011.10333 |
| [8] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63(1): 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [9] |
周瑞, 刘立山, 吴建平, 等. 牛至精油对绵羊瘤胃体外养分降解率、发酵特性及CH4产量的影响[J]. 草业学报, 2019, 28(11): 168-176. ZHOU R, LIU L S, WU J P, et al. Effects of oregano essential oil on nutrient degradability, rumen fermentation, and CH4 production in sheep[J]. Acta Prataculturae Sinica, 2019, 28(11): 168-176 (in Chinese). DOI:10.11686/cyxb2019124 |
| [10] |
史陈博, 安世钰, 赵洁, 等. 日粮中添加杏鲍菇菌糠对湖羊生长性能、瘤胃发酵和瘤胃发育的影响[J]. 南京农业大学学报, 2020, 43(6): 1063-1071. SHI C B, AN S Y, ZHAO J, et al. Effects of adding Pleurotus eryngii substrate to diet on growth performance, rumen fermentation characteristics and rumen development of Hu sheep[J]. Journal of Nanjing Agricultural University, 2020, 43(6): 1063-1071 (in Chinese). |
| [11] |
KIM M, MORRISON M, YU Z T. Status of the phylogenetic diversity census of ruminal microbiomes[J]. FEMS Microbiology Ecology, 2011, 76(1): 49-63. DOI:10.1111/j.1574-6941.2010.01029.x |
| [12] |
张永根, 王一臻, 李洋, 等. 地顶孢霉培养物对奶牛瘤胃发酵、微生物区系及血液生化指标影响[J]. 东北农业大学学报, 2016, 47(8): 60-66. ZHANG Y G, WANG Y Z, LI Y, et al. Effect of Acremonium terricola culture on ruminal fermentation, microflora and blood biochemical parameters in dairy cows[J]. Journal of Northeast Agricultural University, 2016, 47(8): 60-66 (in Chinese). DOI:10.3969/j.issn.1005-9369.2016.08.008 |
| [13] |
马力, 徐世晓, 刘宏金, 等. 不同物候期牧草对放牧牦牛瘤胃内环境参数及瘤胃微生物多样性的影响[J]. 动物营养学报, 2019, 31(2): 681-691. MA L, XU S X, LIU H J, et al. Effects of forage grass in different phenological periods on ruminal environment parameters and rume microbial diversity of free-range yak (Bos grunniens)[J]. Chinese Journal of Animal Nutrition, 2019, 31(2): 681-691 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.02.024 |
| [14] |
SINGH K M, AHIR V B, TRIPATHI A K, et al. Metagenomic analysis of Surti buffalo (Bubalus bubalis) rumen: a preliminary study[J]. Molecular Biology Reports, 2012, 39(4): 4841-4848. DOI:10.1007/s11033-011-1278-0 |
| [15] |
周熊艳, 王松明, 顾招兵, 等. 云南大额牛瘤胃微生物多样性分析[J]. 中国畜牧兽医, 2016, 43(5): 1162-1168. ZHOU X Y, WANG S M, GU Z B, et al. Diversity analysis of rumen microbes in Yunnan gayals (Bos frontalis)[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(5): 1162-1168 (in Chinese). |
| [16] |
吴琼, 王思珍, 张适, 等. 基于16S rRNA高通量测序技术分析草原红牛瘤胃微生物多样性和功能预测的研究[J]. 畜牧与兽医, 2020, 52(1): 62-67. WU Q, WANG S Z, ZHANG S, et al. Analysis of microbial diversity the rumen of grassland red cattle and prediction of the function of the microbes based on the 16s rRNA high-throughput sequencing technology[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(1): 62-67 (in Chinese). |
| [17] |
吴琼, 王思珍, 张适, 等. 基于16S rRNA高通量测序技术分析中国西门塔尔牛瘤胃微生物多样性和功能预测的研究[J]. 中国畜牧兽医, 2019, 46(5): 1370-1378. WU Q, WANG S Z, ZHANG S, et al. Analysis of rumen microbial diversity and functional prediction of Chinese simmental cattle based on 16S rRNA high-throughput sequencing technology[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(5): 1370-1378 (in Chinese). |
| [18] |
彭科兰, 任大喜, 刘建新. 不同年龄奶水牛瘤胃菌群多样性研究[J]. 动物营养学报, 2019, 31(11): 5053-5064. PENG K L, REN D X, LIU J X. Diversity of rumen microflora in dairy buffaloes at different ages[J]. Chinese Journal of Animal Nutrition, 2019, 31(11): 5053-5064 (in Chinese). |
| [19] |
张会会, 李孟伟, 唐振华, 等. 夏季补饲半胱氨酸和烟酸铬对水牛泌乳性能, 抗氧化性能, 瘤胃发酵参数和微生物多样性的影响[J]. 动物营养学报, 2020, 32(12): 5760-5777. ZHANG H H, LI M W, TANG Z H, et al. Effects of supplemental feeding of cysteamine and chromium nicotinate on lactation performance, antioxidant performance, rumen fermentation parameters and microbial diversity of buffalo in summer[J]. Chinese Journal of Animal Nutrition, 2020, 32(12): 5760-5777 (in Chinese). |
| [20] |
LEE C, COPELIN J E, PARK T, et al. Effects of diet fermentability and supplementation of 2-hydroxy-4-(methylthio)-butanoic acid and isoacids on milk fat depression: 2.Ruminal fermentation, fatty acid, and bacterial community structure[J]. Journal of Dairy Science, 2021, 104(2): 1604-1619. DOI:10.3168/jds.2020-18950 |
| [21] |
赵娜, 杨雪海, 陈芳, 等. 青贮饲用油菜对育肥期山羊瘤胃发酵参数及微生物多样性的影响[J]. 草业学报, 2019, 28(9): 146-154. ZHAO N, YANG X H, CHEN F, et al. Effect of silage feeding rape on the rumen fermentation parameters and microbial diversity of goats[J]. Acta Prataculturae Sinica, 2019, 28(9): 146-154 (in Chinese). |
| [22] |
李岚捷, 成述儒, 刁其玉, 等. 不同NFC/NDF水平饲粮对犊牛瘤胃发酵参数和微生物区系多样性的影响[J]. 畜牧兽医学报, 2017, 48(12): 2347-2357. LI L J, CHENG S R, DIAO J Y, et al. Effects of diets with different NFC/NDF levels on the rumen fermentation parameters and bacterial community in male calves[J]. Acta Veterinaria Et Zootechnica Sinica, 2017, 48(12): 2347-2357 (in Chinese). DOI:10.11843/j.issn.0366-6964.2017.12.014 |
| [23] |
JAMI E, MIZRAHI I. Composition and similarity of bovine rumen microbiota across individual animals[J]. PLoS One, 2012, 7(3): e33306. DOI:10.1371/journal.pone.0033306 |
| [24] |
郭凯, 唐梦琪, 霍倩倩, 等. 不同蛋白水平饲粮对犊牛瘤胃微生物区系多样性及组成的影响[J]. 家畜生态学报, 2019, 40(11): 22-28. GUO K, TANG M Q, HUO Q Q, et al. Effects of diets with different protein level on rumen bacterial community in calves[J]. Acta Ecologae Animalis Domastici, 2019, 40(11): 22-28 (in Chinese). DOI:10.3969/j.issn.1673-1182.2019.11.005 |
| [25] |
AVGUSTIN G, WALLACE R J, FLINT H J. Phenotypic diversity among ruminal isolates of Prevotella ruminicola: proposal of Prevotella brevis sp. nov., Prevotella bryantii sp. nov., and Prevotella albensis sp. nov. and redefinition of Prevotella ruminicola[J]. International Journal of Systematic Bacteriology, 1997, 47(2): 284-288. DOI:10.1099/00207713-47-2-284 |
| [26] |
DOERNER K C, WHITE B A. Assessment of the endo-1, 4-beta-glucanase components of Ruminococcus flavefaciens FD-1[J]. Applied and Environmental Microbiology, 1990, 56(6): 1844-1850. DOI:10.1128/aem.56.6.1844-1850.1990 |
| [27] |
张坚. 菌糠饲用酶制剂的研究[D]. 硕士学位论文. 长沙: 湖南农业大学, 2007. ZHANG J. Studies on feed enzyme preparation deriving from cultural residue of edible fungi[D]. Master's Thesis. Changsha: Hunan Agricultural University, 2007. (in Chinese) |
| [28] |
张国庆, 董晓芳, 王贺祥, 等. 8种食用菌菌渣中3种饲用酶活性的测定[J]. 中国食用菌, 2009, 28(5): 28-29, 56. ZHANG G Q, DONG X F, WANG H X, et al. Three kinds of feed enzymes activity of eight mushroom residue[J]. Edible Fungi of China, 2009, 28(5): 28-29, 56 (in Chinese). DOI:10.3969/j.issn.1003-8310.2009.05.011 |
| [29] |
PATRA A K, YU Z. Effects of vanillin, quillaja saponin, and essential oils on in vitro fermentation and protein-degrading microorganisms of the rumen[J]. Applied Microbiology and Biotechnology, 2014, 98(2): 897-905. DOI:10.1007/s00253-013-4930-x |
| [30] |
MITSUMORI M, SUN W. Control of rumen microbial fermentation for mitigating methane emissions from the rumen[J]. Asian-Australasian Journal off Animal Sciences, 2008, 21(1): 144-154. DOI:10.5713/ajas.2008.r01 |
| [31] |
李晨, AHMAD A A, 张建搏, 等. 冷季与暖季对牦牛放牧行为及瘤胃微生物多样性的影响[J]. 中国畜牧兽医, 2020, 47(7): 2312-2324. LI C, AHMAD A A, ZHANG J B, et al. Effect of cold and warm season on grazing behavior and rumen microbial diversity of free range yak[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(7): 2312-2324 (in Chinese). |
| [32] |
程明, 王彩凤. 湖羊、山羊饲料中添加不同比例杏鲍菇菌糠饲喂效果试验[J]. 中国畜牧业, 2020(18): 60-62. CHENG M, WANG C F. Feeding effect experiment of different proportion of Pleurotus eryngii chaff in feed of sheep and goats[J]. China Animal Industry, 2020(18): 60-62 (in Chinese). DOI:10.3969/j.issn.2095-2473.2020.18.039 |
| [33] |
FLORIN T, NEALE G, GIBSON G, et al. Metabolism of dietary sulphate: absorption and excretion in humans[J]. Gut, 1991, 32(7): 766-773. DOI:10.1136/gut.32.7.766 |
| [34] |
ROEDIGER W, MOORE J, BABIDGE W. Colonic sulfide in pathogenesis and treatment of ulcerative colitis[J]. Digestive Diseases and Sciences, 1997, 42(8): 1571-1579. DOI:10.1023/A:1018851723920 |
| [35] |
ROWAN F, DOCHERTY N G, MURPHY M, et al. Desulfovibrio bacterial species are increased in ulcerative colitis[J]. Diseases of the Colon and Rectum, 2010, 53(11): 1530-1536. DOI:10.1007/DCR.0b013e3181f1e620 |
| [36] |
王玉强, 赵倩明, 沈宇, 等. 日粮中添加米糠和玉米胚芽粕对泌乳奶牛瘤胃发酵及微生物菌群的影响[J]. 扬州大学学报(农业与生命科学版), 2019, 40(3): 65-71. WANG Y Q, ZHAO Q M, SHEN Y, et al. Effects of rice bran and corn germ meal on rumen fermentation and microbial flora in lactating dairy cows[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 2019, 40(3): 65-71 (in Chinese). |
| [37] |
耿亚楠. 日粮精粗比对奶山羊泌乳性能、血液生化指标和瘤胃微生物区系的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2020. GENG Y N. Effects of dietary forage to concentrate ratio on milk performance, blood biochemical indexes and rumen microflora in dairy goats[D]. Master's Thesis. Yangling: Northwest A&F University, 2020. (in Chinese) |
| [38] |
金洁, 张飞燕, 谢丽分, 等. 利用Illumina测序技术分析圈养成年滇金丝猴肠道菌群多样性[J]. 野生动物学报, 2019, 40(3): 563-570. JIN J, ZHANG F Y, XIE L F, et al. Analysis of the gut microflora diversity of captive adult snub-nosed monkeys by Illumina high-throughput sequencing[J]. Chinese Journal of Wildlife, 2019, 40(3): 563-570 (in Chinese). DOI:10.3969/j.issn.1000-0127.2019.03.005 |




