谷物类饲料富含的淀粉是畜禽的主要能量来源,具有促进动物生长和影响机体代谢活动的作用[1]。淀粉的消化吸收和代谢对畜禽的健康和生长起着重要作用[2]。玉米中淀粉含量高达60.9%,粗灰分和粗纤维含量较低,粗脂肪含量较高[3-4]。燕麦籽粒中淀粉含量为50%~65%,同时富含蛋白质、脂肪等营养物质[5-6]。大麦中淀粉含量为50%~70%,具有较低的粗脂肪和粗纤维含量[7-8]。赵金标等[9]以玉米、红薯干粉和豌豆粉为原料饲喂生长猪,发现不同的淀粉类型影响了生长猪体内能量利用效率和营养物质消化率。Sun等[10]研究表明,给生长育肥猪长期饲喂含有生土豆淀粉的饲粮可显著改变后肠微生物组成。同时也有研究显示,与补饲玉米和糯米淀粉相比,补饲土豆淀粉能够显著提高育肥猪肠道有益菌数量[11]。马属动物在断奶时所需的能量主要来源于谷物和纤维饲料。由于谷物中淀粉组成、颗粒、晶体结构等不同,导致马对淀粉的消化率存在差异[12]。大量未被酶消化的谷物淀粉到达后肠,会对后肠微生物结构组成产生怎样的影响尚不清楚。因此,本研究在相同营养水平条件下,以断奶马驹为研究对象,通过补喂不同谷物淀粉探究其对盲肠菌群结构、种类和数量的影响,为断奶马驹谷物饲粮科学合理使用提供理论参考。
1 材料与方法 1.1 试验时间和地点试验于2019年8—10月在新疆昭苏县喀拉苏镇兴昭牧业场进行。
1.2 试验动物选择出生日期(2019年3月出生,±5 d)相近、兽医检测健康的18匹哈萨克雄性马驹,5月龄断奶。
1.3 试验设计将18匹5月龄断奶哈萨克马驹按照体重[(112.36±7.50) kg]相近的原则随机分为3组,每组6匹。在相同的粗饲料条件下,以谷物淀粉摄入量相同为原则,按照每头马驹每千克体重补喂谷物淀粉2 g(干物质基础),试验Ⅰ组补喂含有蒸汽压片玉米的精料补充料,试验Ⅱ组补喂含有蒸汽压片燕麦的精料补充料,试验Ⅲ组补喂含有蒸汽压片大麦的精料补充料。按照马驹的体重以及精料补充料的配方,计算出实际的精料补充料的补喂量。试验第1天和第30天早晨马驹空腹时各称量1次体重,调整精料补充料的补喂量。试验第1天马驹平均体重为(112.36±7.50) kg,1~30 d按照此平均体重进行补喂,试验Ⅰ组、试验Ⅱ组、试验Ⅲ组精料补充料补喂量分别为650、660、660 g,试验第30天马驹平均体重为(126.75±5.58) kg,31~60 d按照此平均体重进行补喂,试验Ⅰ组、试验Ⅱ组、试验Ⅲ组精料补充料补喂量分别为710、720、720 g。试验期60 d。
1.4 饲养管理及精料补充料组所有马匹在试验前使用伊维菌素(Ivermectin)驱虫剂进行驱虫,按照体重0.2 mg/kg的剂量口服。09:00—21:00马驹室外活动饲养,将全天的精料补充料平均分成3等份,分别在09:00、15:00和21:00使用料兜进行饲喂。马驹在活动场(80 m×40 m)自由活动,单槽位自由采食粗饲料(苜蓿和干草2∶1均匀混合饲喂)6 kg。21:00至第2天09:00马驹室内单圈舍饲养(4 m×3 m,内置垫草),并提供粗饲料和清洁的饮水。精料补充料组成及营养水平见表 1。
|
|
表 1 精料补充料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of concentrate supplements (DM basis) |
精料补充料由蒸汽压片谷物和豆粕、磷酸氢钙、石灰石、食盐和预混料组成。其中谷物按照精料补充料组成比例进行压片加工,豆粕、磷酸氢钙、石灰石、食盐和预混料制成颗粒饲料。将每组马驹每天的补喂量按照2部分的比例精确称重,混合后放入每匹马驹专用料兜中饲喂。
1.5 样品采集在试验第60天时进行屠宰,早晨在马驹空腹时安乐处死,放血,随后参照解刨学方法,分别在食管与胃贲门口处、胃幽门口与小肠连接处、回盲口及盲结口处用棉线绳结扎,分离盲肠,迅速取盲肠内混合内容物分装于数个无菌EP管中,液氮速冻后放置于-80 ℃冰箱中保存待测。用高通量测序技术检测盲肠内容物菌群多样性。
1.6 样品测定总DNA提取、PCR扩增和Illumina MiSeq测序及结果分析均委托北京诺禾致源生物信息科技有限公司协助完成,以基因组DNA为模板,采用通用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增细菌16S rDNA V3~V4区,PCR扩增结束后,对PCR产物进行琼脂糖电泳。以扩增产物为模板,采用TruSeq Nano DNA LT Library Prep Kit,按照说明书进行操作,制备测序文库。通过Illumina MiSeq高通量测序技术平台进行2×300 bp双端测序。
1.7 数据统计分析在Excel 2010中先将数据进行预处理,再使用SPSS 18.0软件进行单因素方差分析,并采用Duncan氏法进行各组之间多重比较,试验结果均以平均值±标准差(mean±SD)表示。P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果与分析 2.1 基于操作分类单元(OTU)的alpha多样性与韦恩图分析由表 2可知,各组之间Chao1指数、ACE指数、Shannon指数和Simpson指数均无显著差异(P>0.05),其中,试验Ⅲ组和试验Ⅰ组Chao1指数高于试验Ⅱ组,试验Ⅰ组ACE指数高于试验Ⅱ组和试验Ⅲ组。各组覆盖度均超过0.98,说明各组数据能准确反映断奶马驹盲肠微生物菌群的组成。
|
|
表 2 不同谷物淀粉对断奶马驹盲肠菌群alpha多样性的影响 Table 2 Effects of different cereal starches on cecal microflora alpha diversity of weaned foals |
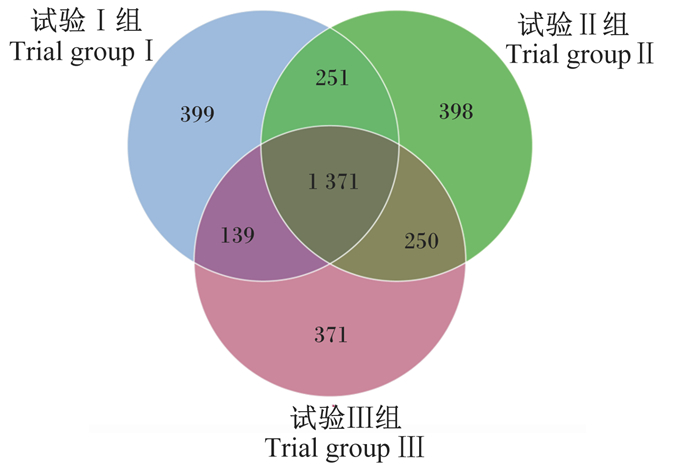
如图 1所示,韦恩图显示了3组之间的共有OTU数量,以及各组特有的OTU数量。3组共有的OTU数量为1 371个,试验Ⅰ组特有的OTU数量为399个,试验Ⅱ组特有的OTU数量为398个,试验Ⅲ组特有的OTU数量为371个。试验Ⅰ组特有的OTU数量高于试验Ⅱ组和试验Ⅲ组,这表明在试验Ⅰ组中检测到更多的细菌种类。
|
图 1 基于OTU的韦恩图分析 Fig. 1 Venn diagram analysis based on OTU |
由表 3可知,断奶马驹盲肠内容物中门水平相对丰度前10的物种为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、螺旋体门(Spirochaetes)、疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)、纤维杆菌门(Fibrobacteres)、放线菌门(Actinobacteria)、Melainabacteria、软壁菌门(Tenericutes)、蓝藻菌门(Cyanobacteria)。其中97%以上是拟杆菌门、厚壁菌门、螺旋体门、疣微菌门、变形菌门。试验Ⅲ组拟杆菌门相对丰度极显著高于试验Ⅰ组和试验Ⅱ组(P < 0.01);试验Ⅱ组厚壁菌门相对丰度极显著高于试验Ⅲ组(P < 0.01),试验Ⅰ组显著高于试验Ⅲ组(P < 0.05);试验Ⅰ组放线菌门相对丰度极显著高于试验Ⅱ组和试验Ⅲ组(P < 0.01);试验Ⅰ组蓝藻菌门相对丰度显著高于试验Ⅱ组和试验Ⅲ组(P < 0.05)。
|
|
表 3 不同谷物淀粉对断奶马驹盲肠菌群门水平物种相对丰度的影响 Table 3 Effects of different cereal starches on cecal microflora species relative abundance at phylum level of weaned foals |
由表 4可知,断奶马驹盲肠内容物中科水平相对丰度前10的物种为乳杆菌科(Lactobacillaceae)、螺旋体科(Spirochaetaceae)、普雷沃氏菌科(Prevotellaceae)、毛螺旋菌科(Lachnospiraceae)、链球菌科(Streptococcaceae)、艾克曼菌科(Akkermansiaceae)、瘤胃球菌科(Ruminococcaceae)、肠杆菌科(Enterobacteriaceae)、未经鉴定的梭菌目(unidentified_Clostridiales)、理研菌科(Rikenellaceae)。试验Ⅱ组乳杆菌科相对丰度极显著高于试验Ⅲ组(P < 0.01),试验Ⅰ组显著高于试验Ⅲ组(P < 0.05);试验Ⅱ组普雷沃氏菌科相对丰度显著高于试验Ⅰ组(P < 0.05);试验Ⅲ组毛螺旋菌科相对丰度显著高于试验Ⅰ组和试验Ⅱ组(P < 0.05);试验Ⅰ组链球菌科相对丰度极显著高于试验Ⅲ组(P < 0.01)。
|
|
表 4 不同谷物淀粉对断奶马驹盲肠菌群科水平物种相对丰度的影响 Table 4 Effects of different cereal starches on cecal microflora species relative abundance at family level of weaned foals |
如表 5可知,断奶马驹盲肠内容物中属水平相对丰度前10的物种为乳酸杆菌属(Lactobacillus)、未经鉴定的螺旋体科(unidentified_Spirochaetaceae)、链球菌属(Streptococcus)、阿克曼氏菌属(Akkermansia)、未经鉴定的肠杆菌科(unidentified_Enterobacteriaceae)、未经鉴定的梭菌目、八叠球菌属(Sarcina)、拟普雷沃菌属(Alloprevotella)、乳球菌属(Lactococcus)、纤维杆菌属(Fibrobacter)。试验Ⅱ组乳酸杆菌属相对丰度极显著高于试验Ⅲ组(P < 0.01),试验Ⅰ组显著高于试验Ⅲ组(P < 0.05);试验Ⅰ组链球菌属相对丰度显著高于试验Ⅲ组(P < 0.05),试验Ⅱ组和试验Ⅲ组之间差异不显著(P>0.05);试验Ⅱ组八叠球菌属相对丰度显著高于试验Ⅲ组(P < 0.05);试验Ⅲ组拟普雷沃菌属相对丰度极显著高于试验Ⅰ组(P < 0.01),试验Ⅲ组显著高于试验Ⅱ组(P < 0.05);试验Ⅰ组乳球菌属相对丰度极显著高于试验Ⅲ组(P < 0.01)。
|
|
表 5 不同谷物淀粉对断奶马驹盲肠菌群属水平物种相对丰度的影响 Table 5 Effects of different cereal starches on cecal microflora species relative abundance at genus level of weaned foals |
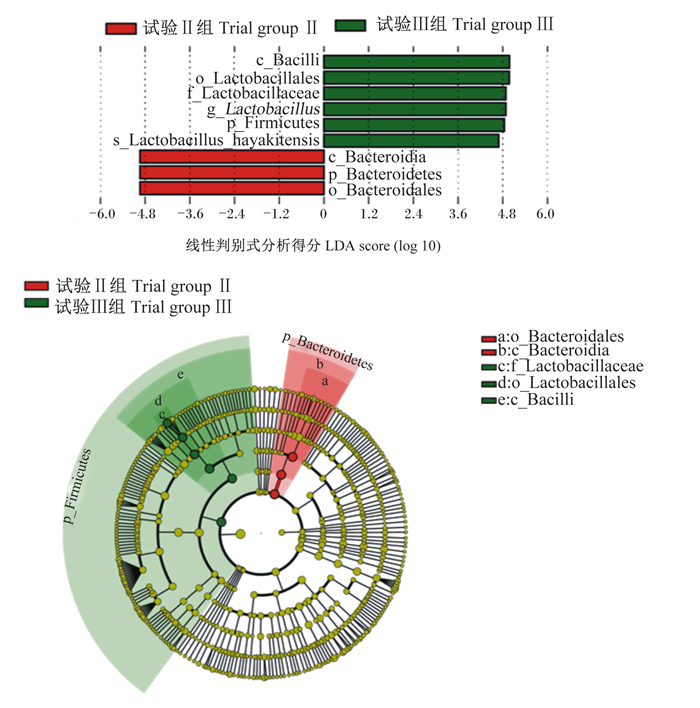
LEfSe分析能够在组与组之间寻找有统计学差异的物种,由图 2可知,试验Ⅱ组与试验Ⅲ组之间有显著性差异的物种有9种,试验Ⅱ组有显著性的物种有6种,分别为芽孢杆菌纲(Bacilli)、乳杆菌目(Lactobacillales)、乳酸杆菌科(Lactobacillaceae)、弯曲乳酸菌属(Lactobacillus)、厚壁菌门(Firmicutes)和Lactobacillus_hayakitensis;试验Ⅲ组有显著性的物种有3种,分别拟杆菌目(Bacteroidales)、拟杆菌门(Bacteroidetes)和拟杆菌纲(Bacteroidia)。
|
Bacilli:芽孢杆菌纲;Lactobacillales:乳杆菌目;Lactobacillaceae:乳酸杆菌科;Lactobacillus:弯曲乳酸菌属;Firmicutes:厚壁菌门;Bacteroidales:拟杆菌目;Bacteroidetes:拟杆菌门;Bacteroidia:拟杆菌纲。 图 2 线性判别分析分布 Fig. 2 LDA distribution |
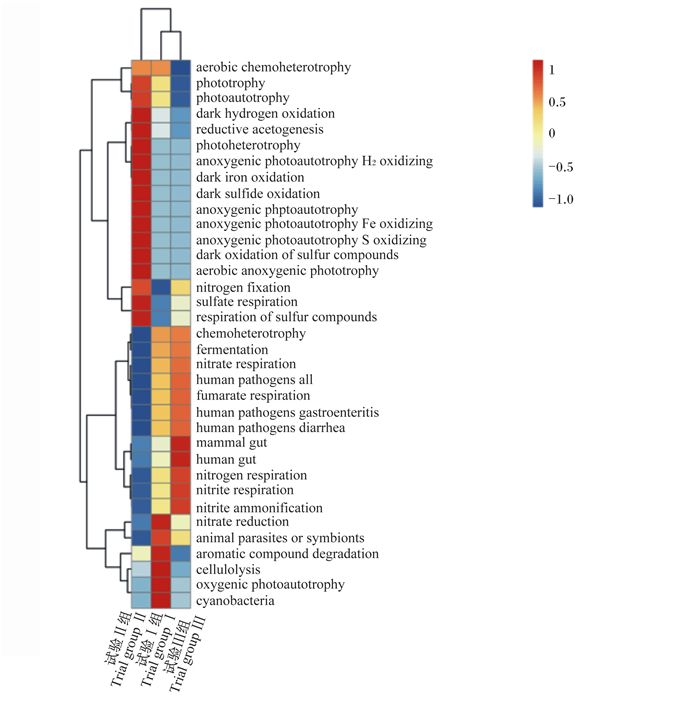
由图 3可知,补喂不同谷物淀粉后盲肠的微生物功能差别明显,其中试验Ⅱ组主要为维护哺乳动物肠道(mammal gut)、人类肠道(human gut)等方面的功能。试验Ⅰ组主要为硝酸盐还原(nitrate reduction)、芳香族化合物的降解(aromatic compound degradation)、纤维素分解(cellulolysis)、含氧光合自养(oxygenic photoautotrophy)以及蓝藻(cyanobacteria)等功能。试验Ⅲ组主要为暗氢氧化(dark hydrogen oxidation)、还原性产乙酸(reductive acetogenesis)、光合异养(photoheterotrophy)、厌氧自养性氢气氧化(anoxygenic photoautotrophy H2 oxidizing)、铁暗氧化(dark iron oxidation)、硫化物暗氧化(dark sulfide oxidation)、厌氧自养性(anoxygenic phptoautotrophy)、无氧光自养性铁氧化(anoxygenic photoautotrophy Fe oxidizing)、无氧光自养性硫氧化(anoxygenic photoautotrophy S oxidizing)、硫化合物的暗氧化(dark oxidation of sulfur compounds)、好氧产养作用(aerobic anoxygenic phototrophy)、硫酸盐呼吸(sulfate respiration)以及硫化合物的呼吸作用(respiration of sulfur compounds)等功能。
|
aerobic chemoheterotrophy:有氧化学异养;phototrophy:光养;photoautotrophy:光合自养;dark hydrogen oxidation:暗氢氧化;reductive acetogenesis:还原性产乙酸;photoheterotrophy:光合异养;anoxygenic photoautotrophy H2 oxidizing:厌氧自养性氢气氧化;dark iron oxidation:铁暗氧化;dark sulfide oxidation:硫化物暗氧化;anoxygenic phptoautotrophy:厌氧自养性;anoxygenic photoautotrophy Fe oxidizing:无氧光自养性铁氧化;anoxygenic photoautotrophy S oxidizing:无氧光自养性硫氧化;dark oxidation of sulfur compounds:硫化合物的暗氧化;aerobic anoxygenic phototrophy:好氧产养作用;nitrogen fixation:固氮;sulfate respiration:硫酸盐呼吸;respiration of sulfur compounds:硫化合物的呼吸作用;chemoheterotrophy:化学异养;fermentation:发酵;nitrate respiration:硝酸盐呼吸;human pathogens all:人类病原体;fumarate respiration:富马酸呼吸;human pathogens gastroenteritis:人类病原体肠胃炎;human pathogens diarrhea:人类病原体腹泻;mammal gut:哺乳动物肠道;human gut:人类肠道;nitrogen respiration:氮呼吸;nitrite respiration:亚硝酸盐呼吸;nitrite ammonification:亚硝酸盐氨化;nitrate reduction:硝酸盐还原;animal parasites or symbionts:动物寄生虫或共生体;aromatic compound degradation:芳香族化合物的降解;cellulolysis:纤维素分解;oxygenic photoautotrophy:含氧光合自养;cyanobacteria:蓝藻。 图 3 断奶马驹盲肠中相对丰度最高细菌的35个功能热图 Fig. 3 Heat maps of 35 functions of bacteria with highest relative abundant in caecum of weaned foals |
肠道中菌群alpha多样性不仅能反映出菌群的种类和数量的多少,还反映出菌群对于不同胃肠道环境的适应性。菌群在肠道适应性越强,其菌群的alpha多样性越明显,对肠道健康和宿主健康更有益[13]。李晓斌等[14]研究3~6月龄伊犁马肠道菌群alpha多样性发现,ACE指数为1 106.38,Chao1指数为1 079.70,Shannon指数为6.46,Simpson指数为0.90。前人研究发现,断奶纯血马驹粪便菌群alpha多样性中ACE指数为1 071.59,Chao1指数为1 057.03,Shannon指数为6.00,Simpson指数为0.90[15]。本试验结果表明,断奶哈萨克马驹盲肠菌群alpha多样性中ACE指数为1 513.52,Chao1指数为2 152.71,Shannon指数为6.66,Simpson指数为0.95。Chao1指数、ACE指数明显高于其他2个品种。一方面可能是品种与饲养管理方面的差异导致,刁慧等[16]研究大白猪、荣昌猪和蔵猪的粪便菌群alpha多样性发现,不同品种猪肠道微生物组成不相同;Campbell等[17]和Hufeldt等[18]的结果也表明生长环境不同可导致小鼠肠道菌群结构的差异。另一方面可能是3种谷物淀粉结构的不同对菌群结构产生差异,相振田[19]分别给仔猪饲喂玉米淀粉、木薯淀粉、小麦淀粉和豌豆淀粉配制的半纯合饲粮,结果表明,饲粮不同来源淀粉显著影响断奶仔猪肠道微生物组成和数量;Martinez等[20]给28位健康人群每天分别摄入60 g大麦、糙米及混合全谷物食物,结果表明3种谷物摄入后增加了肠道菌群的alpha多样性。本试验中,试验Ⅲ组Chao1指数、Shannon指数高于试验Ⅰ组和试验Ⅱ组,试验Ⅰ组ACE指数高于试验Ⅱ组和试验Ⅲ组,说明不同谷物淀粉会影响马驹盲肠菌群结构。与上述研究结果相似,原因可能是3种谷物淀粉中富含的膳食纤维改善了肠道菌群结构,膳食纤维是盲肠菌群的重要能源,通过提供微生物生长的底物来改变肠道的生态环境[21],从而改变哈萨克马驹盲肠物种相对丰度。
3.2 不同谷物淀粉对断奶马驹盲肠菌群物种组成的影响肠道是动物获取饲粮营养物质的重要组织,维持肠道内生态的稳衡是动物获取营养物质的基础[22]。肠道微生物是构成肠道内消化系统的重要组成部分,饲粮结构和类型是影响肠道微生态平衡的关键因素之一[23-26]。单胃草食动物盲肠是饲粮碳水化合物降解的主要场所,微生物的多样性较高,主要以厚壁菌门和拟杆菌门为主[27]。本试验结果显示,断奶马驹盲肠中相对丰度较高的物种为厚壁菌门、拟杆菌门,且占细菌总量的85%以上。饲粮谷物淀粉不同导致厚壁菌门、拟杆菌门相对丰度呈现显著或极显著差异。这种差异一方面与玉米、燕麦、大麦中淀粉的含量及淀粉中直链与支链比例有关。王璇等[28]研究结果显示,谷物中的直链与支链比例不同,淀粉消化率不同,大量直链淀粉到达后肠(盲肠和结肠)导致淀粉降解菌相对丰度增加,如拟杆菌门;纤维降解菌相对丰度降低,如厚壁菌门。本试验中马驹获取的是等淀粉饲粮,但是大麦中直链淀粉的含量要高于玉米和燕麦,胃和小肠中大量未消化的直链淀粉到达马驹的后肠,被微生物降解。淀粉降解菌均属于拟杆菌门[29],这可能是试验Ⅲ组拟杆菌门相对丰度极显著高于试验Ⅰ组和试验Ⅱ组的原因。另一方面,大麦中所含膳食纤维β-葡聚糖含量高于玉米和燕麦,而这一类物质不易被胃酸和消化酶消化,到达后肠后作为普雷沃氏菌和拟杆菌能源物质被快速利用[30],使其迅速增殖,可能是本试验中试验Ⅲ组拟杆菌门相对丰度显著高于试验Ⅰ组和试验Ⅲ组的另一个原因。隶属于拟杆菌门的普雷沃氏菌科和拟普雷沃菌属相对丰度的变化与拟杆菌门一致,这与大麦中淀粉的含量与比例有关。而玉米、燕麦中支链淀粉含量较高,其在胃和小肠消化率相对较高[31],到达后肠淀粉的含量减少,淀粉降解菌的数量降低,因而纤维降解菌增加,提高了对纤维饲料的消化率。研究表明,大量的纤维降解菌隶属于厚壁菌门[32]。这可能是试验Ⅰ组和试验Ⅱ组厚壁菌门相对丰度极显著高于试验Ⅲ组的原因。隶属于乳酸菌科、链球菌科的大部分细菌都具有降解纤维的能力,这类细菌相对丰度的增加与饲粮纤维含量有关。本试验中,试验Ⅰ组和试验Ⅱ组此类细菌相对丰度显著高于试验Ⅲ组,可能是玉米和燕麦中大量淀粉被酶消化,减少了到达后肠的淀粉[33-34],抑制了淀粉水解菌的相对丰度,使纤维降解菌的活性增加。
3.3 不同谷物淀粉对断奶马驹盲肠菌群物种功能的影响肠道菌群参与宿主的物质代谢,具有为宿主提供营养、调节免疫功能、抑制病原菌感染等功能[35-36]。因此,肠道菌群在动物生长发育和机体健康中发挥着重要的作用。通过LEfSe分析发现,试验Ⅱ组与试验Ⅲ组之间有显著性差异的物种有9种,试验Ⅱ组有显著性的物种有6种,分别为厚壁菌门、芽孢杆菌纲、乳杆菌目、乳酸杆菌科、弯曲乳酸菌属和Lactobacillus_hayakitensis;试验Ⅲ组有显著性的物种有3种,分别拟杆菌门、拟杆菌纲和拟杆菌目。这与FAPROTAX功能预测结果一致,试验Ⅱ组盲肠微生物功能主要为维护哺乳动物肠道、人类肠道方面等功能。一方面,乳酸杆菌是存在于肠道内的主要有益微生物,可通过竞争性抑制肠道病原菌的感染和定植,并调控宿主的免疫反应,从而促进宿主的肠道和机体健康[37]。也有研究表明,高直链与支链比例饲粮显著提高了断奶仔猪各肠段芽孢杆菌的数量及与肠道发育相关基因表达[38]。另一方面可能是燕麦中的β-葡聚糖为(1, 3)(1, 4)-β-葡聚糖,可与免疫系统的巨噬细胞结合,增强巨噬细胞的活性及吞噬能力,从而增强机体的抗病能力[39],促进肠道的健康发育。试验Ⅲ组盲肠微生物功能主要为无氧呼吸作用及产乙酸等功能,由于大麦中直链淀粉含量较高,其越易产生更多的抗性淀粉[40],抗性淀粉可在肠道微生物厌氧发酵作用下产生挥发性脂肪酸[41-43]。综上所述,产生这样的差异可能是由于不同谷物所含淀粉的直链与支链淀粉比例不同,在盲肠依靠微生物厌氧发酵来改变肠道内微生物的组成、数量及功能。
4 结论在本试验条件下,补喂玉米、燕麦、大麦能够显著改变断奶马驹盲肠菌群相对丰度,丰富微生物的功能。给断奶马驹补喂大麦能提高盲肠拟杆菌门、厚壁菌门相对丰度,降低放线菌门、蓝藻菌门相对丰度,且能够促进盲肠微生物无氧呼吸作用和产乙酸等功能。
| [1] |
黄菊, 尹富贵, 柏美娟, 等. 半纯合日粮法测定几种麦类及红薯淀粉在生长猪体内的消化率[J]. 农业现代化研究, 2009, 30(4): 501-504. HUANG J, YIN F G, BAI M J, et al. Study on digestibility of starch from oat, wheat, buckwheat and sweet potato in intestinal tract of growing pigs by feeding semi-single diet[J]. Research of Agricultural Modernization, 2009, 30(4): 501-504 (in Chinese). DOI:10.3969/j.issn.1000-0275.2009.04.029 |
| [2] |
李岫怡, 杨桂芹, 郭东新. 不同来源淀粉的组成、结构及其在动物生产上的应用研究进展[J]. 动物营养学报, 2019, 31(3): 1053-1060. LI X Y, YANG G Q, GUO D X. Research progress on composition, structure and application of different starch sources in animal production[J]. Chinese Journal of Animal Nutrition, 2019, 31(3): 1053-1060 (in Chinese). |
| [3] |
中国饲料数据库. 中国饲料成分及营养价值表(2018年第29版)[J]. 中国饲料, 2018(21): 64-73. China Feed Database. Tables of feed composition and nutritive values in China (2018 twenty-ninth edition)[J]. China Feed, 2018(21): 64-73 (in Chinese). |
| [4] |
WHELAN J, FRITSCHE K. Linoleic acid[J]. Advances in Nutrition, 2013, 4(3): 311-312. DOI:10.3945/an.113.003772 |
| [5] |
郭丽娜. 燕麦品种品质及其降血脂功效研究[D]. 硕士学位论文. 北京: 中国农业科学院, 2014. GUO L N. Quality and cholesterol-lowering effects of oat varieties[D]. Master's Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese) |
| [6] |
章海燕, 张晖, 王立, 等. 燕麦研究进展[J]. 粮食与油脂, 2009(8): 7-9. ZHANG H Y, ZHANG H, WANG L, et al. Research and development of oat[J]. Cereals & Oils, 2009(8): 7-9 (in Chinese). DOI:10.3969/j.issn.1008-9578.2009.08.003 |
| [7] |
夏明亮, 邹仕庚, 程璐, 等. 大麦营养价值及其在猪生产中的合理使用[J]. 粮食与饲料工业, 2015(8): 57-60. XIA M L, ZOU S G, CHENG L, et al. The nutritional value of barley and its rational use in pig production[J]. Cereal & Feed Industry, 2015(8): 57-60 (in Chinese). |
| [8] |
王蕾, 王悦, 严宗山, 等. 大麦籽粒淀粉和β-葡聚糖积累特性研究[J]. 作物杂志, 2020(2): 119-124. WANG L, WANG Y, YAN Z S, et al. The research of starch and β-glucan accumulating characteristics in grain of different barley varieties[J]. Crops, 2020(2): 119-124 (in Chinese). |
| [9] |
赵金标, 宋孝明, 李忠超, 等. 不同的淀粉类型对生长猪饲粮有效能和营养物质消化率的影响[J]. 动物营养学报, 2021, 33(3): 1330-1338. ZHAO J B, SONG X M, LI Z C, et al. Effects of different starch types on available energy and nutrient digestibility in growing pigs[J]. Chinese Journal of Animal Nutrition, 2021, 33(3): 1330-1338 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.03.016 |
| [10] |
SUN Y, SU Y, ZHU W Y. Microbiome-metabolome responses in the cecum and colon of pig to a high resistant starch diet[J]. Frontiers in Microbiology, 2016, 7: 779. |
| [11] |
刘军. 淀粉对育肥猪生长性能和营养物质消化率的影响[J]. 当代畜禽养殖业, 2017(12): 8. LIU J. Effects of starch on the growth performance and nutrient digestibility of fattening pigs[J]. Modern Livestock and Poultry Breeding Industry, 2017(12): 8 (in Chinese). DOI:10.3969/j.issn.1005-5959.2017.12.005 |
| [12] |
WEURDING R E, VELDMAN A, VEEN W A, et al. Starch digestion rate in the small intestine of broiler chickens differs among feedstuffs[J]. The Journal of Nutrition, 2001, 131(9): 2329-2335. DOI:10.1093/jn/131.9.2329 |
| [13] |
YANG Y X, DAI Z L, ZHU W Y. Important impacts of intestinal bacteria on utilization of dietary amino acids in pigs[J]. Amino Acids, 2014, 46(11): 2489-2501. DOI:10.1007/s00726-014-1807-y |
| [14] |
李晓斌, 赵国栋, 刘振, 等. 3~6月龄伊犁马肠道微生物群落多样性的研究[J]. 动物营养学报, 2017, 29(5): 1535-1544. LI X B, ZHAO G D, LIU Z, et al. A study on intestinal microbiota diversity of 3- to 6-month-old Yili horses[J]. Chinese Journal of Animal Nutrition, 2017, 29(5): 1535-1544 (in Chinese). |
| [15] |
李晓斌, 李海, 李凤鸣, 等. 断奶前纯血马马驹粪便菌群多样性分析[J]. 动物营养学报, 2019, 31(9): 4363-4370. LI X B, LI H, LI F M, et al. Analysis of fecal microflora diversity for thoroughbred foals before weaning[J]. Chinese Journal of Animal Nutrition, 2019, 31(9): 4363-4370 (in Chinese). |
| [16] |
刁慧, 严鸿林, 肖熠, 等. 不同品种猪肠道菌群结构和肠道发育模式的差异及其通过粪便移植在无菌小鼠上的传递性[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集, 武汉: 中国畜牧兽医学会, 2016: 272. DIAO H, YAN H L, XIAO Y, et al. Differences in the structure and intestinal development patterns of pig intestinal flora of different species and their transmission in sterile mice through fecal transplantation[C]//Proceedings of the 12th symposium on animal nutrition, Branch of Animal Nutrition, Chinese Society of Animal Husbandry and Veterinary Medicine, Wuhan: Chinese Association of Animal Science and Veterinary Medicine, 2016: 272. (in Chinese) |
| [17] |
CAMPBELL J H, FOSTER C M, VISHNIVETSKAYA T, et al. Host genetic and environmental effects on mouse intestinal microbiota[J]. The ISME Journal, 2012, 6(11): 2033-2044. DOI:10.1038/ismej.2012.54 |
| [18] |
HUFELDT M R, NIELSEN D S, VOGENSEN F K, et al. Variation in the gut microbiota of laboratory mice is related to both genetic and environmental factors[J]. Comparative Medicine, 2010, 60(5): 336-347. |
| [19] |
相振田. 饲粮不同来源淀粉对断奶仔猪肠道功能和健康的影响及机理研究[D]. 博士学位论文. 雅安: 四川农业大学, 2011. XIANG Z T. Effects of different dietary starches on intestinal functions and health and the underlying mechanism in weaned piglets[D]. Ph. D. Thesis. Ya'an: Sichuan Agricultural University, 2011. (in Chinese) |
| [20] |
MARTINEZ I, LATTIMER J M, HUBACH K L, et al. Gut microbiome composition is linked to whole grain-induced immunological improvements[J]. ISME Journal, 2013, 7(2): 269-280. DOI:10.1038/ismej.2012.104 |
| [21] |
MAKKI K, DEEHAN E C, WALTER J, et al. The impact of dietary fiber on gut microbiota in host health and disease[J]. Cell Host & Microbe, 2018, 23(6): 705-715. |
| [22] |
张小凤, 郭雁君, 蒋惠, 等. 动物肠道屏障功能对肠道菌群变化的调控[J]. 湖北农业科学, 2018, 57(12): 5-8, 32. ZHANG X F, GUO Y J, JIANG H, et al. The regulation of intestinal barrier function on intestinal flora changes in animals[J]. Hubei Agricultural Sciences, 2018, 57(12): 5-8, 32 (in Chinese). |
| [23] |
王珊珊, 王佳堃, 刘建新. 肠道微生物对宿主免疫系统的调节及其可能机制[J]. 动物营养学报, 2015, 27(2): 375-382. WANG S S, WANG J K, LIU J X. Regulation of host immune system by gut microbiota and its possible mechanisms[J]. Chinese Journal of Animal Nutrition, 2015, 27(2): 375-382 (in Chinese). DOI:10.3969/j.issn.1006-267x.2015.02.007 |
| [24] |
KOCHERGINSKAYA S A, AMINOV R I, WHITE B A. Analysis of the rumen bacterial diversity under two different diet conditions using denaturing gradient gel electrophoresis, random sequencing, and statistical ecology approaches[J]. Anaerobe, 2001, 7(3): 119-134. DOI:10.1006/anae.2001.0378 |
| [25] |
TAJIMA K, ARAI S, OGATA K, et al. Rumen bacterial community transition during adaptation to high-grain diet[J]. Anaerobe, 2000, 6(5): 273-284. DOI:10.1006/anae.2000.0353 |
| [26] |
ZHOU M, HERNANDEZ-SANABRIA E, GUAN L L. Characterization of variation in rumen methanogenic communities under different dietary and host feed efficiency conditions, as determined by PCR-denaturing gradient gel electrophoresis analysis[J]. Applied and Environmental Microbiology, 2010, 76(12): 3776-3786. DOI:10.1128/AEM.00010-10 |
| [27] |
叶翔杨, 宫瑞光, 任战军. 饮水中添加复合维生素纳米乳对生长獭兔生长性能、免疫功能、抗氧化能力、肠道组织结构及盲肠微生态的影响[J]. 动物营养学报, 2021, 33(2): 1044-1054. YE X Y, GONG R G, REN Z J. Effects of multivitamin nanoemulsion on growth performance, immune function, antioxidant ability, intestinal tissue structure and cecal microecology of growing Rex rabbits[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 1044-1054 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.02.044 |
| [28] |
王璇, 王丹丹, 年芳, 等. 不同淀粉源饲粮对肉仔鸡小肠消化酶活性、盲肠挥发性脂肪酸含量和微生物菌群的影响[J]. 动物营养学报, 2021, 33(1): 285-296. WANG X, WANG D D, NIAN F, et al. Effects of different starch source diets on small intestinal digestive enzyme activities, caecum volatile fatty acid contents and microbial community of broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 285-296 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.01.029 |
| [29] |
FLINT H J, BAYER E A, RINCON M T, et al. Polysaccharide utilization by gut bacteria: potential for new insights from genomic analysis[J]. Nature Reviews Microbiology, 2008, 6(2): 121-131. DOI:10.1038/nrmicro1817 |
| [30] |
GONG L X, CAO W Y, CHI H L, et al. Whole cereal grains and potential health effects: involvement of the gut microbiota[J]. Food Research International, 2018, 103: 84-102. DOI:10.1016/j.foodres.2017.10.025 |
| [31] |
肖瑜, 杨爽, 刘炳利, 等. 影响糯性谷物淀粉的消化因素及其改性方法[J]. 食品工业, 2019, 40(4): 263-268. XIAO Y, YANG S, LIU B L, et al. The factors of digestibility on waxy starch and the modified method[J]. The Food Industry, 2019, 40(4): 263-268 (in Chinese). |
| [32] |
EVANS N J, BROWN J M, MURRAY R D, et al. Characterization of novel bovine gastrointestinal tract Treponema isolates and comparison with bovine digital dermatitis treponemes[J]. Applied and Environmental Microbiology, 2011, 77(1): 138-147. DOI:10.1128/AEM.00993-10 |
| [33] |
宾石玉, 赵霞. 日粮淀粉来源对断奶仔猪小肠淀粉消化率的影响[J]. 贺州学院学报, 2007, 23(1): 141-144. BIN S Y, ZHAO X. The effect of dietary starch source on starch digestion of small intestine in weaned pigs[J]. Journal of Hezhou University, 2007, 23(1): 141-144 (in Chinese). DOI:10.3969/j.issn.1673-8861.2007.01.034 |
| [34] |
黄伟, 杨秀娟, 曹志勇, 等. 日粮淀粉直支比对断奶仔猪养分消化率和生长性能的影响[J]. 中国饲料, 2017(14): 20-23. HUANG W, YANG X J, CAO Z Y, et al. Effect of dietary starch amylose ratio on nutrient digestibility and growth performance of weaned piglets[J]. China Feed, 2017(14): 20-23 (in Chinese). |
| [35] |
YOUNG V B. The intestinal microbiota in health and disease[J]. Current Opinion in Gastroenterology, 2012, 28(1): 63-69. DOI:10.1097/MOG.0b013e32834d61e9 |
| [36] |
孙玲利, 宁俊平, 韩战强, 等. 家禽肠道菌群与营养物质代谢的研究进展[J]. 黑龙江畜牧兽医, 2021(3): 54-57. SUN L L, NING J P, HAN Z Q, et al. Research progress of poultry gut microflora and nutrient metabolism[J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(3): 54-57 (in Chinese). |
| [37] |
WANG W, CHEN L P, ZHOU R, et al. Increased proportions of Bifidobacterium and the Lactobacillus group and loss of butyrate-producing bacteria in inflammatory bowel disease[J]. Journal of Clinical Microbiology, 2014, 52(2): 398-406. DOI:10.1128/JCM.01500-13 |
| [38] |
HAN G Q, XIANG Z T, YU B, et al. Effects of different starch sources on Bacillus spp. in intestinal tract and expression of intestinal development related genes of weanling piglets[J]. Molecular Biology Reports, 2012, 39(2): 1869-1876. DOI:10.1007/s11033-011-0932-x |
| [39] |
王凤梅, 樊明寿, 郑克宽. 燕麦β-葡聚糖的保健作用及影响其积累的因素[J]. 麦类作物学报, 2005, 25(2): 116-118. WANG F M, FAN M S, ZHENG K K. Nutritive value of oat β-glucan and the factors affecting its accumulation[J]. Journal of Triticeae Crops, 2005, 25(2): 116-118 (in Chinese). DOI:10.3969/j.issn.1009-1041.2005.02.026 |
| [40] |
张斌, 罗发兴, 黄强, 等. 不同直链含量玉米淀粉结晶结构及其消化性研究[J]. 食品与发酵工业, 2010, 36(8): 26-30. ZHANG B, LUO F X, HUANG Q, et al. Crystalline structures and digestibility of cornstarches with different amylose/amylopectin content[J]. Food and Fermentation Industries, 2010, 36(8): 26-30 (in Chinese). |
| [41] |
TOPPING D L, CLIFTON P M. Short-chain fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides[J]. Physiological Reviews, 2001, 81(3): 1031-1064. DOI:10.1152/physrev.2001.81.3.1031 |
| [42] |
KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |
| [43] |
余群莲. 不同来源淀粉对肉牛瘤胃发酵及营养物质消化代谢的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2011. YU Q L. Effect of different sources of starch on rumen fermentation, digestion and metabolism of nutrients in beef cattle[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2011. (in Chinese) |




