2. 中国水产科学研究院淡水渔业研究中心, 无锡 214081
2. Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China
淡水石首鱼(Aplodinotus grunniens),又名淡水大黄鱼,属鲈形目(Perciformes),石首鱼科(Sciaenidae),原产于北美洲且终生生活在淡水中[1]。淡水石首鱼属于底栖性鱼类,杂食偏肉食性,适应性强,具有生长速度快、营养丰富、肉味鲜美、无肌间刺的等优点,人工养殖前景广阔[2]。目前国内外有关淡水石首鱼的基础研究报道比较缺乏。中国水产科学研究院淡水渔业研究中心自2016年从美国引进淡水石首鱼进行养殖及繁育研究。养殖过程中发现,淡水石首鱼对人工配合饲料的利用率较为低下,容易受到饥饿胁迫的影响,解剖发现其肝脏及腹部易沉积脂肪,影响淡水石首鱼生理健康。
近年来,随着集约化水产养殖模式的快速发展,养殖产量不断提高,但水产品的安全问题日益突出。为降低养殖成本,水产养殖过程中普遍使用高脂或高糖饲料,导致鱼类肝脏和腹部脂肪沉积[3-5],影响鱼体的正常代谢,进而降低免疫及抗氧化性,最终导致生长受阻,严重时导致死亡[6]。肝脏作为鱼类主要代谢器官,对维持鱼类正常代谢及稳态有重大作用[7]。鱼类肝脏脂肪沉积成因较为复杂,目前认为主要是由于饲料中营养素失衡和抗脂肪肝营养物质的缺乏[8]。肝脏脂肪沉积会影响鱼体健康,使鱼类抵抗力下降[9]。因此为切实解决鱼类肝脏和腹部脂肪过度沉积,对于鱼类健康养殖具有重要意义。李钰等[10]通过高脂投喂构建斑马鱼营养型脂肪肝探讨肝脏代谢变化。此外,已有相关研究报道饥饿不仅可以降低肝脏脂肪含量[11],还可以改善鱼体肌肉品质[12]。脂肪作为储能最高的营养物质,是鱼类在饥饿胁迫时主要能量来源[13-14]。饥饿胁迫可以阻断动物体的外源食物补给,因此在饥饿胁迫下,探讨鱼类对营养物质代谢规律具有重要意义。
本研究以淡水石首鱼为研究对象,主要研究了淡水石首鱼在饥饿过程中内脏的重量变化、肌肉脂肪酸的变化以及肝脏脂肪代谢相关基因表达的变化,以期对淡水石首鱼健康养殖以及建立合理的投喂制度提供基础资料。
1 材料与方法 1.1 试验材料试验用鱼为中国水产科学研究院淡水渔业研究中心2016年从美国引进第1批淡水石首鱼所繁育的子二代苗种。淡水石首鱼取自中国水产科学研究院淡水渔业研究中心江阴试验基地。
1.2 试验设计及饲养管理饥饿胁迫试验在中国水产科学研究院淡水渔业研究中心(南泉基地)室内循环养殖系统(规格为820 mm×700 mm)中进行。试验鱼暂养2月,期间连续投喂鲜活饵料(活虾)至表观饱食,投喂量为鱼体总重的3%~5%;选择活力强、体重均匀淡水石首鱼180尾进行饿胁迫试验,初始平均体重为(20.88±0.91) g,设置3个重复,每个重复60尾;饥饿时间为0、1、4、8、12、24、36、48 h及3、4、6、10、14、21、28、42 d。养殖期间每隔3 d进行换水排污,保持水温(26±1) ℃,pH 7.2~7.8,溶解氧浓度>6 mg/L,氨氮浓度 < 0.05 mg/L,饥饿试验进行42 d,试验期间不投喂。
1.3 样品采集分别在饥饿0、1、4、8、12、24、36、48 h及3、4、6、10、14、21、28、42 d时采集样本,每个重复随机采集3尾,每个饥饿时间点共采集9尾。立即放入含有0.1 mg/L丁香油的水桶中,麻醉后,测量体长、体重。解剖称量肝重、腹部脂肪重、内脏重,取其肝脏,液氮速冻后,放置于-80 ℃,用于脂肪代谢基因表达检测。取其侧线上、下1 cm左右背部肌肉,置入密封袋中,于-20 ℃冰箱中保存,用于测定肌肉脂肪酸组成。
1.4 指标测定与分析 1.4.1 形态指标测定
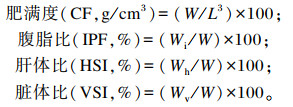
|
式中:W为鱼体质量(g);L为鱼体长(cm);Wi为鱼腹腔脂肪重(g);Wh为鱼肝脏重(g);Wv为鱼内脏重(g)。
1.4.2 肌肉脂肪酸组成测定肌肉样品真空冷冻干燥48 h,研磨粉碎,干燥。制备好肌肉样品采用氯仿∶甲醇∶水=2 ∶ 2 ∶ 1抽提总脂肪,采用氢氧化钾-甲醇对脂肪酸甲酯化,再用正庚烷萃取脂肪酸甲酯。样品经皂化甲酯化后,用气相色谱—质谱仪(Agilent 7890B-5977A)进行分析。采用面积归一化法测定淡水石首鱼肌肉样品脂肪酸组成及含量。
1.4.3 肝脏脂肪代谢相关基因表达测定用Trizol试剂提取总RNA。提取的RNA使用超微量分光光度计测量吸光度(OD)260/280的比值及RNA浓度,OD260/280比值均在1.80~2.00,RNA可用于cDNA反转录。
cDNA合成按照PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)(大连TaKaRa有限公司)说明书进行操作。反应分2步进行。第1步是去除基因组DNA,反应体系:5×g DNA Eraser Buffer 2.0 μL、gDNA Eraser 1.0 μL、RNA 1 μg/μL、补RNA Free dH2O至10 μL,反应条件为42 ℃ 2 min,4 ℃。第2步是反转录反应,反应体系:PrimeScript RT Enzyme Mix I 1.0 μL、RT Primer Mix 1.0 μL、5×PrimeScript Buffer 2(for Real Time)4 μL、RNase Free dH2O 4 μL、步骤1反应液10 μL,反应条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃。
试验所用引物均根据淡水石首鱼三代全长无参转录组测序所得到的基因序列,采用Primer 5设计所得。引物由上海捷瑞生物工程有限公司合成,引物信息见表 1。
|
|
表 1 实时荧光定量PCR引物序列 Table 1 Primer sequences of real-time quantitative PCR |
RT-PCR按照PrimeScriptTM RT Master Mix (Perfect Real Time)(大连TaKaRa有限公司)说明书进行操作。总反应体系25 μL,其中TB Green Premix Ex TaqⅡ(Tli RNaseH Plus)(2×)12.5 μL、PCR Forward Primer(10 μmol/L)1 μL、PCR Reverse Primer(10 μmol/L)1 μmol/L、RT反应液(cDNA溶液)2 μL、灭菌水8.5 μL。反应条件为:预变性95 ℃ 30 s;PCR反应95 ℃ 5 s,60 ℃ 30 s,循环40次。根据三代全长转录组测序数据不同组织之间基因表达量平均值、变异系数以及差异倍数筛选候选内参基因,制作候选内参的标准曲线确定扩增效率,用geNorm等软件筛选得到泛素折叠修饰蛋白1(ufm1)为相对最适内参。本试验选用ufm1为内参,用2-ΔΔCt法计算目的基因相对表达量。
1.5 数据处理数据分析采用SPSS 26统计分析软件对使用数据进行单因素方差分析(one-way ANOVA),差异显著用Duncan氏法进行多重比较,P < 0.05视为差异显著,结果均以平均值±标准误(mean±SE)表示。
2 结果 2.1 饥饿时间对淡水石首鱼形体指标及肌肉粗脂肪含量的影响由表 2可知,试验期间,淡水石首鱼存活率均为100%,体重显著下降(P < 0.05)。饥饿条件下,淡水石首鱼肌肉粗脂肪含量下降,其中在饥饿21 d时开始显著下降;在饥饿21 d以后,肌肉粗脂肪含量无显著差异(P>0.05)。
|
|
表 2 饥饿时间对淡水石首鱼体重和肌肉粗脂肪含量(湿重)的影响 Table 2 Effects of starvation time on body weight and muscle crude lipid content (wet weight) of A.grunniens |
|
|
表 3 饥饿时间对淡水石首鱼肌肉脂肪酸组成的影响(干物质基础) Table 3 Effects of starvation time on fatty acid composition in muscle of A.grunniens (DM basis) |
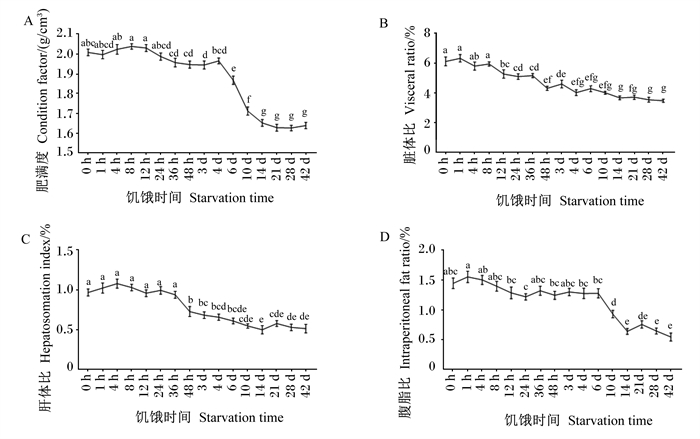
由图 1可知,淡水石首鱼的肥满度、肝体比、脏体比、腹脂比随饥饿时间增加而下降。统计结果表明,以饥饿0 d为对照,肥满度在饥饿48 h内没有显著差异(P>0.05),饥饿3 d后显著降低(P < 0.05),在饥饿4~14 d急剧下降,之后趋于平稳(图 1-A)。脏体比在饥饿12 h后开始显著降低(P < 0.05),饥饿4 d后趋于稳定(图 1-B);肝体比在饥饿48 h后开始显著降低(P < 0.05),饥饿6 d后趋于稳定(图 1-C);腹脂比在饥饿10 d后显著降低(P < 0.05),饥饿14 d后后趋于稳定(图 1-D)。
|
数据点标注不同字母表示差异显著(P < 0.05)。 Value points with different letters mean significant difference (P < 0.05). 图 1 饥饿时间对淡水石首鱼形体指标的影响 Fig. 1 Effects of starvation time on body indexes of A.grunniens |
基于上述结果,发现饥饿24 h及14、42 d是形体指标变化的关键时间点,选取该时间点进行后续试验分析。由表 3可知,在不同饥饿时间下共检测到脂肪酸26种,包括8种饱和脂肪酸(saturated fatty acid, SFA)、6种单不饱和脂肪酸(monounsaturated fatty acids, MUFA)、12种多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)。结果显示,随着饥饿时间增加,SFA含量呈略微下降的趋势,但无显著差异(P>0.05),饥饿14和42 d时,MUFA含量显著低于饥饿24 h(P < 0.05)。PUFA含量在不同饥饿时间差异显著(P < 0.05),饥饿14和42 d显著高于饥饿0和24 h(P < 0.05)。其中,饥饿42 d时二十碳戊烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahexaenoic acid, DHA)含量均显著高于其他饥饿时间(P < 0.05),EPA+DHA含量显著高于其他各饥饿时间(P < 0.05)。此外,饥饿42 d时,n-3系列不饱和脂肪酸含量显著高于其他饥饿时间(P < 0.05);n-6系列饱和脂肪酸含量逐渐升高,饥饿24 h及14、42 d时均显著高于饥饿0 h(P < 0.05)。
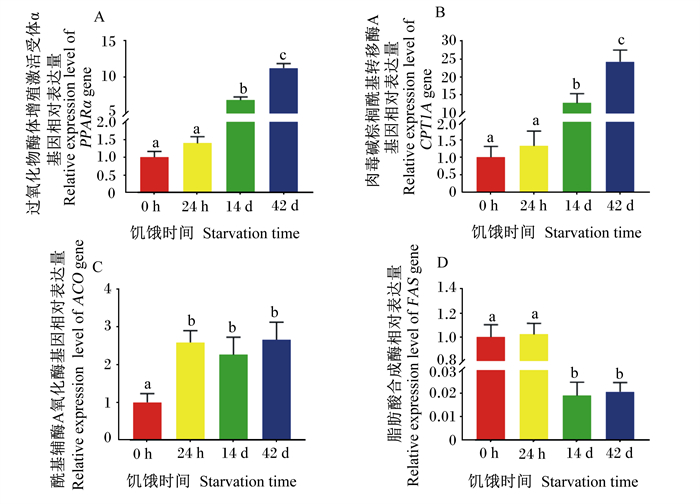
2.3 饥饿时间对淡水石首鱼肝脏脂肪代谢相关基因表达的影响如图 2可知,饥饿14和42 d显著提高了过氧化物酶体增殖激活受体α(PPARα)和肉毒碱棕榈酰基转移酶A(CPT1A)基因相对表达量(P < 0.05)(图 2-A,图 2-B),饥饿24 h及14、42 d显著提高了酰基辅酶A氧化酶(ACO)基因相对表达量(P < 0.05)(图 2-C);而饥饿14和42 d时,脂肪酸合成酶(FAS)基因相对表达量显著降低(P < 0.05)(图 2-D)。
|
图 2 饥饿时间对淡水石首鱼肝脏脂肪代谢相关基因相对表达量的影响 Fig. 2 Effects of starvation time on relative expression levels of liver lipid metabolism-related genes of A.grunniens |
当鱼类处于饥饿状态时,无法有效地从外界获取能量物质,只能消耗自身贮藏的营养物质维持生命活动,形体指标可以直观地反映自身营养消耗及生长状况[15-16]。本试验显示,淡水石首鱼在饥饿42 d时,体重、肥满度、肝体比、脏体比、腹脂比下降,这与黒鯛幼鱼(Acanthopagrus schlegelii)[17]、吉富罗非鱼(GIFT,Oreochromis niloticus)[18]、彭泽鲫(Carassius auratus var. Pengze)幼鱼[19]等的研究结果一致。在饥饿条件下,鱼类动用各种贮能器官中能源物质的先后顺序存在不同[20]。杜震宇等[21]在研究饥饿对鲈(Perca fluviatilis)形体指标影响中发现,鲈在饥饿条件下,会首先动用肠系膜脂肪提供能量。钟金香等[22]研究发鳙鱼(Aristichthys nobilis)在饥饿25 d时会同时动用内脏和肝脏中的物质提供能量。研究发现,淡水石首鱼(取样时腹腔存在大量脂肪)在饥饿条件下,淡水石首鱼脏体比和肝体比先显著降低,其中脏体比在饥饿12 h后显著降低,肝体比在饥饿48 h后显著降低,且两者总体降幅相似,而饥饿6 d后腹脂比明显降低。这表明淡水石首鱼在饥饿状态下,首先会消耗用内脏中残留食物消化供能,其次再动用肝脏提供能量,最后消耗腹部脂肪供能。钟金香等[23]研究发斑点叉尾鮰(Ictalurus punctatus)在饥饿时首先动用内脏中储能物质,其次动用肝脏中的储能物质,这与本试验的研究结果一致。
3.2 饥饿时间对淡水石首鱼肌肉脂肪酸组成的影响肌肉作为鱼类主要产品,其营养价值与人类息息相关。因此分析饥饿胁迫下肌肉脂肪酸组成种类及含量有助于推动淡水石首鱼健康养殖以及提供高品质鱼产品。随着饥饿时间的延长,肌肉粗脂肪含量逐渐在下降。而在饥饿条件下,鱼类对脂肪酸的利用存在一定的规律,一般优先利用SFA,其次利用MUFA,最后利用PUFA[24]。在饥饿状态下,鲵(Miichthys miiuy Basilewsky)幼鱼、点带石斑(Epinephelus coioides)幼鱼和长峭(Octopus minor)优先利用SFA,其次利用MUFA,最后利用PUFA[25-27]。然而有些鱼类在饥饿条件下对脂肪酸的利用顺序存在着一定差异。养殖大黄鱼(Larimichthys crocea)在禁食中,SFA和MUFA含量变化趋势不明显,PUFA含量呈下降趋势[28]。瓦氏黄颡鱼(P. vachelli)脂肪酸利用则表现出SFA含量无显著变化,MUFA含量降低,PUFA含量上升[29]。这说明鱼类对脂肪酸的利用因鱼的种类、禁食条件等存在差异。本试验结果显示,淡水石首鱼在饥饿24 h时,肌肉SFA、MUFA和PUFA含量无显著变化,这可能是因为饥饿时间太短;饥饿14和42 d时,肌肉SFA含量无显著变化,MUFA含量显著降低,PUFA含量显著上升。这可能是因为SFA和MUFA容易通过线粒体进行β氧化提供能量,而PUFA经β氧化需要差向酶和异构酶参与[30-32]。此外,PUFA是生物膜、神经和视觉系统的重要组成成分,具有比供能更加重要的生物功能而被保留下来[33-35]。在饥饿42 d后,本试验中肌肉EPA+DHA含量升高,∑n-3PUFA和∑n-6PUFA含量升高,这与点带石斑幼鱼肌肉脂肪酸研究结果[26]一致。研究结果表明,饥饿可以改变淡水石首鱼肌肉不同类型脂肪酸组成,影响鱼产品的营养价值。
3.3 饥饿时间对淡水石首鱼肝脏脂肪代谢相关基因表达的影响脂肪作为体内能量储存最高的物质,维持机体的生命活动至关重要[36]。为进一步探索淡水石首鱼饥饿胁迫过程脂肪代谢变化规律,对脂肪合成及分解代谢相关基因表达进行分析。脂肪代谢是一个复杂的生物学过程,包括脂肪的转运、分解、合成。脂肪代谢过程中,有大量的酶及辅助因子参与,还会受到糖代谢、氨基酸代谢的影响,它们之间进行相互调控,维持着机体的代谢平衡[37]。因此,探讨脂肪代谢关键因子在脂肪转运、分解及合成的作用,有助于了解淡水石首鱼在饥饿状态下脂肪分解代谢的动态过程。过氧化物酶体增殖激活受体(PPARs)在脂质代谢过程中具有重要作用,其中PPARα可以调节下游脂肪分解代谢关键因子的表达,参与脂肪代谢[38-40]。肉毒碱棕榈酰基转移酶(CPT)是调节体内脂肪酸β氧化的关键酶与限速酶,β氧化是体内脂肪酸主要分解过程[41]。本试验结果显示,淡水石首鱼饥饿24 h时,肝脏PPARα和CPT1A基因相对表达量略微上调,接着在饥饿14 d以后,PPARα和CPT1A基因相对表达量显著上调。这与宁丽军[42]报道尼罗罗非鱼(Oreochromis niloticus)在饥饿3 d开始显著上调PPARα和CPT1A基因相对表达的结果一致。结果表明,淡水石首鱼在饥饿24 h时,鱼体暂时可以满足正常代谢活动所需要的能量,不需要过多的脂肪酸氧化提供能量,因此CPT1A基因相对表达量无显著变化。在饥饿14 d以后,鱼体开始动用脂肪进行供能,此时CPT1A基因相对表达量急剧上升。然而,我们观察到ACO基因相对表达量在饥饿24 h及14、42 d时无显著变化,具体原因需要进一步试验分析。此外淡水石首鱼肝脏FAS基因相对表达量呈现下调趋势,表明机体内脂肪合成代谢也在降低。这与瓦氏黄颡鱼[29]、虎龙斑鱼[43]报道的结果一致。上述分析表明,淡水石首鱼在饥饿条件下,会激活PPARα,上调CPT1A基因相对表达量,加速脂肪酸氧化供能,脂肪分解代谢加剧;同时FAS基因相对表达下调,脂肪合成代谢受阻。FAS基因相对表达量下调表明脂肪酸合成减少,CPT1AS基因相对表达量上调表明脂肪酸进行β氧化分解增强,从侧面反映了淡水石首鱼在饥饿状态下肌肉脂肪酸含量的变化。由此推测,在饥饿条件下,脂肪分解代谢增强而合成代谢减弱,导致淡水石首鱼肝脏脂肪减少。
4 结论① 饥饿胁迫降低淡水石首鱼形体指标,如肥满度、腹脂比、肝体比、脏体比。
② 饥饿胁迫影响淡水石首鱼肌肉不同类型脂肪酸组成。
③ 饥饿胁迫促进淡水石首鱼脂肪酸氧化供能,抑制脂肪酸合成。
| [1] |
BARNEY R L. The distribution of the fresh-water sheepshead, Aplodinotus grunniens Rafinesque, in respect to the glacial history of North America[J]. Ecology, 1926, 7(3): 351-364. DOI:10.2307/1929317 |
| [2] |
闻海波, 马学艳, 徐跑, 等. 淡水石首鱼幼鱼外部形态与内部解剖学特征[J]. 中国水产科学, 2018, 25(6): 1161-1171. WEN H B, MA X Y, XU P, et al. External morphology and internal anatomical characters of juveniles of the freshwater drum Aplodinotus grunniens[J]. Journal of Fishery Sciences of China, 2018, 25(6): 1161-1171 (in Chinese). |
| [3] |
RUSSELL P M, DAVIES S J, GOUVEIA A, et al. Influence of dietary starch source on liver morphology in juvenile cultured European sea bass (Dicentrarchus labrax L.)[J]. Aquaculture Researc, 2001, 32(S1): 306-314. |
| [4] |
NANTON D A, LALL S P, MCNIVEN M A. Effects of dietary lipid level on liver and muscle lipid deposition in juvenile haddock, Melanogrammus aeglefinus L.[J]. Aquaculture Research, 2015, 32(s1): 225-234. |
| [5] |
GAYLORD T G, GATLIN D M. Dietary lipid level but notl-carnitine affects growth performance of hybrid striped bass (Morone chrysops ♀×M.saxatilis ♂)[J]. Aquaculture, 2000, 190(3/4): 237-246. |
| [6] |
SONG C, LIU B, XU P, et al. Oxidized fish oil injury stress in Megalobrama amblycephala: evaluated by growth, intestinal physiology, and transcriptome-based PI3K-Akt/NF-κB/TCR inflammatory signaling[J]. Fish & Shellfish Immunology, 2018, 81: 446-455. |
| [7] |
BECHMANN L P, HANNIVOORT R A, GERKEN G A, et al. The interaction of hepatic lipid and glucose metabolism in liver diseases[J]. Journal of Hepatology, 2012, 56(4): 952-964. DOI:10.1016/j.jhep.2011.08.025 |
| [8] |
杜震宇. 养殖鱼类脂肪肝成因及相关思考[J]. 水产学报, 2014, 38(9): 1628-1638. DU Z Y. Causes of fatty liver in farmed fish: a review and new perspectives[J]. Journal of Fisheries of China, 2014, 38(9): 1628-1638 (in Chinese). |
| [9] |
闫少静, 李欣宇. 鱼类脂肪肝病浅析[J]. 江西水产科技, 2019(1): 34, 36. YAN S J, LI X Y. Analysis of fatty liver disease of fish[J]. Jiangxi Fishery Sciences and Technology, 2019(1): 34, 36 (in Chinese). |
| [10] |
李钰, 何夙旭, 张震, 等. 斑马鱼营养性脂肪肝模型构建[J]. 水产学报, 2017, 41(5): 775-784. LI Y, HE S X, ZHANG Z, et al. Establishment of danio rerio nutritional induced fatty liver model[J]. Journal of Fisheries of China, 2017, 41(5): 775-784 (in Chinese). |
| [11] |
沈文英, 林浩然, 张为民. 饥饿和再投喂对草鱼鱼种生物化学组成的影响[J]. 动物学报, 1999, 45(4): 404-412. SHEN W Y, LIN H R, ZHANG W M. Effect of starvation and refeeding on biochemical composition of grass carp (Ctenopharyngodon idellus) fingerling[J]. Acta Zoologica Sinica, 1999, 45(4): 404-412 (in Chinese). |
| [12] |
刘峰, 吕小康, 刘阳阳, 等. 饥饿对大黄鱼幼鱼肌肉中氨基酸和脂肪酸组成的影响[J]. 渔业科学进展, 2018, 39(5): 58-65. LIU F, LV X K, LIU Y Y, et al. Effect of starvation on amino acids and fatty acids of juvenile Larimichthys crocea[J]. Progress in Fishery Sciences, 2018, 39(5): 58-65 (in Chinese). |
| [13] |
AZODI M, EBRAHIMI E, MOTAGHI E, et al. Metabolic responses to short starvation and re-feeding inrainbow trout (Oncorhynchus mykiss)[J]. Ichthyological Research, 2014, 62(2): 177-183. |
| [14] |
MADDOCK D M, BURTON M P M. Some effects of starvation on the lipid and skeletal muscle layers of the winter flounder, Pleuronectes americanus[J]. Canadian Journal of Zoology, 1994, 72(9): 1672-1679. DOI:10.1139/z94-223 |
| [15] |
NAVARRO I, GUTIÉRREZ J. Chapter 17 fasting and starvation[J]. Biochemistry and Molecular Biology of Fishes, 1995, 4: 393-434. |
| [16] |
LI H Y, XU W J, JIN J Y, et al. Effects of starvation on glucose and lipid metabolism in gibel carp (Carassius auratus gibeliovar.CAS III)[J]. Aquaculture, 2018, 496: 166-175. DOI:10.1016/j.aquaculture.2018.07.015 |
| [17] |
龙章强, 彭士明, 陈立侨, 等. 饥饿与再投喂对黑鲷幼鱼体质量变化、生化组成及肝脏消化酶活性的影响[J]. 中国水产科学, 2008, 15(4): 606-614. LONG Z Q, PENG S M, CHEN L Q, et al. Effects of starvation and re-feeding on body weight, tissue biochemical composition and hepatic digestive enzyme activity in juvenile black seabream, Acanthopagrus schlegeli[J]. Journal of Fishery Science of China, 2008, 15(4): 606-614 (in Chinese). DOI:10.3321/j.issn:1005-8737.2008.04.011 |
| [18] |
陈文静, 丁立云, 邓勇辉, 等. 饥饿胁迫对彭泽鲫幼鱼形体指标、肌肉脂肪酸组成和肝脏脂蛋白脂酶基因表达的影响[J]. 动物营养学报, 2020, 32(6): 2782-2790. CHEN W J, DING L Y, DENG Y H, et al. Effects of starvation stress on physical indices, muscle fatty acid composition and liver lipoprotein lipase gene expression of juvenile crucian carp (Carassius auratus var.Pengze)[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2782-2790 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.06.038 |
| [19] |
刘波, 何庆国, 唐永凯, 等. 饥饿胁迫对吉富罗非鱼生长及生理生化指标的影响[J]. 中国水产科学, 2009, 16(2): 230-237. LIU B, HE Q G, TANG Y K, et al. Effects of starvation on growth, physiological and biochemical parameterof GIFT strain of Nile tilapia (Oreochromis niloticus)[J]. Journal of Fishery Science of China, 2009, 16(2): 230-237 (in Chinese). DOI:10.3321/j.issn:1005-8737.2009.02.011 |
| [20] |
COLLINS A L, ANDERSON T A. The regulation of endogenous energy stores during starvation and refeeding in the somatic tissues of the golden perch[J]. Journal of Fish Biology, 1995, 47(6): 1004-1015. DOI:10.1111/j.1095-8649.1995.tb06024.x |
| [21] |
杜震宇, 刘永坚, 田丽霞, 等. 饥饿对于鲈肌肉、肝脏和血清主要生化组成的影响[J]. 动物学报, 2003, 49(4): 458-465. DU Z Y, LIU Y J, TIAN L X, et al. Effects of starvation on visceral weight and main biochemical composition of the muscle, liver and serum in the Japanese sea bass (Lateolabrax japonicus)[J]. Acta Zoologica Sinica, 2003, 49(4): 458-465 (in Chinese). |
| [22] |
钟金香, 李俊伟, 颉晓勇, 等. 饥饿处理对鳙鱼形态和肌肉营养成分的影响分析[J]. 基因组学与应用生物学, 2019, 38(8): 3515-3520. ZHONG J X, LI J W, JIE X Y, et al. Effects analysis of starvation on morphology and muscle nutrients composition of Aristichthys nobilis[J]. Genomics and Applied Biology, 2019, 38(8): 3515-3520 (in Chinese). |
| [23] |
钟金香, 李俊伟, 颉晓勇, 等. 短期饥饿对斑点叉尾(鮰)形态、肌肉品质构成及营养组成的影响[J]. 南方水产科学, 2018, 14(2): 90-95. ZHONG J X, LI J W, JIE X Y, et al. Effects of short-term starvation on morphometriacal, textural parameters and nutritional composition of Channel catfish (Ictalurus punctatus)[J]. South China Fisheries Science, 2018, 14(2): 90-95 (in Chinese). DOI:10.3969/j.issn.2095-0780.2018.02.012 |
| [24] |
谢小军, 邓利. 饥饿对鱼类生理生态学影响的研究进展[J]. 水生生物学报, 1998, 22(2): 181-188. XIE X J, DENG L. Advances and studies on ecophysiological effects of starvation on fish[J]. Acta Hydrobiologica Sinica, 1998, 22(2): 181-188 (in Chinese). DOI:10.3321/j.issn:1000-3207.1998.02.014 |
| [25] |
柳敏海, 罗海忠, 傅荣兵, 等. 短期饥饿胁迫对鮸鱼生化组成、脂肪酸和氨基酸组成的影响[J]. 水生生物学报, 2009, 33(2): 230-235. LIU M H, LUO H Z, FU R B, et al. Biochemical composition, amino acid and fatty acid composition in juvenile of Miichthysmiiuy under short-time starvation[J]. Acta Hydrobiologica Sinica, 2009, 33(2): 230-235 (in Chinese). |
| [26] |
林黑着, 刘永坚, 何建国, 等. 饥饿对斜带石斑鱼肝脏和肌肉脂肪酸组成的影响[J]. 南方水产, 2006, 2(4): 1-6. LIN H Z, LIU Y J, HE J G, et al. Effects of starvation on fatty acid composition of muscle and liver in grouper, Epinephelus coioides[J]. South China Sea Fisheries Science, 2006, 2(4): 1-6 (in Chinese). DOI:10.3969/j.issn.2095-0780.2006.04.001 |
| [27] |
宋旻鹏, 汪金海, 陈智威, 等. 周期性饥饿再投喂对长蛸存活、生长以及肌肉脂肪酸和氨基酸的影响[J]. 水生生物学报, 2020, 44(2): 372-378. SONG M P, WANG J H, CHEN Z W, et al. Effects of cyclical starvation-refeeding on survival, growth, and muscle fatty acids, amino acids ofoctopus minor[J]. Acta Hydrobiologica Sinica, 2020, 44(2): 372-378 (in Chinese). |
| [28] |
张振宇, 王秋荣, 叶坤, 等. 禁食对养殖大黄鱼体成分、肌肉脂肪酸组成和血清生化指标的影响[J]. 水产学报, 2016, 40(9): 1440-1450. ZHANG Z Y, WANG Q R, YE K, et al. Effect of fasting on body composition, muscle fatty acid profiles and serum biochemical parameters of large yellow croaker (Larimichthys crocea)[J]. Journal of Fisheries of China, 2016, 40(9): 1440-1450 (in Chinese). |
| [29] |
覃川杰, 邵婷, 杨洁萍, 等. 饥饿胁迫对瓦氏黄颡鱼脂肪代谢的影响[J]. 水生生物学报, 2015, 39(1): 58-65. QIN C J, SHAO T, YANG J P, et al. The effect of starvation on lipid metabolism of darkbarbel catfish, Pelteobagrus vachelli[J]. Acta Hydrobiologica Sinica, 2015, 39(1): 58-65 (in Chinese). |
| [30] |
SARGENT J R, TOCHER D R, BELL J G. The lipids[M]//HALVER J E, HARDY R W. Fish nutrition. 3rd ed. San Diego, California: Elsevier (Academic Press), 181-257.
|
| [31] |
SIDELL B D, CROCKETT E L, DRIEDZIC W R. Antarctic fish tissues preferentially catabolize monoenoic fatty acids[J]. Journal of Experimental Zoology, 1995, 271(2): 73-81. DOI:10.1002/jez.1402710202 |
| [32] |
MCKENZIE D J, HIGGS D A, DOSANJH B S, et al. Dietary fatty acid composition influences swimming performance in Atlantic salmon (Salmo salar) in seawater[J]. Fish Physiology and Biochemistry, 1998, 19(2): 111-122. DOI:10.1023/A:1007779619087 |
| [33] |
MOURENTE G, TOCHER D R. Effects of weaning onto a pelleted diet on docosahexaenoic acid(22:6 n-3)levels in brain of developing turbot (Scophthalmus maximus L.)[J]. Aquacultur, 1992, 105(3/4): 363-377. |
| [34] |
SARGENT J R, BELL J G, BELL M V, et al. Requirement criteria for essential fatty acids[J]. Journal of Applied Ichthyology, 1995, 11(3/4): 183-198. |
| [35] |
ZABELINSKII S A, CHEBOTAREVA M A, KOSTKIN V B, et al. Phospholipids and their fatty acids in mitochondria, synaptosomes and myelin from the liver and brain of trout and rat: a new view on the role of fatty acids in membranes[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1999, 124(2): 187-193. DOI:10.1016/S0305-0491(99)00113-3 |
| [36] |
张辉, 单安山, 牟振波, 等. 鱼类脂类代谢调控机制[J]. 饲料工业, 2008, 29(2): 41-44. ZHANG H, SHAN A S, MOU Z B, et al. Regulation mechanism of lipids metabolism in fish[J]. Feed Industry, 2008, 29(2): 41-44 (in Chinese). |
| [37] |
刘文斌, 徐维娜, 李向飞, 等. 鱼类脂肪沉积与调控的研究进展[C]//中国畜牧兽医学会动物营养学分会第十一次全国动物营养学术研讨会论文集. 长沙: 中国农业科学技术出版社, 2012: 203-213. LIU W B, XU W N, LI X F, et al. Research progress on lipid deposition and its regulation[C]//Proceedings of the 11th National Symposium on Animal Nutrition, Animal Nutrition Branch, Chinese Animal Husbandry and Veterinary Society. Changsha: China Agricultural Science and Technology Press, 2012: 203-213. (in Chinese). |
| [38] |
CHO H K, KONG H J, NAM B H, et al. Molecular cloning and characterization of olive flounder (Paralichthys olivaceus) peroxisome proliferator-activated receptor γ[J]. General and Comparative Endocrinology, 2009, 163(3): 251-258. DOI:10.1016/j.ygcen.2009.04.018 |
| [39] |
KLIEWER S A, SUNDSETH S S, JONES S A, et al. Fatty acids and eicosanoids regulate gene expression through direct interactions with peroxisome proliferator-activated receptors alpha and gamma[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(9): 4318-4323. DOI:10.1073/pnas.94.9.4318 |
| [40] |
RIBET C, MONTASTIER E, VALLE C, et al. Peroxisome proliferator-activated receptor-alpha control of lipid and glucose metabolism in human white adipocytes[J]. Endocrinology, 2010, 151(1): 123-133. DOI:10.1210/en.2009-0726 |
| [41] |
NILSSON-EHLEP N, GARFINKEL A S, SCHOTZ M C. Lipolytic enzymes and plasma lipoprotein metabolism[J]. Annual Review of Biochemistry, 1980, 49(1): 667-693. DOI:10.1146/annurev.bi.49.070180.003315 |
| [42] |
宁丽军. 尼罗罗非鱼过氧化物体增殖激活受体(PPARα)激活及其降脂机制研究[D]. 博士学位论文. 上海: 华东师范大学, 2016. NING L J. The activation and the related regulatory mechanism of PPARα in lipid metabolism of Nile tilapia, Oreochromis niloticus[D]. Ph. D. Thesis. Shanghai: East China Normal University, 2016. (in Chinese) |
| [43] |
马细兰, 黄文俞, 刘炎丰. 饥饿-复投喂对虎龙斑FAS及CPT-1A表达的影响[J]. 惠州学院学报, 2018, 38(6): 15-20. MA X L, HUANG W Y, LIU Y F. Effect of starvation and re-feeding on the expression of FAS and CPT-1A in Hulong grouper[J]. Journal of Huizhou University, 2018, 38(6): 15-20 (in Chinese). |




