2. 新疆肉乳用草食动物营养重点实验室, 乌鲁木齐 830052
2. Xinjiang Key Laboratory of Meat & Milk Production Herbivore Nutrition, Urumqi 830052, China
动物肌内脂肪的含量和积累使肌肉表现出大理石花纹状,影响和决定着肉的品质,动物体内脂肪的沉积最先是皮下脂肪沉积,再是内脏脂肪沉积,最后才是肌间脂肪的沉积;这就要求实现对脂肪代谢的调控,最大可能地增加动物体内脂肪的合成与沉积, 才能实现脂肪在肌间的沉积。柠檬酸作为脂代谢中的关键产物,对脂肪的代谢起着重要的调控作用,高浓度的柠檬酸可活化柠檬酸裂解酶,产生大量的乙酰辅酶A,乙酰辅酶A和柠檬酸共同激活乙酰辅酶A羧化酶,促进丙二酰辅酶A的合成,从而促进脂肪酸的合成[1]。赵俭[2]研究发现柠檬酸经过柠檬酸裂解酶催化生成草酰乙酸和乙酰辅酶A, 它们对真菌生物脂肪积累具有重要调节作用。杨文洲等[3]研究发现柠檬酸能够促进酵母菌体内三羧酸循环,而三羧酸循环直接影响脂代谢。田静[4]研究发现,柠檬酸合成酶基因与牛肉脂肪性状、含量、分布和品质显著相关。国内针对柠檬酸对脂肪细胞脂肪代谢的影响尚未见报道,柠檬酸对脂肪代谢影响和调控机制有待深入研究。本试验通过研究不同剂量的柠檬酸对小鼠脂肪代谢的影响,以期促进脂肪的合成与沉积,并在细胞分子水平上利用酶联免疫吸附试验(ELISA)的双抗夹心法检测脂肪在合成和分解代谢中生成的关键限速酶、代谢产物的含量,阐述柠檬酸对脂肪代谢调控的整体影响,探索其对脂肪代谢调控的机制,为实现调控脂肪代谢提供新的思路和理论依据,也为今后实现动物肌肉内脂肪的沉积改善肉品品质奠定理论基础。
1 材料与方法 1.1 试验设计试验于2016年10月至2017年9月在新疆农业大学肉乳用草食动物营养重点实验室进行。按照单因素试验设计,在细胞培养液中加入不同剂量的柠檬酸作为不同组,试验组柠檬酸剂量分别为20 (试验Ⅰ组)、50(试验Ⅱ组)、200 μmol/L(试验Ⅲ组),对照组(CK组)不添加柠檬酸,在0、36和72 h收集细胞冻存、以备送检;每组3个平行样,每个平行样3次重复。
1.2 试验材料小鼠前脂细胞(3T3-L1细胞)购于上海赛笠生物技术公司;柠檬酸、DMEM高糖培养基、胎牛血清(FBS)、乙二胺四乙酸(EDTA)、磷酸盐缓冲液(PBS)、青-链霉素试剂、3-异丁基-1-甲基黄嘌呤(IBMX)、地塞米松(DEX)、胰岛素(INS)均购于美国GIBCO公司;试验所用ELISA试剂盒均由上海美轩生物技术公司生产。
1.3 试验方法 1.3.1 试剂配制完全培养基组成为89% DMEM高糖培养基、10%胎牛血清(FBS)、1%青-链霉液;诱导液Ⅰ由完全培养基添加0.5 mmol/L IBMX、1 μmol/L DEX、5 mg/L INS组成;诱导液Ⅱ由完全培养基添加5 mg/L INS组成。
1.3.2 细胞培养参照郭秀玲等[5]方法。将小鼠前脂细胞放入含10%胎牛血清的完全培养基中,在37 ℃、5% CO2饱和湿度条件下培养,待细胞融合度达80%左右,将细胞传代接种到培养板中常规培养,融合度达80%时诱导,先用诱导液Ⅰ培养2 d, 再换诱导液Ⅱ培养2 d, 更换完全培养基培养的第14天, 按试验设计剂量加入含柠檬酸完全培养基培养细胞,于0、36、72 h收集细胞进行后续检测。
1.3.3 细胞形态观察细胞经过油红O染色,采用光学显微镜观察细胞形态。
1.3.4 代谢产物和酶含量的测定试验中各种代谢产物和酶含量的测定均参照闫莉等[6]的双抗夹心法。试验收集的细胞冻存后送由上海赛笠生物技术公司检测。
1.4 统计方法数据用平均值(mean)±标准差(SD)表示,用SPSS 22.0进行单因素方差分析,并用LSD法进行多重比较。
2 结果 2.1 柠檬酸对小鼠脂肪细胞脂滴形态的影响不同柠檬酸水平下小鼠脂肪细胞脂滴形态见图 1。
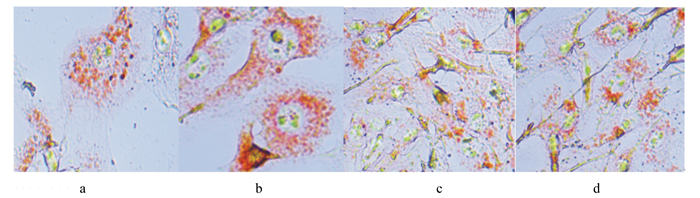
|
a:对照组CK group;b:试验Ⅰ组test group Ⅰ;c:试验Ⅱ组test group Ⅱ;d:试验Ⅲ组test group Ⅱ。 图 1 柠檬酸对小鼠脂肪细胞脂滴形态的影响(72 h,油红O染色) Figure 1 Effects of citric acid on lipid droplet morphology of mouse adipocytes (72 hours, oil red O staining, 400×)s |
由表 1可知,在36和72 h时,试验Ⅰ组醛缩酶(FDA)含量均显著高于对照组(P<0.05),试验Ⅱ和Ⅲ组FDA含量均极显著高于对照组(P<0.01);各试验组果糖-6-磷酸激酶(6-PFK)、葡萄糖-6-磷酸脱氢酶(G6PD)、丙酮酸脱氢酶E1(PDHE1)、二氢硫辛酸转乙酰基酶(DLAT)、甘油二酯转酰基酶2(DGAT2)含量与对照组在0、36、72 h差异均不显著(P>0.05);在36和72 h时,各试验组二氢硫辛酰胺脱氢酶(DLD)、乙酰辅酶A羧化酶(ACC)、脂肪酸合成酶(FAS)含量均极显著高于对照组(P<0.01)。
|
|
表 1 柠檬酸对小鼠脂肪细胞TG合成中关键限速酶含量的影响 Table 1 Effects of citric acid on key rate-limiting enzyme contents in TG synthesis of mouse adipocytes |
由表 2可知,在36和72 h时,试验Ⅰ、Ⅱ、Ⅲ组激素敏感脂肪酶(HSL)含量均极显著低于对照组(P<0.01),各试验组间差异不显著(P>0.05);在0、36和72 h时,各试验组甘油三酯水解酶(TGH)含量与对照组差异均不显著(P>0.05);在0 h时,各试验组肉碱脂酰转移酶1(CPT1)含量与对照组差异不显著(P>0.05),在36和72 h时,各试验组CPT1含量均极显著低于对照组(P<0.01),各试验组间差异不显著(P>0.05)。
|
|
表 2 柠檬酸对小鼠脂肪细胞TG分解代谢中关键限速酶含量的影响 Table 2 Effects of citric acid on key rate-limiting enzyme contents in TG catabolism of mouse adipocytes |
由表 3可知,在0 h时,各试验组TG含量与对照组差异均不显著(P>0.05),在36和72 h时,试验Ⅰ、Ⅱ、Ⅲ组TG含量均显著高于对照组(P<0.05);各试验组甘油二酯(DG)含量在各时间点与对照组相比差异均不显著(P>0.05);在36和72 h时,各试验组游离脂肪酸(FFA)含量均极显著低于对照组(P<0.01), 各试验组间差异不显著(P>0.05);在0 h时,各试验组丙酮酸(PA)含量与对照组差异不显著(P>0.05),在36和72 h时,各试验组丙酮酸(PA)含量均显著高于对照组(P<0.05);在36和72 h时,各试验组乙酰辅酶A含量均极显著低于对照组(P<0.01), 各试验组差异不显著(P>0.05)。
|
|
表 3 柠檬酸对小鼠脂肪细胞TG代谢产物含量的影响 Table 3 Effects of citric acid on the contents of TG metabolites of mouse adipocytess |
6-PFK、G6PD和FDA是脂代谢过程糖酵解的关键限速酶,能够催化葡糖糖向丙酮酸的代谢。本试验中,添加不同剂量的柠檬酸各试验组的6-PFK和G6PD含量均高于对照组,但差异不显著,在36和72 h时,试验Ⅰ组的FDA含量在均显著高于对照组,试验Ⅱ和Ⅲ组均极显著高于对照组。而Khu等[7]研究发现糖代谢中G6PD和FDA的含量升高能够促进细胞对糖的利用增加脂肪的合成和沉积,门丽媛等[8]研究也证实FDA的表达量升高能够显著提高TG的合成和沉积,这与本试验结果一致,说明添加不同剂量的柠檬酸能够促进小鼠脂肪细胞内糖的酵解,为合成TG提供更多的原料,而各试验组PA的含量均显著高于对照组也能证明这一点。
PDHE1、DLAT、DLD统称为丙酮酸脱氢酶复合体,是丙酮酸进入线粒体脱羧生成生脂原料乙酰辅酶A的关键酶系,DLAT和DLD在该酶系中起到主要调节作用,二者共同作用使该酶系复合物磷酸化和去磷酸化而调节其活性。本试验中,添加不同剂量柠檬酸对PDHE1和DLAT含量影响不大,在36和72 h时,各试验组DLD的含量极显著提高。程钰蓉等[9]研究发现,丙酮酸脱氢酶系活性增加脂肪合成增强,其活性抑制能够降低脂肪的合成。与本试验结果相似,这说明添加不同剂量的柠檬酸能够提高细胞中丙酮酸脱氢酶系的活性,从而促进丙酮酸的代谢,为合成TG提供更多的乙酰辅酶A等原料。
ACC是细胞内以乙酰辅酶A为原料合成脂肪酸的重要限速酶,柠檬酸是其激活剂,能够催化乙酰辅酶A生成丙二酰辅酶A,进而合成脂肪。本试验中,添加不同剂量的柠檬酸各试验组能够极显著提高ACC的含量,且各试验组之间差异不显著。Mao等[10]和Barber等[11]研究证实,ACC活性增加能够促进细胞TG的合成与沉积,这与本试验结果一致。
FAS是一个多酶复合体,在脂肪酸从头合成中起催化作用。本试验结果表明,添加不同剂量柠檬酸能够极显著提高FAS的含量,且各试验组之间差异不显著。Dentin等[12]研究证实FAS活性的高低直接控制脂肪合成的强弱,其基因表达水平升高能够显著增加TG的沉积,充分证明本试验结果。
3.2 柠檬酸对小鼠脂肪细胞TG分解关键限速酶含量的影响TG的存在是一个合成和分解动态平衡的结果,其在合成的同时分解也在进行。HSL在脂肪分解中起到决定性作用,是分解脂肪的最关键的限速酶。本试验中,添加不同剂量柠檬酸的各试验组HSL的含量均极显著低于对照组,且各试验组之间差异不显著。这与Lorente-Cebrián等[13]与Chong等[14]研究结果一致,说明柠檬酸能够极显著降低HSL含量和活性,从而抑制TG在胞内的分解。
TGH存在细胞质、脂滴和细胞膜上,是催化TG水解的重要脂肪酶。Cornaciu等[15]、Chakrabarti等[16]和Serr等[17]研究发现TGH的表达抑制能够促进TG的沉积,袁禹惠[18]研究发现,高脂营养水平能够抑制脂肪的沉积,但是对TGH的表达和TGH含量影响并不显著,与本试验结果一致。这表明添加柠檬酸对TGH含量影响不显著, 说明本试验中柠檬酸主要是通过抑制HSL合成从而抑制了TG的分解,从而增加了TG在胞内的沉积。
CPT1是转运活化的脂肪酸(脂酰辅酶A)进入线粒体进行氧化分解的关键限速酶。本试验结果表明,添加柠檬酸的各试验组CPT1的含量均在36和72 h时均极显著低于对照组, 各试验组之间差异均不显著。董婧[19]、Abu-Elheiga等[20]研究证实抑制CPT1的表达和CPT1合成能够抑制脂肪的氧化,增加脂肪的沉积。与本试验结果一致。这说明柠檬酸能够抑制脂肪细胞内CPT1的含量,抑制脂肪酸的β氧化分解,从而增加了TG在脂肪细胞内的沉积。
3.3 柠檬酸对小鼠脂肪细胞TG代谢产物含量的影响本试验中,添加柠檬酸各试验组TG的含量在36和72 h时均显著高于对照组,各试验组之间差异不显著,说明一定剂量的柠檬酸能够促进小鼠脂肪细胞TG的合成和沉积,且20 μmol/L为最佳。这是因为在脂肪酸合成过程中,首先,柠檬酸能够作为激活剂催化乙酰辅酶A生成丙二酰辅酶A, 而生成的丙二酰辅酶A越多,细胞合成的脂肪酸和TG也就越多;其次,柠檬酸参与柠檬酸-丙酮酸循环,葡萄糖分解产生的丙酮酸进入线粒体经一系列酶催化生成乙酰辅酶A与柠檬酸结合通过线粒体膜进入胞液内,用于合成脂肪酸进而合成TG;再次,柠檬酸作为糖代谢关键中间产物,其本身经过一系列酶的催化可以生成用于合成脂肪酸的原料乙酰辅酶A。童晋[21]研究结果表明细胞内柠檬酸合成酶与柠檬酸含量表达上升能够增加脂肪酸和脂肪的合成增加,与本试验结果类似。
DG和FFA既是TG的合成前体同时也是其分解产物,在本试验中添加不同浓度柠檬酸的各试验组FFA的含量均极显著低于对照组,这与杨竹青等[22]通过烟酸抑制TG分解从而显著降低细胞中FFA含量结果一致,因为添加柠檬酸能够显著降低TG水解酶HSL的含量,所以FFA的含量显著降低。
PA作为脂代谢的关键中间产物,和柠檬酸构成柠檬酸-丙酮酸循环转运合成脂肪的原料乙酰辅酶A,在本试验中各试验组PA的含量均高于对照组。Wang等[23]研究发现在脂代谢的调控过程,多余的葡萄糖会诱导葡萄糖激酶、丙酮酸激酶、ACC及FAS等表达,从而促进脂肪的合成。
乙酰辅酶A是脂代谢最关键的中间产物,由糖分解代谢产生用于脂肪的合成代谢。本试验中各试验组的乙酰辅酶A的含量均极显著低于对照组,但是本试验结果显示添加柠檬酸能够促进丙酮酸脱氢酶系中DLAT、DLD的含量,促进丙酮酸的代谢生成更多的乙酰辅酶A, 分析原因是因为添加了柠檬酸更好的激活了ACC的作用,使糖酵解生成的乙酰辅酶A更多用于合成脂肪。王倩倩等[24]研究发现,ACC表达上升能够显著促进鹅脂肪细胞中TG的合成,同时降低脂肪合成原料乙酰辅酶A在细胞的内的含量,与本试验结果一致。
4 结论① 柠檬酸能够促进小鼠脂肪细胞TG的合成, 抑制TG的分解,增加小鼠脂肪中脂肪含量和沉积,添加20 μmol/L柠檬酸最佳。
② 柠檬酸能够显著或极显著提高合成TG合成代谢中的关键限速酶FDA、ACC、FAS的含量,能够极显著抑制TG分解代谢中关键限速酶HSL、CPT1的含量。
③ 柠檬酸能够显著提高TG代谢的中间产物PA含量,能够极显著降低FFA和乙酰辅酶A的含量。
| [1] |
邹思湘. 动物生物化学[M]. 4版. 北京: 中国农业出版社, 2017.
|
| [2] |
赵俭. 不同真菌来源的ATP-柠檬酸裂解酶基因的克隆与表达[D]. 硕士学位论文. 武汉: 华中农业大学, 2011: 2-9. http://cdmd.cnki.com.cn/article/cdmd-10504-1011404700.htm
|
| [3] |
杨文洲, 薛永常, 农晓帆, 等. 柠檬酸对啤酒酵母TCA循环中有机酸的影响[J]. 大连轻工业学院学报, 2007, 26(4): 313-315. |
| [4] |
田静. 中国西门塔尔牛生产性能测定及CS基因多态性与肉质性状的关联分析[D]. 博士学位论文. 长春: 吉林大学, 2012: 3-21. http://cdmd.cnki.com.cn/Article/CDMD-10183-1013119169.htm
|
| [5] |
郭秀玲, 徐民岗, 张秀丽, 等. 小鼠3T3-L1前脂肪细胞培养与诱导分化方法的建立[J]. 中国药物与临床, 2013, 12(13): 1542-1545, 1662. |
| [6] |
闫莉, 许言午, 王晓梁, 等. 双抗体夹心法检测3-硝基酪氨酸方法的建立及应用[J]. 中国应用生理学杂志, 2009, 25(4): 569-572. |
| [7] |
KHU L Y, STOREY K B, RUBSTOV A M, et al. Regulation of glucokinase activity in liver of hibernating ground squirrel Spermophilus undulatus[J]. Biokhimiya, 2014, 79(7): 727-732. |
| [8] |
门丽媛, 刘帅, 宋士一, 等. 达乌尔黄鼠育肥过程和冬眠期白色脂肪组织糖代谢相关基因的差异表达[J]. 兽类学报, 2015, 35(4): 422-430. |
| [9] |
程钰蓉, 孙志杰, 崔球. 丙酮酸脱氢酶竞争性抑制剂调控裂殖壶菌脂肪酸合成的研究[J]. 食品工业科技, 2016, 37(16): 161-166. |
| [10] |
MAO J Q, DEMAYO F J, LI H G, et al. Liver-specific deletion of acetyl-CoA carboxylase 1 reduces hepatic triglyceride accumulation without affecting glucose homeostasis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(22): 8552-8557. DOI:10.1073/pnas.0603115103 |
| [11] |
BARBER M C, PRICE N T, TRAVERS M T. Structure and regulation of acetyl-CoA carboxylase genes of metazoa[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2005, 1733(1): 1-28. DOI:10.1016/j.bbalip.2004.12.001 |
| [12] |
DENTIN R, BENHARMED F, PEGORIER J P, et al. Polyunsaturated fatty acids suppress glycolytic and lipogenic genes through the inhibition of ChREBP nuclear protein translocation[J]. Journal of Clinical Investigation, 2005, 115(10): 2843-2854. DOI:10.1172/JCI25256 |
| [13] |
LORENTE-CEBRIÁN S, KULYTÉ A, HEDÉN P, et al. Relationship between site-spcific HSL phosphorylation and adipocyte lipocyte in obese women[J]. Obesity Facts, 2011, 4(5): 365-371. DOI:10.1159/000334036 |
| [14] |
CHONG X, HE J H, JIANG H F, et al. Direct effect of glucocorticoids on lipolysis in adipocytes[J]. Molecular Endocrinology, 2009, 23(8): 1161-1170. DOI:10.1210/me.2008-0464 |
| [15] |
CORNACIU I, BOESZOERMENYI A, LINDERMUTH H, et al. The minimal domain of adipose triglyceride (ATGL) ranges until leucine 254 and can be activated and inhibited by cgi-58 and GS respectively[J]. PLoS One, 2011, 6(10): 26349. DOI:10.1371/journal.pone.0026349 |
| [16] |
CHAKRABARTI P, KANDROR K V. FoxO1 controls insulin-dependent adipose triglyceride lipase (ATGL) expression and lipolysis in adipocytes[J]. Journal of Biological Chemistry, 2009, 284(20): 13296-13300. DOI:10.1074/jbc.C800241200 |
| [17] |
SERR J, SUH Y, LEE K. Regulation of adipose triglyceride lipase by fasting and refeeding in avian species[J]. Poultry Science, 2009, 88(12): 2585-2591. DOI:10.3382/ps.2009-00265 |
| [18] |
袁禹惠. 饲料中脂肪及花生四烯酸水平对半滑舌鳎(Cynoglossus semilaevis)幼鱼生长、脂肪酸组成及代谢相关基因表达的影响[D]. 硕士学位论文. 青岛: 中国海洋大学, 2015: 2-9. http://cdmd.cnki.com.cn/Article/CDMD-10423-1015719097.htm
|
| [19] |
董婧. 肉碱对鲤鱼幼鱼脂肪酸代谢调控作用的研究[D]. 博士学位论文. 长春: 吉林农业大学, 2014: 2-6. http://cdmd.cnki.com.cn/Article/CDMD-10193-1014052784.htm
|
| [20] |
ABU-ELHEIGA L, MATZUK M M, ABO-HASHEMA K A, et al. Continuous fatty acid oxidation and reduce fat storage in mice lacking acetyl-CoA carboxylase 2[J]. Science, 2001, 291: 2613-2616. DOI:10.1126/science.1056843 |
| [21] |
童晋. 油菜柠檬酸合酶与柠檬酸裂解酶基因克隆及功能研究[D]. 博士学位论文. 北京: 中国农业科学院, 2009: 3-21. http://cdmd.cnki.com.cn/Article/CDMD-82101-2009152072.htm
|
| [22] |
杨竹青, 瞿明仁, 赵向辉, 等. 烟酸对反刍动物脂类代谢和肉质的影响及其作用机制[J]. 动物营养学报, 2013, 25(6): 1150-1157. |
| [23] |
WANG Y X, JONES V B, URS S, et al. The human fatty acid synthase gene and de novo lipogenesis are coordinately regulated in human adipose tissue[J]. The Journal of Nutrition, 2004, 134(5): 1032-1038. DOI:10.1093/jn/134.5.1032 |
| [24] |
王倩倩, 杨彪, 夏丽丽, 等. 鹅乙酰辅酶A酰基转移酶2基因的克隆及其在鹅肥肝形成过程中的表达变化[J]. 畜牧兽医学报, 2016, 47(4): 700-708. |




