研究表明,肉鸡饲养环境温度达到32 ℃时即可发生显著的热应激反应[1]。肉鸡为满足适应高温环境的需要,机体主动改变体内多种物质的代谢,以维持机体高温环境下的热平衡。热应激危害的程度与热应激引起机体营养物质吸收、代谢改变密切相关[2]。国内外研究者研究肉鸡发生热应激时血清部分生化指标的变化,初步证实了热应激发生时机体体内营养物质吸收、代谢发生了显著的变化[3-4]。但这些数据无法从整体上系统全面的揭示机体重要营养物质吸收、代谢状况,对发生热应激时的差异性代谢标志物以及代谢通路改变的情况仍无法得知,阻碍了从调控营养物质吸收、代谢的角度来缓解热应激危害的思路。代谢组学研究能借助高通量分析技术更直接、准确和系统地反映机体多种生命存续状态下机体体内代谢物的总和。利用代谢组学技术鉴定疾病发生过程中的特异性生物标志物,可为疾病的早期诊断和提出针对性的治疗措施提供依据[5-6]。检测肉鸡热应激时血清全部小分子物质的组成轮廓有助于进一步揭示热应激引起肉鸡危害的机制,但尚缺乏采用代谢组学方法分析肉鸡热应激时血清全部代谢物的变化的研究。因此,本研究拟采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术,结合模式识别方法研究急性热应激时肉鸡血清代谢组学变化,鉴定热应激发生时肉鸡差异代谢物及代谢通路的变化,进一步阐明肉鸡热应激发生机制,为早期诊断和防治热应激提供新思路。
1 材料与方法 1.1 试验设计鸡舍使用前1周按照清洁消毒程序进行处理,分别用电子加热器和加湿器进行温控和湿控。试验开始时,购进的爱拔益加(AA)商品肉鸡按照饲养标准适应性饲养至28日龄,选择60只健康AA肉鸡,随机分为标准饲养组(对照组)和热环境饲养组(热应激组)2组,每组5个重复,每个重复6只鸡,于同一笼饲养。继续适应性饲养7 d至肉鸡35日龄开始正式试验。对照组肉鸡饲养舍内继续按照饲养标准设定的温度饲养,热应激组饲养舍内温度调至(32±1) ℃,均持续12 h。饲养舍内相对湿度均控制在(60±5)%。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验开始12 h后,分别从每重复(笼)肉鸡中随机抽取2只鸡,每组共抽取10只鸡用于试验,单侧翅下静脉一次性采集非抗凝血2 mL。血液置于4 ℃冰箱12 h,再置于37 ℃水浴锅温育20 min,4 ℃、3 000 r/min离心10 min,收集血清,待测。
1.3 样本前处理血清和L-2-氯-苯丙氨酸(0.3 mg/mL)按照1 : 5比例放入离心管漩涡10 s充分混匀。添加按照2 : 1体积比配制的甲醇和乙腈溶液150 μL析出蛋白质,置于-20 ℃低温环境静置10 min;借助超声波作用完成提取后再次于-20 ℃下冷却静置10 min,15 000 r/min低温离心10 min,取150 μL上清挥干后加入80 μL 15 mg/mL甲氧胺盐酸吡啶溶液完成肟化反应;加入80 μL含1%三甲基氯硅烷(TMCS)的N, O-双(三甲基硅烷基)三氟乙酰胺(BSTFA)衍生试剂和20 μL的正己烷,于70 ℃反应60 min。采用GC-MS仪对取出后放置于室温条件下30 min的样品进行代谢组学分析。
1.4 GC-MS分析气相色谱飞行时间质谱联用仪(7890A-5975C,Agilent公司,美国)用于本次试验数据采集。制备好的样品采用无分流模式注入GC-MS系统,经DB-5MS毛细管柱分离后进行质谱检测。以流速1.0 mL/min高纯氦气为载气。升温程序为50~125 ℃,15 ℃/min;125~210 ℃,5 ℃/min;210~270 ℃,10 ℃/min;270~305 ℃,20 ℃/min;305 ℃维持5 min。进样口温度、电子轰击电离源温度、电压分别设定为260、230 ℃和70 V。质量扫描范围(m/z)50~600,5 min后以20谱/s开始采集信号。
1.5 质控样本试验以2组AA肉鸡血清样品提取物充分混合制备质控样本。采用相同的方法处理和检测制备好的质控样本。仪器分析操作过程中,每5个分析样本中插入1个质控样本,以验证本次试验分析过程的准确性和重复性。
1.6 数据分析GC-MS的原始数据经ChromaTOF软件(v 4.34,LECO公司,美国)进行预处理,导出包括样品信息、保留时间-质核比和质谱响应强度的三维数据矩阵CSV格式的文件。去除内标峰以及假阳性峰(包括噪音、柱流失和衍生物化试剂峰),并进行去冗余和峰合并,分析样本得到144个代谢物。样本质谱峰的响应强度归一化后的数据矩阵导入SIMCA-P+14.0软件包,采用主成分分析法(PCA)和偏最小二乘法(PLS-DA)分析各样本之间的总体分布、分析过程的稳定性和各组间代谢轮廓的总体差异,鉴定组间差异代谢物。PLS-DA分析中,变量权重值(variable important in projection,VIP)大于1的变量被认为是差异变量。通过7次循环交互验证分析法以及200次响应排序检验分析法防止试验分析模型过拟合。
1.7 代谢物的鉴定结合PLS-DA多维分析和t检验的单维分析方法筛选对照组与热应激组2组组间差异代谢物(VIP>1,P < 0.05)。差异代谢物鉴定时,GC-MS工作站软件自动把本试验中检测到的每种物质的特征离子片段谱的质荷比和丰度与NIST数据库、Feihn代谢组学数据库标准代谢物质进行比对,其标准物质选择标准要求匹配度超过70%。
1.8 代谢通路富集分析使用MBRole数据库(http://csbg.cnb.csic.es/mbrole/)的ID转换功能,获取差异代谢物的KEGG数据库(http://www.genome.jp/kegg/pathway.html)的物质ID;结合2个数据库的通路分析和通路富集功能,鉴别出对照组与热应激组2组肉鸡血清中表现出来的显著差异代谢通路;下载数据库生成的代谢通路图和肉鸡热应激时代谢通路富集分析柱状图。
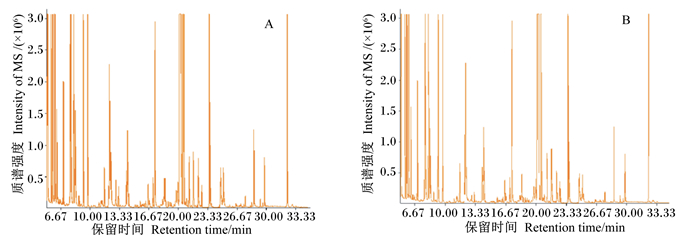
2 结果 2.1 2组血清样品的GC-MS图谱图 1显示了对照组和热应激组2组肉鸡具有代表性的血清样品的GC-MS检测总离子流图。图中显示本试验过程中仪器收集血清代谢物质的信号较强,生成的峰保留时间和容量均能达到试验要求。将血清检测质谱图与NIST数据库标准质谱图对比,其匹配程度超过70%的代谢物共144种。结合多元统计和单维统计的方法分析热应激组与对照组2组间肉鸡血清代谢物差异,描绘代谢组学特征。
|
图 1 GC-MS检测获得的对照组(A)和热应激组(B)总离子流图 Figure 1 A total ion chromatograms (TICs) of control group (A) and heat-stressed group (B) by GC-MS analysis |
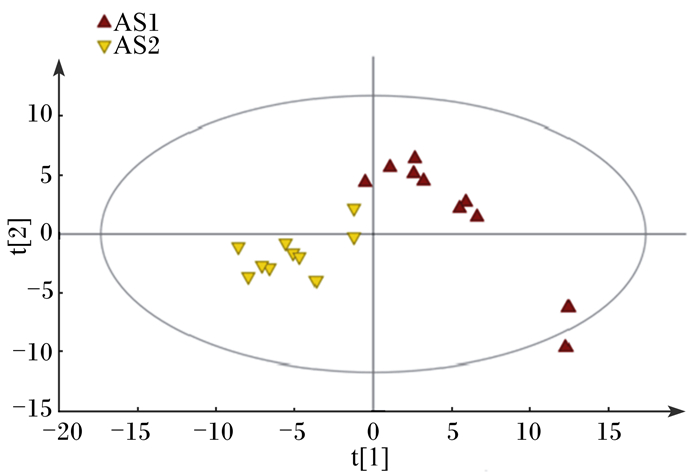
图 2显示了2组血清代谢物的PCA分析结果。从图中可以看出,有效样本属于95%的置信区间范围。PCA分析显示其解释率较高/强(RX2=0.514>0.5),证实该分析模型可靠[7]。由图可见,对照组与热应激组主要分布在不同的象限,说明对照组和热应激组有一定的组间差异性,各试验组间的差异性是真实存在的。
|
图 2 血清样品GC-MS的PCA得分图 Figure 2 PCA score scatter plots of serum samples |
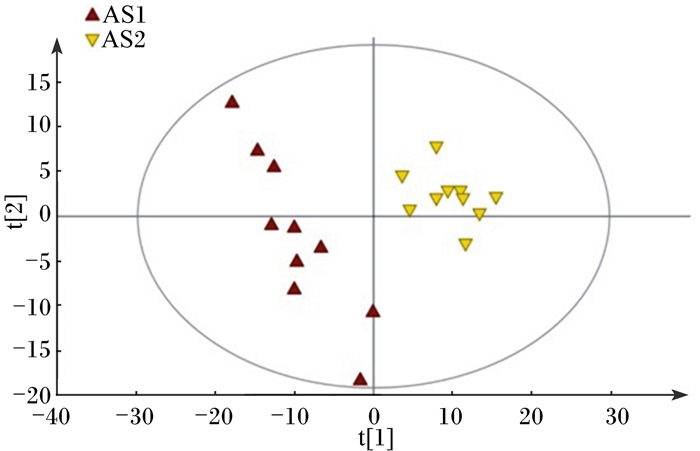
为了消除与分类不相关的噪音信息,在PCA模型的基础上,建立了PLS-DA模型(RX2=0.808,RY2=0.936,Q2=0.738),进一步分析对照组与热应激组血清代谢模式的变化。Q2=0.738>0.5表示模型具有较好的判别分析能力[7]。PLS-DA模型得分图(图 3)显示,对照组与热应激组2组肉鸡血清代谢物在主成分坐标轴上分离较好,差异确实存在。
|
图 3 血清样品GC-MS的PLS-DA得分图 Figure 3 PLS-DA score scatter plots of serum samples |
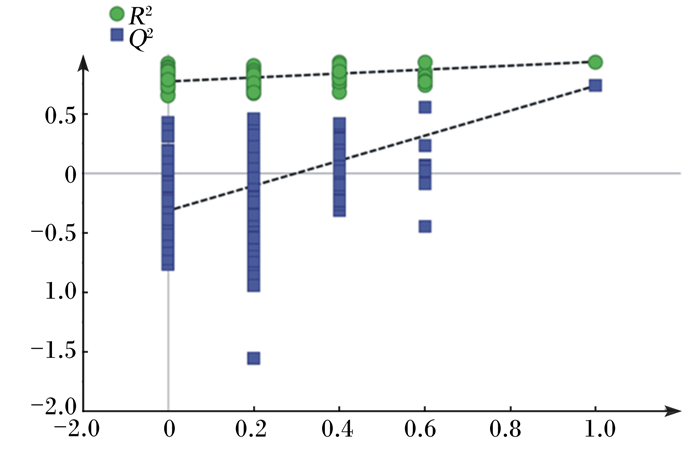
采用200次响应排序的方法对模型的稳健性进行考察,结果见图 4,其中R2=0.771>0.5,Q2=-0.314 < 0,说明此模型是稳定可靠的。
|
图 4 使用200次响应法对PLS-DA进行验证的点图 Figure 4 Validation plots of PLS-DA with 200 permutation |
通过PLS-DA分析后,并根据VIP>1及t检验的P<0.05的相对变量标准分析结果,将代谢物的峰面积进行归一化处理,经过相对定量,筛选出30种差异代谢物(VIP>1,P < 0.05)。其中延胡索酸、3-羟丁酸、丙氨酸等14种代谢物含量上调[差异倍数(FC)>1],草酸、苹果酸、二羟基丙酮等16种代谢物含量下调(FC < 1)(表 1)。
2.4 相关代谢通路富集分析相关代谢通路富集分析结果见图 5。其中热应激对三羧酸循环代谢通路影响极显著(P < 0.01),对丙酸盐代谢通路影响次之(P < 0.01),此外,代谢通路富集分析还表明半乳糖代谢、精氨酸和脯氨酸代谢、乙醛酸和二羧酸代谢、脂肪酸生物合成和不饱和脂肪酸生物合成代谢通路在急性热应激过程中也均发生显著变化(P < 0.05)。
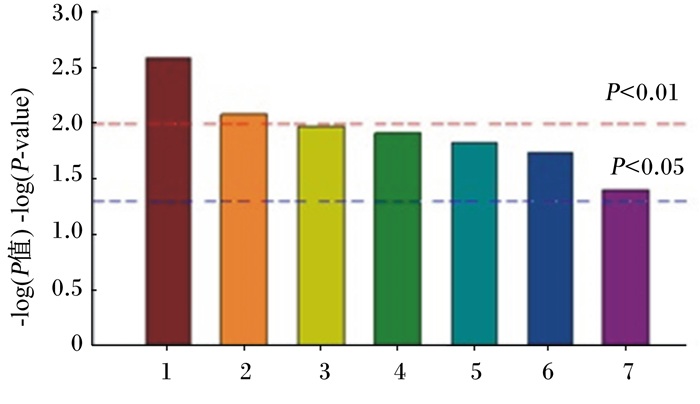
|
1:三羧酸循环;2:丙酸盐代谢;3:半乳糖代谢;4:乙醛酸和二羧酸代谢;5:脂肪酸生物合成;6:不饱和脂肪酸生物合成;7:精氨酸和脯氨酸代谢。 1: TCA cycle; 2: propanoate metabolism; 3: galactose metabolism; 4: glyoxylate and dicarboxylate metabolism; 5: fatty acid biosynthesis; 6: biosynthesis of unsaturated fatty acids; 7: arginine and proline metabolism. 图 5 代谢通路富集分析 Figure 5 Metabolic pathway enrichment analysis |
热应激时机体在高环境温度中为适应外界环境会引起机体营养物质吸收、代谢的改变。研究表明,热应激时机体部分组织的基因转录、蛋白质表达方面发生了显著的变化[8-9],但上述变化是如何最终引起机体代谢通路的变化及最终代谢物的变化不得而知。本研究利用GC-MS技术共鉴定出肉鸡血清中144种代谢物,其中差异代谢物30种。通过代谢通路富集分析发现,三羧酸循环代谢通路发生了最显著的变化。同时,丙酸盐代谢、半乳糖代谢、脂肪酸生物合成等代谢通路也发生显著改变。
3.1 能量代谢异常肉鸡发生热应激时,机体需要动员自身能量适应外界环境。Hu等[10]研究表明,热应激可通过调节细胞能量代谢如改变细胞腺苷酸活化蛋白激酶(AMPK)活性发挥抗热应激作用。此外,热应激时其线粒体功能受到影响,产生脂质过氧化产物可抑制三羧酸循环过程中酶以及呼吸链复合酶的活性[11-12]。本试验通过代谢通路富集分析发现,三羧酸循环代谢通路发生了最显著的变化。这提示热应激时机体三羧酸循环代谢过程中一些酶的活性可能发生显著改变,从而导致该循环的一些代谢中间产物如延胡索酸无法正常进入循环参与代谢引起体内该类物质含量发生显著变化。同时,血清中苹果酸含量显著降低,提示热应激发生时,其对三羧酸循环中由延胡索酸生成苹果酸的步骤影响更为显著。因此,可通过在饲粮中添加三羧酸循环的中间代谢物质改善三羧酸循环效率,提高肉鸡抗热应激的能力。
|
|
表 2 对照组和热应激组差异代谢物鉴定 Table 2 Identification of significantly different metabolites of control group and heat-stressed group |
热应激导致机体能量消耗增多,代谢速率加快,并下调果糖和甘露糖代谢[13-14]。本试验研究表明,热应激时肉鸡血清中糖代谢通路相关代谢物,如蔗糖、赤藻糖醇、β-甘露糖等含量显著降低,表明热应激导致机体能量代谢异常,机体需加速分解糖类从而提供更多能量,以对抗应激状态。D-核糖是5-磷酸核糖和其他含有该单糖代谢物的前体,而5-磷酸核糖为合成RNA和DNA的原料。肉鸡热应激时血清中D-核糖的含量显著升高。因此推测热应激过程中DNA合成的减少可能与D-核糖含量无关,而与由D-核糖合成DNA过程失去控制有关[15]。此外,D-核糖参与机体腺苷酸如ATP合成与再生,进而维持心脏和骨骼肌的能量平衡。这与Gu等[16]报道不一致,可能与热应激维持的时间长短有关。此外,肌肉中代谢肌酸可增加肌糖原含量,从而提高热应激肉鸡的散热能力[14]。KEGG路径富集后进一步分析表明,三羧酸循环发生了显著改变,且乙醛酸和二羧酸代谢在热应激中也表现出异常。这与乙醛酸代谢通路产生的柠檬酸盐和琥珀酸盐,在生物氧化呼吸链反应中充当催化剂,二羧酸转运蛋白又可将柠檬酸、琥珀酸等物质转运到胞内参与能量的合成,进而调控能量代谢有关[17]。
3.2 脂质代谢异常高温环境致使肉鸡基础代谢率发生显著变化,腹脂作为额外能量贮存形式沉积增多[18-19]。本研究结果发现,热应激肉鸡血清中羟丁酸、油酸、棕榈油酸等多种脂质代谢的相关指标有显著差异,说明肉鸡热应激发生时脂质代谢出现紊乱,这与Xiong等[20]的研究结果一致。此外,肉鸡热应激时采食量下降导致能量缺乏,进而引起机体动员周围组织脂肪供能。此时如生成的脂肪酸进入肝脏经β-氧化生成大量酮体,不能被机体肝外组织充分利用,进入血液循环后引起高酮血症[21]。本研究结果表明,热应激肉鸡血清中羟丁酸的含量显著升高,说明肉鸡热应激时由于脂肪大量动员供能,大量的脂肪酸进入体内,肝外组织利用酮体的能力低于肝中合成酮体量,导致酮体类物质显著增加[22]。
机体中油酸、棕榈油酸、花生四烯酸等是动物体内不饱和脂肪酸存在的重要形式。油酸可提高动物机体能量代谢效率,通过调节动物体内脂类物质代谢相关酶的活性发挥脂类分解和沉积的作用[23-24]。棕榈油酸在体内发挥调节葡萄糖代谢和脂质特别三酰甘油的合成,同时还可调节脂酶的活性[25]。花生四烯酸除作为磷脂结合的结构直接调节脂类代谢外,还可以通过白细胞三烯、血栓烷素A2、前列腺素E2的间接途径发挥调节脂质代谢作用[26]。试验表明肉鸡热应激时血清多种不饱和脂肪酸含量显著增加,可能是机体为应对热应激时能量代谢的需要而出现的短暂的上升,也是脂肪定向沉积的搬运形式。上述结果提示,饲粮中通过添加具有促进脂肪代谢的不饱和酸有利于减少热应激时脂肪代谢紊乱的发生。
综合上述物质含量的变化规律,经KEGG路径分析表明,热应激肉鸡血清中饱和和不饱和脂肪酸合成通路均发生了显著变化。因此,揭示脂质代谢通路特别是饱和和不饱和脂肪合成途径改变机制,是急性肉鸡热应激代谢机制的又一重要研究课题。
3.3 氨基酸代谢异常碳架结构和氨是氨基酸在体内分解的最终形式。碳架结构可继续参与机体糖、脂代谢,氨以含氮代谢废物的形式排出体外。本研究结果显示,热应激肉鸡血清中丙氨酸的含量显著增加,推测可能是丙氨酸在体内参与能量代谢有关。丙氨酸-葡萄糖循环是其发挥能量代谢的重要途径[27]。肉鸡发生热应激时,机体需要调整体内能量代谢过程来适应高温环境,作为能量的提供形式,葡萄糖的消耗伴随大量丙酮酸的生成,为了维持能量持续供给,此时需要丙氨酸代谢通路的参与[28]。此外,机体内精氨酸、脯氨酸可通过氨基酸转化途径生成谷氨酰胺,然后在丙氨酸转氨酶作用下,脱去氨基生成三羧酸循环途径的重要中间物质α-酮戊二酸提供能量。在这一过程中,通过脱氨基作用,丙氨酸迅速转变为丙酮酸促进机体内三羧酸供能循环的进行[29]。血清中天冬氨酸含量在本试验过程中呈现显著下降的趋势。热应激影响了机体的血液循环系统,机体通过消耗大量的天冬氨酸向心肌输送钾离子、镁离子增强心肌收缩功能,降低氧耗,减轻热应激对心肌的危害。此外,肉鸡热应激时需要消耗大量的葡萄糖供能对抗热应激发生的危害,此时,生糖氨基酸如天冬氨酸通过糖异生途径生成葡萄糖,缓解机体代谢过程中葡萄糖含量不足的问题[30]。热应激时氨基酸代谢特征分析表明,饲粮中添加一些具有生糖或促进能量物质吸收的氨基酸有助于热应激的防控。
另外,经KEGG数据库查阅发现,除丙酸盐代谢通路(KEGG数据库ID号gga00640)发生显著改变外,机体精氨酸、脯氨酸代谢也参与热应激反应过程。肉鸡热应激时机体蛋白质分解代谢增强,为避免此时产生的氨对机体造成危害,需要及时排出体外,而精氨酸是体内氨排出过程的重要中间代谢物。脯氨酸是机体内重要渗透压调节物质,其代谢通路变化可能与机体热应激时脱水引起的机体内环境渗透压的改变有密切关系。此外,精氨酸和脯氨酸合成和代谢与肠道功能密切相关,其代谢通路异常可能与肠道在肉鸡急性热应激过程中有重要影响有关。今后通过加强精氨酸和脯氨酸在热应激肉鸡肠道功能的影响,有助于为揭示急性肉鸡热应激发生机理和防治肉鸡急性热应激提供新线索。
4 结论① 本试验应用GC-MS技术的代谢组学方法研究了肉鸡热应激时血清中小分子代谢物的改变,共有30种差异代谢物被鉴别出,其中14种物质上调,16种物质下调,说明热应激时肉鸡为适应高温环境其营养物质代谢发生了显著的变化。
② 通过代谢通路富集研究发现,三羧酸循环、脂肪酸生物合成、精氨酸和脯氨酸代谢通路等发生显著改变。
| [1] |
NAJAFI P, ZULKIFLI I, JAJULI N A, et al. Environmental temperature and stocking density effects on acute phase proteins, heat shock protein 70, circulating corticosterone and performance in broiler chickens[J]. International Journal of Biometeorology, 2015, 59(11): 1577-1583. DOI:10.1007/s00484-015-0964-3 |
| [2] |
BAUMGARD L H, RHOADS R P Jr, et al. Effects of heat stress on postabsorptive metabolism and energetics[J]. Annual Review of Animal Biosciences, 2013, 1(1): 311-337. DOI:10.1146/annurev-animal-031412-103644 |
| [3] |
姜润深, 夏文涛, 陈兴勇, 等. 利用热应激初期血清生化指标的变化幅度评价鸡的耐热性能[J]. 中国农业大学学报, 2011, 16(2): 114-117. |
| [4] |
XIE J J, TANG L, LU L, et al. Effects of acute and chronic heat stress on plasma metabolites, hormones and oxidant status in restrictedly fed broiler breeders[J]. Poultry Science, 2015, 94(7): 1635-1644. DOI:10.3382/ps/pev105 |
| [5] |
MONTE A A, BROCKER C, NEBERT D W, et al. Improved drug therapy:triangulating phenomics with genomics and metabolomics[J]. Human Genomics, 2014, 8: 16. DOI:10.1186/s40246-014-0016-9 |
| [6] |
郭延生, 贾启鹏, 陶金忠. 基于GC-MS策略的奶牛热应激血液代谢组学研究[J]. 畜牧兽医学报, 2015, 46(8): 1356-1362. |
| [7] |
张征, 雷治海, 贾翠翠, 等. 基于血清代谢组学研究Kisspeptin对热应激大鼠的保护作用[J]. 畜牧与兽医, 2017, 49(3): 72-77. |
| [8] |
COBLE D J, FLEMING D, PERSIA M E, et al. Rna-seq analysis of broiler liver transcriptome reveals novel responses to high ambient temperature[J]. BMC Genomics, 2014, 15: 1084. DOI:10.1186/1471-2164-15-1084 |
| [9] |
LUO Q B, SONG X Y, JI C L, et al. Exploring the molecular mechanism of acute heat stress exposure in broiler chickens using gene expression profiling[J]. Gene, 2014, 546(2): 200-205. DOI:10.1016/j.gene.2014.06.017 |
| [10] |
HU H, BAI X, WEN A, et al. Assessment of interactions between glutamine and glucose on meat quality, AMPK, and glutamine concentrations in pectoralis major meat of broilers under acute heat stress[J]. The Journal of Applied Poultry Research, 2016, 25(3): 370-378. DOI:10.3382/japr/pfw021 |
| [11] |
HUANG C, JIAO H, SONG Z, et al. Heat stress impairs mitochondria functions and induces oxidative injury in broiler chickens[J]. Journal of Animal Science, 2015, 93(5): 2144-2153. DOI:10.2527/jas.2014-8739 |
| [12] |
ZHANG J F, HU Z P, LU C H, et al. Dietary curcumin supplementation protects against heat-stress-impaired growth performance of broilers possibly through a mitochondrial pathway[J]. Journal of Animal Science, 2015, 93(4): 1656-1665. DOI:10.2527/jas.2014-8244 |
| [13] |
PEARCE S C, GABLER N K, ROSS J W, et al. The effects of heat stress and plane of nutrition on metabolism in growing pigs[J]. Journal of Animal Science, 2013, 91(5): 2108-2118. DOI:10.2527/jas.2012-5738 |
| [14] |
LU Z, HE X F, MA B B, et al. Chronic heat stress impairs the quality of breast-muscle meat in broilers by affecting redox status and energy-substance metabolism[J]. Journal of Agricultural and Food Chemistry, 2017, 65(51): 11251-11258. DOI:10.1021/acs.jafc.7b04428 |
| [15] |
BELHADJ SLIMEN I, NAJAR T, GHRAM A, et al. Heat stress effects on livestock:molecular, cellular and metabolic aspects, a review[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(3): 401-412. DOI:10.1111/jpn.2016.100.issue-3 |
| [16] |
GU Z T, WANG H, LI L, et al. Heat stress induces apoptosis through transcription-independent p53-mediated mitochondrial pathways in human umbilical vein endothelial cell[J]. Scientific Reports, 2014, 4: 4469. |
| [17] |
YANG C Y, GAO Q, LIU C, et al. The transcriptional response of the pacific oyster Crassostrea gigas against acute heat stress[J]. Fish & Shellfish Immunology, 2017, 68: 132-143. |
| [18] |
DE ANTONIO J, FERNANDEZ-ALARCON M F, LUNEDO R, et al. Chronic heat stress and feed restriction affects carcass composition and the expression of genes involved in the control of fat deposition in broilers[J]. The Journal of Agricultural Science, 2017, 155(9): 1487-1496. DOI:10.1017/S0021859617000624 |
| [19] |
HE S J, ZHAO S J, DAI S F, et al. Effects of dietary betaine on growth performance, fat deposition and serum lipids in broilers subjected to chronic heat stress[J]. Animal Science Journal, 2015, 86(10): 897-903. DOI:10.1111/asj.2015.86.issue-10 |
| [20] |
XIONG Y, DONG S, ZHAO X, et al. Gene expressions and metabolomic research on the effects of polyphenols from the involucres of Castanea mollissima blume on heat-stressed broilers chicks[J]. Poultry Science, 2016, 95(8): 1869-1880. DOI:10.3382/ps/pew170 |
| [21] |
FERNANDEZ M W V, JOHNSON J S, ABUAJAMIEH M, et al. Effects of heat stress on carbohydrate and lipid metabolism in growing pigs[J]. Physiological Reviews, 2015, 3(2): e12315. |
| [22] |
MA D K, LI Z J, LU A Y, et al. Acyl-coa dehydrogenase drives heat adaptation by sequestering fatty acids[J]. Cell, 2015, 161(5): 1152-1163. DOI:10.1016/j.cell.2015.04.026 |
| [23] |
KIM H E, GRANT A R, SIMIC M S, et al. Lipid biosynthesis coordinates a mitochondrial-to-cytosolic stress response[J]. Cell, 2016, 166(6): 1539-1552. DOI:10.1016/j.cell.2016.08.027 |
| [24] |
TIAN H, ZHENG N, WANG W J, et al. Integrated metabolomics study of the milk of heat-stressed lactating dairy cows[J]. Scientific Reports, 2016, 6: 24208. DOI:10.1038/srep24208 |
| [25] |
LEE J, ELLIS J M, WOLFGANG M J. Adipose fatty acid oxidation is required for thermogenesis and potentiates oxidative stress-induced inflammation[J]. Cell Reports, 2015, 10(2): 266-279. |
| [26] |
WU D, XU J, SONG E B, et al. Acetyl salicylic acid protected against heat stress damage in chicken myocardial cells and may associate with induced hsp27 expression[J]. Cell Stress and Chaperones, 2015, 20(4): 687-696. DOI:10.1007/s12192-015-0596-x |
| [27] |
WILSON K, HESS J, ZHANG G F, et al. Metabolism of beta-alanine in rat liver:degradation to acetyl-coa and carboxylation to 2-(aminomethyl)-malonate[J]. The FASEB Journal, 2017, 31(1): 655. |
| [28] |
MCCOMMIS K S, CHEN Z J, FU X R, et al. Loss of mitochondrial pyruvate carrier 2 in the liver leads to defects in gluconeogenesis and compensation via pyruvate-alanine cycling[J]. Cell Metabolism, 2015, 22(4): 682-694. DOI:10.1016/j.cmet.2015.07.028 |
| [29] |
RAUCKHORST A J, GRAY L R, SHELDON R D, et al. The mitochondrial pyruvate carrier mediates high fat diet-Induced increases in hepatic TCA cycle capacity[J]. Molecular Metabolism, 2017, 6(11): 1468-1479. DOI:10.1016/j.molmet.2017.09.002 |
| [30] |
SNIPE R M J, KHOO A, KITIC C M, et al. Carbohydrate and protein intake during exertional heat stress ameliorates intestinal epithelial injury and small intestine permeability[J]. Applied Physiology, Nutrition, and Metabolism, 2017, 42(12): 1283-1292. DOI:10.1139/apnm-2017-0361 |




