霉菌毒素(mycotoxins)是一类由丝状真菌所产生的次级代谢产物,能直接经口摄入动物和人体内,也能够通过食用被污染的农产品、饲料、肉制品及奶制品进入动物和人体内,对免疫系统、生殖系统、神经系统、胃肠道等多种组织器官造成不同程度的危害[1]。玉米赤霉烯酮(zearalenone,ZEN)与脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)是目前农产品及饲料中污染率最高的2种霉菌毒素[2],均具有较强的氧化毒性[3-4],而氧化损伤被认为是引起大多数疾病的主要致病机理。研究表明,ZEN具有雌激素效应,过量ZEN会导致母猪产生“雌激素综合征”,公猪出现雄激素分泌下降、雌性化和性欲下降等症状,ZEN中毒是导致生猪繁殖障碍的重要因素[5]。Sprando等[6]研究指出,DON能致大鼠生殖细胞变性与激素分泌紊乱。
茶多酚(tea polyphenols,TP)是由茶叶提取的一种有效活性成分。黄烷醇是茶多酚的主要成分,具有基础的抗氧化结构,大量的酚羟基结构能够与自由基直接反应,生成稳定的酚氧自由基,因此茶多酚是一种天然的抗氧化剂。其抗氧化性远高于维生素C、维生素E及人工合成的丁基羟基甲苯(BHT)等[7-8]。此外,茶多酚还具有增强机体抵抗力、延缓衰老、抑制细菌生长、抑制病毒、降血糖和血脂、防肿瘤、防辐射、减少心血管类疾病发生等功能[9-14],推测茶多酚也可能是一种有效缓解霉菌毒素毒性的保护剂。因此,本试验以昆明小鼠为研究对象,通过测定茶多酚对ZEN与DON联合染毒小鼠睾丸脏器系数、精子质量、睾丸组织标志酶活性、血清性激素含量、睾丸组织氧化与抗氧化功能以及睾丸组织形态学的影响,探讨茶多酚对ZEN与DON联合毒性的缓解效果,为ZEN及DON引起雄性动物生殖毒性的防控提供试验依据。
1 材料与方法 1.1 试验试剂与材料茶多酚购于上海信裕生物科技有限公司;ZEN标准品(含量≥99%)和DON标准品(含量≥99%)购于美国Sigma公司;碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、乳酸脱氢酶(LDH)和γ-谷氨酰转移酶(γ-GGT)的测定试剂盒购于深圳迈瑞生物医疗电子股份有限公司;促卵泡激素(FSH)、睾酮(T)、黄体生成素(LH)、雌二醇(E2)、丙二醛(MAD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的酶联免疫吸附试验(ELISA)试剂盒购于南京森贝伽生物科技有限公司;Infinite-M200 PRO酶标仪购于澳大利亚帝肯TECAN公司;CX31正置光学显微镜购于日本OLYMPUS公司;7170A全自动生化分析仪购于日本Hatachi公司。
1.2 试验动物及分组选取8周龄雄性昆明小鼠75只[体重(40±5) g],随机分成5组,每组分别灌服生理盐水(对照组)、200 mg/kg茶多酚(Ⅰ组)、1 mg/kg ZEN+0.5 mg/kg DON(Ⅱ组)、100 mg/kg茶多酚+1 mg/kg ZEN+0.5 mg/kg DON(Ⅲ组)和200 mg/kg茶多酚+1 mg/kg ZEN+0.5 mg/kg DON(Ⅳ组),每组15只。
1.3 标准品试剂的配制用1 mL二甲基亚砜将1 mg ZEN标准品溶于ZEN的棕色瓶中,配成1 mg/mL的ZEN储备液,密封存放于4 ℃冰箱内备用。DON标准品的配制方法同ZEN。用生理盐水配制成10、20 mg/mL的茶多酚的生理盐水溶液,以0.01 mL/g的量对小鼠进行灌胃。
1.4 试验饲粮及饲养管理基础饲粮组成及营养水平见表 1。试验小鼠按照分组情况分笼饲养,每笼3只。试验期间小鼠自由采食和饮水,饲养温度为24~26 ℃,保证周围环境清洁卫生,每3 d换1次垫料,保证充足采食、饮水,自然光照。适应性饲养7 d后,从第8天开始试验,各组小鼠按照不同的处理每天早上进行灌胃,连续4周,试验过程中,每天观察记录小鼠的生长状况。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
分别于试验的第1、14、28天,每组随机选取5只小鼠进行称重和采样。采用摘眼球采血法,收集并分离血清分装于灭菌的离心管中,置于-20 ℃冰箱存放。采用颈椎脱臼法处死,分离两侧附睾,分别放入1 mL事先预热37 ℃的生理盐水(0.9%)中,剪碎,进行精子活力、数量和畸形率检查;分离两侧的睾丸并精确称取脏器重量,将小鼠的一侧睾丸放入4%多聚甲醛溶液中固定,用以制作组织切片,另一侧及时放于液氮中冻存后转移至-80 ℃冰箱中保存,待后续试验使用。
1.6 小鼠睾丸脏器系数测定采用颈椎脱臼法处死小鼠后进行解剖,分离两侧的睾丸,生理盐水漂洗,再用滤纸吸干多余水分之后用精密分析天平称重脏器重量,计算脏器系数。
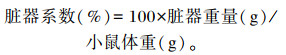
|
将两侧附睾分别放入1 mL事先预热37 ℃的生理盐水(0.9%)中,剪碎,放入37 ℃恒温箱内孵育15 min,使精子充分游离。利用光学显微镜和血球计数板计数活精子数量和总精子数量。计算精子活率与精子数量。使用伊红染色制作涂片在光学显微镜下计数1 000个精子内畸形精子数量,计算精子畸形率。
1.8 睾丸组织标志酶活性测定从-80 ℃冰箱取出睾丸组织,加入9倍组织块重量预冷(4 ℃)过的生理盐水(0.9%),制备出10%的睾丸组织匀浆,用低温离心机(4 ℃)以10 000 r/min离心15 min,取上清液。检测指标包括AKP、ACP、LDH和γ-GGT活性。使用全自动生化分析仪检测以上指标,将检测出指标乘以稀释倍数为组织内酶的实际活性。
1.9 血清性激素含量测定将保存于-20 ℃的血清恢复室温,用于检测FSH、LH、T和E2含量。严格按照试剂盒说明书步骤进行操作,利用酶标仪在450 nm处读取吸光度(OD)值,计算血清性激素的含量。
1.10 睾丸组织氧化与抗氧化功能指标测定取睾丸组织上清液,进行MDA含量及SOD、GSH-Px和CAT活性检测。严格按照试剂盒说明书步骤进行操作,采用酶标仪进行测定,于450 nm处读取OD值,计算睾丸组织内各项氧化与抗氧化指标。
1.11 睾丸病理组织切片制作将4%多聚甲醛固定的小鼠睾丸组织块用石蜡包埋后用切片机切片,然后进行苏木精-伊红(HE)染色,封片后使用光学显微镜进行观察。
1.12 数据统计与分析本试验数据均以平均值±标准差(X±SD)表示,利用SPSS 20.0统计软件进行方差分析,多重比较采用LSD法。P < 0.05为差异显著。
2 结果 2.1 小鼠睾丸脏器系数由表 2可知,DON与ZEN联合染毒致小鼠睾丸脏器系数降低。试验第14和28天,Ⅰ、Ⅲ和Ⅳ组小鼠睾丸脏器系数与对照组相比差异不显著(P>0.05),Ⅲ和Ⅳ组小鼠睾丸脏器系数均显著高于Ⅱ组(P < 0.05)。
|
|
表 2 小鼠睾丸脏器系数 Table 2 Testicular organ coefficient of mice |
由表 3可知,DON与ZEN联合染毒使小鼠精子活率和精子数量下降,精子畸形率上升。随着时间推移,与试验第1天相比,试验第14和28天Ⅱ组小鼠精子活率与精子数量显著降低(P < 0.05),精子畸形率显著升高(P < 0.05)。试验第14和28天,Ⅰ、Ⅲ、Ⅳ组小鼠精子活率、精子数量和精子畸形率与对照组相比差异不显著(P>0.05);与Ⅱ组相比,Ⅰ、Ⅲ、Ⅳ组精子活率与精子数量显著升高(P < 0.05),精子畸形率显著降低(P < 0.05)。
|
|
表 3 小鼠精子质量 Table 3 Sperm quality of mice |
由表 4可知,DON与ZEN联合染毒致小鼠睾丸组织内AKP、LDH和γ-GGT活性降低。试验第14和28天,Ⅰ、Ⅲ和Ⅳ组小鼠睾丸组织内AKP、LDH和γ-GGT活性与对照组相比差异不显著(P>0.05),Ⅲ和Ⅳ组小鼠睾丸组织内AKP、LDH和γ-GGT活性均显著高于Ⅱ组(P < 0.05)。整个试验期间,各组ACP活性变化不显著(P>0.05)。
|
|
表 4 小鼠睾丸组织标志酶活性 Table 4 Marker enzymes activities in testicular tissue of mice |
由表 5可知,DON与ZEN联合染毒致小鼠血清中FSH、LH、T和E2含量降低。试验第14天,Ⅲ和Ⅳ组小鼠血清中FSH、LH、T和E2含量均显著高于Ⅱ组(P < 0.05)。试验第28天,血清E2含量与对照组相比显著降低(P < 0.05),Ⅲ和Ⅳ组小鼠血清中FSH、LH、T和E2含量均显著高于Ⅱ组(P < 0.05)。
|
|
表 5 小鼠血清性激素含量 Table 5 Serum sex hormone contents of mice |
由表 6可知,DON与ZEN联合染毒致小鼠睾丸组织内MDA含量升高。试验第14与28天,Ⅲ和Ⅳ组小鼠睾丸组织MDA含量均显著低于Ⅱ组(P < 0.05)。与试验第1天相比,在试验第14与28天时,Ⅱ和Ⅲ组小鼠睾丸组织CAT活性均显著降低(P < 0.05)。Ⅳ组中,试验第28天时,小鼠睾丸组织CAT活性与试验第1和14天相比显著降低(P < 0.05)。试验第14天时,Ⅱ、Ⅲ组小鼠睾丸组织CAT活性与对照组相比显著降低(P < 0.05),Ⅳ组小鼠睾丸组织CAT活性与Ⅱ组相比显著升高(P < 0.05)。试验第28天时,Ⅱ、Ⅲ、Ⅳ组小鼠睾丸组织CAT活性与对照组相比显著降低(P < 0.05)。
|
|
表 6 小鼠睾丸组织氧化与抗氧化指标 Table 6 Oxidative and antioxidant indexes in testicular tissue of mice |
DON与ZEN联合染毒致小鼠睾丸组织SOD活性降低。试验第14与28天,Ⅲ和Ⅳ组小鼠睾丸组织SOD活性均显著高于Ⅱ组(P < 0.05)。与试验第1天相比,试验第14与28天时,Ⅱ、Ⅲ组小鼠睾丸组织GSH-Px活性显著降低(P < 0.05)。试验第14天时,与对照组相比,Ⅰ组小鼠睾丸组织GSH-Px活性显著升高(P < 0.05),Ⅱ、Ⅲ、Ⅳ组小鼠睾丸组织GSH-Px活性显著降低(P < 0.05)。Ⅲ、Ⅳ组小鼠睾丸组织GSH-Px活性与Ⅱ组相比显著升高(P < 0.05)。试验第28天时,与对照组相比,Ⅰ组小鼠睾丸组织GSH-Px活性显著升高(P < 0.05),Ⅱ、Ⅲ组小鼠睾丸组织GSH-Px活性显著降低(P < 0.05)。Ⅲ、Ⅳ组小鼠睾丸组织GSH-Px活性与Ⅱ组相比显著升高(P < 0.05),Ⅳ组显著高于Ⅲ组(P < 0.05)。
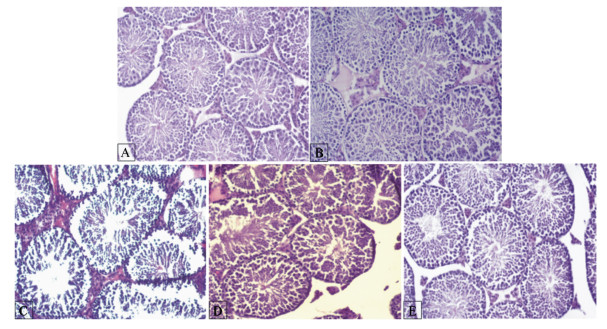
2.6 睾丸组织病理学变化图 1为试验第28天时睾丸组织的病理切片,对照组和Ⅰ组生精小管完整,管内支持细胞和各级生精细胞层次清晰完整,排列井然,管腔内成熟精子清晰可见。Ⅱ组生精小管基膜不完整,支持细胞和各级生精细胞排列紊乱无序,细胞减少,精原细胞与支持细胞之间出现空泡,初级精母细胞体积缩小,管腔内精子数量减少。茶多酚保护后,各组组织有所改善,Ⅳ组改善最为明显,各级生精细胞排列趋于正常,数量有所增加。
|
A:对照组control group;B:Ⅰ组group Ⅰ;C:Ⅱ组group Ⅱ;D:Ⅲ组group Ⅲ;E:Ⅳ组group Ⅳ。 图 1 睾丸组织病理切片 Fig. 1 Pathological section of mice testis tissue (100×) |
ZEN是一种具有类雌激素样作用的霉菌毒素,主要危害动物的生殖系统,DON作为饲料中检出率和检出量最高的霉菌毒素,常与ZEN共存于饲料中,对动物的生长性能、繁殖性能及免疫功能等造成损害,给养殖业造成了不可忽视的损失。根据王文祥等[16]、黄菊等[17]、逄健等[18]试验报道,确定了最佳染毒浓度(DON:0.5 mg/kg,ZEN:1 mg/kg)与茶多酚浓度范围(100~200 mg/kg),通过检测DON与ZEN联合染毒后小鼠的精子质量、睾丸脏器系数、睾丸组织标志酶活性、血清性激素含量、睾丸组织氧化与抗氧化功能以及茶多酚作用后各指标的变化,以研究DON与ZEN联合染毒对小鼠生殖毒性的影响以及茶多酚的保护作用,为后续研究提供参考依据。
睾丸作为雄性生殖系统的重要器官,易受温度、化学物质及药物的影响,发生功能障碍及形态学变化。赵丽华等[19]研究表明,大鼠砷中毒可使大鼠睾丸质量下降,生精上皮细胞排列紊乱,各级生精细胞减少,精子数量变少,且睾丸间质有充血和渗出。本研究中也出现类似的病理组织学变化,可见ZEN与DON联合染毒对小鼠睾丸造成了严重损伤,而茶多酚对该损伤具有缓解作用。在动物试验中,脏器系数是反映器官所受影响的重要指标[20],睾丸脏器系数能够综合反映小鼠睾丸受到的毒性损伤作用。精子质量直接反映了雄性动物的生殖能力,精子活率与精子畸形率是评测精子质量的重要标准[21],研究表明,通过给公猪饲喂含ZEN的饲粮能影响公猪精子质量,降低精液密度[22-23]。2.4 mg/kg DON通过插胃管的方式作用于大鼠28 d能使其精细胞数量减少[24]。本试验发现,ZEN与DON联合染毒降低了小鼠的睾丸脏器系数与精子质量,说明ZEN与DON联合染毒可降低大鼠的性发育水平,而添加茶多酚组小鼠精子质量明显改善,睾丸脏器系数明显升高,且与对照组差异不显著,说明茶多酚在缓解ZEN与DON联合生殖毒性作用上有良好的效果。
雄性生殖细胞的发育依赖于其生存的稳定内环境、激素以及相关酶类的调节[25]。有研究表明,睾丸组织标志酶在精子发生与成熟过程中起重要作用[26]。AKP主要存在于精原细胞及初级精母细胞上,与生精细胞分裂有关,也与精子发育早期阶段提供能量有关[27]。ACP分布于睾丸支持细胞的细胞质内,参与生精细胞变性过程,可作为衡量是否存在生精障碍的标志酶之一[28]。LDH主要存在于生精细胞的线粒体上,是生精上皮的标志性酶,保证精子有足够的能量成熟[29]。γ-GGT是睾丸支持细胞的特异性标志酶,它的活性变化与支持细胞的功能息息相关[30]。此外,睾丸的生理功能还依靠E2、T、FSH和LH等性激素来共同调节。T是一种甾体类激素,能够促进精子发生及成熟,刺激睾丸的生长发育,促进雄性动物发育出副性征并保持其正常状态。雄性动物睾丸和肾上腺皮质可分泌的少量E2,主要由T转化而来,能够在一定程度上调控雄性生殖系统发育。FSH由腺垂体产生,主要作用于生精小管内的支持细胞,促进精子的产生[31]。此外,腺垂体还分泌了LH,主要作用于睾丸间质细胞,睾丸间质细胞位于各生精小管之间的间质内,其主要作用是分泌雄激素,雄激素能够促进精子和生殖器官的生长发育。FSH、LH的含量受对应的促性腺激素释放激素(GnRH)信号、T、抑制素等反馈共同调节。本试验结果显示,ZEN与DON联合染毒降低了小鼠睾丸标志酶的活性与血清性激素含量,推测ZEN与DON可能影响了大鼠精子发生过程中的能量供给与变性过程,引起生精障碍,且导致小鼠性激素调节紊乱。经茶多酚保护后睾丸组织酶活性与血清性激素含量得到明显提高,表明茶多酚能够有效缓解ZEN与DON联合毒性对睾丸组织酶活性和血清性激素含量的影响。
大量研究显示,镰刀菌具有氧化毒性,通常自由基在机体内的产生与消除处于一种动态平衡之中,当遭受刺激的时候,体内自由基产生过多,氧化速度超出自由基清除的速度,即造成机体氧化损伤[31]。MDA是机体一种脂质过氧化产物,其在机体含量高低代表脂质过氧化反应的强弱[32]。CAT是一种催化酶,普遍存在于细胞之中,可以促进过氧化氢(H2O2)的分解,从而提高细胞抗氧化防御机制;SOD作为一种活性物质,能够催化超阴离子,通过减少机体的有害物质,从而达到抗氧化的效果[33]。GSH-Px是能分解过氧化物的一种酶,它不仅能清除和分解过氧化物,还能够减少其对机体的伤害,这些指标都反映机体的抗氧化能力,都是氧化和抗氧化防御系统的关键指标[34]。本试验结果显示,ZEN与DON联合攻毒增加了睾丸组织内MAD含量,降低了SOD、CAT及GSH-Px的活性,而茶多酚保护组小鼠睾丸组织内的氧化与抗氧化指标与对照组相比差异不显著,这表明茶多酚可以在一定程度上缓解ZEN与DON联合染毒对小鼠睾丸系统造成的氧化损伤。
4 结论试验结果表明,ZEN与DON联合染毒可致小鼠睾丸脏器系数、精子活力和数量下降,精子畸形率增加,血清性激素含量和睾丸组织内标志酶活性降低,抗氧化功能损伤,茶多酚可提高小鼠睾丸脏器系数和精子质量,增加血清性激素含量,增强睾丸生精相关酶活性与抗氧化功能,有效缓解ZEN与DON联合染毒对雄性小鼠的生殖毒性及氧化损伤。
| [1] |
JUAN C, RAIOLA A, MA ÑES J, et al. Presence of mycotoxin in commercial infant formulas and baby foods from Italian market[J]. Food Control, 2014, 39: 227-236. |
| [2] |
SMITH J E, SOLOMONS G, LEWIS C, et al. Role of mycotoxins in human and animal nutrition and health[J]. Neurogastroenterology & Motility, 2010, 3(4): 187-192. |
| [3] |
ABID-ESSEFI S, OUANES Z, HASSEN W, et al. Cytotoxicity, inhibition of DNA and protein syntheses and oxidative damage in cultured cells exposed to zearalenone[J]. Toxicology in Vitro, 2004, 18(4): 467-474. |
| [4] |
PETROV V, QURESHI M K, HILLE J, et al. Occurrence, biochemistry and biological effects of host-selective plant mycotoxins[J]. Food and Chemical Toxicology, 2018, 112: 251-264. |
| [5] |
闫昭明, 陈清华, 陈凤鸣. 玉米赤霉烯酮毒性研究[J]. 动物营养学报, 2018, 30(9): 3453-3458. |
| [6] |
SPRANDO R L, COLLINS T F X, BLACK T N, et al. Characterization of the effect of deoxynivalenol on selected male reproductive endpoints[J]. Food and Chemical Toxicology, 2005, 43(4): 623-635. DOI:10.1016/j.fct.2004.12.017 |
| [7] |
AHMED K K M, BARAL M. Tea polyphenols as antioxidants[J]. Free Radicals and Antioxidants, 2011, 1(2): 2-3. |
| [8] |
石惠宇, 闫素梅. 维生素A对动物氧化应激的减缓作用机制[J]. 动物营养学报, 2019, 31(6): 2458-2464. |
| [9] |
LAMBERT J D, YANG C S. Mechanisms of cancer prevention by tea constituents[J]. The Journal of Nutrition, 2003, 133(10): 3262S-3267S. DOI:10.1093/jn/133.10.3262S |
| [10] |
FRAGA C G, CROFT K D, KENNEDY D O, et al. The effects of polyphenols and other bioactives on human health[J]. Food & Function, 2019, 10(2): 514-528. |
| [11] |
SENTKOWSKA A, PYRZY N ′ SKA K. Investigation of antioxidant activity of selenium compounds and their mixtures with tea polyphenols[J]. Molecular Biology Reports, 2019, 46(3): 3019-3024. |
| [12] |
王慧敏, 朱军莉, 陆海霞, 等. 茶多酚抑制腐败希瓦氏菌机理研究[J]. 茶叶科学, 2014, 34(2): 149-155. |
| [13] |
李振, 陈现伟. 茶多酚的免疫调节作用及应用[J]. 中国兽药杂志, 2004, 38(4): 33-35. |
| [14] |
张劲, 彭天英, 张令君, 等. 茶多酚提取技术及其功能化研究进展[J]. 广东化工, 2019, 46(4): 86-87. |
| [15] |
元辉雄, 庞艳芳, 王俊利, 等. 铝对大鼠精子质量及精子线粒体的影响[J]. 中华男科学杂志, 2019, 25(7): 579-585. |
| [16] |
王文祥, 张文昌, 廖惠珍. 茶多酚对镉致大鼠精子损伤的保护作用[J]. 福建医科大学学报, 2011, 45(5): 319-322, 326. |
| [17] |
黄菊, 张光佑, 沈伶, 等. 茶多酚对大鼠卵巢卵泡发育的影响[J]. 汕头大学医学院学报, 2015, 28(2): 94-96. |
| [18] |
逄健, 孙中义. 小剂量玉米赤霉烯酮损害雄性小鼠生殖能力的研究[J]. 第三军医大学学报, 2017, 39(12): 1225-1230. |
| [19] |
赵丽华, 张爱君. 砷中毒对大鼠睾丸组织及精子形态的影响[J]. 中国地方病防治杂志, 2018, 33(4): 370. |
| [20] |
IBRAHIM A, NATARAJAN S, GHAFOORUNISSA. Dietary trans-fatty acids alter adipocyte plasma membrane fatty acid composition and insulin sensitivity in rats[J]. Metabolism, 2005, 54(2): 240-246. |
| [21] |
MOZAFFARIAN D, PISCHON T, HANKINSON S E, et al. Dietary intake of trans fatty acids and systemic inflammation in women[J]. The American Journal of Clinical Nutrition, 2004, 79(4): 606-612. |
| [22] |
HASCHEK W M, HALIBURTON J C.Fusarium moniliforme and zearalenone toxicoses in domestic animals: a review[M]//RICHARD J L, THURSTON J R.Diagnosis of mycotoxicoses.Dordrecht: Springer, 1986: 156.
|
| [23] |
刘彩艳. 猪玉米赤霉烯酮中毒的临床表现及其治疗[J]. 现代畜牧科技, 2016(9): 114. |
| [24] |
凌阿茹.脱氧雪腐镰刀菌烯醇诱导睾丸组织细胞凋亡及精子损伤的作用机制研究[C]//中国毒理学会第七次全国会员代表大会暨中国毒理学会第六次中青年学者科技论坛论文摘要.北京: 中国毒理学会, 2018: 2.
|
| [25] |
樊友平. 精液微量元素锌、硒对精子质量的影响[J]. 生殖与避孕, 2005(1): 63. |
| [26] |
王卫杰, 李惠, 王乐, 等. 饲料添加剂的蓄积对幼犬睾丸功能相关酶活性的影响[J]. 饲料博览, 2016(7): 1-3. |
| [27] |
张波, 徐光翠, 刘峰, 等. 氧乐果对小鼠睾丸特征性酶的影响及茶多酚的拮抗作用[J]. 环境与健康杂志, 2005, 22(5): 340-342. |
| [28] |
GENG X, SHAO H, ZHANG Z H, et al. Malathion-induced testicular toxicity is associated with spermatogenic apoptosis and alterations in testicular enzymes and hormone levels in male Wistar rats[J]. Environmental Toxicology and Pharmacology, 2015, 39(2): 659-667. |
| [29] |
郭海, 才秀莲, 王国秀. 锰诱导大鼠生精细胞凋亡过程中半胱氨酸酶-3 mRNA与增殖细胞核抗原表达变化[J]. 解剖学杂志, 2015, 38(1): 15-17, 103. |
| [30] |
李晓凤, 杨旸, 周义军. 妊娠期氰戊菊酯暴露对雄性仔鼠睾丸标志酶的影响[J]. 上海交通大学学报(医学版), 2011, 31(8): 1117-1120. |
| [31] |
丁皎, 孙应彪, 常旭红, 等. 硫酸镍对体外小鼠精原细胞所致氧化应激水平的研究[J]. 毒理学杂志, 2010, 24(1): 34-37. |
| [32] |
王希春, 曹利, 刘秦, 等. 脱氧雪腐镰刀菌烯醇和黄曲霉毒素B1单一及联合染毒对小鼠脑组织病理变化、抗氧化性能和紧密连接蛋白表达量的影响[J]. 浙江农业学报, 2019, 31(6): 886-892. |
| [33] |
杨小军, 贺喜, 何丽霞, 等. 日粮添加多不饱和脂肪酸对肉仔鸡抗氧化指标的影响[J]. 动物营养学报, 2008, 20(3): 299-304. |
| [34] |
UTOMO A, JIANG X Z, FURUTA S, et al. Identification of a novel putative non-selenocysteine containing phospholipid hydroperoxide glutathione peroxidase (NPGPx) essential for alleviating oxidative stress generated from polyunsaturated fatty acids in breast cancer cells[J]. Journal of Biological Chemistry, 2004, 279(42): 43522-43529. |




