2. 中国农业科学院特产研究所, 长春 130112;
3. 深圳市红狗宠物营养研究院, 深圳 518117
2. Institute of Special Animal and Plant Sciences, Chinese Academy of Agriculture Sciences, Changchun 130112, China;
3. Shenzhen Red Dog Pet Nutrition Institute, Shenzhen 518117, China
近年来,我国社会经济迅猛发展,人们生活水平显著提升,宠物作为伴侣动物已进入千家万户,养猫也已成为时下热门,越来越受到年轻人的追捧,宠物猫的健康也日益受到人们关注。然而,环境中大量存在的应激刺激(stress stimulation)对猫的健康造成严重威胁。应激刺激是指动物机体在受到内外环境的各种强烈刺激或长期作用时所产生的全身性非特异性适应性反应[1]。日常生活中宠物猫遇到的应激刺激主要有饥渴、冷热、运输、同伴动物的接触、噪音、疫苗注射、换笼、过敏反应、母猫妊娠期间激素的变化、受到恐惧和惊吓、环境突变、主人的怒斥及冷落等。应激会导致猫出现诸多行为学变化,如采食量下降、舔舐梳理被毛行为减少、安静喜卧、玩耍行为减少、探索行为减少、与其他猫和人类的互动行为减少、警觉性提高、尿液标记及攻击性行为增加等[2-3]。当猫遭受严重、突然、长期或慢性刺激时,甚至会诱发疾病,如严重的胃肠反应(呕吐、腹泻、厌食症、异食癖等),诱发抑郁症,感觉过敏综合征(feline hyperesthesia syndrome,FHS),精神源性脱毛等[4-5];有的导致严重的泌尿系统疾病,如尿失禁、尿频、尿色改变等,并可能加重猫自发性膀胱炎(feline idiopathic cystitis,FIC)的症状[6];最严重时部分猫罹患免疫系统抑制性疾病[7],甚至造成猝死。随着国内外科学养宠意识逐步建立,宠物食品行业近年也发展迅速,然而,人们对宠物食品和营养的关注点往往在其健康生长阶段(常规宠物食品)或疾病阶段(处方粮),经常忽视宠物处于应激状态等亚健康阶段风险,因此,相关研究也鲜有报道。Beata等[8]证明了作为一种γ-氨基丁酸激动剂的α-牛乳蛋白肽可以减少猫心理上的焦虑,减缓猫应激。在对人类应激营养的研究中发现,体内能量、氨基酸、维生素和矿物质等营养物质代谢增强[9]。在对农场动物的研究中也发现,母猪和仔猪饲粮中添加由多种维生素和氨基酸制成的复合抗氧化剂,表现出良好的抗应激效果,增强了动物机体抵抗力和对外界环境的适应能力[10]。据李昊阳等[11]的报道,常规的生理参数及血液指标,如心率、血细胞数目、血糖浓度、血清酶活性以及皮质醇(cortisol,COR)含量等可用来衡量应激。在应激状态下不同类型的饲粮对猫生长及有关生理指标会产生影响。因此,本研究拟通过建立猫应激刺激试验模型,对比分析提高猫饲粮中粗蛋白质、粗脂肪、维生素E和维生素C、精氨酸含量,能否改善猫应激状态下的生理状况和维持正常生长,以及对于不同应激环境效果有无差异,旨在为受到应激刺激的宠物猫提供基于饲粮营养调控可缓解应激的方案,提高动物福利。鉴于目前国内对缓解宠物应激的营养学评价未见报道,本研究也将提供一种缓解宠物应激的营养学评价策略与方法,为宠物应激的相关试验研究提供参考。
1 材料与方法 1.1 试验动物及设计在正式试验前,按照如下标准选择12只英国短毛猫:年龄在6月龄~3岁,平均体重为(3.70±0.76) kg,已做好驱虫及免疫,健康,无用药史,比较温顺,未处于疫苗接种或驱虫期、孕期、哺乳期、疾病防治或恢复期等特殊阶段,饲养在同一环境下超过1个月。基于随机区组设计将试验猫分为对照组(CON组)和试验组(CAS组),每组6只。试验期为3周,预试验1周,正式试验2周。
所有的试验设计都经过华中农业大学伦理委员会审查批准(HZAUCA-2019-007)。
1.2 试验饲粮及饲养管理CAS组日常主粮为缓解应激刺激全价处方猫粮(CAS),由深圳市某生物科技有限公司提供,其产品为以鸡胸肉、鱼油、豆油、卵磷脂等作为主原料的全价湿性宠物罐头食品,其组成及营养水平见表 1,其推荐饲喂量为每只猫每天150~250 g。CON组日常主粮为市售成年猫商品粮,即采用膨化工艺加工的全价干性宠物食品,其组成及营养水平见表 2,饲喂量为每只猫每天58~85 g。每只猫单笼饲养,有独立的活动空间,做好环境的日常消毒清洁,自由饮水。
|
|
表 1 CAS组饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the diet for CAS group (DM basis) |
|
|
表 2 CON组饲粮组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of the diet for CON group (DM basis) |
在正式试验的1周内同时给予猫运输及慢性适度应激刺激。具体方法见表 3。
|
|
表 3 应激刺激模型制造方法 Table 3 Method of stress stimulating model manufacture (00:00—23:59) |
于模型建立的第0、7、14天进行空腹体重称量,记录体温(肛温)、心率、血压、呼吸频率。
1.4.2 采食量测定模型建立前,记录1周的每只动物对日常饲粮的平均日采食量数据(收集每只动物正常食量)。模型建立后,每只每天饲喂2次,每次自由采食4~6 h;为了保证食物新鲜度,每次给予的食物均为刚开封的罐头食品;每天称量并记录每只每次的采食量。
1.4.3 血液采集与血液指标测定于模型建立的第0、7、14天采集血液检测相应指标,模型建立当天先开始采集5 mL全血,其中取2 mL加入乙二胺四乙酸二钠(EDTA-Na2)抗凝管中,轻弹管底,使血液充分抗凝,再取3 mL静置10 min,3 000 r/min离心10 min分离血清,将血清分装后放在-20 ℃冰箱,然后再进行建模操作。采用pocH-100iV Diff全自动动物血液分析仪[希森美康医用电子(上海)有限公司]测定全血血常规指标:白细胞(white blood cells, WBC)数目、淋巴细胞(lymphocyte, LYM)数目、嗜中性粒细胞(neutrophils, NEUT)数目、血红蛋白(hemoglobin, HGB)浓度及红细胞(red blood cells, RBC)数目。采用SPOTCHEMTM EZ SP-4430自动干式生化分析仪[爱科来医疗电子(上海)有限公司]测定血清生化指标:总蛋白(total proteins, TP)、白蛋白(albumin, ALB)、肌酐(creatine, CRE)、尿素氮(urea nitrogen, UN)、总胆固醇(total cholesterol, T-CHO)、甘油三酯(triglycerides, TG)含量及肌酸激酶(creatine kinase, CK)、乳酸脱氢酶(lactate dehydrogenase, LDH)、谷草转氨酶(aspartate aminotransferase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)活性。采用稳捷倍易血糖仪[美国强生(中国)有限公司]测定动物空腹血清葡萄糖(glucose,Glu)含量。采用酶联免疫吸附法测定血清抗氧化指标:超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活性及丙二醛(malondialdehyde, MDA)含量,试剂盒购自南京建成生物工程研究所。采用酶联免疫吸附试验法测定血清COR含量,试剂盒购自欣博盛科技有限公司。
1.5 数据分析试验数据采用Excel 2010软件进行整理,采用Graphpad Prism 8.0软件进行图形绘制及单因素方差分析(one-way ANOVA),LSD法进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。
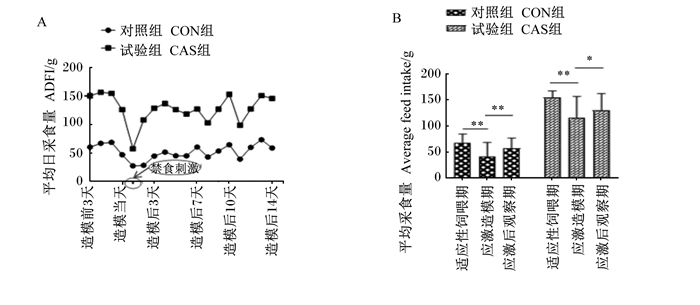
2 结果和分析 2.1 缓解应激刺激试验期间采食量的变化试验期间,每天记录12只猫的采食量,得到平均日采食量变化曲线图,如图 1-A所示。在整个试验过程中,可根据应激刺激造模阶段,将试验分为3个阶段——适应性饲喂期、应激造模期、应激后观察期,各个阶段的平均采食量如图 1-B所示,可以看出CON组在应激造模期的平均采食量较其他2个阶段的平均采食量极显著下降(P<0.01),CAS组应激造模期平均采食量较适应性饲喂期极显著下降(P<0.01),比应激观察期显著下降(P<0.05)。
|
造模前3天3 days before molding;造模当天the day of molding; 造模后3天3 days after molding; 造模后7天7 days after molding; 造模后10天10 days after molding; 造模后14天14 days after molding; 适应性饲喂期adaptive feeding period; 应激造模期stress modeling period; 应激后观察期post-stress observation period。 A:平均日采食量折线图;B:不同阶段平均采食量比较图。图B中,*表示差异显著(P<0.05);* *表示差异极显著(P<0.01)。A: line chart of average daily feed intake; B: comparison of average feed intake at different stages. In Fig.B, *mean significant difference (P<0.05); * *mean extremely significant difference (P<0.01). 图 1 试验期间采食量变化图 Fig. 1 Graph of changes in feed intake during trial period |
由表 4可知,在给予应激刺激期间试验猫体重均有所下降,但与第0天相比下降不显著(P>0.05),2组间差异不显著(P>0.05)。试验期间2组体温先下降后上升,第0天2组体温处于正常范围内,第7天CON组和CAS组体温处于最低水平,分别为37.69、37.85 ℃,相较于CON组,CAS组体温波动较小。CAS组第7天测得的心率在正常范围内,为(134.00±19.76)次/min,而CON组第7天心率为(140.33±9.50)次/min,超出正常范围,第14天2组测得的心率均超过正常140次/min。试验期间CON组和CAS组所测呼吸频率均超过正常范围,2组间无显著差异(P>0.05)。
|
|
表 4 基本生理指标分析表 Table 4 Analysis table of basic physiological indicators (n=6) |
由表 5可知,试验期间测得的全血白细胞数目处于正常范围,2组间无显著差异(P>0.05),CAS组第7天测得的全血白细胞数目与第0天相比显著下降(P<0.05),而CON组下降,但差异不显著(P>0.05),仍处于正常范围;应激刺激后全血红细胞数目都有升高,且均高于正常范围。CAS组在第7天时,测定的全血红细胞数目显著高于第0天(P<0.05),第14天与第0天相比血液中红细胞数目升高不显著(P>0.05)。CON组在第7、14天全血红细胞数目均显著高于第0天(P<0.05);血红蛋白浓度的变化与红细胞数目变化近似。全血嗜中性粒细胞数目、淋巴细胞数目2组间无显著差异(P>0.05)。
|
|
表 5 全血血常规指标分析表 Table 5 Analysis table of blood routine indexes (n=6) |
由表 6可知,在第7天,CAS组血清中Glu含量比CON组高,但2组间差异不显著(P>0.05),第14天血清Glu含量与第7天相比也较为恒定;在第7天,CAS组血清CK和LDH活性升高,第14天试验结束血清CK、LDH活性降至较低水平,与CON组相比,第7天血清CK、LDH活性下降,但差异不显著(P>0.05),第14天血清LDH活性显著低于CON组(P<0.05),而CK活性亦低于CON组,但差异不显著(P>0.05);在第7天,各组血清AST和ALT活性均有升高,第14天有所下降,在试验结束时CAS组血清中ALT和AST活性下降幅度要大于CON组,2组间均无显著差异(P>0.05);在第7天,CAS组血清TP和ALB含量比第0天低,第14天恢复至正常水平,而CON组在试验期间血清TP和ALB含量一直呈下降趋势;在试验期间CAS组血清CRE和UN含量有所降低,且UN含量第7天显著低于第0天(P<0.05),第14天的含量极显著低于第0天(P<0.01),而CON组血清UN含量在试验结束时略有升高;试验期间CAS组血清T-CHO和TG含量在第7天显著低于第0天(P<0.05),第14天与第7天相比变化不大,而CON组先下降后上升,波动较大。
|
|
表 6 血清生化指标分析表 Table 6 Analysis table of serum biochemical indexes (n=6) |
由表 7可知,CAS组第7天血清中SOD活性比第0天极显著升高(P<0.01),而CON组第7天血清中SOD活性仅比第0天显著升高(P<0.05)。2组第7天血清中GSH-Px活性均比第0天极显著提高(P<0.01)。CAS组血清MDA含量波动较缓,基本处于稳定状态,CON组血清MDA含量波动较大,变化明显。2组间血清中SOD、GSH-Px活性及MDA含量差异不显著(P>0.05)。
|
|
表 7 血清抗氧化指标分析表 Table 7 Analysis table of serum antioxidant index (n=6) |
由表 8可知,在第7天时2组血清中COR含量均升高,第14天有所下降,差异均不显著(P>0.05),也可以看出CAS组第7、14天血清COR含量均低于CON组,但差异不显著(P>0.05),CAS组血清COR含量的波动较CON组平缓,COR含量的变化不明显。
|
|
表 8 血清皮质醇含量分析表 Table 8 Analysis table of serum cortisol content (n=6) |
动物的平均日采食量往往是判断动物是否处于健康状态的最直观表现,但现在尚未见到有关应激猫采食量的研究报道。据报道,当动物遭受应激时,其平均日采食量会产生不利的影响[12]。孙凤莉等[13]研究了抗热应激剂对奶牛生长性能的影响,结果表明在饲喂抗应激剂后,各组奶牛采食量变化差异不明显。从平均日采食量变化曲线中可以看出,本研究在猫应激造模前进行适应性饲喂,2组猫平均日采食量稳定,没有明显的变化。高温等应激因素导致动物采食量降低主要是由于下丘脑的摄食中枢兴奋性降低。本试验中,给予应激刺激后2组猫在应激造模期采食量均有下降,这与郭春华等[14]、李绍钰等[15]的研究报道一致,应激对动物采食量有着显著的影响。2组猫采食量在应激刺激结束后又逐渐恢复,结果显示应激会导致猫的食欲下降,采食量相应下降,当应激原消除后,食欲逐渐恢复正常,采食量也会逐渐恢复到原有水平。猫属于严格肉食性动物,对肉类含量高的食物更为青睐,另外,犬猫NRC(2006)中也指出一般来讲猫更倾向于选择水分高食物(如肉类和罐头类饲粮),而不是干性膨化饲粮,但那些存在口味厌恶习性和口味适应性差的猫除外。CAS组饲粮中含肉量和含水量更高,这可能是其采食量及适口性高于CON组的原因。
3.2 缓解应激刺激试验期间基本生理指标的变化动物在各种应激原的作用下,机体为了应对应激刺激而做出积极的防御性反应,提高动物机体抵抗应激的能力,而使机体的代谢分解加强,导致机体物质的过分消耗,从而造成暂时性的体重下降。邢漫萍等[16]研究发现,运输应激会使文昌鸡总重和平均体重下降2.21%。本研究在第0、7、14天时对猫空腹称重结果显示试验期间2组猫体重变化不大,CON组在试验结束后体重略有增加,而CAS组体重有所下降,原因可能是CAS组干物质摄入量降低。CAS组饲粮中水分含量远高于CON组饲粮,猫受到强烈应激后采食量下降,干物质摄入量也会降低。高水分的宠物食品可以增加动物的水分摄入量,不会因为猫在应激状态下减少饮水行为而导致水分摄入降低,同时保证充足的水分摄入对猫的健康十分有利,尤其是可以预防泌尿道相关疾病的发生。猫本身对饮水没有强烈的渴望,并且在喂食67%~73%含水量的食物时,在不饮水情况下仍可以保持体内水分平衡。
动物在遭受单一或多种应激刺激时,动物的精神和机体同时受到巨大的影响,由于体内神经-内分泌系统功能的改变而导致机体代谢情况的变化,从而影响动物正常的生理指征。邢漫萍等[16]、魏光河等[17]、Srikandakumar等[18]研究发现,动物在受到应激刺激时基础生理指标会有所升高。单强等[19]对富铬酵母添加剂缓解奶牛热应激的研究表明,随着富铬酵母添加剂量的增加,奶牛直肠体温、呼吸频率等呈线性下降。而马峰涛等[20]研究饲粮中添加金银花提取物缓解奶牛热应激的作用,发现金银花提取物可显著降低奶牛直肠温度,对呼吸频率无显著影响。本研究中猫在遭受不同类型应激刺激后体温低于正常范围以下且体温变化呈先下降后上升趋势,可能是由于在冷应激刺激后,猫体温尚未恢复正常水平,另外在整个试验期间除了特定需要,猫舍空调维持在恒定的温度。从CON组和CAS组体温变化比较来看,CAS组饲粮在维持体温恒定在正常范围方面有一定的作用,同时猫即使是处于某些对体温影响比较大的环境应激过程中,如汽车运输、冷、热应激等,CAS组饲粮也可以使猫维持正常的体温。心率变化结果显示,CON组波动幅度比CAS组更加明显,第7天应激结束,CAS组心率在正常范围内,而CON组心率则比正常范围高,说明CAS组饲粮可以维持猫的正常心率,能够让猫恢复平静,减缓应激刺激引起的心跳过速。本研究中所测得的呼吸频率高于正常范围,可能是由于在测量时无法彻底让猫平静下来。
3.3 缓解应激刺激试验期间血液指标的变化 3.3.1 全血生理指标的变化血常规生理指标的变化可以灵敏地反映动物应对应激时自身生理反应情况,动物在受到应激刺激时,血液生理指标会受到一定的影响,常会发生一系列的变化[21-23]。血液中白细胞、嗜中性粒细胞、淋巴细胞等主要参与机体免疫机能的调节,其数量的变化通常代表着机体抵抗疾病能力高低和健康程度。范超等[24]研究了断奶应激对犊牛血液生理生化指标和免疫功能的影响,发现白细胞总数、嗜中性粒细胞数目、单核细胞数目在断奶前后变化不显著,断奶后呈一定程度的下降。本研究结果显示,应激刺激结束时CAS组白细胞数目比第0天显著下降,可能是由于猫通过进食CAS组饲粮获得丰富且充足的营养物质,相关营养物质达到了协助机体建立免疫功能的效应,试验结束后又逐渐恢复,与赵恩军等[25]的报道一致。红细胞是动物机体中最多的一类细胞,主要生理功能是通过细胞内所含有的血红蛋白进行气体交换,血红蛋白是一类可以运送氧气的特殊蛋白质[26]。动物在受到应激刺激时机体需氧量增加、糖皮质激素刺激使骨髓的造血机能旺盛导致红细胞数目和血红蛋白浓度生理性升高[27]。本研究发现,第7天CAS组和CON组红细胞数目比第0天均显著升高,这与Earley等[28]报道的对荷斯坦公牛进行禁食禁水运输8 h后血液红细胞数目和血红蛋白浓度显著升高结果一致,而马永生等[22]研究发现,甘南牦牛在运输应激后血液红细胞数目和血红蛋白浓度升高不显著,可能与动物的状况、应激的条件有关。本研究中试验结束时,CON组血液红细胞数目和血红蛋白浓度仍显著高于第0天,而CAS组已逐渐恢复,说明CAS组饲粮可以降低由应激引起的血液红细胞数目和血红蛋白浓度升高,反映出CAS组饲粮对维持血液红细胞数目和血红蛋白浓度稳定有一定的作用。
3.3.2 血清生化指标的变化研究表明,动物在受到应激刺激时血浆中糖皮质激素含量大大升高,而糖皮质激素会使机体物质分解代谢加强,来抵御外界对机体造成的压力[29]。肖海霞等[30]研究了不同月龄断奶应激对马驹血清生化指标的影响,发现所有马驹的血清Glu含量在不同时期都发生了显著的变化。而本研究中血清Glu含量变化一直处于正常范围以内,变化不显著,与Knowles等[31]、邓红雨等[32]报道一致,CAS组血清Glu含量在第7、14天差异不显著,说明CAS组饲粮可能在应激时会提高血清Glu含量,以协助机体抵御外界压力,且作用效果较持久,但需要更多的证据证明。动物在应激时,肌肉能量供应不足,肌肉营养不良,肌细胞受损,导致肌肉中的CK和LDH逸出,进而造成血清中的CK和LDH活性升高[33]。同样在应激条件下,肝细胞膜通透性增加,导致ALT和AST进入血液,活性升高。芦春莲等[34]、高得仪等[35]、韩瑾瑾等[36]研究动物运输应激对其血液理化指标的影响,结果表明血清CK、LDH、ALT和AST活性在运输后均显著上升,也证实了应激会造成肌肉能量供应不足,肌细胞受损,导致血清中相应的酶活性升高。翁恺麒等[37]研究报道了肉鸭在屠宰前休息2 h血清酶指标已恢复到正常水平,说明宰前休息2 h可以显著缓解应激,提高肉品质。本研究中应激结束时血清中CK、LDH、ALT和AST活性均高于第0天,但差异不显著,说明应激对猫肌细胞造成了轻微的损伤,在试验结束时逐渐恢复,而CAS组恢复的程度比CON组明显,表明CAS组饲粮可以缓解由不同类型应激导致的机体组织细胞受损,也可以缓解机体因应激刺激所带来的异常能量代谢,维持正常能量代谢,保护机体健康。TP和ALB可以反映动物机体蛋白质营养水平,反映蛋白质在动物机体内的代谢情况,也与血液中各种重要蛋白质的生成有关,动物在应激时,由于代谢加强,血液中TP和ALB合成减少,分解增加,从而导致血清TP、ALB含量会有所下降[38]。Song等[39]研究发现,中草药添加剂可以显著提高热应激下肉牛血清中TP和ALB含量,缓解了肉牛的热应激。本研究发现试验期间血清中TP和ALB含量在应激前后变化不显著,与曾涵芳等[40]报道相一致。此外,本研究结果表明,CAS组在试验结束时血清中TP和ALB含量逐渐恢复,而CON组仍在下降,说明CAS组饲粮中使用的鸡肉、鸭肝、猪肝等具有高消化吸收率的动物源性蛋白质原料,保证了蛋白质营养的需求,可以维持猫在应激状态的蛋白质代谢水平,缓解应激消耗。CRE和UN可以反映肾脏滤过功能,是反映氨基酸平衡的重要指标之一。通常较低的UN含量表明氨基酸平衡较好,机体蛋白合成率较高[41]。本研究发现CAS组在应激结束、试验结束时血清中UN含量显著下降,CRE含量呈下降趋势,而在干物质基础上CAS组饲粮中精氨酸含量高于CON组,说明CAS组饲粮中较高水平的精氨酸在机体中能促使氨转变成为尿素,降低血氨含量,因此,CAS组饲粮在猫受到应激刺激时,可保护肾脏功能,保持血氨平衡,维持机体内环境稳态。T-CHO和TG是血脂的主要成分,血脂含量的高低反映了机体脂类代谢水平。黄光远等[21]报道了急性热应激条件下兔血浆T-CHO和TG含量在72 h内持续升高。与本研究结果不同,本研究结果显示血清T-CHO和TG含量呈现下降后上升的趋势,而CAS组在应激结束下降显著,说明CAS组饲粮中添加鱼油等脂肪原料,能为机体及时补充能量以及不饱和脂肪酸,可以维持血液脂类物质平衡,保证各组织器官发挥正常功能,减少猫因应激刺激而导致患病的风险。
3.4 缓解应激刺激试验期间血清抗氧化指标的变化动物在遭受应激刺激时,机体会产生较多的过氧化物,如氧自由基(ROs)、MDA,如不及时清除这些过氧化物,便会导致机体损伤以及疾病的发生。MDA是反映机体内自由基水平和脂质过氧化代谢的重要指标,SOD可通过清除超氧阴离子保护细胞免受损伤,GSH-Px能特异性地催化过氧化氢的还原反应,对细胞膜起到保护作用。这3个指标是衡量机体氧化胁迫程度的常用指标,血清SOD和GSH-Px活性降低,机体清除氧自由基能力下降,抗氧化能力下降,引起血清MDA含量提高,从而加快机体组织的脂质过氧化,造成组织损伤。王玲等[42]研究表明,肉牛在热应激条件下血清MDA含量极显著升高,SOD、GSH-Px活性显著降低。单强等[19]研究发现,饲粮中添加富铬酵母可显著增强热应激奶牛血清SOD、GSH-Px活性,而血清MDA含量减少。Balnave等[43]对肉鸡的研究发现,饲粮氨基酸平衡受环境温度的影响,在适宜温度下,饲粮中精氨酸与赖氨酸之比为1.10时最佳,而在高温环境中(即热应激条件下),其比例应调至1.27~1.37。孙皓然[44]对同为食肉目动物蓝狐的研究中发现,蓝狐受到脂多糖刺激后会对精氨酸需求增加,提高饲粮中精氨酸含量可以缓解脂多糖诱导的免疫应激对蓝狐肠道结构和功能造成的损伤,抑制炎症反应相关基因的过度表达。Yu等[45]研究发现,宠物猫粮中额外补充维生素E、维生素C和β-胡萝卜素可以降低患有慢性肾衰猫的体内氧化应激水平。本研究中,血清SOD和GSH-Px活性在应激结束时显著升高,这与李玉丹等[46]的研究结果一致。这说明CAS组饲粮对精氨酸、维生素E、维生素C、β-胡萝卜素和硒等营养物质进行强化后,可以提高机体过氧化物清除能力并及时清除体内由应激刺激产生的多余氧自由基,起到保护生物膜的功效。本研究中血清MDA含量变化结果表明CAS组饲粮能维持机体氧自由基产生水平及脂质过氧化代谢水平。
3.5 缓解应激刺激试验期间血清COR含量的变化COR是一种重要的肾上腺糖皮质激素,常作为重要的生物化学参数被用来检测动物在应激环境下的生理反应,因此又被称作“应激激素”[47]。COR可以促进肌肉蛋白质分解,主要是用作糖异生,使血糖升高,同时释放氨基酸、Glu、脂肪酸等物质,这些物质会被运送到血液里充当能量使用,以抵御来自外界的应激刺激,同样也能抑制蛋白质合成(尤其对Ⅰ型肌纤维影响更明显)。因此机体在应激状态下需要COR来维持正常生理机能,如果没有COR,机体将无法对应激做出有效反应。朱骞等[48]报道了运输应激可使拉布拉多犬血清COR含量显著升高,而本研究中猫在应激结束时血清COR含量升高但不显著,可能是与动物种类、应激刺激条件、饲养条件等不同有关。在本研究中,CAS组血清COR含量的变化不如CON组明显,波动较缓,说明CAS组饲粮在一定程度上可以及时补充外界应激所造成的机体消耗,能够发挥COR维持正常生理机能的作用。
3.6 不同类型猫粮在缓解应激刺激中营养学差异的比较分析猫作为一种食肉动物,蛋白质是其重要的能量来源。对于犬猫,饲粮中动物源性蛋白质的消化吸收率一般要高于植物源性的蛋白质,但是当动物原料中皮肤、皮毛、羽毛和结缔组织较高时,会降低其蛋白质消化率,甚至可能低于植物原料[49]。邓华彬等[50]的研究表明,犬粮和猫粮中添加6%水解羽毛粉均会造成贵宾犬和英国短毛猫的干物质、粗蛋白质和有机质的表观消化率和适口性的显著降低,并导致犬猫体重显著下降。在市售宠物商品粮中,植物源性蛋白质(如豆粕等)、肉骨粉和羽毛粉等均是常用原料,可以用于满足正常的维持需要,但消化吸收率较纯肉类低。本试验中所用的缓解应激损伤全价处方猫粮的主要原料为鸡胸肉等动物类原料,是主要的蛋白质来源,较一般市售商品粮植物原料低,且不含动物皮肤等原料,可以增强适口性,并提供利于消化的优质蛋白质。
油脂类原料不仅可以为宠物提供能量,而且n-3多不饱和脂肪酸也具有免疫调节及屏障保护功能。鱼油富含n-3多不饱和脂肪酸,有研究报道,饲粮中添加鱼油可以抑制糖皮质激素释放激素(CRH)/糖皮质激素释放激素受体1(CRHR1)信号通路及肥大细胞激活,改善脂多糖应激所导致的断奶仔猪小肠屏障功能障碍[51]。而宠物商品粮使用的油脂类原料主要为鸡油等动物油脂,以提高适口性和补充能量为主要目的,多不饱和脂肪酸含量相对较低。犬猫受到应激后,对能量的需求会提高,当外界环境温度降低时成年猫(从20 ℃降到3~8 ℃)和幼猫(从30 ℃降低到20 ℃)的能量代谢率会提高60%[52]。脂肪、蛋白质和碳水化合物是动物获得能量的来源,宠物食品中这3种物质的消化系数分别为90%、80%和85%[53]。骨骼肌是冷应激能量消耗的主要组织,需要消耗大量糖原。大米等谷物的淀粉经膨化后回肠消化率可达99%,可为机体高效提供Glu等能量物质。CAS组饲粮中以富含多不饱和脂肪酸的鱼油和豆油作为主要脂肪和能量来源,并搭配膨化大米粉提供碳水化合物。
动物在亚健康状态下受到的各种病原菌及其毒素侵袭,甚至是病原菌的感染、创伤和内部肿瘤等都会引起免疫应激[54],使原本用于维持生长的营养供给转向维持免疫应答。疫苗接种是犬猫饲养中必须采取的措施,对预防不同传染性疾病具有重要作用,然而,疫苗接种也会引起动物的免疫应激,产生一系列的应激反应,如采食量下降、精神沉郁等。在猪上的研究表明,口蹄疫疫苗、蓝耳病灭活疫苗和猪瘟脾淋苗作为特殊的应激原在接种后都能引起机体内促肾上腺皮质激素和COR含量的升高,导致机体出现疫苗免疫应激[55]。此外,维生素A、维生素D、维生素E、微量元素锌、精氨酸和异亮氨酸都能够不同程度地诱导猪小肠上皮细胞β防御素(pBD)基因的表达和蛋白分泌,进而缓解免疫应激[56]。本研究也证明了饲粮中维生素E、锌和精氨酸等含量的提高可以缓解机体应激损伤。
本研究通过2款产品的比较,探讨了猫在受到应激后的临床营养解决方案的选择。从适口性和补充水分的角度,罐头类型的宠物食品较之膨化干粮在猫应激期饲喂更具有优势;而增加优质肉类原料的使用,不仅可以提高产品适口性,也能保证蛋白质的有效吸收利用;鱼油等脂肪原料可以提供n-3多不饱和脂肪酸,提高机体抗应激能力;经膨化后的大米粉等原料可以提高猫对淀粉的消化吸收率,保证机体的能量损耗的补充;高于维持需要的维生素E、精氨酸和锌等营养物质,可以提高机体的抗氧化力,增强抗应激能力。因此,在猫受到应激刺激后选择具有针对性的处方粮比仅维持一般需求的普通商品粮更能满足其营养需求,避免了不同类型应激对机体的损伤,以及对动物福利的破坏。
4 结论本试验条件下,提高猫饲粮中蛋白质、脂肪、维生素E和维生素C、精氨酸含量能够改善猫应激状态下的采食量,并能维持其正常生长,在一定程度上可改善血清酶指标、蛋白质、脂质代谢水平以及保护肝肾功能,提高应激状态下机体的抗氧化能力,缓解应激刺激全价处方猫粮在不同应激环境中发挥的效果没有差异,具有缓解应激的功能。
| [1] |
ROMERO L M, PLATTS S H, SCHOECH S J, et al. Understanding stress in the healthy animal-potential paths for progress[J]. Stress, 2015, 18(5): 491-497. DOI:10.3109/10253890.2015.1073255 |
| [2] |
SOLOMON D A, KELLER M B, LEON A C, et al. Multiple recurrences of major depressive disorder[J]. American Journal of Psychiatry, 2000, 157(2): 229-233. |
| [3] |
LOWE S E, BRADSHAW J W S. Ontogeny of individuality in the domestic cat in the home environment[J]. Animal Behaviour, 2001, 61(1): 231-237. DOI:10.1006/anbe.2000.1545 |
| [4] |
ROCHLITZ I.Feline welfare issues[M]//TURNER D C, BATESON P.The domestic cat.Cambridge: Cambridge University Press, 2000: 131-153.
|
| [5] |
BEAVER B V.Feline grooming behavior[M]//BEAVER B V.Feline behavior: a guide for veterinarians.2nd ed.Saunders, St Louis: Elsevier, 2003.
|
| [6] |
BUFFINGTON C A T, WESTROPP J L, CHEW D J, et al. Risk factors associated with clinical signs of lower urinary tract disease in indoor-housed cats[J]. Journal of the American Veterinary Medical Association, 2006, 228(5): 722-725. DOI:10.2460/javma.228.5.722 |
| [7] |
TANAKA A, WAGNER D C, KASS P H, et al. Associations among weight loss, stress, and upper respiratory tract infection in shelter cats[J]. Journal of the American Veterinary Medical Association, 2012, 240(5): 570-576. DOI:10.2460/javma.240.5.570 |
| [8] |
BEATA C, BEAUMONT E, COLL V, et al. Effect of alpha-casozepine (Zylkene) on anxiety in cats[J]. Journal of Veterinary Behavior, 2007, 2(2): 40-46. DOI:10.1016/j.jveb.2007.02.002 |
| [9] |
顾景范, 杜寿玢, 郭长江. 现代临床营养学[M]. 2版. 北京: 科学出版社, 2009.
|
| [10] |
谭艳芳.复合抗应激剂对舍饲条件下猪的抗应激效果的研究[D].硕士学位论文.长沙: 湖南农业大学, 2003.
|
| [11] |
李昊阳, 钟荣珍, 杨连玉. 评价应激的方法及抗应激添加剂的研究进展[J]. 中国畜牧杂志, 2014, 50(13): 95-99. |
| [12] |
KIM K Y, CHOI Y H, HOSSEINDOUST A, et al. Evaluation of high nutrient diets and additional dextrose on reproductive performance and litter performance of heat-tressed lactating sows[J]. Animal Science Journal, 2019, 90(9): 1212-1219. DOI:10.1111/asj.13214 |
| [13] |
孙凤莉, 李英, 刘荣昌, 等.抗热应激剂对奶牛泌乳性能、乳成分及血清指标的影响[C]//中国畜牧兽医学会动物营养学分会第十次学术研讨会论文集.杭州: 中国畜牧兽医学会动物营养学分会, 2008.
|
| [14] |
郭春华, 柴映青, 王康宁. 高温对不同体重生长猪采食量影响模式的研究[J]. 养猪, 2004(4): 15-18. |
| [15] |
李绍钰, 张敏红, 张子仪, 等. 热应激对肉用仔鸡生产性能及生理生化指标的影响[J]. 华北农学报, 2000, 15(3): 140-144. |
| [16] |
邢漫萍, 杨少雄, 林大捷, 等. 运输性应激对文昌鸡生理指标的影响[J]. 家禽科学, 2016(4): 9-10. |
| [17] |
魏光河, 张培晏. 运输对荣昌猪生理生化指标的影响[J]. 动物医学进展, 2011, 32(10): 123-127. |
| [18] |
SRIKANDAKUMAR A, JOHNSON E H. Effect of heat stress on milk production, rectal temperature, respiratory rate and blood chemistry in Holstein, Jersey and Australian milking Zebu cows[J]. Tropical Animal Health and Production, 2004, 36(7): 685-692. DOI:10.1023/B:TROP.0000042868.76914.a9 |
| [19] |
单强, 马峰涛, 金宇航, 等. 富铬酵母对热应激奶牛生产性能、血清指标及血浆和牛奶中微量元素含量的影响[J]. 动物营养学报, 2020, 32(5): 2198-2208. |
| [20] |
马峰涛, 单强, 金宇航, 等. 金银花提取物对热应激奶牛生产性能、血清生化指标和免疫功能的影响[J]. 动物营养学报, 2020, 32(5): 2209-2217. |
| [21] |
黄光远, 赵川, 杨晓炼, 等. 急性持续热应激对成年兔血液部分生理生化指标的影响[J]. 安徽农业科学, 2015, 43(32): 69-71, 153. |
| [22] |
马永生, 董艳娇, 马雄, 等. 运输应激对甘南牦牛血液生理生化指标的影响[J]. 畜牧兽医杂志, 2016, 35(5): 20-22. |
| [23] |
王雪莹, 王之盛, 薛白, 等. 烟酸对热应激牦牛生长性能、营养物质表观消化率和血液指标的影响[J]. 动物营养学报, 2020, 32(5): 2228-2240. |
| [24] |
范超, 吴勇, 刘孝然, 等. 断奶应激对奶水牛犊牛血液生理生化指标和免疫功能的影响[J]. 中国畜牧兽医, 2016, 43(7): 1749-1754. |
| [25] |
赵恩军, 华修国, 张斌, 等. 冷热刺激对犬血清皮质醇、促肾上腺皮质激素及血液生理指标的影响[J]. 畜牧兽医学报, 2003, 34(5): 457-460. |
| [26] |
高维平, 姜桂苗, 梁伟超, 等. 运输应激对驴血液指标的影响[J]. 中国畜牧兽医, 2019, 46(2): 373-379. |
| [27] |
杨焕民, 李士泽. 动物冷应激的研究进展[J]. 黑龙江畜牧兽医, 1999(3): 3-5. |
| [28] |
EARLEY B, FISHER A D, O'RIORDAN E G. Effects of pre-transport fasting on the physiological responses of young cattle to 8-hour road transport[J]. Irish Journal of Agricultural and Food Research, 2006, 45(1): 51-60. |
| [29] |
NOHARA M, TOHEI A, SATO T, et al. Evaluation of response to restraint stress by salivary corticosterone levels in adult male mice[J]. Journal of Veterinary Medical Science, 2016, 78(5): 775-780. DOI:10.1292/jvms.15-0610 |
| [30] |
肖海霞, 托乎提·阿及德, 石国庆, 等. 不同月龄断奶应激对马驹血清指标和体增重的影响[J]. 畜牧兽医学报, 2015, 46(11): 2010-2019. |
| [31] |
KNOWLES T G, BROWN S N, EDWARDS J E, et al. Effect on young calves of a one-hour feeding stop during a 19-hour road journey[J]. Veterinary Record, 1999, 144(25): 687-692. DOI:10.1136/vr.144.25.687 |
| [32] |
邓红雨, 范佳英, 郑立, 等. 禁食禁水长途运输和运输后恢复对肉牛血液指标的影响[J]. 中国兽医学报, 2012, 32(12): 1866-1871, 1885. |
| [33] |
SWANSON J C, MORROW-TESCH J. Cattle transport:historical, research, and future perspectives[J]. Journal of Animal Science, 2001, 79(Suppl.E): E102-E109. |
| [34] |
芦春莲, 李妍, 曹玉凤, 等. 肉牛宰前运输应激对其血液理化指标及免疫机能的影响[J]. 中国兽医学报, 2016, 36(7): 1173-1177. |
| [35] |
高得仪, 韩博, 王清兰, 等. 猪运输应激血液生化指标变化[J]. 中国兽医学报, 1996, 16(3): 285-289. |
| [36] |
韩瑾瑾, 杨高丰, 张凯韩, 等. 夏南牛运输前后生理指标和血液指标的对比研究[J]. 动物医学进展, 2011, 32(3): 121-124. |
| [37] |
翁恺麒, 张扬, 陈博雯, 等. 运输应激和宰前休息对肉鸭血液指标和肉品质的影响[J]. 中国家禽, 2017, 39(14): 37-40. |
| [38] |
DAS R, SAILO L, VERMA N, et al. Impact of heat stress on health and performance of dairy animals:a review[J]. Veterinary World, 2016, 9(3): 260-268. DOI:10.14202/vetworld.2016.260-268 |
| [39] |
SONG X Z, LUO J R, FU D B, et al. Traditional Chinese medicine prescriptions enhance growth performance of heat stressed beef cattle by relieving heat stress responses and increasing apparent nutrient digestibility[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(10): 1513-1520. DOI:10.5713/ajas.2014.14058 |
| [40] |
曾涵芳, 李烨青, 王泽栋, 等. 黄芪多糖对热应激下奶牛生产性能、血清生化指标的影响[J]. 中国奶牛, 2019(12): 42-49. |
| [41] |
COMA J, CARRION D, ZIMMERMAN D R. Use of plasma urea nitrogen as a rapid response criterion to determine the lysine requirement of pigs[J]. Journal of Animal Science, 1995, 73(2): 472-481. DOI:10.2527/1995.732472x |
| [42] |
王玲, 罗宗刚, 蔡明成, 等. 热应激对肉牛血清离子、酶活性、抗氧化及免疫指标的影响[J]. 西南师范大学学报(自然科学版), 2017, 42(12): 37-41. |
| [43] |
BALNAVE DBRYDEN W L. Advances in the amino acid nutrition of broilers[J]. Asian-Australasian Journal of Animal Sciences, 2000, 13: 73. |
| [44] |
孙皓然.饲粮精氨酸水平对蓝狐生长性能和免疫功能的影响[D].硕士学位论文.北京: 中国农业科学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-82101-1016171241.htm
|
| [45] |
YU S, PAETAU-ROBINSON I. Dietary supplements of vitamins E and C and β-carotene reduce oxidative stress in cats with renal insufficiency[J]. Veterinary Research Communications, 2006, 30(4): 403-413. DOI:10.1007/s11259-006-3269-5 |
| [46] |
李玉丹, 杨保奎, 杨榛, 等. 不同化学形式微量元素对热应激奶牛生产性能和血清指标的影响[J]. 动物营养学报, 2015, 27(11): 3558-3566. |
| [47] |
SAEKI K, YUO A, TAKAKU F. Cell-cycle-regulated phosphorylation of cAMP response element-binding protein:identification of novel phosphorylation sites[J]. Biochemical Journal, 1999, 338: 49-54. DOI:10.1042/bj3380049 |
| [48] |
朱骞, 秦海斌, 温海, 等. 运输应激对拉布拉多犬血液皮质醇和生化指标的影响[J]. 天津农学院学报, 2018, 25(2): 39-41. |
| [49] |
CASE L P, DARISTOTLE L, HAYEK M G, et al. Canine and feline nutrition:a resource for companion animal professionals[M]. 3rd ed. Amsterdam: Elsevier, 2011.
|
| [50] |
邓华彬, 周佳, 唐超, 等. 血球蛋白粉和水解羽毛粉在犬猫粮上的应用研究[J]. 饲料与畜牧, 2019(8): 59-64. |
| [51] |
朱惠玲, 刘玉兰, 陈少魁, 等.鱼油提高LPS应激仔猪小肠屏障功能、抑制CRH/CRHR1信号通路[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集.武汉: 中国畜牧兽医学会动物营养学分会, 2016.
|
| [52] |
美国动物营养国家研究委员会犬猫营养特别委员会组.犬猫营养需要[M].丁丽敏, 夏兆飞译.北京: 中国农业大学出版社, 2010.
|
| [53] |
李欣.广州市宠物猫饮食状况与疾病关系的调查及中药处方粮的辅助治疗作用[D].硕士学位论文.广州: 华南农业大学, 2016.
|
| [54] |
陈代文, 吴德, 张克英, 等. 猪抗病营养理论与实践[M]. 北京: 中国农业大学出版社, 2012.
|
| [55] |
文利新, 邬静, 李荣芳, 等.疫苗免疫应激临床观察及其机理研究[C]//中国畜牧兽医学会家畜内科学分会2009年学术研讨会论文集.青岛: 中国畜牧兽医学会家畜内科学分会, 2009.
|
| [56] |
齐莎日娜.猪β-防御素基因表达特点及精氨酸的调节作用[D].博士学位论文.成都: 四川农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10626-1011222526.htm
|




