2. 辛集市动物疫病预防控制中心, 辛集 052360;
3. 保定市顺平县农业农村局, 保定 071001;
4. 山东省农业科学院家禽研究所, 济南 250023;
5. 北京大友汉腾畜牧技术有限公司, 北京 101300
2. Xinji City Center for Animal Disease Prevention and Control, Xinji 052360, China;
3. Agricultural and Rural Bureau of Shunping County of Baoding City, Baoding 071001, China;
4. Institute of Poultry Science, Shandong Academy of Agricultural Sciences, Ji'nan 250023, China;
5. Beijing Dayou Hanteng Animal Husbandry Technology Co., Ltd., Beijing 101300, China
植物提取物是一类来源于天然植物且具有一种或多种生物学功效的活性物质[1]。植物提取物的活性成分差别很大,其活性成分基本可以分为生物碱类、植物多酚、挥发油类、有机酸类和多糖类等[2]。大量研究表明,在畜禽饲粮中添加单一或复合植物提取物具有抗菌杀菌、提高动物自身免疫机能、改善机体抗氧化能力、改善适口性、提高采食量等作用[3-5],植物提取物的功能与所含的活性成分相关。大蒜素是从大蒜的球形鳞茎中提取的生物活性物质[6],具有提高畜禽生长性能和机体免疫力等作用[7-8]。菊粉是一种植物源性多糖,研究表明,菊粉具有改善畜禽肠道健康和调节机体免疫功能等作用[9]。大量研究表明,在饲粮中添加大蒜素和菊粉可提高动物机体的生长性能[10],改善肠道黏膜的消化吸收功能[11],改善肠道微生态环境[12],促进机体生长发育。“营养活性物质组学”理论表明,复合植物提取物对畜禽的调控作用优于单一植物提取物可能是由于植物提取物中各种营养活性物质之间存在协同作用[13]。因此,复合植物提取物在畜禽生产中有着非常广阔的应用前景。已有研究大多关注复合植物提取物对畜禽生产性能、繁殖性能、免疫及抗氧化功能的影响等方面[14-18],关于复合植物提取物对蛋鸡肠道黏膜形态与盲肠菌群结构方面的研究较少。因此,本试验通过在饲粮中添加复合植物提取物,探讨其对蛋鸡生产性能、肠道黏膜形态及盲肠菌群结构的影响,以期为复合植物提取物在蛋鸡生产中的应用提供参考依据。
1 材料与方法 1.1 试验材料复合植物提取物主要由大蒜提取物和蒲公英提取物组成,辅料为沸石粉,水分含量在7%~12%,产品成分分析保证值(最低含量):大蒜素≥70 g/kg;菊粉≥10 g/kg。
1.2 试验设计试验选用960只42周龄的健康状况良好且体重、产蛋率相近的海兰灰蛋鸡,随机分为4组,每组5个重复,每个重复48只鸡。对照组饲喂基础饲粮,试验Ⅰ、Ⅱ、Ⅲ组在基础饲粮中分别添加150、300和450 mg/kg复合植物提取物。试验期共66 d,其中预试期10 d,正试期56 d。饲养试验在河北省邢台市威县德青源蛋鸡场进行,采用4层叠层笼养方式,每天分6次定时饲喂,自由采食,充足饮水,光照强度为15 lx,光照时间为16 h,鸡舍温度控制在24 ℃左右。每天观察蛋鸡的采食、粪便和健康状况,按正常免疫程序进行免疫接种。试验期间蛋鸡所饲喂基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
在相同管理条件下,以重复为单位,记录每天产蛋总数和总蛋重;每隔2周测定饲粮消耗量;计算平均蛋重、产蛋率、平均日采食量、料蛋比。
1.3.2 肠道黏膜形态测定试验结束时每个重复随机选择2只蛋鸡,禁食12 h后进行屠宰,在十二指肠和空肠中段各取2 cm肠段,用生理盐水冲洗后迅速置于4%中性甲醛中固定,固定组织经全自动脱水机脱水、包埋、切片、染色和封片,最后镜检,测量肠道黏膜绒毛高度(villous height, VH)、隐窝深度(crypt depth, CD),并计算绒毛高度与隐窝深度的比值(V/C)。
1.3.3 盲肠菌群测定试验结束时每个重复随机选择2只蛋鸡,禁食12 h后进行屠宰,取盲肠内容物,装入冻存管中,经液氮速冻后,转移到-80 ℃冰箱保存,以备检测盲肠菌群结构。盲肠菌群结构相关指标的测定由北京某生物科技有限公司完成。
1.4 数据处理与分析数据经Excel 2016整理后,使用SPSS 22.0软件进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行组间多重比较,以P < 0.05表示差异显著,P>0.05表示差异不显著,结果用平均值±标准差表示。
2 结果 2.1 复合植物提取物对蛋鸡生产性能的影响由表 2可知,与对照组相比,饲粮中添加300和450 mg/kg复合植物提取物显著提高了蛋鸡的产蛋率(P < 0.05);饲粮中添加450 mg/kg复合植物提取物显著提高了蛋鸡的平均日采食量(P < 0.05)。各组间平均蛋重和料蛋比无显著差异(P>0.05)。
|
|
表 2 复合植物提取物对蛋鸡生产性能的影响 Table 2 Effects of compound plant extracts on performance of laying hens |
由表 3可知,与对照组相比,饲粮中添加300mg/kg复合植物提取物显著降低了空肠和十二指肠隐窝深度(P < 0.05),显著提高了十二指肠绒毛高度与隐窝深度的比值(P < 0.05)。
|
|
表 3 复合植物提取物对蛋鸡肠道黏膜形态的影响 Table 3 Effects of compound plant extracts on intestinal mucosal morphology of laying hens |
由图 1可知,试验组与对照组盲肠内容物中共有的OTU数为138个。

|
多个颜色图形之间交叠部分数字为多个样品之间共有OTU数,非交叠部分为各样品特有OTU数。 P1N15为试验Ⅰ组,P2N30为试验Ⅱ组,P3N45为试验Ⅲ组,CK为对照组。下图同。 The number of overlapping parts between multiple color graphics was the total number of OTU among multiple samples, and the non-overlapping part was the number of unique OTU for each sample. P1N15 was the test group Ⅰ, P2N30 was the test group Ⅱ, P3N45 was the test group Ⅲ, and CK was the control group. The same as below. 图 1 盲肠内容物OTU维恩图 Fig. 1 OTU Venn diagram of cecal content |
样品的物种稀释曲线和香农指数曲线分别见图 2和图 3。物种稀释曲线和香农指数曲线均趋于平缓,说明测序量足够大,表明OTU数不会再随着测序量的增加而增长,可真实反映群落各物种间的相对比例关系,可以进行数据分析。
|
a、b和c为各组的3个样本。下图同。 a, b and c were three samples in each group. The same as below. 图 2 物种稀释曲线 Fig. 2 Species rarefaction curve |
|
图 3 香农指数曲线 Fig. 3 Shannon index curve |
由表 4可知,各试验组和对照组的测序覆盖率均在98.34%以上,表明测序深度基本覆盖到样品中的所有物种。与对照组相比,各试验组Ace指数、Chao1指数、Shannon指数和Simpson指数均无显著变化(P>0.05)。
|
|
表 4 复合植物提取物对蛋鸡盲肠菌群测序数据和Alpha多样性指数的影响 Table 4 Effects of compound plant extracts on sequencing data and Alpha diversity indexes of cecal flora of laying hens |
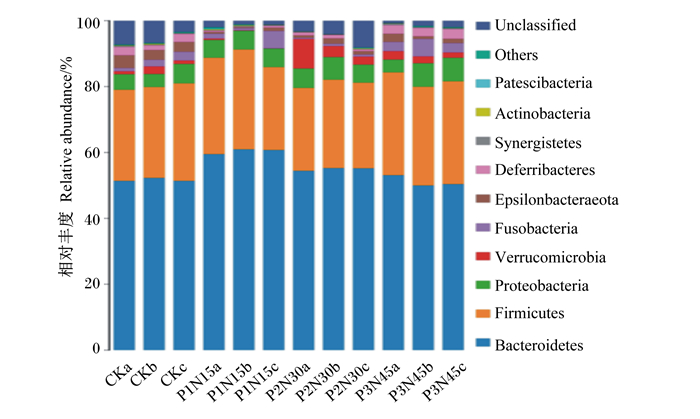
在门水平上,盲肠菌群组成见图 4。试验组和对照组蛋鸡盲肠菌群中相对丰度大于1%的有拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、梭杆菌门(Fusobacteria)、Epsilonbacteraeota、脱铁杆菌门(Deferribacteres)。由表 5可知,与对照组相比,饲粮中添加300和450 mg/kg复合植物提取物显著升高了拟杆菌门的相对丰度(P < 0.05);饲粮中添加450 mg/kg复合植物提取物显著降低了厚壁菌门的相对丰度(P < 0.05)。
|
Unclassified:未分类;Others:其他;Actinobacteria:放线菌门;Synergistetes:互养菌门;Deferribacteres:脱铁杆菌门;Fusobacteria:梭杆菌门;Verrucomicrobia:疣微菌门;Proteobacteria:变形菌门;Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门。 图 4 门水平上盲肠菌群组成 Fig. 4 Composition of cecal microflora at phylum level |
|
|
表 5 复合植物提取物对蛋鸡盲肠菌群在门、属水平上相对丰度的影响 Table 5 Effects of compound plant extracts on relative abundance of cecal microflora at phylum and genus levels of laying hens |
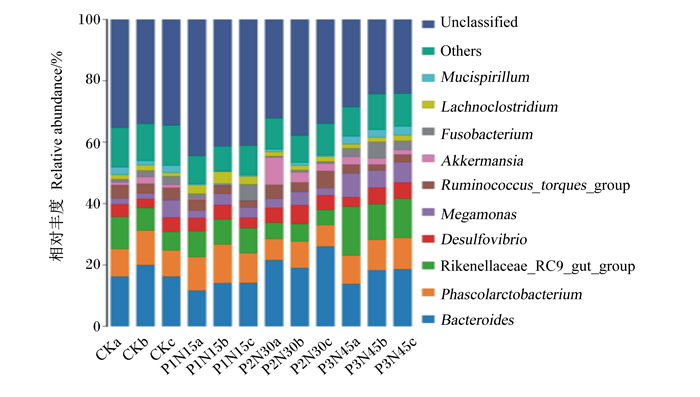
在属水平上,盲肠菌群组成见图 5。由表 5可知,与对照组相比,饲粮中添加450 mg/kg复合植物提取物显著提高了拟杆菌属的相对丰度(P < 0.05),有提高艾克曼菌属相对丰度的趋势(P=0.063)。
|
Unclassified:未分类;Others:其他;Fusobacterium:梭杆菌属;Akkermansia:艾克曼菌属;Ruminococcus_torques_group:瘤胃球菌属扭链群;Megamonas:巨单胞菌属;Desulfovibrio:脱硫弧菌属;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群;Phascolarctobacterium:考拉杆菌属;Bacteroides:拟杆菌属。 图 5 属水平上盲肠菌群组成 Fig. 5 Composition of cecal microflora at genus level |
研究发现,存在于复合植物提取物中的多糖以及挥发油等活性成分,能够促进钙、铁等矿物元素的吸收,改善肠道微生态环境,提高肠道消化能力,进而提高蛋鸡的生产性能[14-16]。王凡等[17]研究表明,在饲粮中添加大蒜素可显著提高蛋鸡的产蛋率,显著降低料蛋比。金永才等[18]研究表明,在饲粮中添加0.5%的复合植物提取物可以显著降低“农大3号”小型蛋鸡父母代种鸡的破蛋率,显著提高种鸡产蛋率,与本试验研究结果一致。在本试验条件下,饲粮中添加复合植物提取物对蛋鸡的平均蛋重和料蛋比无显著影响,饲粮中添加300和450 mg/kg复合植物提取物能够显著提高蛋鸡的产蛋率。这可能是由于大蒜素具有浓郁的自然香味,诱食效果良好,可增加蛋鸡的采食量,促进肠道蠕动,提高肠道对钙、磷等营养物质的摄入,保证蛋鸡产蛋的钙源供应;菊粉可改善肠道微生态环境,提高其消化机能,维持蛋鸡良好的营养状态,进而提高蛋鸡的产蛋性能。但有关复合植物提取物中各种营养活性物质之间的协同作用机制尚不清楚,需进一步研究。
3.2 饲粮中添加复合植物提取物对蛋鸡肠道黏膜形态的影响小肠是动物最主要的消化吸收场所,对营养物质的消化吸收起着重要的作用,其黏膜结构与功能的完整性对营养物质消化吸收具有重要保障作用[19-21]。当小肠绒毛高度增加时,能增加肠黏膜与食糜的接触面积,增强小肠的消化和吸收能力;小肠隐窝深度越浅,肠上皮细胞成熟率越高,营养物质吸收功能越强;绒毛高度与隐窝深度的比值增大,则综合反映肠黏膜结构的完善性[22-24]。肠道健康直接关系到机体免疫与健康及营养物质消化与吸收,是保障畜禽健康和产品安全优质的前提。赵铭伟等[25]研究表明,在断奶仔猪饲粮中添加植物提取物能增加小肠绒毛高度,降低隐窝深度,提高仔猪小肠黏膜中紧密连接蛋白相关基因的表达,改善仔猪小肠健康状态,与本试验研究结果一致。在本试验条件下,饲粮中添加300 mg/kg复合植物提取物能够降低蛋鸡空肠和十二指肠隐窝深度,提高十二指肠绒毛高度与隐窝深度的比值,从而改善蛋鸡肠道黏膜形态,提高小肠黏膜消化吸收能力,进而保障蛋鸡的肠道健康。
3.3 饲粮中添加复合植物提取物对蛋鸡盲肠菌群结构的影响肠道微生物群是维持胃肠道内环境稳定的关键因素,肠道微生物群与宿主免疫系统和新陈代谢有着重要的相互作用[26]。动物年龄、饲养环境和饲粮存在差异,肠道菌群的种类和数量也不尽相同。健康的动物肠道菌群中有益菌和有害菌处于一种动态平衡状态,从而维持机体的正常生长发育[27]。研究表明,植物提取物可以通过促进肠道黏膜发育和改善肠道菌群结构等来保证家禽肠道健康[28]。Alpha多样性指数是用来反映单个样品的物种丰度及物种多样性的指标。其中,衡量物种丰度的是Chao1指数和Ace指数,衡量物种多样性的是Shannon指数和Simpson指数,Shannon指数越大,Simpson指数越小,说明样品的物种多样性越高[29]。覆盖率反映样品的测序深度。本试验结果表明,在蛋鸡饲粮中添加不同水平的复合植物提取物对盲肠菌群的Ace指数、Chao1指数、Shannon指数和Simpson指数均无显著影响,表明在蛋鸡饲粮中添加复合植物提取物对盲肠菌群多样性没有显著影响,可维持盲肠菌群的动态平衡。
现有研究表明,肠道菌群组成对于动物机体的生长发育、营养物质消化吸收和免疫功能有着重要影响[30]。厚壁菌门和拟杆菌门是与宿主营养物质消化吸收和能量代谢密切相关的2个菌门。在门水平上,徐帅等[31]研究表明,科宝肉鸡的盲肠菌群中拟杆菌门最丰富,比例最大,其次为厚壁菌门和变形菌门,与本试验研究结果一致。张亚楠等[32]研究表明,利用高通量测序技术对不同产蛋水平蛋鸡的肠道菌群进行多样性研究,结果显示不同产蛋水平蛋鸡肠道菌群中均以厚壁菌门、拟杆菌门、放线菌门和变形菌门为优势菌门,且厚壁菌门占据绝对优势地位,与本试验研究结果不一致。在本试验条件下,饲粮中添加复合植物提取物后盲肠菌群中占据绝对优势地位的是拟杆菌门,厚壁菌门和变形菌门次之,出现差异的原因可能是试验选用的蛋鸡日龄不同。张璐等[33]研究表明,在高脂饮食中添加菊粉可提高小鼠粪便中拟杆菌门的相对丰度,降低厚壁菌门的相对丰度,与本试验研究结果一致。王俊等[34]研究表明,饲粮中添加植物提取物能够显著降低28日龄肉鸡肠道菌群中厚壁菌门的相对丰度,与本试验研究结果一致。本试验结果表明,饲粮中添加300和450 mg/kg复合植物提取物能够提高蛋鸡盲肠菌群中拟杆菌门相对丰度,降低厚壁菌门的相对丰度,改善盲肠菌群结构。在属水平上,在本试验条件下,拟杆菌属的相对含量最高。研究表明,拟杆菌属不仅能够提高营养利用率、维持肠道微生态平衡,还能够提高宿主的免疫力[35]。
杨建平等[36]研究表明,在属水平上,饲粮中添加复合植物精油能够显著提高拟杆菌属的相对丰度,与本试验研究结果一致。艾克曼菌属被认为是健康人体肠道中最丰富的黏液溶解细菌,肠道中艾克曼菌属比例的增加可以降低肝脏损伤以及治疗肝脏脂肪变性[37];肠道中艾克曼菌属比例较低时可能导致黏膜层变薄,从而导致肠道屏障功能减弱,使肠道内的毒素更容易侵入机体[38]。研究表明,考拉杆菌属可与致病菌竞争营养物质以抑制致病菌在肠道中的定植[39]。在本试验条件下,饲粮中添加450 mg/kg复合植物提取物可显著提高蛋鸡盲肠菌群中拟杆菌属的相对丰度,有增加艾克曼菌属相对丰度的趋势,说明可以增强动物机体肠道屏障功能,维持肠道微生态平衡,进而维持蛋鸡肠道健康,提高生产性能。本试验结果表明在饲粮中添加300和450 mg/kg复合植物提取物能够维持蛋鸡肠道微生态平衡,改善盲肠菌群结构,进而维持动物机体健康。
4 结论在本试验条件下,饲粮中添加300 mg/kg复合植物提取物能够提高蛋鸡的产蛋率,改善肠道黏膜形态和盲肠菌群结构。
| [1] |
金立志, 杨江涛. 植物提取物的抗氧化特性及其在动物无抗饲料中的应用研究进展[J]. 中国畜牧杂志, 2020, 56(4): 29-34. JIN L Z, YANG J T. Antioxidative actions of phytogenics and their application in AGP-free diets for domestic animals[J]. Chinese Journal of Animal Science, 2020, 56(4): 29-34 (in Chinese). |
| [2] |
肖传明, 王蕾, 黄远荣, 等. 常见植物提取物在饲料中的主要应用研究进展[J]. 广东饲料, 2016, 25(12): 29-31. XIAO C M, WANG L, HUANG Y R, et al. Research progress on main application of common plant extracts in feed[J]. Guangdong Feed, 2016, 25(12): 29-31 (in Chinese). |
| [3] |
王晓杰, 黄立新, 张彩虹, 等. 植物提取物饲料添加剂的研究进展[J]. 生物质化学工程, 2018, 52(3): 50-58. WANG X J, HUANG L X, ZHANG C H, et al. Research development of botanical extract as feed additive in poultry[J]. Biomass Chemical Engineering, 2018, 52(3): 50-58 (in Chinese). |
| [4] |
徐腾腾, 张腾龙, 王丽芳, 等. 复合植物提取物对奶牛生产性能及血清免疫、抗氧化指标的影响[J]. 动物营养学报, 2019, 31(12): 5707-5718. XU T T, ZHANG T L, WANG L F, et al. Effects of compound plant extracts on production, serum immune and antioxidant indexes of dairy cows[J]. Chinese Journal of Animal Nutrition, 2019, 31(12): 5707-5718 (in Chinese). |
| [5] |
陶勇, 吉慧帆, 吴楚筠, 等. 复合植物提取物对苏姜猪生长性能、养分消化率及粪中微生物比例的影响[J]. 西北农业学报, 2019, 28(12): 1942-1947. TAO Y, JI H F, WU C J, et al. Effects of compound plant extracts on growth performance, nutrient apparent digestibility and manure microbial proportion in Sujiang pigs[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2019, 28(12): 1942-1947 (in Chinese). |
| [6] |
秦兴然, 王莉, 叶宝娜, 等. 浅谈大蒜素在蛋鸡生产中的应用[J]. 中国畜牧兽医文摘, 2015, 31(5): 224. QIN X R, WANG L, YE B N, et al. Talking about the application of allicin in layer production[J]. Abstracts of Chinese Animal Husbandry and Veterinary, 2015, 31(5): 224 (in Chinese). |
| [7] |
KHAN S H, SARDAR R, ASHRAF M A. Effects of dietary garlic on performance and serum and egg yolk cholesterol concentration in laying hens[J]. Asian Journal of Poultry Science, 2007, 1(1): 22-27. |
| [8] |
何云, 王浓章, 周培军, 等. 大蒜、杜仲添加剂对雏鸡生产性能和肠道微生物的影响[J]. 兽药与饲料添加剂, 2004, 9(4): 6-9. HE Y, WANG N Z, ZHOU P J, et al. Effects of garlic and eucommia ulmoides additives on performance and intestinal microbes of chicks[J]. Veterinary Pharmaceuticals and Feed Additives, 2004, 9(4): 6-9 (in Chinese). |
| [9] |
赵姝娴, 贾俊涛, 赵宇飞. 枯草芽孢杆菌和菊粉对产蛋后期蛋鸡生产性能、蛋品质及肠道绒毛形态的影响[J]. 中国饲料, 2018(24): 44-48. ZHAO S X, JIA J T, ZHAO Y F. Dietary supplementation of bacillus subtilis and inulin on laying performance, egg quality and intestinal morphology of laying hens in late production phase[J]. China Feed, 2018(24): 44-48 (in Chinese). |
| [10] |
蔡超, 魏艳红, 曲湘勇, 等. 菊粉的生物学功能及其在畜禽生产中的应用[J]. 中国饲料, 2013(3): 37-40. CAI C, WEI Y H, QU X Y, et al. Biochemical function of inulin and its application in livestock and poultry production[J]. China Feed, 2013(3): 37-40 (in Chinese). |
| [11] |
徐静, 张子儒, 王德贺, 等. 饮水中添加大蒜精油对蛋鸡生长性能、肠道组织形态及盲肠菌群的影响[J]. 动物营养学报, 2021, 33(1): 308-316. XU J, ZHANG Z R, WANG D H, et al. Effects of adding garlic essential oil into drinking water on growth performance, intestinal tissue morphology and cecum microbial flora of layer hens[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 308-316 (in Chinese). |
| [12] |
奚文博, 严昌国, 崔莲花. 益生元-菊粉在动物营养中的研究进展[J]. 饲料研究, 2017(21): 8-12, 21. XI W B, YAN C G, CUI L H. Research progress of prebiotic-inulin in animal nutrition[J]. Feed Research, 2017(21): 8-12, 21 (in Chinese). |
| [13] |
卢德勋. 饲料营养活性物质(nutricines): 一个亟待重新审视的研究领域[J]. 饲料工业, 2020, 41(3): 1-5. LU D X. Feed nutricines: a research area that is worth to examine closely[J]. Feed Industry, 2020, 41(3): 1-5 (in Chinese). |
| [14] |
易中华, 张建云. 膳食纤维与菊粉、低聚果糖对肠道生理功能的影响[J]. 中国动物保健, 2008(12): 102-104. YI Z H, ZHANG J Y. The influence of dietary fiber, inulin and oligofructose on the physiological function of intestine[J]. China Animal Health, 2008(12): 102-104 (in Chinese). |
| [15] |
陈泽, 上官明军, 杜彬, 等. 日粮中添加不同水平菊粉对白羽肉鸡生产的影响[J]. 山西农业科学, 2017, 45(9): 1530-1533. CHEN Z, SHANGGUAN M J, DU B, et al. Effects of different levels of inulin in daily ration on performance of white feather broilers[J]. Journal of Shanxi Agricultural Sciences, 2017, 45(9): 1530-1533 (in Chinese). DOI:10.3969/j.issn.1002-2481.2017.09.32 |
| [16] |
徐静, 陈一凡, 王德贺, 等. 大蒜精油对0~4周龄蛋雏鸡生长性能、肠道组织形态、免疫机能和血清生化指标的影响[J]. 动物营养学报, 2020, 32(12): 5684-5691. XU J, CHEN Y F, WANG D H, et al. Effects of garlic essential oil on growth performance, intestinal tissue morphology, immune function and serum biochemical indexes of 0 to 4 weeks old layer chickens[J]. Chinese Journal of Animal Nutrition, 2020, 32(12): 5684-5691 (in Chinese). |
| [17] |
王凡, 张学科, 张学艳, 等. 大蒜素对蛋雏鸡免疫器官抗氧化能力及生产性能的影响[J]. 饲料博览, 2019(10): 19-23. WANG F, ZHANG X K, ZHANG X Y, et al. Effects of allicin on immune organs antioxidant function and growth performance of laying hens[J]. Feed Review, 2019(10): 19-23 (in Chinese). |
| [18] |
金永才, 刘璇, 王国伟, 等. 复合植物提取物对"农大3号"小型蛋鸡父母代种鸡产蛋性能和种蛋品质的影响[J]. 中国家禽, 2020, 42(3): 103-105. JIN Y C, LIU X, WANG G W, et al. Effects of compound plant extracts on laying performance and egg quality of dwarf parent stock layer of Nongda No.3[J]. China Poultry, 2020, 42(3): 103-105 (in Chinese). |
| [19] |
WANG M, YANG C, WANG Q Y, et al. The growth performance, intestinal digestive and absorptive capabilities in piglets with different lengths of small intestines[J]. Animal, 2020, 14(6): 1196-1203. DOI:10.1017/S175173111900288X |
| [20] |
张耀文, 马文峰, 张志丹, 等. 天蚕素抗菌肽对产蛋后期蛋鸡生产性能、蛋品质及肠道黏膜形态的影响[J]. 家畜生态学报, 2020, 41(5): 30-35. ZHANG Y W, MA W F, ZHANG Z D, et al. Effects of antimicrobial peptides on laying performance, egg quality and intestinal morphology of hens during the late laying period[J]. Journal of Domestic Animal Ecology, 2020, 41(5): 30-35 (in Chinese). |
| [21] |
周建民, 马友彪, 张海军, 等. 白酒糟酵母培养物对肉仔鸡生长性能、血清抗氧化指标和肠道形态结构的影响[J]. 动物营养学报, 2019, 31(5): 2357-2366. ZHOU J M, MA Y B, ZHANG H J, et al. Effects of yeast culture using distiller's grains on growth performance, serum antioxidant indices and intestinal morphology of broilers[J]. Chinese Journal of Animal Nutrition, 2019, 31(5): 2357-2366 (in Chinese). |
| [22] |
JIN L Z, BAIDOO S K, MARQUARDT R R, et al. In vitro inhibition of adhesion of enterotoxigenic Escherichia coli K88 to piglet intestinal mucus by egg-yolk antibodies[J]. FEMS Immunology & Medical Microbiology, 1998, 21(4): 313-321. |
| [23] |
PLAZA-DÍAZ J, RUIZ-OJEDA F J, GIL-CAMPOS M, et al. Immune-mediated mechanisms of action of probiotics and synbiotics in treating pediatric intestinal diseases[J]. Nutrients, 2018, 10(1): 42. DOI:10.3390/nu10010042 |
| [24] |
陶振阳, 张耀文, 曹忠洋, 等. 粪肠球菌对产蛋后期蛋鸡生产性能、蛋品质及肠道组织形态的影响[J]. 中国畜牧兽医, 2020, 47(5): 1421-1428. TAO Z Y, ZHANG Y W, CAO Z Y, et al. Effects of Enterococcus faecalis on Production performance, egg quality and intestinal morphology of laying hens during the late laying period[J]. Chinese Animal Husbandry and Veterinary Medicine, 2020, 47(5): 1421-1428 (in Chinese). |
| [25] |
赵铭伟, 奉玲丽, 张琰芳, 等. 鞣花酸对断奶仔猪小肠黏膜形态及肠黏膜屏障功能的影响[J]. 黑龙江畜牧兽医, 2020(21): 126-130, 135. ZHAO M W, FENG L L, ZHANG Y F, et al. The effect of ellagic acid on the intestinal mucosal morphology and intestinal barrier function in weaned piglets[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(21): 126-130, 135 (in Chinese). |
| [26] |
YOUNG V B. The intestinal microbiota in health and disease[J]. Current Opinion in Gastroenterology, 2012, 28(1): 63-69. DOI:10.1097/MOG.0b013e32834d61e9 |
| [27] |
徐凤文. 饲料中添加绞股蓝粉对蛋鸡生产性能、蛋品质、血清生化指标和盲肠微生物区系影响的研究[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2019. XU F W. Effect of gypenia powder added to feed on performance, egg quality, serum biochemical indexes and caecum microflora of laying hens[D]. Master's Thesis. Yangling: Northwest A&F University, 2019. (in Chinese) |
| [28] |
肖发沂, 孙汝江. 植物提取物在家禽生产中的应用进展[J]. 家禽科学, 2018(2): 51-53. XIAO F Y, SUN R J. Research progress on plant extracts in poultry production[J]. Poultry Science, 2018(2): 51-53 (in Chinese). |
| [29] |
GRICE E A, KONG H H, CONLAN S, et al. Topographical and temporal diversity of the human skin microbiome[J]. Science, 2009, 324(5931): 1190-1192. |
| [30] |
曾李, 倪冬姣, 熊爱军, 等. 发酵茶籽粕对海兰褐蛋鸡产蛋性能、鸡蛋品质、血清生化指标和肠道菌群结构的影响[J]. 国外畜牧学(猪与禽), 2020, 40(3): 75-80. ZENG L, NI D J, XIONG A J, et al. Effect of fermented tea seed meal on laying performance, egg quality, serum biochemical indexes and intestinal flora structure of Hailan brown layer[J]. Animal Science Abroad (Pigs & Poultry), 2020, 40(3): 75-80 (in Chinese). |
| [31] |
徐帅, 林奕岑, 周梦佳, 等. 基于高通量测定肉鸡回肠微生物多样性及PICRUSt基因预测分析[J]. 动物营养学报, 2016, 28(8): 2581-2588. XU S, LIN Y C, ZHOU M J, et al. Analyzing of ileum microbial diversity of chickens by high-throughput sequencing and PICRUSt predicted[J]. Chinese Journal of Animal Nutrition, 2016, 28(8): 2581-2588 (in Chinese). |
| [32] |
张亚楠, 魏单平, 韩瑞丽, 等. 高产期不同产蛋水平蛋鸡肠道微生物群落特征[J]. 中国兽医学报, 2017, 37(6): 1179-1185. ZHANG Y N, WEI S P, HAN R L, et al. The character of the intestinal microbiota associated with laying performance in hens[J]. Chinese Journal of Veterinary Science, 2017, 37(6): 1179-1185 (in Chinese). |
| [33] |
张璐, 周林康, 廖榕玉, 等. 高脂饮食中添加短链菊粉对小鼠肠道菌群的影响[J]. 现代生物医学进展, 2017, 17(22): 4201-4206, 4258. ZHANG L, ZHOU L K, LIAO R Y, et al. Effect of short-chain inulin supplement on the gut microbiota in mice fed by high fat diet[J]. Progress in Modern Biomedicine, 2017, 17(22): 4201-4206, 4258 (in Chinese). |
| [34] |
王俊, 虞龙飞, 张祺满, 等. 植物提取物和抗生素对肉鸡生产性能和肠道菌群和代谢功能的研究[C]//中国畜牧兽医学会动物微生态学分会第五届第十三次全国学术研讨会论文集. 广州: 中国畜牧兽医学会, 2018: 240. WANG J, YU L F, ZHANG Q M, et al. On the effect of extracts and antibiotics on broiler performance, intestinal flora and metabolic function[C]//Proceedings of the Fifth 13th National Academic Symposium of the Animal Microecology Branch of the Chinese Society of Animal Husbandry and Veterinary Medicine. Guangzhou: Chinese Society of Animal Husbandry and Veterinary Medicine, 2018: 240. (in Chinese) |
| [35] |
HOOPER L V. Bacterial contributions to mammalian gut development[J]. Trends in Microbiology, 2004, 12(3): 129-134. |
| [36] |
杨建平, 王笑笑, 李新锋, 等. 饲粮中添加复合植物精油对58周龄海兰褐壳蛋鸡生产性能、蛋品质和肠道菌群结构的影响[J]. 动物营养学报, 2020, 32(6): 2869-2879. YANG J P, WANG X X, LI X F, et al. Effects of compound plant essential oils on performance, egg quality and cecal microflora of 58-week-old Hy-Line brown laying hens[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2869-2879 (in Chinese). |
| [37] |
GRANDER C, ADOLPH T E, WIESER V, et al. Recovery of ethanol-induced Akkermansia muciniphila depletion ameliorates alcoholic liver disease[J]. Gut, 2018, 67(5): 891-901. |
| [38] |
BRAHE L K, LE CHATELIER E, PRIFTI E, et al. Specific gut microbiota features and metabolic markers in postmenopausal women with obesity[J]. Nutrition & Diabetes, 2015, 5(6): e159. |
| [39] |
NAGAO-KITAMOTO H, LESLIE J L, KITAMOTO S, et al. Interleukin-22-mediated host glycosylation prevents Clostridioides difficile infection by modulating the metabolic activity of the gut microbiota[J]. Nature Medicine, 2020, 26(4): 608-617. |




