2. 岭南现代农业科学与技术广东省实验室茂名分中心, 茂名 525000
2. Maoming Branch, Guangdong Laboratory for Lingnan Modern Agricultural Science and Technology, Maoming 525000, China
淀粉作为谷物类饲料碳水化合物的主要成分,是畜禽维持其正常生长所需能量的重要来源[1]。诸多研究发现,由于淀粉来源、组成和结构等的不同,其在动物宿主消化道内的消化速率和消化吸收部位均存在明显差异,并影响能量的供应效率、养分吸收和利用、肠道微生物的组成和代谢活性,进而导致动物体内的营养生理效应存在差异[2-4]。在自然界中,淀粉主要由线性分支状的支链淀粉和线性螺旋状的直链淀粉2种类型的分子组成,其中支链淀粉属于快速消化淀粉,可被宿主小肠中的α-淀粉酶快速降解并被机体吸收;而直链淀粉属于慢速消化淀粉,不易被宿主小肠中的α-淀粉酶降解或降解很慢,但可到达后肠作为微生物发酵的底物而被发酵产生大量的短链脂肪酸,对宿主的生长发育和肠道健康具有重要的影响[5-6]。因此,不同淀粉类型饲粮由于其所含有的直链淀粉与支链淀粉的比值不同,对宿主动物的营养生理效应以及黏膜免疫稳态也不尽相同。结肠是机体内肠道微生物发酵比较活跃的部位,其上皮免疫功能的稳定对宿主的肠道健康具有重要的作用,但不同淀粉类型饲粮对结肠黏膜免疫稳态的影响还相对缺乏。在断奶仔猪上的研究发现,饲喂含有不同淀粉类型的饲粮显著改变了采食后不同时间点血清中葡萄糖和脂代谢相关物质的浓度[7]。在育肥猪上的研究发现,饲喂含有不同直链淀粉与支链淀粉比例的饲粮对其生长性能无显著影响,但随着饲粮直链淀粉/支链淀粉值的提高,降低了营养物质的表观消化率,改变了后肠食糜中微生物的组成及其对碳水化合物的代谢[8],同时还显著下调了结肠黏膜中白细胞介素(interleukin,IL)-6、IL-12、IL-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达[9],有益于维系育肥猪的肠道健康。另有研究发现,与含有高支链的蜡质玉米淀粉饲粮相比,饲喂含有高直链的豌豆淀粉饲粮可显著提高育肥猪的生长性能和肉品质[10],并促进机体对氨基酸的转运吸收[11]。本试验前期研究结果也发现,给育肥猪饲喂含有不同淀粉类型饲粮显著影响了其生长性能、肉品质以及后肠微生物的组成和代谢活性,与低直链的木薯淀粉饲粮相比,饲喂含有高直链的豌豆淀粉饲粮可增加其平均日增重达14.12%,降低料重比达9.88%,同时提高屠宰性能和肉品质[12];此外,还增加了盲肠食糜中有益微生物的数量和短链脂肪酸类物质的浓度,降低了潜在致病菌的数量和代谢相关产物的浓度,进而有利于维持宿主的肠道健康[13]。
目前,尽管国内外已有不少关于不同淀粉类型饲粮在猪上应用的研究报道,但主要停留在对猪生长性能、肉品质、营养物质表观消化率以及肠道微生物组成和代谢等的影响方面,其对后肠黏膜免疫稳态的影响还相对缺乏。因此,本试验拟通过研究不同淀粉类型饲粮对育肥猪营养物质表观消化率、血清生化和免疫相关指标、结肠黏膜免疫状态以及食糜中主要微生物数量的影响,从肠道黏膜免疫角度来揭示摄食含有高直链的豌豆淀粉饲粮是如何维护肠道健康,进而提高育肥猪的生长性能的,相关研究结果将为在育肥猪生产中科学且合理地利用淀粉原料提供理论依据和试验数据。
1 材料与方法 1.1 试验设计和试验饲粮本试验是探究不同淀粉类型饲粮对育肥猪生长、机体代谢、免疫状态以及肠道微生物结构影响中的一部分内容,其动物试验设计同前期已发表的文章[12-14]。试验采用单因素完全随机区组试验设计,选取130日龄、健康且初始体重[(77.00±0.52) kg]相近的“杜×长×大”三元杂交阉公猪72头,按照体重随机分为3组,每组8个重复,每个重复3头猪。3组分别饲喂以木薯淀粉(tapioca starch,TS)、玉米淀粉(corn starch,CS)和豌豆淀粉(pea starch,PS)为唯一淀粉源配制的饲粮。试验饲粮参照NRC(2012)育肥猪营养需要进行配制,通过调整配方,使得3组饲粮的代谢能以及粗蛋白质、总淀粉和4种主要必需氨基酸(赖氨酸、蛋氨酸、苏氨酸和色氨酸)含量基本一致,直链淀粉与支链淀粉的比例分别为0.11、0.25和0.44,饲粮组成及营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of diets (as-fed basis) |
动物饲养试验在广东省农业科学院动物科学研究所试验基地进行,试验期间育肥猪自由采食和饮水,所有猪的饲养管理条件保持一致,每天不定期打扫圈舍,保持舍内清洁、通风和干燥,环境适宜。试验预试期4 d,正试期42 d。
试验结束前3天早上开始收集饲粮和刚排出未被污染的新鲜粪便样品。饲粮样品参照GB/T 14699.1—2005《饲料采样》的要求,以组为单位,采用四分法分别采集不同组的饲粮样品1 kg左右,经研磨过筛混匀后,置于密封袋保存在-20 ℃冰箱中待测;粪便样品以重复为单位,其具体采集和处理方法同余苗等[15]的操作步骤。
饲养试验结束当天,每组选取1头体重接近平均体重的猪(8头/组,共24头)运至广东省农业科学院动物科学研究所屠宰车间,电击晕后,采集前腔静脉血10 mL,经低温静止30 min后,于4 ℃ 3 000 r/min条件下离心10 min后得到血清,分装后置于-20 ℃冰箱中保存,用于血清生化和免疫指标的测定。采血结束后,将试验猪立即进行放血处死,迅速分离出结肠,收集所有结肠食糜经混匀后,取10 g左右样品置于-80 ℃超低温冰箱中保存,用于后续主要微生物数量的分析。取结肠中段组织,经生理盐水清洗干净并用滤纸吸干后,用载玻片刮取黏膜于灭菌后的冻存管中,放入液氮罐中保存测定。
1.3 指标测定及方法 1.3.1 营养物质表观消化率采用内源指示剂盐酸不溶灰分标记法测定营养物质表观消化率,其中饲粮和粪便样品中盐酸不溶灰分含量参照GB/T 23742—2009《饲料中盐酸不溶灰分的测定》[16]中的方法进行测定,饲粮和粪便样品中干物质、粗蛋白质、有机物、粗灰分和粗脂肪含量参照《饲料分析与检验》[17]中的方法进行测定。营养物质表观消化率具体计算公式如下:
某营养物质表观消化率(%)=100-100×
(粪便中该营养物质含量×饲粮中盐酸不溶
灰分含量)/(饲粮中该营养物质含量×
粪便中盐酸不溶灰分含量)。
1.3.2 血清生化指标采用全自动生化分析仪测定血清中总蛋白、白蛋白、球蛋白、尿素氮、葡萄糖、甘油三酯、总胆固醇、高密度脂蛋白和低密度脂蛋白浓度,测定所使用的试剂盒购买于中生北控生物科技股份有限公司。
1.3.3 结肠黏膜Toll样受体(Toll-like receptor,TLR)信号通路、细胞因子和屏障功能相关基因mRNA相对表达量结肠黏膜RNA采用Trizol试剂(TaKaRa,大连)提取,具体提取步骤参照Yu等[18]的方法。采用核酸蛋白检测仪(Nanodrop 2000,Thermo Fisher Scientific)测定RNA的浓度和纯度,260 nm吸光度/280 nm吸光度(OD260 nm/OD280 nm)应介于1.9~2.1。随后采用1%甲醛变性凝胶电泳对RNA完整性进行检测,选取RNA质量较高的样品,使用PrimerScriptTM RT Reagent Kit逆转录试剂盒(TaKaRa,大连)进行cDNA合成,具体操作步骤参照说明书,获得cDNA置于-20 ℃保存备用。以cDNA为模板,选取15个与肠道黏膜TLR信号通路、细胞因子和屏障功能相关的基因进行实时荧光定量PCR,相关特异性引物序列见表 2[19-27]。采用实时荧光定量PCR仪(CFX96 Real-time PCR System,Bio-Rad Laboratories,美国)进行检测,PCR反应体系和反应条件均参照前期已发表的相关文献[28-29]。定量结果以β-肌动蛋白(β-actin)作为内参基因,每个样品重复3次,采用2-△△Ct法分析相关基因的mRNA相对表达量[30]。
|
|
表 2 引物序列 Table 2 Primer sequences |
采用酶联免疫吸附试验(ELISA)法测定结肠黏膜和血清细胞因子和免疫球蛋白浓度,试剂盒购买于北京方程生物科技有限公司,具体操作步骤按照说明书进行操作。结肠黏膜样品在测定之前解冻,加2倍体积的磷酸盐缓冲液(PBS),用电匀浆机进行匀浆,然后在4 ℃条件下5 000 r/min离心10 min,收集上清液,用于测定相关细胞因子和免疫球蛋白浓度。
1.3.5 结肠食糜微生物DNA提取和实时荧光定量PCR检测称取0.25 g结肠食糜,采用MOBIO PowerFecal DNA试剂盒(Qiagen,德国)提取各样品总DNA,具体操作步骤参照试剂盒说明书。提取的DNA采用核酸蛋白检测仪(Nanodrop 2000,Thermo Fisher Scientific)检测其浓度和质量,检验样品合格的标准为:OD260 nm/OD280 nm为1.80~2.00,260 nm吸光度/230 nm吸光度为2.00左右。
采用实时荧光定量PCR仪(CFX96 Real-time PCR System,Bio-Rad Laboratories,美国)对结肠食糜中主要的微生物,包括总菌、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、大肠杆菌(Escherichia coli)、乳酸杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)、梭菌Ⅳ(Clostridium cluster Ⅳ)、梭菌ⅩⅣ(Clostridium cluster ⅩⅣ)、瘤胃球菌属(Ruminococcus)和普雷沃氏菌属(Prevotella)的16S rRNA基因拷贝数进行定量分析,所用引物序列、PCR反应体系以及扩增程序均参照余苗等[31]和Yu等[32]的方法,结果表示为每克结肠食糜中16S rRNA基因拷贝数的对数值。
1.4 数据统计分析采用SPSS 20.0软件对所有试验数据进行单因素方差分析(one-way ANOVA),并结合Tukey法进行多重比较。试验结果数据均表示为“平均值±标准误”,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 不同淀粉类型饲粮对育肥猪营养物质表观消化率的影响由表 3可知,与木薯淀粉组相比,豌豆淀粉组育肥猪粗蛋白质表观消化率显著提高(P < 0.05),而玉米淀粉组粗蛋白质表观消化率与木薯淀粉组和豌豆淀粉组相比差异均不显著(P>0.05)。各组干物质、有机物、粗灰分和粗脂肪表观消化率均无显著差异(P>0.05)。
|
|
表 3 不同淀粉类型饲粮对育肥猪营养物质表观消化率的影响 Table 3 Effects of different starch type diets on nutrient apparent digestibility of finishing pigs |
由表 4可知,与木薯淀粉组相比,豌豆淀粉组育肥猪血清中尿素氮、葡萄糖、总胆固醇和甘油三酯浓度显著降低(P < 0.05),而玉米淀粉组的上述指标与木薯淀粉组和豌豆淀粉组相比差异均不显著(P>0.05)。此外,各组育肥猪血清中总蛋白、白蛋白、球蛋白、高密度脂蛋白和低密度脂蛋白浓度均无显著差异(P>0.05)。
|
|
表 4 不同淀粉类型饲粮对育肥猪血清生化指标的影响 Table 4 Effects of different starch type diets on serum biochemical indices of finishing pigs |
由表 5可知,与木薯淀粉组相比,豌豆淀粉组育肥猪血清中细胞因子IL-8和干扰素-γ(IFN-γ)浓度显著降低(P < 0.05),而血清中IL-10和免疫球蛋白A(IgA)浓度显著提高(P < 0.05),而玉米淀粉组上述指标无显著差异(P>0.05)。此外,各组育肥猪血清中肿瘤坏死因子-α(TNF-α)和免疫球蛋白G(IgG)浓度差异均不显著(P>0.05)。
|
|
表 5 不同淀粉类型饲粮对育肥猪血清细胞因子和免疫球蛋白浓度的影响 Table 5 Effects of different starch type diets on concentrations of cytokines and immunoglobulins in serum of finishing pigs |
由表 6可知,与木薯淀粉组相比,豌豆淀粉组育肥猪结肠黏膜中IL-10、分泌型免疫球蛋白A(sIgA)和IgG浓度显著提高(P < 0.05),而玉米淀粉组的上述指标与木薯淀粉组和豌豆淀粉组相比差异均不显著(P>0.05)。此外,各组育肥猪结肠黏膜中IL-8、IFN-γ和TNF-α浓度均无显著差异(P>0.05)。
|
|
表 6 不同淀粉类型饲粮对育肥猪结肠黏膜细胞因子和免疫球蛋白浓度的影响 Table 6 Effects of different starch type diets on concentrations of cytokines and immunoglobulins in colonic mucosa of finishing pigs |
由图 1可知,不同淀粉类型饲粮对育肥猪结肠食糜中微生物总菌和2个主要菌门(厚壁菌门和拟杆菌门)数量无显著影响(P>0.05)。与木薯淀粉组相比,豌豆淀粉组育肥猪结肠食糜中乳酸杆菌、普雷沃氏菌属和双歧杆菌数量显著增加(P < 0.05),结肠食糜中大肠杆菌数量显著降低(P < 0.05),而玉米淀粉组上述微生物数量与木薯淀粉组和豌豆淀粉组相比差异均不显著(P>0.05)。此外,不同组间育肥猪结肠食糜中瘤胃球菌属、梭菌Ⅳ和梭菌ⅩⅣ数量差异均不显著(P>0.05)。
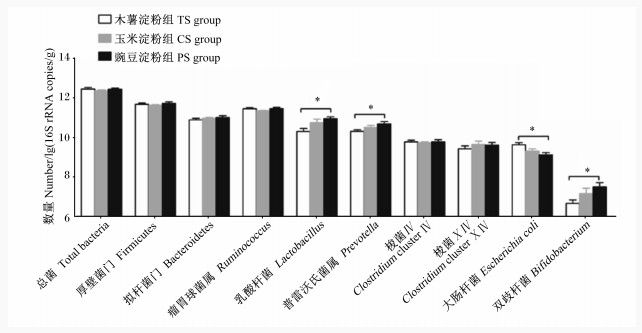
|
*表示差异显著(P < 0.05),* *表示差异极显著(P < 0.01)。下图同。 * mean significantly different (P < 0.05), and * * mean extremely significantly different (P < 0.01). The same as below. 图 1 不同淀粉类型饲粮对育肥猪结肠食糜主要微生物数量的影响 Fig. 1 Effects of different starch type diets on main microorganism numbers in colonic digesta of finishing pigs |
由图 2可知,与木薯淀粉组相比,豌豆淀粉组育肥猪结肠黏膜中TLR2、TLR4、髓样分化因子88(MyD88)、核转录因子-κB(NF-κB)和IFN-γ的mRNA相对表达量极显著下调(P < 0.01),而结肠黏膜中IL-10的mRNA相对表达量极显著上调(P < 0.01);玉米淀粉组结肠黏膜中TLR2、TLR4和IFN-γ的相对mRNA表达量显著下调(P < 0.05),结肠黏膜中MyD88和NF-κB的mRNA相对表达量极显著下调(P < 0.01),而结肠黏膜中IL-10的mRNA相对表达量极显著上调(P < 0.01)。此外,各组育肥猪结肠黏膜中TLR5、IL-8和TNF-α的mRNA相对表达量均无显著差异(P>0.05)。
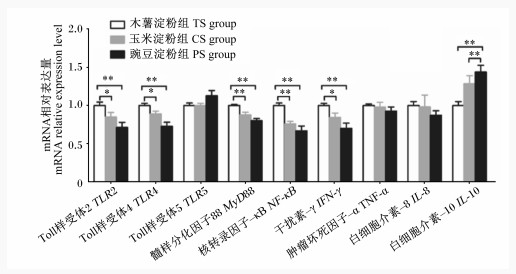
|
图 2 不同淀粉类型饲粮对育肥猪结肠黏膜TLR信号通路及细胞因子mRNA相对表达量的影响 Fig. 2 Effects of different starch type diets on mRNA relative expression levels of TLR signaling pathway and cytokines in colonic mucosa of finishing pigs |
由图 3可知,与木薯淀粉组相比,豌豆淀粉组育肥猪结肠黏膜中闭锁小带蛋白-1(ZO-1)和封闭蛋白-2(claudin-2)的mRNA相对表达量极显著上调(P < 0.01),玉米淀粉组结肠黏膜中ZO-1和claudin-2的mRNA相对表达量显著上调(P < 0.05),但玉米淀粉组和豌豆淀粉组组上述指标无显著差异(P>0.05)。此外,各组育肥猪结肠黏膜中闭锁蛋白(occludin)、封闭蛋白-1(claudin-1)、黏蛋白1(MUC1)和黏蛋白2(MUC2)的mRNA相对表达量均无显著差异(P>0.05)。
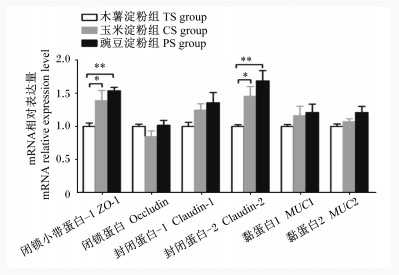
|
图 3 不同淀粉类型饲粮对育肥猪结肠黏膜屏障功能相关基因mRNA相对表达量的影响 Fig. 3 Effects of different starch type diets on mRNA relative expression levels of genes related to barrier function in colonic mucosa of finishing pigs |
淀粉是动物维持其正常生长所需能量的主要来源,不同淀粉类型饲粮由于其来源、组成和结构等的不同,动物对其利用效率和营养生理效应也存在明显差异。蒲俊宁等[8]在育肥猪上的研究发现,饲粮中总能、粗灰分、粗脂肪和粗蛋白质的表观消化率随着饲粮中直链淀粉与支链淀粉比例的提高而降低。李丰隆[33]研究不同来源淀粉对75~100 kg阶段育肥猪的营养物质表观消化率发现,饲喂含有高直链的玉米淀粉饲粮组的钙和总磷的表观消化率显著高于低直链的糯米淀粉组,而干物质、粗蛋白质和能量的表观消化率无显著差异。何锦[34]在研究不同来源淀粉对育肥猪小肠不同肠段营养物质消化率的影响时发现,与含有低直链淀粉/支链淀粉值(0.02)的糯米淀粉组相比,给育肥猪饲喂含有高直链淀粉/支链淀粉值(0.40)的玉米淀粉饲粮显著提高了空肠和回肠部位干物质、粗蛋白质、钙和磷的消化率。本试验也发现,含有高直链淀粉/支链淀粉值(0.44)的豌豆淀粉组的全肠道粗蛋白质表观消化率显著高于含有低直链淀粉/支链淀粉值(0.11)的木薯淀粉组。动物对饲粮中营养物质的消化吸收和利用的效率越高,对其生长越有利。因此,这一研究结果正好解释笔者前期的研究发现,即饲喂豌豆淀粉组的生长性能显著高于木薯淀粉组[12]。前人研究发现,当饲粮中直链淀粉/支链淀粉值较低时,可导致淀粉的能量代谢过程和蛋白质的吸收合成过程的同步性不对应,从而使得氨基酸转化为蛋白质的通路受阻,进而负反馈调节蛋白质的消化过程,最终降低蛋白质的消化率[35]。另有研究发现,豌豆淀粉饲粮具有促进猪小肠的发育和肠细胞增殖的作用[36]。因此,本试验中摄食豌豆淀粉饲粮提高了育肥猪对粗蛋白质的表观消化率,其原因一方面可能是豌豆淀粉饲粮中的直链淀粉与支链淀粉的比例适中,使得淀粉的能量代谢速率和蛋白质吸收速率处于同步性,进而提高了蛋白质的消化率;另一方面,豌豆淀粉可能通过促进了育肥猪肠道发育和肠细胞的增殖,进而促进了机体对蛋白质的消化吸收,但其具体作用机制还有待进一步研究。
3.2 不同淀粉类型饲粮对育肥猪血液生化指标的影响一般而言,血清中的生化指标可间接反映动物机体对营养物质的消化吸收代谢水平和生长性能等状况,其也是衡量宿主健康状态的重要指标[37]。本试验研究发现,豌豆淀粉组育肥猪血清中尿素氮的浓度显著低于木薯淀粉组。血清尿素氮是机体氨基酸代谢的终产物之一,其浓度在一定程度上反映了饲粮中蛋白质的营养水平以及动物对蛋白质的代谢利用状况,通常用来评估动物的生长以及营养物质消化的趋势,该指标降低则表明饲粮蛋白质的利用率提高,宿主机体内氮沉积和蛋白质合成率增加[38]。同时,在肝脏中合成尿素是一个消耗能量的过程,合成1 mol的尿素需要消耗3 mol的ATP[38]。因此,本试验中血清尿素氮浓度的降低可能表明育肥猪摄食含有高直链的豌豆淀粉后,机体对蛋白质和氨基酸的利用率得以提高,机体对能量的消耗得以降低,最终促进其生长。
血糖是机体细胞首要的供能物质,而淀粉是动物机体葡萄糖的主要来源物质,其来源、颗粒大小、直链淀粉与支链淀粉比例不同均可影响血液中葡萄糖的含量。本试验中,饲喂豌豆淀粉饲粮的育肥猪血清中葡萄糖的浓度显著低于木薯淀粉组,这与戴求仲[39]和张珍珍[7]的研究结果一致,即摄食含高直链淀粉的饲粮组动物血清中葡萄糖浓度最低。木薯淀粉中的支链淀粉含量最高,豌豆淀粉中含有较高的直链淀粉,而支链淀粉在动物机体内易被消化酶迅速降解生成葡萄糖,而直链淀粉难被消化酶降解。此外,低直链淀粉/支链淀粉值饲粮可上调小肠黏膜中葡萄糖转运载体的表达水平,进而提高对葡萄糖的吸收速率,最终导致血糖浓度升高[11]。因此,本试验中造成这一结果的主要原因可能是这3种淀粉组成上存在明显差异,进而影响了其消化和葡萄糖的吸收速率,最终影响了血清中葡萄糖的浓度。
葡萄糖在宿主体内的代谢途径之一是作为脂肪酸合成的前提物质,参与机体内的脂代谢,因此,血糖浓度的改变也会引起血液中脂代谢相关指标发生相应的变化[7]。本研究中,与木薯淀粉相比,育肥猪摄食含有高直链的豌豆淀粉饲粮显著降低了血清中甘油三酯和总胆固醇的浓度,这与前人诸多在猪上的研究结果[40-42]一致。血清中甘油三酯和胆固醇的浓度取决于其肠道吸收的速率,含有高直链淀粉的饲粮可导致释放葡萄糖的速率降低,进而降低脂类的代谢,但其具体作用机制还有待进一步研究。
3.3 不同淀粉类型饲粮对育肥猪结肠食糜主要微生物数量的影响定殖于动物胃肠道内的微生物,具有多种生物学活性,可通过广泛参与宿主对各类营养物质的代谢从而对机体的免疫稳态产生重要的影响[43],其种类、数量和代谢活性主要受宿主所摄食的饲粮结构和组成的影响。本试验通过实时荧光定量PCR检查结肠食糜中主要微生物的数量发现,育肥猪摄食含有高直链的豌豆淀粉饲粮显著抑制了潜在致病菌大肠杆菌的增殖,促进了有益菌乳酸杆菌、双歧杆菌和普雷沃氏菌属的增殖,这与笔者前期在盲肠中的研究结果[13]一致,也与Bird等[6]和Fouhse等[44]在断奶仔猪上以及蒲俊宁等[8]在育肥猪上的研究结果一致,即摄食含有高直链淀粉的饲粮可显著增加后肠食糜中乳酸杆菌和双歧杆菌的数量。乳酸杆菌和双歧杆菌属细菌属于对机体健康有益的肠道菌群,一方面可通过平衡抗炎与促炎因子间的比值来对宿主肠道具有益生作用;另一方面也可通过产生一些抗菌因子(如细菌素和乳酸),通过竞争性抑制潜在致病菌的感染和定殖,进而维系宿主肠道和整个机体的健康[45]。普雷沃氏菌属于肠道中主要的淀粉降解菌,可分解淀粉生成大量的短链脂肪酸,进而调节肠道黏膜免疫系统的发育[46]。大肠杆菌属于潜在致病菌,是导致动物宿主发生细菌性痢疾或结肠炎症的主要细菌[47]。健康的肠道内环境可维系宿主肠道健康,进而改善其生长性能。因此,本试验中有益菌数量的增加以及潜在致病菌数量的减少,表明摄食高直链的豌豆淀粉饲粮可维系宿主肠道微生物菌群的稳态,并对肠道健康具有益生作用。这一研究结果进一步从肠道微生态层面解释笔者前期的研究发现,即饲喂豌豆淀粉显著提高了育肥猪的生长性能[12]。
饲粮是影响肠道微生物组成的主要因素,饲粮中各组分的含量或类型的改变均可快速改变肠道微生物的种类和数量。如前言所属,豌豆淀粉中含有较高的直链淀粉,在前肠不易消化,可到达后肠作为微生物发酵的底物。因此,本试验中不同淀粉类型饲粮改变了结肠微生物的数量可能是由于其不同淀粉类型结构导致的。
3.4 不同淀粉类型饲粮对育肥猪免疫功能的影响作为宿主第一道防线的肠道黏膜免疫系统,具有独特的先天和适应性防御机制,可有效防止病原菌的入侵和肠道抗原感染,进而维系宿主肠道健康。肠道模式识别受体TLR可通过识别肠道细菌产生的病原体相关分子信号来调节肠道上皮的免疫应答。本研究结果发现,摄食含有高直链的豌豆淀粉饲粮下调了育肥猪结肠黏膜中TLR2、TLR4、MyD88、NF-κB和IFN-γ的mRNA相对表达量,而上调了抗炎因子IL-10的mRNA相对表达量和蛋白浓度,同时上调了屏障功能相关基因ZO-1和claudin-2的mRNA相对表达量。Ren等[9]在育肥猪上的研究也发现,摄食高直链淀粉/支链淀粉值的饲粮显著下调了结肠黏膜炎性细胞因子的表达水平,进而维系其肠道健康。TLR2可通过识别肠道细菌产生的磷壁酸,进而激活肠道黏膜免疫反应[48]。TLR4是另一种重要的肠道上皮模式识别受体,可通过MyD88依赖性信号通路激活转录因子NF-κB的表达,进而刺激炎性细胞因子、趋化因子和活化T细胞的产生[49]。IFN-γ属于促炎细胞因子,参与机体炎症反应以抵御病原微生物,其过度表达可导致肠上皮细胞屏障功能紊乱,抑制动物的生长并降低生产效益。IL-10属于限制免疫反应中组织过度损伤的关键抗炎因子,可阻止免疫反应的过度激活并发挥抗炎作用[50]。封闭蛋白(claudin)和ZO-1是组成肠黏膜机械屏障完整性并决定肠道通透性的主要蛋白分子,能够封闭肠道上皮细胞之间蛋白的间隙,进而有效阻止肠道中细菌和毒素的旁细胞转运[51]。有研究表明,肠道微生物组成及其代谢产物的改变可影响肠道健康,如双歧杆菌属的细菌可上调仔猪肠道IL-10的表达[52],乳酸杆菌属细菌可改善仔猪肠上皮屏障功能,减少产肠毒素型大肠杆菌的定殖,促进肠道健康[53];大肠杆菌可通过TLR4信号通路引发肠道炎症[54];丁酸可通过抑制核内转录因子NF-κB的活性,进而发挥抗炎症和维系肠道屏障功能完整性的作用[55];微生物含氮代谢产物,如生物胺、酚和吲哚类等物质对肠道上皮具有产生促炎症的效应[56]。本试验前期研究结果发现,豌豆淀粉饲粮降低了结肠食糜中大肠杆菌数量以及生物胺、酚和吲哚类物质的浓度,提高了乳酸杆菌和双歧杆菌属细菌的数量以及乳酸、乙酸和丁酸等短链脂肪酸的浓度[14]。因此,本试验中豌豆淀粉饲粮通过减弱TLR4-MyD88-NF-κB信号通路的激活,进而下调促炎细胞因子的表达,上调抗炎因子和屏障功能相关基因的表达,其原因可能是豌豆淀粉饲粮增加了结肠食糜中双歧杆菌和乳酸杆菌属细菌的数量以及短链脂肪酸类物质的浓度,从而减少潜在致病菌大肠杆菌的数量和含氮代谢产物的浓度,进而维系了结肠黏膜的免疫稳态,但其具体作用机制还有待进一步研究。
免疫球蛋白对病毒和细菌等微生物具有抗体活性,可通过抑制其增殖,进而减少其黏附在肠黏膜上[57]。本研究还发现,摄食豌豆淀粉饲粮提高了育肥猪结肠黏膜中sIgA和IgG的蛋白浓度。肠黏膜sIgA和IgG对维持黏膜免疫和微生物区系的稳态具有重要的调控作用,sIgA可结合细菌的表面多糖,包被在细菌表面,引起细菌凝集,形成局部免疫屏障,进而减少微生物对黏膜的损伤[58]。IgG在免疫应答反应中可活化补体,清除病原体[57]。因此,本试验中结肠黏膜中sIgA和IgG浓度的提高,表明摄食含有高直链的豌豆淀粉饲粮可增强肠道免疫系统的防御功能。此外,本试验还发现,豌豆淀粉饲粮提高了血清中抗炎细胞因子IL-10和IgA的浓度,降低了血清中促炎因子IL-8和IFN-γ的浓度。血清中免疫球蛋白和细胞因子的浓度可反映动物机体系统免疫能力的高低。因此,本试验中血清中相关免疫指标的改变表明摄食含有高直链的豌豆淀粉饲粮具有提高育肥猪系统免疫力的作用,进而促进其生长。
4 结论综上所述,本研究结果表明,与含有低直链的木薯淀粉相比,给育肥猪饲喂含有高直链的豌豆淀粉饲粮可显著提高育肥猪对饲粮粗蛋白质的表观消化率,降低血清中尿素氮、葡萄糖及脂代谢相关物质的浓度;同时具有促进结肠有益菌增殖,降低潜在致病菌生长,进而维系其结肠黏膜和系统免疫的稳态。以上结果表明摄食含有高直链的淀粉对整个机体的健康具有益生作用。
| [1] |
NOFRARÍAS M, MARTÍNEZ-PUIG D, PUJOLS J, et al. Long-term intake of resistant starch improves colonic mucosal integrity and reduces gut apoptosis and blood immune cells[J]. Nutrition, 2007, 23(11/12): 861-870. |
| [2] |
DENG J, WU X, BIN S, et al. Dietary amylose and amylopectin ratio and resistant starch content affects plasma glucose, lactic acid, hormone levels and protein synthesis in splanchnic tissues[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 94(2): 220-226. DOI:10.1111/j.1439-0396.2008.00902.x |
| [3] |
REGMI P R, METZLER-ZEBELI B U, GÄNZLE M G, et al. Starch with high amylose content and low in vitro digestibility increases intestinal nutrient flow and microbial fermentation and selectively promotes Bifidobacteria in pigs[J]. The Journal of Nutrition, 2011, 141(7): 1273-1280. DOI:10.3945/jn.111.140509 |
| [4] |
DOTI S, SUÁREZ B J, LATORRE M A, et al. Effect of dietary starch source on growth performances, digestibility and quality traits of growing pigs[J]. Livestock Science, 2014, 164: 119-127. DOI:10.1016/j.livsci.2014.03.016 |
| [5] |
KNUDSEN K E B, HEDEMANN M S, LÆRKE H N. The role of carbohydrates in intestinal health of pigs[J]. Animal Feed Science and Technology, 2012, 173(1/2): 41-53. |
| [6] |
BIRD A R, VUARAN M, BROWN I, et al. Two high-amylose maize starches with different amounts of resistant starch vary in their effects on fermentation, tissue and digesta mass accretion, and bacterial populations in the large bowel of pigs[J]. The British Journal of Nutrition, 2007, 97(1): 134-144. DOI:10.1017/S0007114507250433 |
| [7] |
张珍珍. 不同直链、支链组成的淀粉对断奶仔猪脂肪代谢影响的研究[D]. 硕士学位论文. 南昌: 南昌大学, 2010. ZHANG Z Z. Dietary amylopectin-amylose starch content affects lipid metabolism in weaned pigs[D]. Master's Thesis. Nanchang: Nanchang University, 2010. (in Chinese) |
| [8] |
蒲俊宁, 王华杰, 陈代文, 等. 饲粮直链/支链淀粉比对育肥猪生长性能、营养物质表观消化率、肠道食糜菌群数量与挥发性脂肪酸浓度以及肌内脂肪含量的影响[J]. 动物营养学报, 2018, 30(12): 4874-4885. PU J N, WANG H J, CHEN D W, et al. Effects of dietary amylose/amylopectin ratio on growth performance, nutrient apparent dgestibility, intestinal microflora number and volatile fatty acid concentrations and intramuscular fat content of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2018, 30(12): 4874-4885 (in Chinese). |
| [9] |
REN W, YAN H L, YU B, et al. Prevotella-rich enterotype may benefit gut health in finishing pigs fed a diet with high amylose-to-amylopectin ratio[J/OL]. Animal Nutrition. (2021-02-25)[2021-03-20]. https://www.sciencedirect.com/science/article/pii/S2405654521000226. DOI: 10.1016/j.aninu.2020.08.007.
|
| [10] |
LI Y J, LI J L, ZHANG L, et al. Effects of dietary starch types on growth performance, meat quality and myofibre type of finishing pigs[J]. Meat Science, 2017, 131: 60-67. DOI:10.1016/j.meatsci.2017.04.237 |
| [11] |
谢晨, 李艳娇, 李蛟龙, 等. 不同淀粉类型日粮对育肥猪消化代谢的影响[J]. 畜牧兽医学报, 2017, 48(12): 2337-2346. XIE C, LI Y J, LI J L, et al. Effect of dietary starch types on intestinal digestion and metabolism of finishing pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(12): 2337-2346 (in Chinese). DOI:10.11843/j.issn.0366-6964.2017.12.013 |
| [12] |
YU M, LI Z, RONG T, et al. Different dietary starch sources alter the carcass traits, meat quality, and the profile of muscle amino acid and fatty acid in finishing pigs[J]. Journal of Animal Science and Biotechnology, 2020, 11(1): 78. DOI:10.1186/s40104-020-00484-9 |
| [13] |
余苗, 李贞明, 陈卫东, 等. 不同淀粉类型饲粮对育肥猪盲肠食糜主要微生物及其代谢产物的影响[J]. 动物营养学报, 2020, 32(2): 613-625. YU M, LI Z M, CHEN W D, et al. Effects of different starch type diets on main microbes and their metabolites in cecal digesta of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2020, 32(2): 613-625 (in Chinese). |
| [14] |
YU M, LI Z M, CHEN W D, et al. Microbiome-metabolomics analysis investigating the impacts of dietary starch types on the composition and metabolism of colonic microbiota in finishing pigs[J]. Frontiers in Microbiology, 2019, 10: 1143. DOI:10.3389/fmicb.2019.01143 |
| [15] |
余苗, 李贞明, 陈卫东, 等. 黑水虻幼虫粉对育肥猪营养物质消化率、血清生化指标和氨基酸组成的影响[J]. 动物营养学报, 2019, 31(7): 3330-3337. YU M, LI Z M, CHEN W D, et al. Effects of hermetia illucens L. larvae meal on nutrient digestibility, serum biochemical indices and amino acid composition of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2019, 31(7): 3330-3337 (in Chinese). |
| [16] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中盐酸不溶灰分的测定: GB/T 23742-2009[S]. 北京: 中国标准出版社, 2009. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration. Animal feeding stuffs-determination of ash insoluble in hydrochloric acid: GB/T 23742-2009[S]. Beijing: Standards Press of China, 2009. (in Chinese) |
| [17] |
王加启, 于建国. 饲料分析与检验[M]. 北京: 中国计量出版社, 2004. WANG J Q, YU J G. Feed analysis and inspection[M]. Beijing: China Metrology Publishing House, 2004 (in Chinese). |
| [18] |
YU M, MU C L, YANG Y X, et al. Increases in circulating amino acids with in-feed antibiotics correlated with gene expression of intestinal amino acid transporters in piglets[J]. Amino Acids, 2017, 49(9): 1587-1599. DOI:10.1007/s00726-017-2451-0 |
| [19] |
PIEPER R, KRÖGER S, RICHTER J F, et al. Fermentable fiber ameliorates fermentable protein-induced changes in microbial ecology, but not the mucosal response, in the colon of piglets[J]. The Journal of Nutrition, 2012, 142(4): 661-667. DOI:10.3945/jn.111.156190 |
| [20] |
COLLADO-ROMERO M, ARCE C, RAMÍREZ-BOO M, et al. Quantitative analysis of the immune response upon Salmonella typhimurium infection along the porcine intestinal gut[J]. Veterinary Research, 2010, 41(2): 23. DOI:10.1051/vetres/2009072 |
| [21] |
LIU Y L, CHEN F, ODLE J, et al. Fish oil enhances intestinal integrity and inhibits TLR4 and NOD2 signaling pathways in weaned pigs after LPS challenge[J]. The Journal of Nutrition, 2012, 142(11): 2017-2024. DOI:10.3945/jn.112.164947 |
| [22] |
ZHENG R A, YANG L Y, ZHOU X L, et al. Effect of soybean oligosaccharides on immunity and TLR2-NF-κB signal pathway response for weanling pigs[J]. Journal of Food Agriculture and Environment, 2012, 10(1): 273-279. |
| [23] |
ZHOU X L, KONG X F, LIAN G Q, et al. Dietary supplementation with soybean oligosaccharides increases short-chain fatty acids but decreases protein-derived catabolites in the intestinal luminal content of weaned Huanjiang mini-piglets[J]. Nutrition Research, 2014, 34(9): 780-788. DOI:10.1016/j.nutres.2014.08.008 |
| [24] |
TUDELA C V, BOUDRY C, STUMPFF F, et al. Down-regulation of monocarboxylate transporter 1(MCT1) gene expression in the colon of piglets is linked to bacterial protein fermentation and pro-inflammatory cytokine-mediated signalling[J]. The British Journal of Nutrition, 2015, 113(4): 610-617. DOI:10.1017/S0007114514004231 |
| [25] |
YU X L, ZHOU Z, HU D M, et al. Pathogenic pseudorabies virus, China, 2012[J]. Emerging Infectious Diseases, 2014, 20(1): 102-104. DOI:10.3201/eid2001.130531 |
| [26] |
GAO Y, HAN F, HUANG X, et al. Changes in gut microbial populations, intestinal morphology, expression of tight junction proteins, and cytokine production between two pig breeds after challenge with Escherichia coli K88:a comparative study[J]. Journal of Animal Science, 2013, 91(12): 5614-5625. DOI:10.2527/jas.2013-6528 |
| [27] |
JIANG J J, CHEN D W, YU B, et al. Improvement of growth performance and parameters of intestinal function in liquid fed early weanling pigs[J]. Journal of Animal Science, 2019, 97(7): 2725-2738. DOI:10.1093/jas/skz134 |
| [28] |
YU M, LI Z M, CHEN W D, et al. Use of hermetia illucens larvae as a dietary protein source: effects on growth performance, carcass traits, and meat quality in finishing pigs[J]. Meat Science, 2019, 158: 107837. DOI:10.1016/j.meatsci.2019.05.008 |
| [29] |
YU M, LI Z M, CHEN W D, et al. Hermetia illucens larvae as a potential dietary protein source altered the microbiota and modulated mucosal immune status in the colon of finishing pigs[J]. Journal of Animal Science and Biotechnology, 2019, 10: 50. DOI:10.1186/s40104-019-0358-1 |
| [30] |
YU M, LI Z M, CHEN W D, et al. Hermetia illucens larvae as a fishmeal replacement alters intestinal specific bacterial populations and immune homeostasis in weanling piglets[J]. Journal of Animal Science, 2020, 98(3): skz395. DOI:10.1093/jas/skz395 |
| [31] |
余苗, 李贞明, 王刚, 等. 黑水虻幼虫粉对育肥猪盲肠食糜主要微生物数量和代谢产物的影响[J]. 畜牧兽医学报, 2020, 51(2): 299-310. YU M, LI Z M, WANG G, et al. Effects of hermetia illucens larvae meal on the number of main microbes and metabolites in the cecal digesta of finishing pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(2): 299-310 (in Chinese). |
| [32] |
YU M, LI Z M, CHEN W D, et al. Dietary supplementation with citrus extract altered the intestinal microbiota and microbial metabolite profiles and enhanced the mucosal immune homeostasis in yellow-feathered broilers[J]. Frontiers in Microbiology, 2019, 10: 2662. DOI:10.3389/fmicb.2019.02662 |
| [33] |
李丰隆. 不同来源淀粉对育肥猪生长性能、养分消化率以及血液生化指标的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2015. LI F L. The effect of starch sources on growth performance, nutrient digestibility and blood biochemical indicators in growing-finishing pigs[D]. Master's Thesis. Yangling: Northwest A & F University, 2015. (in Chinese) |
| [34] |
何锦. 不同来源淀粉对育肥猪养分消化率的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2015. HE J. The effect of starch sources on nutrient digestion in growing-finishing pigs[D]. Master's Thesis. Yangling: Northwest A & F University, 2015. (in Chinese) |
| [35] |
WEURDING R E, ENTING H, VERSTEGEN M W A. The effect of site of starch digestion on performance of broiler chickens[J]. Animal Feed Science and Technology, 2003, 110(1/4): 175-184. |
| [36] |
相振田. 饲粮不同来源淀粉对断奶仔猪肠道功能和健康的影响及机理研究[D]. 博士学位论文. 雅安: 四川农业大学, 2011. XIANG Z T. Effects of different dietary starches on intestinal functions and health and the underlying mechanism in weaned piglets[D]. Ph. D. Thesis. Ya'an: Sichuan Agricultural University, 2011. (in Chinese) |
| [37] |
NICHOLSON J K, HOLMES E, KINROSS J M, et al. Metabolic phenotyping in clinical and surgical environments[J]. Nature, 2012, 491(7424): 384-392. DOI:10.1038/nature11708 |
| [38] |
METGES C C, PETZKE K J, HENNIG U. Gas chromatography/combustion/isotope ratio mass spectrometric comparison of N-acetyl-and N-pivaloyl amino acid esters to measure 15N isotopic abundances in physiological samples: a pilot study on amino acid synthesis in the upper gastro-intestinal tract of minipigs[J]. Journal of Mass Spectrometry, 1996, 31(4): 367-376. DOI:10.1002/(SICI)1096-9888(199604)31:4<367::AID-JMS310>3.0.CO;2-V |
| [39] |
戴求仲. 日粮淀粉来源对生长猪氨基酸消化率、门静脉净吸收量和组成模式的影响[D]. 博士学位论文. 雅安: 四川农业大学, 2004. DAI Q Z. The effect of dietary starch source on ileum digestibility, net portal absorption and pattern of amino acids in growing pigs[D]. Ph. D. Thesis. Ya'an: Sichuan Agricultural University, 2004. (in Chinese) |
| [40] |
YANG C, CHEN D W, YU B, et al. Effect of dietary amylose/amylopectin ratio on growth performance, carcass traits, and meat quality in finishing pigs[J]. Meat Science, 2015, 108: 55-60. DOI:10.1016/j.meatsci.2015.05.026 |
| [41] |
BIRD A R, JACKSON M, KING R A, et al. A novel high-amylose barley cultivar (Hordeum vulgare var. Himalaya 292) lowers plasma cholesterol and alters indices of large-bowel fermentation in pigs[J]. The British Journal of Nutrition, 2004, 92(4): 607-615. DOI:10.1079/BJN20041248 |
| [42] |
HE J, CHEN D W, ZHANG K Y, et al. A high-amylopectin diet caused hepatic steatosis associated with more lipogenic enzymes and increased serum insulin concentration[J]. The British Journal of Nutrition, 2011, 106(10): 1470-1475. DOI:10.1017/S0007114511001966 |
| [43] |
朱伟云, 余凯凡, 慕春龙, 等. 猪的肠道微生物与宿主营养代谢[J]. 动物营养学报, 2014, 26(10): 3046-3051. ZHU W Y, YU K F, MU C L, et al. Gut microbiota and host nutrition metabolism in pigs[J]. Chinese Journal of Animal Nutrition, 2014, 26(10): 3046-3051 (in Chinese). |
| [44] |
FOUHSE J M, GÄNZLE M G, REGMI P R, et al. High amylose starch with low in vitro digestibility stimulates hindgut fermentation and has a bifidogenic effect in weaned pigs[J]. The Journal of Nutrition, 2015, 145(11): 2464-2470. DOI:10.3945/jn.115.214353 |
| [45] |
WANG W, CHEN L P, ZHOU R, et al. Increased proportions of Bifidobacterium and the Lactobacillus group and loss of butyrate-producing bacteria in inflammatory bowel disease[J]. Journal of Clinical Microbiology, 2014, 52(2): 398-406. DOI:10.1128/JCM.01500-13 |
| [46] |
FLINT H J, BAYER E A, RINCON M T, et al. Polysaccharide utilization by gut bacteria: potential for new insights from genomic analysis[J]. Nature Reviews Microbiology, 2008, 6(2): 121-131. DOI:10.1038/nrmicro1817 |
| [47] |
LOUIS P, HOLD G L, FLINT H J. The gut microbiota, bacterial metabolites and colorectal cancer[J]. Nature Reviews Microbiology, 2014, 12(10): 661-672. DOI:10.1038/nrmicro3344 |
| [48] |
KAWAI T, AKIRA S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors[J]. Nature Immunology, 2010, 11(5): 373-384. DOI:10.1038/ni.1863 |
| [49] |
MU C L, YANG Y X, ZHU W Y. Crosstalk between the immune receptors and gut microbiota[J]. Current Protein & Peptide Science, 2015, 16(7): 622-631. |
| [50] |
SANJABI S, ZENEWICZ L A, KAMANAKA M, et al. Anti-inflammatory and pro-inflammatory roles of TGF-β, IL-10, and IL-22 in immunity and autoimmunity[J]. Current Opinion in Pharmacology, 2009, 9(4): 447-453. DOI:10.1016/j.coph.2009.04.008 |
| [51] |
LI X L, AKHTAR S, CHOUDHRY M. Alteration in intestine tight junction protein phosphorylation and apoptosis is associated with increase in IL-18 levels following alcohol intoxication and burn injury[J]. Biochimica et Biophysica Acta, 2012, 1822(2): 196-203. DOI:10.1016/j.bbadis.2011.09.019 |
| [52] |
HERFEL T M, JACOBI S K, LIN X, et al. Dietary supplementation of Bifidobacterium longum strain AH1206 increases its cecal abundance and elevates intestinal interleukin-10 expression in the neonatal piglet[J]. Food and Chemical Toxicology, 2013, 60: 116-122. DOI:10.1016/j.fct.2013.07.020 |
| [53] |
O'FLAHERTY S, SAULNIER D M, POT B, et al. How can probiotics and prebiotics impact mucosal immunity?[J]. Gut Microbes, 2010, 1(5): 293-300. DOI:10.4161/gmic.1.5.12924 |
| [54] |
CROXEN M A, FINLAY B B. Molecular mechanisms of Escherichia coli pathogenicity[J]. Nature Reviews Microbiology, 2010, 8(1): 26-38. DOI:10.1038/nrmicro2265 |
| [55] |
GUO Z Z, WANG P, YI Z H, et al. The crosstalk between gut inflammation and gastrointestinal disorders during acute pancreatitis[J]. Current Pharmaceutical Design, 2014, 20(7): 1051-1062. DOI:10.2174/13816128113199990414 |
| [56] |
BLACHIER F, MARIOTTI F, HUNEAU J F, et al. Effects of amino acid-derived luminal metabolites on the colonic epithelium and physiopathological consequences[J]. Amino Acids, 2007, 33(4): 547-562. DOI:10.1007/s00726-006-0477-9 |
| [57] |
HEIDEBRECHT H J, KULOZIK U. Fractionation of casein micelles and minor proteins by microfiltration in diafiltration mode.Study of the transmission and yield of the immunoglobulins IgG, IgA and IgM[J]. International Dairy Journal, 2019, 93: 1-10. DOI:10.1016/j.idairyj.2019.01.009 |
| [58] |
BROWN E M, SADARANGANI M, FINLAY B B. The role of the immune system in governing host-microbe interactions in the intestine[J]. Nature Immunology, 2013, 14(7): 660-667. DOI:10.1038/ni.2611 |




