2. 济南百斯杰生物工程有限公司, 济南 251600
2. Jinan Bestzyme Bio-Engineering Co., Ltd., Jinan 251600, China
木聚糖是植物性饲料原料中主要的抗营养因子之一,具有极强的抗营养作用,它与其他非淀粉多糖(NSP)一起产生笼壁效应,使淀粉、蛋白质等营养物质被包裹,不易与消化酶接触,还导致食糜黏度的增加,降低了原料中营养成分的利用率[1-3]。木聚糖是一种多聚五碳糖,主链由β-D-1, 4木糖苷键连接起来,侧链有L-阿拉伯糖等多种取代基,常见的饲料原料如玉米、小麦、高粱等中木聚糖结构各异[4-6]。目前木聚糖酶仅针对木聚糖主链进行降解,但因为侧链的存在,造成空间位阻,大大降低主链木聚糖酶的酶解效果。阿拉伯呋喃糖苷酶可以去除半纤维素、果胶等植物原料中的侧链基团,能够破除木聚糖酶解限制瓶颈,显著提高底物的整体降解效率[7]。阿魏酸酯酶能切断细胞壁中多糖与多糖、多糖与木质素间的交联,加速植物细胞壁成分的降解,提高植物营养物质的纤维消化,同时还能提高动物对饲粮的消化率,促进动物生长发育[8]。因此,本试验中使用木聚糖复合酶,添加阿拉伯呋喃糖苷酶、阿魏酸酯酶等支链木聚糖酶,与主链木聚糖酶协同,更高效打破植物细胞壁,进而增强消化酶对营养物质的消化利用,旨在考察木聚糖复合酶对肉鸡的生长性能和肠道微生物的影响。
1 材料与方法 1.1 试验材料木聚糖复合酶购自济南某生物工程有限公司,木聚糖酶活性为12 500 IU/g,呋喃糖苷酶活性为1 000 IU/g,阿魏酸脂酶活性为200 IU/g。
1.2 试验设计试验选取体况良好的7日龄白羽肉鸡1 200只,随机分为5组,每组6个重复,每个重复40只鸡。对照组饲喂玉米-豆粕型基础饲粮,试验组饲喂在基础饲粮中分别添加100、200、300和500 g/t木聚糖复合酶的试验饲粮。试验分为2个阶段:试验前期(7~27日龄)和试验后期(28~47日龄),共40 d。
1.3 试验饲粮与饲养管理基础饲粮为玉米-豆粕型饲粮,参照《鸡饲养标准》(NY/T 33—2004)中的营养需求配制,试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
试验开始前对鸡舍内基础设施进行彻底的清理和消毒。试验期间肉鸡自由采食和饮水,在试验结束前的禁食期间断料不断水。试验期间保持圈舍通风、光照、卫生和干燥,免疫程序及其他管理条件按常规进行。
1.4 指标测定 1.4.1 生长性能按照每个重复为单位,在试验开始之前对试验肉鸡进行称重,在试验进行期间每7 d对肉鸡剩余饲粮量称重并记录每周的肉鸡采食量,在试验第20天(27日龄)和第40天(47日龄)对试验肉鸡进行称重并记录肉鸡增重,在试验期间记录肉鸡的死亡和淘汰数量并计算死淘率。通过肉鸡采食量和肉鸡增重统计并计算试验前期、试验后期和试验全期(7~47日龄)肉鸡的平均日采食量(ADFI)、平均日增重(ADG)与料重比(F/G)。
1.4.2 营养物质表观消化率饲养试验结束后,每个重复选择1只与组平均体重接近的鸡屠宰,取回肠食糜并冷冻保存。将各组的饲粮和收集到的回肠食糜在冻干机内冻干,室温下回潮24 h后粉碎过40目筛并制备成分析试样。取各重复部分样品直接烘干测定干物质(DM)含量(GB/T 6435—2014);取各重复部分样品按照灼烧法测定酸不溶灰分(AIA)含量(GB/T 23742—2009);取各重复部分样品采用凯氏定氮仪测定粗蛋白质(CP)含量(GB/T 6432—2018);取各重复部分样品送至沈阳农业大学分析测样中心,采用氧弹仪测定能量含量。并以酸不溶灰分为内源指示剂测定出CP、DM和能量表观消化率。
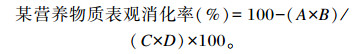
|
式中:A为回肠中的该营养物质含量;B为饲粮中酸不溶灰分的含量;C为饲粮中的该营养物质含量;D为回肠中酸不溶灰分的含量。
1.4.3 盲肠微生物指标饲养试验结束后,禁食12 h,每个重复选择l只与组平均体重接近的鸡屠宰,通过无菌的EP管收集盲肠食糜并液氮速冻,送样至深圳微生太科技有限公司委托测序,采用通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTwTCTAAT-3′)对细菌16s rRNA V3~V4可变区进行PCR扩增。获得有效数据,并对数据进行分析。
1.5 数据处理试验数据经Excel 2019进行初步处理后,采用SPSS 25.0软件的one-way ANOVA程序进行方差分析,并采用Turkey法进行组间多重比较,结果以平均值(mean)和均值标准误(SEM)表示。P<0.05为差异显著,0.05<P<0.10为有显著趋势。利用多项式比较法确定添加木聚糖复合酶添加量与测定指标之间的线性(linear)关系和二次(quadratic)效应。
2 结果与分析 2.1 木聚糖复合酶对肉鸡生长性能的影响由表 2可知,添加木聚糖复合酶线性提高肉鸡27日龄体重(P=0.001)。与对照组相比, 饲粮中添加200、300、500 g/t木聚糖复合酶组肉鸡27日龄体重差异显著(P<0.05);与对照组相比,饲粮中添加木聚糖复合酶组肉鸡47日龄体重差异不显著(P>0.05)。
|
|
表 2 木聚糖复合酶对肉鸡的生长性能的影响 Table 2 Effects of xylanase compound enzyme on growth performance of broilers |
在试验前期,添加木聚糖复合酶能够线性提高肉鸡的ADFI(P=0.003)和ADG(P=0.001),但肉鸡F/G和对照组相比差异不显著(P>0.05);与对照组相比,饲粮中添加300、500 g/t木聚糖复合酶组肉鸡ADFI和ADG差异显著(P<0.05);与对照组相比,饲粮中添加200 g/t木聚糖复合酶组肉鸡ADG差异显著(P<0.05);饲粮中添加100 g/t木聚糖复合酶组与饲粮中添加500 g/t木聚糖复合酶组肉鸡ADG差异显著(P<0.05)。在试验后期,添加木聚糖复合酶的肉鸡ADFI、ADG和F/G与对照组相比差异不显著(P>0.05)。
在试验全期,肉鸡饲粮添加木聚糖复合酶后肉鸡ADFI、ADG和F/G和对照组相比差异不显著(P>0.05)。肉鸡饲粮添加木聚糖复合酶后肉鸡死淘率与对照组相比差异不显著(P>0.05),但肉鸡死淘率最高为对照组,饲粮中添加100 g/t木聚糖复合酶组和饲粮中添加500 g/t木聚糖复合酶组死淘率最低。
2.2 木聚糖复合酶对肉鸡营养物质表观消化率的影响由表 3可知,饲粮中添加木聚糖复合酶组总能(GE)表观消化率呈线性上升(P=0.035);与对照组相比,饲粮中添加100、200、500 g/t木聚糖复合酶组GE表观消化率差异显著(P<0.05)。与对照组相比,饲粮中添加木聚糖复合酶组CP和DM表观消化率差异不显著(P>0.05)。
|
|
表 3 木聚糖复合酶对肉鸡营养物质表观消化率的影响 Table 3 Effects of xylan complex enzyme on nutrient apparent digestibility of broilers |
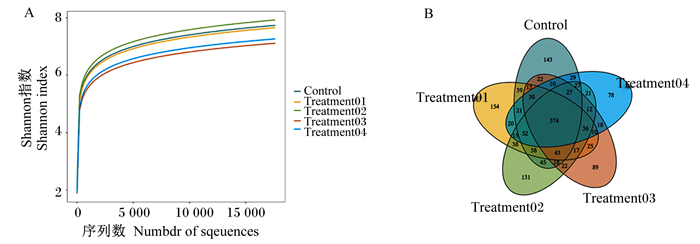
由图 1-A可知,由Shannon指数曲线可知,Shannon指数曲线趋于平缓,说明测序量足够大,表明OTU数不会再随着测序量的增加而增长,可真实反映群落各物种间的相对比例关系,可以进行数据分析。由图 1-B可知,试验组与对照组盲肠内容物中共有的OTU 374个。
|
A:Shannon指数的稀释曲线B:不同添加量木聚糖复合酶的肉鸡肠道微生物菌群韦恩图。 A: dilution curve of Shannon index B: Venn diagram of intestinal microflora of broilers added with different doses of xylan complex enzyme. Control:添加0 g/t木聚糖复合酶;treatment01:添加100 g/t木聚糖复合酶;treatment02:添加200 g/t木聚糖复合酶;treatment03:添加300 g/t木聚糖复合酶;treatment04:添加500 g/t木聚糖复合酶。下图同。Control: adding 0 g/t xylanase; Treatment01: adding 100 g/t xylanase; Treatment02: adding 200 g/t xylanase; Treatment03: adding 300 g/t xylanase; Treatment04: adding 500 g/t xylan complex enzyme. The same as below. 图 1 盲肠内容物有效操作分类单元数统计 Fig. 1 Statistics of effective operational taxonomic unit of cecal contents |
由表 4可知,饲粮中添加木聚糖复合酶可线性提高Shannon指数(P=0.027),添加200 g/t木聚糖复合酶组Chao1指数、Shannon指数和Simpson指数最高。与对照组相比,饲粮中添加300 g/t木聚糖复合酶组Shannon指数显著降低(P<0.05),与饲粮中添加300 g/t木聚糖复合酶组相比,添加200 g/t木聚糖复合酶组Shannon指数显著提高(P<0.05),与饲粮中添加500 g/t木聚糖复合酶组相比,添加200 g/t木聚糖复合酶组Shannon指数显著提高(P<0.05)。其余各组间Chao1指数和Simpson指数均差异不显著(P>0.05)。
|
|
表 4 木聚糖复合酶对肉鸡盲肠微生物alpha多样性的影响 Table 4 Effects of xylan complex enzyme on cecal microbial alpha diversity of broilers |
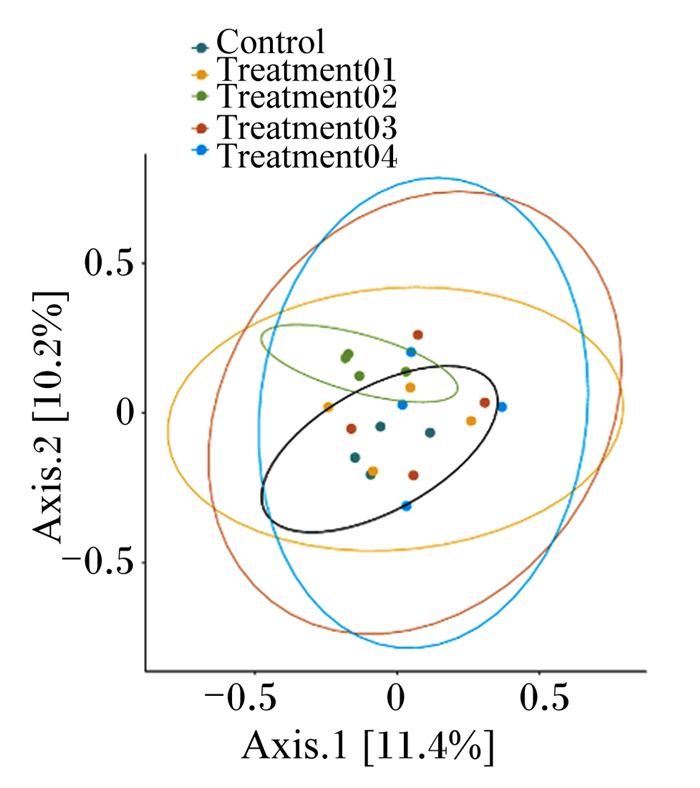
Beta多样性分析可以比较不同样品间在物种多样性方面存在的差异大小, 在主坐标分析(PCoA)中,样本距离越接近,表示物种组成结构越相似。由图 2可知,饲粮中添加200 g/t木聚糖复合酶组和对照组菌群结构分布相对紧凑,相似度较高群,落构成差异较大,而添加100、300、500 g/t木聚糖复合酶组菌群结构分布相对零散,相似度低,群落构成差异较大。
|
X轴(Axis 1)表示第1主成分,百分比则表示第1主成分对样品差异的贡献值;Y轴(Axis 2)表示第2主成分,百分比表示第2主成分对样品差异的贡献值。 X-axis (Axis 1) represents the first principal component, while percentage represents the contribution value of the first principal component to the sample difference. Y-axis (Axis 2) represents the second principal component, and percentage represents the contribution value of the second principal component to sample difference. 图 2 木聚糖复合酶对肉鸡盲肠微生物beta多样性的影响 Fig. 2 Effects of xylan complex enzyme on cecal microflora beta diversity of broilers |
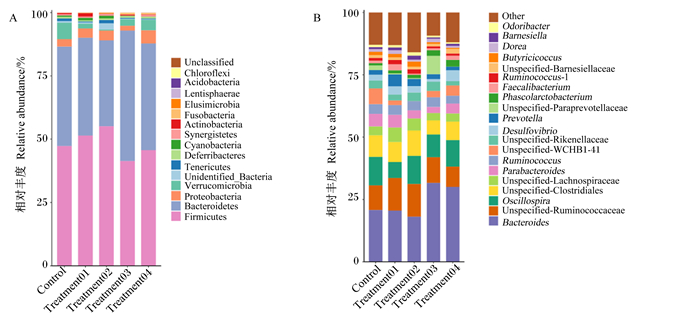
由图 3所示,在门水平中,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和疣微菌门(Verrucomicrobia)相对丰度达90%以上;在属水平中,除未知菌属和其他菌属,5个组在属水平上相对丰度超过1%的有拟杆菌属(Bacteroides)、未分类瘤胃球菌科(unspecified-Ruminococcaceae)、颤螺旋菌属(Oscillospira)、未分类梭菌科(unspecified-Clostridiales)、未分类毛螺菌科(unspecified-Lachnospiraceae)、副拟杆菌属(Parabacteroides)、瘤胃球菌属(Ruminococcus)、未分类WCHB1-41(unspecified-WCHB1-41)、未分类理研菌科(unspecified-Rikenellaceae)、脱硫弧菌属(Desulfovibrio)、普氏菌属(Prevotella)、未分类帕拉普氏菌科(unspecified-Paraprevotellaceae)、考拉杆菌属(Phascolarctobacterium)、粪杆菌属(Faecalibacterium)、瘤胃球菌属-1(Ruminococcus-1)、未分类巴恩斯氏菌科(unspecified-Barnesiellaceae)、丁酸菌属(Butyricicoccus)、多尔氏菌属(Dorea)、巴恩斯氏菌属(Barnesiella)和嗅杆菌属(Odoribacter)。
|
A:肉鸡盲肠微生物门水平上的组成;B:肉鸡盲肠微生物属水平上的组成。A: composition of cecal microflora of broilers at phylum level; B:composition of cecal microflora of broilers at genus level. Firmicutes: 厚壁菌门; Bacteroidetes: 拟杆菌门; Proteobacteria: 变形菌门; Verrucomicrobia: 疣微菌门; Unidentified-Bacteria: 未分类细菌; Tenericutes: 软壁菌门; Deferribacteres: 脱铁杆菌门; Cyanobacteria: 蓝藻细菌门; Synergistetes: 互养菌门; Actinobacteria: 放线菌门; Fusobacteria: 梭杆菌门; Elusimicrobia: 迷踪菌门; Lentisphaerae: 黏胶球形菌门; Acidobacteria: 酸杆菌门; Chloroflexi: 绿弯菌门;Unclassified: 未分类;Bacteroides: 拟杆菌属; Unspecified-Ruminococcaceae:未分类瘤胃球菌科;Oscillospira:颤螺旋菌属;Unspecified-Clostridiales:未分类梭菌科;Unspecified-Lachnospiraceae:未分类毛螺菌科;Parabacteroides:副拟杆菌属;Ruminococcus:瘤胃球菌属;Unspecified-WCHB1-41:未分类WCHB1-41;Unspecified-Rikenellaceae:未分类理研菌科;Desulfovibrio:脱硫弧菌属;Prevotella:普氏菌属;Unspecified-Paraprevotellaceae:未分类帕拉普氏菌科;Phascolarctobacterium:考拉杆菌属;Faecalibacterium:粪杆菌属;Ruminococcus-1:瘤胃球菌属-1;Unspecified-Barnesiellaceae:未分类巴恩斯氏菌科;Butyricicoccus:丁酸菌属;Dorea:多尔氏菌属;Barnesiella:巴恩斯氏菌属;Odoribacter:嗅杆菌属;Other:其他。 图 3 肉鸡盲肠微生物门水平和属水平上的组成 Fig. 3 Composition of cecal microflora of broilers at phylum and genus levels |
由表 5所示,盲肠微生物在门水平和属水平上的组成中,饲粮添加木聚糖复合酶组均差异不显著(P>0.05)。饲粮中添加100、200 g/t木聚糖复合酶组厚壁菌门相对丰度高于其余组(P>0.05);添加300 g/t木聚糖复合酶组拟杆菌门相对丰度高于其余组(P>0.05);添加500 g/t木聚糖复合酶组变形菌门相对丰度高于其余组(P>0.05);添加100、200 g/t木聚糖复合酶组未分类瘤胃球菌科相对丰度高于其余组(P>0.05);添加100、200 g/t木聚糖复合酶组未分类毛螺群菌科相对丰度高于其余组(P>0.05);添加100、500 g/t木聚糖复合酶组脱硫弧菌属相对丰度高于其余组且有显著趋势(0.01>P>0.05);添加300、500 g/t木聚糖复合酶组考拉杆菌属相对丰度高于其余组(P>0.05)。
|
|
表 5 肉鸡盲肠微生物优势门和优势属相对丰度的影响 Table 5 Effects of relative abundance of dominant phylum and dominant genus in cecal microflora of broilers |
已有研究表明,在玉米、豆粕、次粉等饲料中NSP含量较高,导致食糜黏性高,饲粮的营养价值降低和动物对饲粮的消化利用降低。饲粮中添加含阿拉伯木聚糖酶、呋喃糖苷键木聚糖酶、β-葡聚糖酶和纤维素酶等为主的酶制剂后,可通过对阿拉伯木聚糖、呋喃糖苷键木聚糖、β-葡聚糖和纤维素的作用,将饲粮中的NSP降解为单糖或小分子片段寡糖,消除NSP的抗营养作用[9];同时还可以降低食糜黏度、释放出细胞壁内被包裹的养分、促进肠道蠕动、提高饲粮营养物质消化和改善肉品质[10],从而提高肉鸡的消化效率。丁楠等[11]研究表明,在玉米-豆粕饲粮中添加木聚糖酶具有增加生长前期肉仔鸡ADFI的趋势,提高肉仔鸡体重和ADG等指标。张依量等[12]在蛋鸡玉米-豆粕型饲粮中添加含有木聚糖酶、β-葡聚糖酶和纤维素酶的木聚糖复合酶制剂,能显著改善饲料转化率。张芹等[13]研究发现,在玉米-豆粕型饲粮中添加木聚糖酶可提高肉鸡的ADG,降低F/G。武书庚等[14]在玉米-豆粕型饲粮中添加1 000 IU/kg的木聚糖酶对肉鸡的生长性能无显著影响,但具有改善的趋势。本试验结果显示,与对照组相比,肉鸡的生长性能均有明显改善,尤其在肉鸡试验前期,添加300 g/t木聚糖复合酶组和500 g/t木聚糖复合酶组的肉鸡27日龄体重、ADFI和ADG显著提高,与上述试验相符。随着肉鸡日龄的增长,肉鸡的肠道微生物发酵能力逐渐升高,对高黏性饲粮具有较高的消化力[15],而添加木聚糖复合酶降低了食糜的黏度[16]。加上饲粮结构、NSP含量和木聚糖酶对阿拉伯木聚糖的降解能力以及木聚糖复合酶的组成都会限制肉鸡的生长性能[17-19],所以在本试验肉鸡试验后期木聚糖复合酶添加剂量升高导致肉鸡的生长性能降低。
3.2 木聚糖复合酶对肉鸡营养物质表观消化率的影响研究表明,饲粮中营养物质的消化代谢率在肉鸡生产中起着非常重要的作用,其代谢率直接影响肉鸡的生长性能和生长速度[20],而木聚糖复合酶对肉鸡表观消化率的影响作用与饲粮中添加木聚糖复合酶的剂量密切相关[21-22]。具体为肉鸡消化道内不能分泌水解木聚糖的内源酶,其在肠道内通常表现出增加肠道食糜黏度、存在于细胞壁中的NSP将淀粉和蛋白质等营养物质包裹其中、破坏肠道菌群结构、改变消化道生理特性等抗营养作用[23-24]。饲粮中添加木聚糖酶可高效水解木聚糖,消除其抗营养作用,改善机体肠道健康,从而提高肉鸡养分利用率[23]。王海英等[25]研究发现,小麦饲粮中添加木聚糖酶可使CP表观消化率提高7.4%。周晓容[26]研究表明,在玉米-豆粕型饲粮中添加木聚糖酶,可不同程度地提高养分能值和真利用率,在木聚糖含量为4.13%的玉米-豆粕型饲粮中添加225 U/kg木聚糖酶,饲粮DM利用效率提高5.23%。王玲[27]在肉鸡生长前期的玉米-豆粕型饲粮中添加含有木聚糖酶、葡聚糖酶和纤维素酶复合酶制剂,结果表明木聚糖复合酶制剂能使饲粮中DM的表观消化率显著提高11.02%,CP的表观消化率显著提高11.63%,EE的表观消化率显著提高28.09%,CF的表观消化率显著提高49.83%和粗灰分(Ash)的表观消化率显著提高21.05%。本试验中,添加木聚糖复合酶组与对照组的GE表观消化率差异显著,与上述研究结果相符。这表明饲粮中添加木聚糖复合酶可以提高肉鸡的GE、CP和DM表观消化率。推测是木聚糖复合酶通过对饲粮中植物细胞壁成分中的NSP酶解作用,释放被包裹的或被绑定的营养物质,从而提高饲粮中DM、GE和EE的表观消化率[28]。同时木聚糖复合酶中的木聚糖酶和纤维素酶的部分酶解产物是还原糖类,可被肉鸡机体吸收,进一步提高了肉鸡对GE表观消化率[29]。
3.3 木聚糖复合酶对肉鸡盲肠微生物的影响肉鸡的消化道是细菌多样性和丰富度最高的区域[30],其中盲肠是水分调节、尿素循环和碳水化合物发酵的最重要场所,对肉鸡肠道营养健康起着非常重要的作用[31]。大量研究表明,当肠道菌群多样性和丰富度减少,会增加引起肉鸡疾病的概率[32-35]。而Shannon和Simpson指数是判定菌群多样性的重要指标,通常Shannon和Simpson指数越高,就越难破坏菌群区系的平衡[36]。本试验结果表明,饲粮中添加200 g/t木聚糖复合酶可显著提高肉鸡盲肠微生物的Shannon指数,说明饲粮中添加木聚糖复合酶可以提高肉鸡盲肠微生物的多样性;添加300、500 g/t木聚糖复合酶的Shannon指数和Simpson指数较低,推测木聚糖复合酶剂量过多改变菌群多样性,影响菌群区系平衡。而beta多样性的结果表明,饲粮添加木聚糖复合酶可以影响肉鸡盲肠的微生物区系,发现其优势菌门是厚壁菌门和拟杆菌门,占全部微生物群落的80%以上,这与之前的研究结果[37-38]一致。在属水平上, 有研究发现, 瘤胃球菌科具有降低和改善肠道炎症的抗炎性作用[39], 脱硫弧菌属与肠炎、肠癌以及某些代谢疾病的发生有关[40], 毛螺菌科与腹腔疾病和溃疡性结肠炎有关[41],考拉杆菌属可与致病菌竞争营养物质从而抑制致病菌在肠道中的定植[42]。本试验研究结果显示,添加100、200 g/t木聚糖复合酶的未分类瘤胃球菌科、未分类毛螺菌科、脱硫弧菌属以及考拉杆菌属的相对丰度高于对照组,与上述研究结果一致,证明木聚糖复合酶可协同改善肉鸡肠道微生物平衡,改善了肉鸡盲肠微生物多样性和菌群丰度,促进肉鸡肠道健康。
在本试验中,试验前期添加500 g/t木聚糖复合酶组的肉鸡27日龄体重、ADFI和ADG显著高于对照组与添加100 g/t木聚糖复合酶组,说明试验前期饲粮中500 g/t木聚糖复合酶为最佳添加量;试验后期添加100 g/t木聚糖复合酶组的肉鸡27日龄体重、ADFI、ADG和F/G与其他组差异不显著,但综合肉鸡生长性能趋势、GE表观消化率的显著性和肠道微生物属水平上的显著性,说明试验后期饲粮中100 g/t木聚糖复合酶为最佳添加量。
4 结论① 肉鸡饲粮中添加适量木聚糖复合酶可显著提高肉鸡的生长性能、GE表观消化率和盲肠微生物多样性。
② 在试验的不同阶段,肉鸡对木聚糖复合酶的最佳添加量不同,试验前期添加量要高于试验后期。
③ 本试验中, 在试验前期肉鸡饲粮中500 g/t木聚糖复合酶为最佳添加量,在试验后期肉鸡饲粮中100 g/t木聚糖复合酶为最佳添加量。
| [1] |
梁方方, 莫毅, 黄亮华, 等. 抗抑制活性木聚糖酶研究进展[J]. 饲料研究, 2021, 44(11): 123-126. LIANG F F, MO Y, HUANG L H, et al. The research progress of resistant xylanse[J]. Feed Research, 2021, 44(11): 123-126 (in Chinese). DOI:10.13557/j.cnki.issn1002-2813.2021.11.028 |
| [2] |
徐良梅, 陈盈霖, 吕荣创, 等. 木聚糖酶及其畜牧业应用研究进展[J]. 东北农业大学学报, 2016, 47(12): 93-100. XU L M, CHEN Y L, LV R C, et al. Progress on xylanase and its application in animal husbandry[J]. Journal of Northeast Agricultural University, 2016, 47(12): 93-100 (in Chinese). DOI:10.3969/j.issn.1005-9369.2016.12.012 |
| [3] |
林伟文, 刘桂生. 木聚糖复合酶制剂在凉亭肉鸡饲养中的效果研究[J]. 农业与技术, 2014, 34(8): 172-172, 174. LIN W W, LIU G S. Study on the effect of xylan compound enzyme preparation in Liangting broiler[J]. Agriculture & Technology, 2014, 34(8): 172-172, 174 (in Chinese). DOI:10.3969/j.issn.1671-962X.2014.08.151 |
| [4] |
刘鸫, 方热军. 饲用木聚糖酶及其抑制蛋白研究进展综述[J]. 江西饲料, 2012(3): 10-12. LIU D, FANG R J. Review on the research progress of xylanase and its inhibitory protein in feed[J]. Jiangxi Feed, 2012(3): 10-12 (in Chinese). DOI:10.3969/j.issn.1008-6137.2012.03.004 |
| [5] |
徐叶桐, 曾志凯, 何政肖, 等. 木聚糖酶对小麦型基础日粮肉仔鸡生长和消化率的影响[J]. 饲料研究, 2017(7): 1-4, 11. XU Y T, ZENG Z K, HE Z X, et al. Effects of xylanase on growth and digestibility of wheat-based broilers[J]. Feed Research, 2017(7): 1-4, 11 (in Chinese). DOI:10.13557/j.cnki.issn1002-2813.2017.07.001 |
| [6] |
RUTHERFURD S M, CHUNG T K, MOUGHAN P J. The effect of a commercial enzyme preparation on apparent metabolizable energy, the true ileal amino acid digestibility, and endogenous ileal lysine losses in broiler chickens[J]. Poultry Science, 2007, 86(4): 665-672. DOI:10.1093/ps/86.4.665 |
| [7] |
李世英. 草酸青霉α-L-阿拉伯呋喃糖苷酶系研究及半纤维素酶高产菌株构建[D]. 硕士学位论文. 济南: 山东大学, 2020. LI S Y. Study on the α-L-arabinofuranosidases from penicillium oxalicum and the construction of hemicellulase high-producing strains[D]. Master's Thesis. Jinan: Shandong University, 2020. (in Chinese) |
| [8] |
LYNCH J P, PREMA D, VAN HAMME J D, et al. Fiber degradability, chemical composition and conservation characteristics of alfalfa haylage ensiled with exogenous fibrolytic enzymes and a ferulic acid esterase-producing inoculant[J]. Canadian Journal of Animal Science, 2014, 94(4): 697-704. DOI:10.4141/cjas-2014-086 |
| [9] |
张芹. 复合酶制剂对肉鸡生产性能及血液生化指标的影响[J]. 安徽农业科学, 2012, 40(17): 9285-9287. ZHANG Q. Effects of compound enzyme preparation on growth performance and serum biochemical indexes of broilers[J]. Journal of Anhui Agricultural Sciences, 2012, 40(17): 9285-9287 (in Chinese). DOI:10.3969/j.issn.0517-6611.2012.17.038 |
| [10] |
李东红, 李永社, 陈清亮, 等. 木聚糖酶与其在鸡生产中的应用[J]. 今日畜牧兽医, 2018, 34(9): 58-61. LI D H, LI Y S, CHEN Q L, et al. Xylanase and its application in chicken production[J]. Animal Husbandry and Veterinary Medicine Today, 2018, 34(9): 58-61 (in Chinese). DOI:10.3969/j.issn.1673-4092.2018.09.049 |
| [11] |
丁楠, 邸佳妮, 丁洪涛. 木聚糖酶对肉仔鸡前期生长性能和屠宰性能的影响[J]. 饲料研究, 2020, 43(8): 36-38. DING N, DI J N, DING H T. Effect of xylanase on growth performance and carcass traits of broilers in early stage[J]. Feed Research, 2020, 43(8): 36-38 (in Chinese). DOI:10.13557/j.cnki.issn1002-2813.2020.08.009 |
| [12] |
张依量, 赵国先, 杜健, 等. 非淀粉多糖酶对蛋鸡生产性能和蛋品质的影响[J]. 饲料工业, 2015, 36(s2): 61-64. ZHANG Y L, ZHAO G X, DU J, et al. Effect of non-starch polysaccharide enzyme on production performance and egg quality of laying hens[J]. Feed Industry, 2015, 36(s2): 61-64 (in Chinese). DOI:10.13302/j.cnki.fi.2015.Z2.015 |
| [13] |
张芹, 毛胜勇, 朱伟云, 等. 玉米-豆粕型日粮中添加木聚糖酶对肉鸡生产性能和内源酶活性的影响[J]. 畜牧与兽医, 2007, 39(8): 5-7. ZHANG Q, MAO S Y, ZHU W Y, et al. Effects of xylanase supplementation on growth performance and endogenous enzyme activities of broiler diets based on corn and soybean meal[J]. Animal Husbandry & Veterinary Medicine, 2007, 39(8): 5-7 (in Chinese). DOI:10.3969/j.issn.0529-5130.2007.08.002 |
| [14] |
武书庚, 齐广海, 姚斌, 等. 木聚糖酶对肉仔鸡生产性能的影响[J]. 中国饲料, 2006(6): 20-22, 24. WU S G, QI G H, YAO B, et al. Effect of xylanase on the growth performance of the broiler chicken[J]. China Feed, 2006(6): 20-22, 24 (in Chinese). DOI:10.3969/j.issn.1004-3314.2006.06.009 |
| [15] |
CHOCT M, HUGHES R J, WANG J, et al. Increased small intestinal fermentation is partly responsible for the anti-nutritive activity of non-starch polysaccharides in chickens[J]. British Poultry Science, 1996, 37(3): 609-621. DOI:10.1080/00071669608417891 |
| [16] |
LÁZARO R, GARCÍA M, MEDEL P, et al. Influence of enzymes on performance and digestive parameters of broilers fed rye-based diets[J]. Poultry Science, 2003, 82(1): 132-140. DOI:10.1093/ps/82.1.132 |
| [17] |
AGGER J, VIKSØ-NIELSEN A, MEYER A S. Enzymatic xylose release from pretreated corn bran arabinoxylan: differential effects of deacetylation and deferuloylation on insoluble and soluble substrate fractions[J]. Journal of Agricultural and Food Chemistry, 2010, 58(10): 6141-6148. DOI:10.1021/jf100633f |
| [18] |
YEGANI M, KORVER D R. Effects of corn source and exogenous enzymes on growth performance and nutrient digestibility in broiler chickens[J]. Poultry Science, 2013, 92(5): 1208-1220. DOI:10.3382/ps.2012-02390 |
| [19] |
陈丹蝶, 彭翔, 张广民, 等. 酶菌复合制剂对肉鸡生长性能、免疫功能和抗氧化功能的影响[J]. 动物营养学报, 2021, 33(10): 5557-5568. CHEN D D, PENG X, ZHANG G M, et al. Effects of compound preparation of enzyme and probiotics on growth performance, immune function and antioxidant function of broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(10): 5557-5568 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.10.016 |
| [20] |
张宪. 外源淀粉酶对肉鸡饲粮体外养分消化、生长和肠道形态的影响研究[D]. 硕士学位论文. 邯郸: 河北工程大学, 2018. ZHANG X. Effect of exogenous amylase on in vitro nutrient digestion of diets, growth, and intestinal morphology for broilers[D]. Master's Thesis. Handan: Hebei University of Engineering, 2018. (in Chinese) |
| [21] |
刘永超, 刘宁, 石学刚. 低能是粮添加术聚糖或复合酶对肉鸡生产性能和养分消化率的影响[J]. 饲料工业, 2011, 32(16): 39-42. LIU Y C, LIU N, SHI X G. Effect of xylanase or multiple enzymes added in low energy diets on the growth performance and nutrient digestibility of broilers[J]. Feed Industry, 2011, 32(16): 39-42 (in Chinese). DOI:10.3969/j.issn.1001-991X.2011.16.009 |
| [22] |
黄学琴. 复合酶制剂对肉鸭生产性能、养分利用率及钙磷代谢的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2013. HUANG X Q. Effects of enzyme complex on growth performance, nutrient utilization, calcium and phosphorus metabolism of ducks[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2013in Chinese |
| [23] |
RAZA A, BASHIR S, TABASSUM R. An update on carbohydrases: growth performance and intestinal health of poultry[J]. Heliyon, 2019, 5(4): e01437. DOI:10.1016/j.heliyon.2019.e01437 |
| [24] |
ABD EL-WAHAB A, LINGENS J B, CHUPPAVA B, et al. Impact of rye inclusion in diets for broilers on performance, litter quality, foot pad health, digesta viscosity, organ trails and intestinal morphology[J]. Sustainability, 2020, 12(18): 7753. DOI:10.3390/su12187753 |
| [25] |
王海英, 呙于明, 袁建敏. 小麦日粮中添加木聚糖酶对肉仔鸡生产性能和养分消化率的影响[J]. 粮食与饲料工业, 2003(12): 53-55. WANG H Y, GUO Y M, YUAN J M. Effects of xylanase supplementation in wheat diet on performance and nutrient digestibility of broilers[J]. Cereal & Feed Industry, 2003(12): 53-55 (in Chinese). DOI:10.3969/j.issn.1003-6202.2003.12.019 |
| [26] |
周晓容. 肉鸡饲粮中木聚糖与木聚糖酶关系的研究[D]. 硕士学位论文. 雅安: 四川农业大学, 2003: 25-27. ZHOU X R. Studies on the relationship between xylanase supplementation and total xylans content in broiler diets[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2003: 25-27. (in Chinese) |
| [27] |
王玲. 酶制剂在肉雏鸡饲料中的应用研究[J]. 饲料研究, 2001(2): 31-32. WANG L. Study on the application of enzyme preparation in broiler feed[J]. Feed Research, 2001(2): 31-32 (in Chinese). DOI:10.3969/j.issn.1002-2813.2001.02.014 |
| [28] |
OUHIDA I, PEREZ J F, GASA J, et al. Enzymes (beta-glucanase and arabinoxylanase) and/or sepiolite supplementation and the nutritive value of maize-barley-wheat based diets for broiler chickens[J]. British Poultry Science, 2000, 41(5): 617-624. DOI:10.1080/713654974 |
| [29] |
赵必迁, 张克英, 丁雪梅. 非淀粉多糖复合酶制剂对肉鸡养分表观利用率及肠道组织形态结构的影响[J]. 粮食与饲料工业, 2012(10): 49-52. ZHAO B Q, ZHANG K Y, DING X M. Effects of non-starch enzymes preparation on the nutrients apparent avaibility and intestine tissue morphosis of broiler[J]. Cereal & Feed Industry, 2012(10): 49-52 (in Chinese). DOI:10.3969/j.issn.1003-6202.2012.10.014 |
| [30] |
O'HARA A M, SHANAHAN F. The gut flora as a forgotten organ[J]. EMBO Reports, 2006, 7(7): 688-693. DOI:10.1038/sj.embor.7400731 |
| [31] |
王美艳, 童玉鑫, 闵遥, 等. 叶黄素对脂多糖应激黄羽肉鸡生长性能、空肠形态和盲肠微生物的影响[J]. 动物营养学报, 2021, 33(10): 5569-5580. WANG M Y, TONG Y X, MIN Y, et al. Effects of lutein on growth performance, jejunum morphology and cecal microorganisms of lipopolysaccharide-stimulated yellow-feathered broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(10): 5569-5580 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.10.017 |
| [32] |
GUO X, XIA X, TANG R, et al. Development of a real-time PCR method for Firmicutes and Bacteroidetes in faeces and its application to quantify intestinal population of obese and lean pigs[J]. Letters in Applied Microbiology, 2008, 47(5): 367-373. DOI:10.1111/j.1472-765X.2008.02408.x |
| [33] |
SHEN J, ZHANG B R, WEI G F, et al. Molecular profiling of the Clostridium leptum subgroup in human fecal microflora by PCR-denaturing gradient gel electrophoresis and clone library analysis[J]. Applied and Environmental Microbiology, 2006, 72(8): 5232-5238. DOI:10.1128/AEM.00151-06 |
| [34] |
ABRAHAMSSON T R, JAKOBSSON H E, ANDERSSON A F, et al. Low diversity of the gut microbiota in infants with atopic eczema[J]. Journal of Allergy and Clinical Immunology, 2012, 129(2): 434-440. DOI:10.1016/j.jaci.2011.10.025 |
| [35] |
WANG M, KARLSSON C, OLSSON C, et al. Reduced diversity in the early fecal microbiota of infants with atopic eczema[J]. Journal of Allergy and Clinical Immunology, 2008, 121(1): 129-134. DOI:10.1016/j.jaci.2007.09.011 |
| [36] |
FORNO E, ONDERDONK A B, MCCRACKEN J, et al. Diversity of the gut microbiota and eczema in early life[J]. Clinical and Molecular Allergy, 2008, 6(1): 11. DOI:10.1186/1476-7961-6-11 |
| [37] |
AHIR V B, KORINGA P G, BHATT V D, et al. Metagenomic analysis of poultry gut microbes[J]. Indian Ournal of Poultry Science, 2010, 45(2): 111-114. |
| [38] |
OAKLEY B B, LILLEHOJ H S, KOGUT M H, et al. The chicken gastrointestinal microbiome[J]. FEMS Microbiology Letters, 2014, 360(2): 100-112. DOI:10.1111/1574-6968.12608 |
| [39] |
HUWS S A, KIM E J, LEE M R F, et al. As yet uncultured bacteria phylogenetically classified as Prevotella, Lachnospiraceae incertae sedis and unclassified Bacteroidales, Clostridiales and Ruminococcaceae may play a predominant role in ruminal biohydrogenation[J]. Environmental Microbiology, 2011, 13(6): 1500-1512. DOI:10.1111/j.1462-2920.2011.02452.x |
| [40] |
BALAMURUGAN R, RAJENDIRAN E, GEORGE S, et al. Real-time polymerase chain reaction quantification of specific butyrate-producing bacteria, Desulfovibrio and Enterococcus faecalis in the feces of patients with colorectal cancer[J]. Journal of Gastroenterology and Hepatology, 2008, 23(8 Pt 1): 1298-1303. |
| [41] |
LI S Y, WANG Z L, YANG Y, et al. Lachnospiraceae shift in the microbial community of mice faecal sample effects on water immersion restraint stress[J]. AMB Express, 2017, 7(1): 82. DOI:10.1186/s13568-017-0383-4 |
| [42] |
NAGAO-KITAMOTO H, LESLIE J L, KITAMOTO S, et al. Interleukin-22-mediated host glycosylation prevents Clostridioides difficile infection by modulating the metabolic activity of the gut microbiota[J]. Nature Medicine, 2020, 26(4): 608-617. DOI:10.1038/s41591-020-0764-0 |




