近几年,我国生猪出栏体重有增加的趋势,以前是90 kg左右出栏,现在是120 kg左右出栏。学者们对体重90 kg以内的猪研究较多,而对育肥后期(体重90~120 kg)的猪研究较少。益生菌是一种能够改善动物肠道功能、提高动物生产性能及健康水平的饲料添加剂。赵秀英等[1]研究显示,给7日龄仔猪灌喂植物乳杆菌和干酪乳杆菌提高了肠道菌群多样性,促进了乳酸杆菌、双歧杆菌等有益菌的增殖以及肠道短链脂肪酸(SCFAs)的生成。Lan等[2]在断奶仔猪(体重7~30 kg)饲粮中添加复合芽孢杆菌和丁酸梭菌,显著提高了仔猪的平均日增重及饲粮中干物质、氮和总能的全消化道表观消化率,降低了粪便中的大肠杆菌数量。刘辉等[3]在生长猪(体重23~46 kg)饲粮中添加乳酸片球菌,提高了肠道菌群多样性,改善了消化道菌群结构,提高了生长性能和饲料利用率,对猪群产生了有益作用。陈宝剑等[4]分析了不同发育阶段猪的肠道菌群情况,发现断奶后随着日龄的不断增加,肠道菌群结构趋于稳定。Wang等[5]的研究发现,育肥猪的肠道菌群多样性与母猪相似。有关益生菌的研究在仔猪、保育猪和生长猪上较多,而在育肥猪上尤其是育肥后期的研究较少,缺乏相关数据。为此,本项目组根据生猪产业发展需求,拟探讨益生菌对体重90~120 kg阶段育肥猪生长性能、养分表观消化率、粪便菌群及短链脂肪酸含量的影响,旨在为育肥猪育肥后期的科学饲养提供科技支撑。
1 材料与方法 1.1 试验材料本试验所用益生菌制剂主要成分为干酪乳杆菌(有效活菌数2×1010 CFU/g)和酿酒酵母(有效活菌数2×109 CFU/g),由北京市农林科学院畜牧兽医研究所动物营养研究室制备。
1.2 试验动物、试验饲粮及饲养管理选用“长×大”二元杂交育肥猪100头,平均体重为(92.01±0.91) kg,随机分成2组,分别为对照组和益生菌组,每组5个重复,每个重复10头。对照组饲喂基础饲粮,益生菌组饲喂在基础饲粮中添加益生菌制剂的试验饲粮,每千克试验饲粮中干酪乳杆菌有效活菌数为2.0×109 CFU、酿酒酵母有效活菌数为2.0×108 CFU。基础饲粮参照NRC(2012)配制,其组成及营养水平见表 1。试验猪饲养在同一猪舍内,自由采食,自由饮水,舍内温度22~28 ℃,相对湿度60%~80%,猪群饲养管理按场内统一技术规程进行,试验期31 d。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
在试验开始和结束时对试验猪进行空腹称重,分别记录为初始体重和终末体重;在试验期内,记录每天的耗料量;根据记录的数据计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.4 养分表观消化率测定参照杨凤[6]的内源指示剂法开展消化试验。试验第28~30天采集饲粮样品,连续采集3 d,以重复为单位混匀,粉碎、制样;试验第29~31天采集新鲜粪样,每天上午和下午各采集1次,采集的粪样混匀,用10%的盐酸溶液固氮,低温冰箱保存,连续采集3 d,然后将3 d采集的粪样以重复为单位混匀,65 ℃烘干、粉碎、制样。测定饲粮和粪样中粗蛋白质、钙、总磷和盐酸不溶灰分含量,计算养分表观消化率:
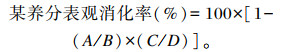
|
式中:A为粪中该养分含量;B为饲粮中该养分含量;C为饲粮中盐酸不溶灰分含量;D为粪中盐酸不溶灰分含量。
1.5 粪便样品采集及测定 1.5.1 粪便采集试验结束当天早晨采集新鲜粪样,每个重复随机采集2份,装于无菌离心管中,并置于干冰中带回实验室后-80 ℃保存,用于粪便菌群分析和短链脂肪酸含量测定。试验共采集粪便样品20份。
1.5.2 粪便菌群分析总DNA提取、PCR产物纯化参照王四新[7]的方法进行。纯化后的PCR产物样品送至上海美吉生物医药科技有限公司进行环境微生物测序,比对数据库为细菌16S rRNA数据库。菌群分析在美吉I-Sanger云平台上完成。
1.5.3 粪便中短链脂肪酸含量与组成分析使用安捷伦气相色谱仪GC-6890对短链脂肪酸含量与组成进行分析,具体参照王四新[7]的方法进行。
1.6 数据处理育肥猪育肥后期生长性能、养分表观消化率、短链脂肪酸含量结果用平均值和均值标准误(SEM)表示,数据经Excel 2016初步处理后,采用SPSS 19.0软件中的独立样本t检验方法进行分析,P < 0.05为差异显著。
2 结果与分析 2.1 育肥猪育肥后期的生长性能和养分表观消化率由表 2可知,与对照组相比,益生菌组育肥猪的平均日增重提高了9.42%(P < 0.05),料重比降低了6.90%(P>0.05)。
|
|
表 2 益生菌对育肥猪育肥后期生长性能的影响 Table 2 Effects of probiotics on growth performance of finishing pigs in later finishing period |
由表 3可知,与对照组相比,添加益生菌制剂后,育肥猪的钙和总磷表观消化率显著提高(P < 0.05),粗蛋白质表观消化率也有所提高,但提高程度不显著(P>0.05)。
|
|
表 3 益生菌对育肥猪育肥后期养分表观消化率的影响(干物质基础) Table 3 Effects of probiotics on nutrient apparent digestibility of finishing pigs in later finishing period (DM basis) |
由表 4可知,益生菌组育肥猪粪便菌群的Shannon指数、Simpson指数、ACE指数、Chao1指数以及覆盖度与对照组相比均无显著差异(P>0.05)。
|
|
表 4 育肥猪育肥后期粪便菌群Alpha多样性 Table 4 Alpha diversity of fecal microbiota of finishing pigs in later finishing period |
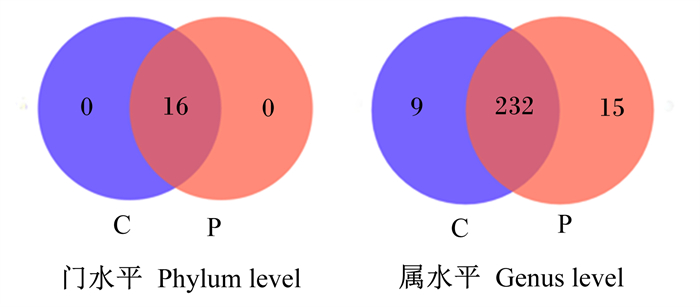
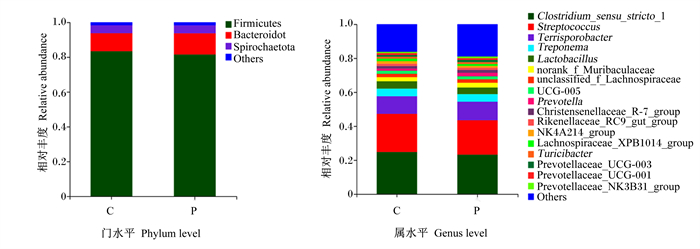
由图 1、图 2可知,在门分类水平上,对照组和益生菌组育肥猪粪便中共有菌门有16个,没有独有菌门;2组均以厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)为优势菌门,其次是螺旋体门(Spirochaetota)。在属分类水平上,对照组和益生菌组育肥猪粪便中分别有241和247个菌属,2组共有菌属为232个,独有菌属分别为9和15个,但相对丰度较低;相对丰度大于1%的菌属分别有15和16个,相对丰度总和分别为82.02%和80.04%;2组相对丰度较高的菌属有狭义梭菌属1(Clostridium_sensu_stricto_1)、链球菌属(Streptocossus)、Terrisporobacter、密螺旋体属(Treponema)和乳杆菌属(Lactobacillus)。
|
C为对照组,P为益生菌组。下图同。 C was control group and P was probiotic group. The same as below. 图 1 粪便中菌群门水平和属水平韦恩图 Fig. 1 Venn diagram of fecal microbiota at phylum level and genus level |
|
Firmicutes: 厚壁菌门;Bacteroidota: 拟杆菌门;Spirochaetota: 螺旋体门;Others: 其他;Clostridium_sensu_stricto_1:狭义梭菌属1;Streptococcus: 链球菌属;Treponema: 密螺旋体属;Lactobacillus: 乳杆菌属;unclassified_f_Lachnospiraceae: 未分类毛螺旋菌科;Prevotella:普氏菌属;Christensenellaceae_R-7_group: 克里斯滕森菌科R-7群;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群;NK4A214_group:NK4A214群;Lachnospiraceae_XPB1014_group:毛螺菌科XPB1014群;Prevotellaceae_UCG-003:普雷沃氏菌科UCG-003;Prevotellaceae_UCG-001:普雷沃氏菌科UCG-001;Prevotellaceae_NK3B31_group:普雷沃氏菌科NK3B31群。 图 2 粪便中优势菌群分布 Fig. 2 Distribution of dominant microbiota in feces |
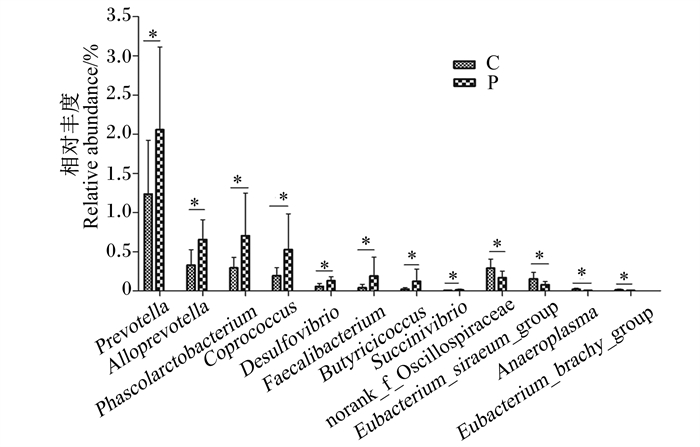
与对照组相比,在门和属分类水平上,益生菌组育肥猪粪便中高丰度菌群如厚壁菌门的相对丰度降低(83.35% vs. 81.47%),拟杆菌门的相对丰度增加(10.37% vs. 12.19%),但均未达到显著水平(P>0.05);而低丰度菌群普氏菌属(Prevotella,1.237% vs. 2.057%)、Alloprevotella(0.329% vs. 0.656%)、考拉杆菌属(Phascolarctobacterium,0.293% vs. 0.705%)、粪球菌属(Coprococcus,0.194% vs. 0.258%)、脱硫弧菌属(Desulfovibrio,0.056% vs. 0.129%)、粪杆菌属(Faecalibacterium,0.040% vs. 0.191%)、丁酸球菌属(Butyricicoccus,0.021% vs. 0.121%)和琥珀酸弧菌属(Succinivibrio,0.007% vs. 0.013%)等的相对丰度显著增加(P < 0.05,图 3),未标记颤螺菌科(norank_f_Oscillospiraceae,0.289% vs. 0.168%)、惰性真杆菌群(Eubacterium_siraeum_group,0.153% vs. 0.079%)、Anaeroplasma(0.019% vs. 0.007%)和短优杆菌群(Eubacterium_brachy_group,0.013% vs. 0.005%)等的相对丰度显著降低(P < 0.05,图 3)。
|
“*”表示组间差异显著(P < 0.05)。下图同。 Prevotella:普氏菌属;Phascolarctobacterium:考拉杆菌属;Coprococcus:粪球菌属;Desulfovibrio:脱硫弧菌属;Faecalibacterium:粪杆菌属;Butyricicoccus:丁酸球菌属;Succinivibrio:琥珀酸弧菌属;norank_f_Oscillospiraceae:未标记颤螺菌科;Eubacterium_siraeum_group:惰性真杆菌群;Eubacterium_brachy_group:短优杆菌群。 "*" indicated significant difference between groups (P < 0.05). The same as below. 图 3 粪便中差异菌群 Fig. 3 Differential microbiota in feces |
由表 5可知,与对照组相比,益生菌组育肥猪粪便中除甲酸含量有所降低外,总短链脂肪酸、乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸含量均提高,其中总短链脂肪酸、丙酸和戊酸含量与对照组的差异达到显著水平(P < 0.05)。
|
|
表 5 育肥猪育肥后期粪便中短链脂肪酸含量 Table 5 Contents of SCFAs in feces of finishing pigs in later finishing period |
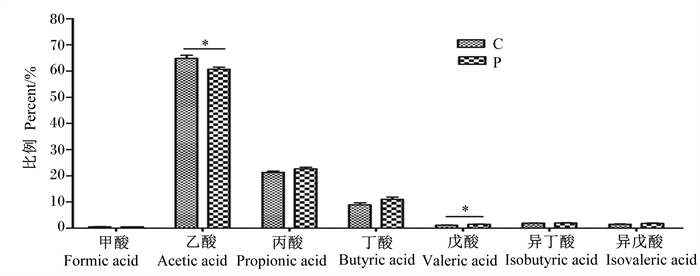
对照组育肥猪粪便中甲酸、乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸占短链脂肪酸总量的摩尔百分比分别为0.6%、64.8%、21.3%、8.9%、1.1%、1.9%、1.5%,益生菌组则分别为0.5%、60.7%、22.7%、11.0%、1.5%、2.1%、1.8%。由图 4可知,与对照组相比,益生菌组粪便短链脂肪酸中乙酸比例显著降低(P < 0.05),丙酸和丁酸比例有所升高(P>0.05),戊酸比例显著升高(P < 0.05)。
|
图 4 粪便中短链脂肪酸组成 Fig. 4 Composition of SCFAs in feces |
益生菌影响饲粮中营养成分的利用率及饲料转化率,调控动物的生长。据报道,乳酸菌可在动物肠道内定植,形成肠道屏障,分泌细菌素和有机酸等活性代谢产物,抑制病原菌的生长,减少肠道疾病发生,促进肠道健康,提高动物生长性能[9-10]。有研究表明,干酪乳杆菌对酸、胆盐有较好的耐受性,产酸和抑制有害菌能力强,能够显著增加仔猪小肠绒毛高度及绒毛高度与隐窝深度的比值,显著提高肠道蛋白酶活性和仔猪日增重,显著降低仔猪的腹泻率和死亡率,能有效维护仔猪肠道健康,促进肠道发育[11-13]。王四新等[14-15]在体重7~18 kg和62~94 kg的北京黑猪饲粮中添加干酪乳杆菌,改善了肠道菌群结构,显著提高了猪的ADG,降低了F/G。酿酒酵母本身含有丰富的蛋白质、氨基酸、维生素和微量元素,其通过发酵饲料可以产生β-葡聚糖、甘露聚糖、酶等多种营养物质,可为动物补充营养,改善动物胃肠道的生态环境,提高饲料转化率[16-17]。Jiang等[18]在早期断奶仔猪饲粮中添加酿酒酵母,促进了仔猪小肠发育,提高了饲料转化率和健康水平。Rai等[19]给2.5~3月龄的断奶仔猪饲喂添加酿酒酵母的饲粮提高了杂交猪的ADG。Garcia等[20]在饲粮中添加酿酒酵母RC016促进了断奶仔猪的生长,改善了肠道免疫系统。本研究在育肥猪育肥后期(90~120 kg阶段)饲喂含益生菌(干酪乳杆菌和酿酒酵母)的试验饲粮,取得与上述研究基本一致的结果,说明益生菌对育肥猪育肥后期的生长性能仍有改善作用。
养分表观消化率是评定饲粮营养价值的重要指标。提高营养物质消化率,可以减少养分排泄,对于绿色养殖有重要意义。通常情况下,饲粮中45%~60%的氮、50%~80%的钙与磷会排出体外[21]。研究发现,益生菌进入肠道发酵产生乳酸、消化酶等物质,促进肠道营养物质的消化吸收[22]。侯改凤[23]给体重65~92 kg阶段的“杜×长×大”育肥猪饲喂德氏乳杆菌,生长性能得到改善,试验前期和中期粗蛋白质、粗脂肪和能量表观消化率显著提高。杨东吉等[24]研究了酿酒酵母培养物对体重8~25 kg阶段断奶仔猪养分表观消化率的影响,发现酿酒酵母培养物显著提高了断奶仔猪的粗蛋白质、粗脂肪和磷的表观消化率。张紫微等[25]研究了复合益生菌制剂(含枯草芽孢杆菌、凝结芽孢杆菌、地衣芽孢杆菌和酵母菌等)对210日龄、体重84~104 kg阶段的杜陆二元杂交育肥猪的影响,结果发现试验组的磷表观消化率显著高于对照组,粗蛋白质和钙表观消化率略高于对照组,但未达到显著水平。本试验结果显示,在饲粮中添加含有干酪乳杆菌和酿酒酵母的益生菌制剂后,提高了体重92~121 kg阶段的“长×大”二元杂交育肥猪的粗蛋白质表观消化率,显著提高了钙和总磷表观消化率,与上述报道结果类似。而程皇座等[26]在体重74~108 kg阶段的“长×大”杂交育肥猪基础饲粮中添加含乳酸菌、枯草芽孢杆菌和酵母菌的益生菌制剂后发现,其对生长性能和养分表观消化率的作用效果不明显。本试验结果与程皇座等[26]的研究结果存在差异,其可能是饲用益生菌的菌种或菌种组合不同、饲粮组成或营养水平不同以及养殖环境不同等造成的,具体原因还需要进一步精准研究与分析。
3.2 益生菌对育肥猪育肥后期粪便菌群Alpha多样性和组成的影响肠道菌群数量庞大、复杂多样,对宿主肠道结构功能、营养物质代谢、机体免疫调节等具有重要影响。Zhao等[27]研究了1、2、3和6月龄长白猪粪便菌群及6月龄长白猪肠道菌群情况,发现粪便中菌群与大肠中菌群有显著的相似性,平均相似度为0.75,能够间接反映肠道菌群状况。本研究分析了育肥猪育肥后期粪便菌群的丰富度和多样性,发现益生菌组与对照组育肥猪粪便菌群的Shannon指数、Simpson指数、ACE指数、Chao1指数等Alpha多样性指数均差异不显著。而刘辉等[3]在体重23~46 kg阶段生长猪饲粮中添加乳酸片球菌,显著增加了生长猪粪便菌群的Shannon指数、ACE指数和Chao1指数,提高了生长猪肠道菌群的物种丰富度和多样性。本研究结果与刘辉等[3]的研究结果有所不同,这可能是因为育肥猪育肥后期的肠道菌群比体重23~46 kg阶段生长猪更加稳定,说明随着猪日龄增大,体重增加,益生菌对肠道菌群多样性的影响变小。
在菌群组成方面,对照组和益生菌组育肥猪粪便中均以厚壁菌门和拟杆菌门为优势菌门,狭义梭菌属1、链球菌属、Terrisporobacter、密螺旋体属和乳杆菌属等为优势菌属。从门和属分类水平上比较,发现益生菌降低了育肥猪粪便中厚壁菌门的相对丰度,提高了拟杆菌门的相对丰度,与张阳等[28]的研究结果基本一致。而在低丰度菌群中,益生菌组普氏菌属、Alloprevotella、考拉杆菌属、粪球菌属、脱硫弧菌属、粪杆菌属、丁酸球菌属和琥珀酸弧菌属的相对丰度较对照组显著增加,未标记颤螺菌科、惰性真杆菌群、Anaeroplasma和短优杆菌群的相对丰度较对照组显著降低。普氏菌属可降解纤维素,与粪便中短链脂肪酸含量的增加相关[29]。粪球菌属、粪杆菌属和丁酸球菌属等是丁酸盐产生菌[30],对动物健康有益[31]。这些变化表明益生菌能够促进育肥猪育肥后期肠道中产短链脂肪酸菌群的增殖,有利于肠道内环境的改善,也表明益生菌对育肥猪生长性能和养分表观消化率的影响可能与肠道菌群变化有关。
3.3 益生菌对育肥猪育肥后期粪便中短链脂肪酸含量与组成的影响益生菌通过争夺营养、产生代谢产物和时空占位效应等调节肠道菌群结构和稳态,促进动物肠道健康[8]。短链脂肪酸是肠道菌群发酵未消化的食物成分产生的代谢产物,包括甲酸、乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸等,在调节宿主能量代谢、免疫和肠道健康等方面发挥着重要作用。丁酸是肠上皮细胞重要的能量来源;丙酸被肝脏吸收,参与糖异生并抑制胆固醇合成;乙酸是胆固醇合成的主要底物,大部分被吸收入血液而进入肝脏代谢,作为周边组织的能源[32]。张阳等[28]在体重33~116 kg阶段生长育肥猪饲粮中添加复合益生菌(枯草芽孢杆菌、嗜乳酸杆菌和屎肠球菌)后发现,粪便中乙酸和丙酸含量极显著降低,丁酸含量显著降低,其分析粪便中菌群结构时发现梭菌属、乳杆菌属等短链脂肪酸产生菌的相对丰度降低。本试验结果显示,育肥猪育肥后期粪便中短链脂肪酸以乙酸为主,其次是丙酸和丁酸,饲喂含益生菌(干酪乳杆菌和酿酒酵母)制剂的饲粮后,除甲酸含量降低外,其他短链脂肪酸含量均得到提高。这与菌群分析结果一致,说明肠道中产短链脂肪酸菌群的增殖是短链脂肪酸含量增加的主要因素。Schwiertz等[33]和Rahat-Rozenbloom等[34]比较了胖人和瘦人结肠及粪便中短链脂肪酸含量,发现胖人结肠和粪便中短链脂肪酸含量高于瘦人,过多的短链脂肪酸增加了结肠的能量供应,会导致体重增加。
Brestenský等[35]分析了生长猪空肠和盲肠消化物及新鲜粪便中短链脂肪酸的情况,发现盲肠消化物和新鲜粪便中短链脂肪酸含量极显著高于空肠消化物,空肠、盲肠消化物和新鲜粪便中乙酸、丙酸和丁酸摩尔比值分别为85 ∶ 9 ∶ 6、61 ∶ 28 ∶ 11和71 ∶ 19 ∶ 10。本研究结果显示,对照组和益生菌组育肥猪粪便中乙酸、丙酸和丁酸的摩尔比值分别为64.8 ∶ 21.3 ∶ 8.9和60.7 ∶ 22.7 ∶ 11.0,与Brestenský等[35]的研究结果基本一致。与对照组相比,饲喂益生菌降低了育肥猪育肥后期粪便中乙酸的比例,增加了丙酸和丁酸的比例。研究表明,肠道细菌可通过特定酶的介导,经不同途径合成短链脂肪酸,短链脂肪酸之间也可相互转化,如粪球菌属和粪杆菌属以乙酸为底物通过丁酰辅酶A转移酶产生丁酸[36]。由此推测,造成育肥猪育肥后期粪便中乙酸、丙酸和丁酸等比例变化的主要原因可能是益生菌影响了肠道菌群组成及其特定酶的活性,改变了不同短链脂肪酸的合成速率,具体原因还有待于进一步验证。
4 结论在育肥猪育肥后期(体重90~120 kg阶段)饲粮中添加含有干酪乳杆菌和酿酒酵母的益生菌制剂,可提高平均日增重和钙、磷表观消化率,影响粪便中部分低丰度菌群的相对丰度,增加粪便中普氏菌属、粪球菌属、粪杆菌属和丁酸球菌属等产短链脂肪酸菌群的相对丰度以及丙酸、戊酸和总短链脂肪酸的含量。
| [1] |
赵秀英, 县怡涵, 李晨博, 等. 灌喂植物乳杆菌和干酪乳杆菌增加仔猪肠道菌群多样性及短链脂肪酸生成[J]. 微生物学报, 2016, 56(8): 1291-1300. ZHAO X Y, XIAN Y H, LI C B, et al. Feeding Lactobacillus plantarum and Lactobacillus casei increased microbial diversity and short chain fatty acids production in the gut-intestinal tract of weaning piglets[J]. Acta Microbiologica Sinica, 2016, 56(8): 1291-1300 (in Chinese). |
| [2] |
LAN R X, LEE S I, KIM I H. Effects of multistrain probiotics on growth performance, nutrient digestibility, blood profiles, faecal microbial shedding, faecal score and noxious gas emission in weaning pigs[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(6): 1130-1138. DOI:10.1111/jpn.12501 |
| [3] |
刘辉, 季海峰, 王四新, 等. 乳酸片球菌对生长猪生长性能、粪便菌群、血清生化和免疫指标的影响[J]. 动物营养学报, 2020, 32(6): 2558-2566. LIU H, JI H F, WANG S X, et al. Effects of Pediococcus acidilactici on growth performance, fecal microbiota, serum biochemical and immune indexes of growing pigs[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2558-2566 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.06.015 |
| [4] |
陈宝剑, 吴永绍, 覃兆鲜, 等. 猪不同发育阶段肠道微生物菌群特征分析[J]. 中国畜牧杂志, 2021, 57(1): 101-108. CHEN B J, WU Y S, QIN Z X, et al. Characteristics of intestinal microflora in different developmental stages of pigs[J]. Chinese Journal of Animal Science, 2021, 57(1): 101-108 (in Chinese). |
| [5] |
WANG X F, TSAI T, DENG F L, et al. Longitudinal investigation of the swine gut microbiome from birth to market reveals stage and growth performance associated bacteria[J]. Microbiome, 2019, 7(1): 109. DOI:10.1186/s40168-019-0721-7 |
| [6] |
杨凤. 动物营养学[M]. 第2版. 北京: 中国农业出版社, 2000. YANG F. Animal nutrition science[M]. 2nd ed. Beijing: China Agriculture Press, 2000 (in Chinese). |
| [7] |
王四新, 季海峰, 王红卫, 等. 干酪乳杆菌对北京黑猪育肥阶段肠道消化物菌群组成及乳酸、短链脂肪酸和长链脂肪酸含量的影响[J]. 动物营养学报, 2020, 32(4): 1595-1604. WANG S X, JI H F, WANG H W, et al. Effects of Lactobacillus casei on microbiota composition, lactic acid, short chain fatty acids and long chain fatty acids contents in intestinal digesta of Beijing black pigs during fattening stage[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1595-1604 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.04.017 |
| [8] |
孙朋朋, 宋春阳. 益生菌的生物学功能及其在仔猪生产中的应用[J]. 饲料博览, 2014(11): 33-37. SUN P P, SONG C Y. The biological function and application of probiotics in piglets[J]. Feed Review, 2014(11): 33-37 (in Chinese). DOI:10.3969/j.issn.1001-0084.2014.11.008 |
| [9] |
崔毅, 白长胜. 乳酸菌的生物学功能及在养猪生产中的应用[J]. 现代畜牧科技, 2018(1): 4-5. CUI Y, BAI C S. The biological function of lactic acid bacteria and its application in pig production[J]. Modern Animal Husbandry Science & Technology, 2018(1): 4-5 (in Chinese). |
| [10] |
HU Y L, DUN Y H, LI S N, et al. Dietary Enterococcus faecalis LAB31 improves growth performance, reduces diarrhea, and increases fecal Lactobacillus number of weaned piglets[J]. PLoS One, 2015, 10(1): e0116635. DOI:10.1371/journal.pone.0116635 |
| [11] |
窦茂鑫, 赵迪, 侯永清, 等. 饲用干酪乳杆菌的生物学特性研究[J]. 中国饲料, 2013(10): 24-26. DOU M X, ZHAO D, HOU Y Q, et al. Study on biological characteristics of Lactobacillus casei for feeding[J]. China Feed, 2013(10): 24-26 (in Chinese). DOI:10.3969/j.issn.1004-3314.2013.10.008 |
| [12] |
张魏伟, 王安如, 滕可导, 等. 干酪乳杆菌对断奶仔猪十二指肠发育的组织学影响[J]. 中国农业大学学报, 2015, 20(3): 114-120. ZHANG W W, WANG A R, TENG K D, et al. Histologic effect of Lactobacillus casei on the development of duodenum in weaned piglets[J]. Journal of China Agricultural University, 2015, 20(3): 114-120 (in Chinese). |
| [13] |
LIU C Q, ZHU Q, CHANG J, et al. Effects of Lactobacillus casei and Enterococcus faecalis on growth performance, immune function and gut microbiota of suckling piglets[J]. Archives of Animal Nutrition, 2017, 71(2): 120-133. DOI:10.1080/1745039X.2017.1283824 |
| [14] |
王四新, 季海峰, 石国华, 等. 干酪乳杆菌对北京黑猪保育阶段生长性能及肠道菌群的影响[J]. 动物营养学报, 2018, 30(1): 326-335. WANG S X, JI H F, SHI G H, et al. Effects of Lactobacillus casei on growth performance and intestinal microbiota of Beijing black pigs in nursery stage[J]. Chinese Journal of Animal Nutrition, 2018, 30(1): 326-335 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.01.039 |
| [15] |
王四新, 季海峰, 王红卫, 等. 干酪乳杆菌对北京黑猪育肥阶段生长性能和肌肉营养成分含量的影响[J]. 动物营养学报, 2019, 31(1): 469-476. WANG S X, JI H F, WANG H W, et al. Effects of Lactobacillus casei on growth performance and muscle nutritional component contents of Beijing black pigs during fattening stage[J]. Chinese Journal of Animal Nutrition, 2019, 31(1): 469-476 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.01.055 |
| [16] |
ELGHANDOUR M M Y, TAN Z L, ABU HAFSA S H, et al. Saccharomyces cerevisiae as a probiotic feed additive to non and pseudo-ruminant feeding: a review[J]. Journal of Applied Microbiology, 2020, 128(3): 658-674. DOI:10.1111/jam.14416 |
| [17] |
丁斌, 邢爽, 刘露, 等. 酿酒酵母在动物生产中的应用研究进展[J]. 饲料研究, 2019, 42(7): 114-116. DING B, XING S, LIU L, et al. Research progress on application of Saccharomyces cerevisiae in animal production[J]. Feed Research, 2019, 42(7): 114-116 (in Chinese). |
| [18] |
JIANG Z Y, WEI S Y, WANG Z L, et al. Effects of different forms of yeast Saccharomyces cerevisiae on growth performance, intestinal development, and systemic immunity in early-weaned piglets[J]. Journal of Animal Science and Biotechnology, 2015, 6: 47. DOI:10.1186/s40104-015-0046-8 |
| [19] |
RAI V, LAKHANI G P, ROY B. Effect of Saccharomyces cerevisiae on the growth performance of crossbred pigs[J]. Indian Journal of Animal Nutrition, 2013, 30(4): 392-395. |
| [20] |
GARCIA G R, DOGI C A, POLONI V L, et al. Beneficial effects of Saccharomyces cerevisiae RC016 in weaned piglets: in vivo and ex vivo analysis[J]. Beneficial Microbe, 2019, 10(1): 33-42. DOI:10.3920/BM2018.0023 |
| [21] |
KORNEGAY E T, HARPER A F, JONES R D, et al. Environmental nutrition: nutrient management strategies to reduce nutrient excretion of swine[J]. The Professional Animal Scientist, 1997, 13(3): 99-111. DOI:10.15232/S1080-7446(15)31861-1 |
| [22] |
LIU Y H, ESPINOSA C D, ABELILLA J J, et al. Non-antibiotic feed additives in diets for pigs: a review[J]. Animal Nutrition, 2018, 4(2): 113-125. DOI:10.1016/j.aninu.2018.01.007 |
| [23] |
侯改凤. 德氏乳杆菌对育肥猪生长性能、猪肉品质及脂肪沉积影响研究[D]. 硕士学位论文. 长沙: 湖南农业大学, 2015. HOU G F. Study on effects of Lactobacillus delbrueckii on growth performance、meat quality and fat deposition in fattening pigs[D]. Master's Thesis. Changsha: Hunan Agricultural University, 2015. (in Chinese) |
| [24] |
杨东吉, 张静静, 朱随亮, 等. 酿酒酵母培养物替代抗生素对断奶仔猪生长性能、养分消化率及盲肠微生物区系的影响[J]. 动物营养学报, 2020, 32(1): 138-147. YANG D J, ZHANG J J, ZHU S L, et al. Effects of Saccharomyces cerevisiae culture instead of antibiotics on growth performance, nutrient digestibility and cecal microflora of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 138-147 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.019 |
| [25] |
张紫微, 卜棚, 陈月丽, 等. 复合益生菌制剂在杜陆二元杂育肥猪中的应用效果[J]. 饲料研究, 2017(16): 1-6. ZHANG Z W, BU P, CHEN Y L, et al. Application effect of compound probiotics in Dulu hybrid finishing pigs[J]. Feed Research, 2017(16): 1-6 (in Chinese). |
| [26] |
程皇座, 马渭青, 赵旦华, 等. 益生菌制剂对生长后期育肥猪生长性能和养分表观消化率的影响[J]. 黑龙江畜牧兽医, 2019(6): 117-119, 122. CHENG H Z, MA W Q, ZHAO D H, et al. Effects of probiotics on growth performance and nutrient digestibility of growing finishing pigs[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(6): 117-119, 122 (in Chinese). |
| [27] |
ZHAO W J, WANG Y P, LIU S Y, et al. The dynamic distribution of porcine microbiota across different ages and gastrointestinal tract segments[J]. PLoS One, 2015, 10(2): e0117441. DOI:10.1371/journal.pone.0117441 |
| [28] |
张阳, 吕慧源, 徐盛玉, 等. 复合益生菌与黄芪多糖对生长育肥猪生长性能、血清生化指标和粪便微生物的影响[J]. 动物营养学报, 2021, 33(6): 3542-3553. ZHANG Y, LV H Y, XU S Y, et al. Effects of compound probiotics and Astragalus polysaccharide on growth performance, serum biochemical indices and fecal microorganism of growing-finishing pigs[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3542-3553 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.06.056 |
| [29] |
TREMAROLI V, BÄCKHED F. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489(7415): 242-249. DOI:10.1038/nature11552 |
| [30] |
VALLES-COLOMER M, FALONY G, DARZI Y, et al. The neuroactive potential of the human gut microbiota in quality of life and depression[J]. Nature Microbiology, 2019, 4(4): 623-632. DOI:10.1038/s41564-018-0337-x |
| [31] |
ROSELLI M, PIEPER R, ROGEL-GAILLARD C, et al. Immunomodulating effects of probiotics for microbiota modulation, gut health and disease resistance in pigs[J]. Animal Feed Science and Technology, 2017, 233: 104-119. DOI:10.1016/j.anifeedsci.2017.07.011 |
| [32] |
范秋丽, 马现永. 短链脂肪酸对畜禽肠道生理功能及生长性能的影响[J]. 广东饲料, 2016, 25(8): 33-35. FAN Q L, MA X Y. Effects of short chain fatty acids on intestinal physiological function and growth performance of livestock and poultry[J]. Guangdong Feed, 2016, 25(8): 33-35 (in Chinese). DOI:10.3969/j.issn.1005-8613.2016.08.009 |
| [33] |
SCHWIERTZ A, TARAS D, SCHÄFER K, et al. Microbiota and SCFA in lean and overweight healthy subjects[J]. Obesity, 2010, 18(1): 190-195. DOI:10.1038/oby.2009.167 |
| [34] |
RAHAT-ROZENBLOOM S, FERNANDES J, GLOOR G B, et al. Evidence for greater production of colonic short-chain fatty acids in overweight than lean humans[J]. International Journal of Obesity, 2014, 38(12): 1525-1531. DOI:10.1038/ijo.2014.46 |
| [35] |
BRESTENSKÝ M, NITRAYOVÁ S, BOMBA A, et al. The content of short chain fatty acids in the jejunal digesta, caecal digesta and faeces of growing pigs[J]. Livestock Science, 2017, 205: 106-110. DOI:10.1016/j.livsci.2017.09.015 |
| [36] |
KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |




